江西省南昌市聚仁高级中学2023-2024学年高二上学期10月第一次月考化学试卷(含答案)
文档属性
| 名称 | 江西省南昌市聚仁高级中学2023-2024学年高二上学期10月第一次月考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 108.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-08 23:50:30 | ||
图片预览


文档简介
聚仁高级中学2023-2024学年高二上学期10月第一次月考
化学试卷
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、单选题
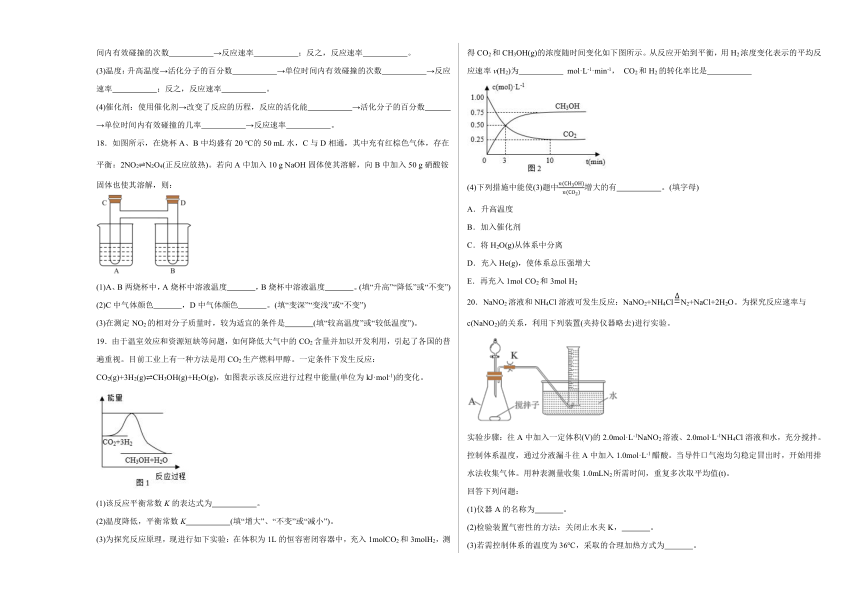
1.已知H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)= H2(g)+Cl2(g)的ΔH为
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+92.3 kJ·mol-1
2.下列说法中正确的是
A.增加水的量,可以加快镁与水反应的反应速率
B.增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
C.在反应2H++S2O=S↓+SO2↑+H2O中,增大压强,可以加快硫析出的速率
D.煅烧硫铁矿时,把硫铁矿粉碎或通入纯O2可加快反应的速率
3.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高经济效益
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
4.反应A(g)+3B(g) 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A.v(A)=0.05 mol·L-1·s-1 B.v(B)=0.06 mol·L-1·min-1
C.v(C)=0.04 mol·L-1·s-1 D.v(D)=0.03 mol·L-1·s-1
5.工业上用氨氧化法制硝酸涉及到反应:。下列反应速率的关系式错误的是
A. B.
C. D.
6.下列说法中正确的是
A.0.1mol L-1盐酸和0.1mol L-1硫酸分别与2mol L-1NaOH溶液反应,其反应速率相同
B.相同质量的大理石块与大理石粉分别与0.1mol L-1盐酸反应,反应速率相同
C.Mg、Al在相同条件下分别与0.1mol L-1盐酸反应,反应速率相同
D.0.1mol L-1HCl和0.1mol L-1HNO3分别与相同形状和大小的大理石块反应,反应速率相同
7.下列关于工业合成氨: 的说法正确的是
A.该反应使用催化剂,加快反应速率的原因是降低了活化能,提高了活化分子百分数
B.该反应达平衡状态后,恒温恒容下充入氦气,则正反应速率增大,逆反应速率减小
C.增大氮气的浓度,化学反应速率加快,平衡常数增大
D.该反应中反应物的键能之和大于生成物的键能之和
8.一定温度下,在恒容密闭容器中投入 和 ,发生反应 ,下列叙述能说明反应已达化学平衡状态的是
A.与的物质的量之比保持不变
B.消耗速率与生成速率之比为
C.容器中压强保持不变
D.容器内气体总质量保持不变
9.下列事实中,不能用勒夏特列原理解释的是
A.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
10.已知反应ΔH>0。在一定温度和压强下的密闭容器中,反应达到平衡。下列叙述错误的是
A.升高温度,K增大 B.移出部分水。c(CO2)减小
C.更换高效催化剂,a(CO2)增大 D.充入一定量的氮气,n(H2)不变
11.某温度时,在1L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化曲线如图所示。下列叙述正确的是
A.该反应的化学方程式为
B.达到平衡时,A和B浓度一定相等
C.8min时,该反应已处于化学平衡状态
D.0~4min,B的平均反应速率为0.1mol/(L min)
12.下列变化过程的、的是
A.
B.
C.
D.
13.某课外兴趣小组利用硫代硫酸钠()与稀硫酸反应,探究影响化学反应速率的因素(反应方程式为),设计了如表系列实验。下列说法不正确的是
实验序号 反应温度/℃ 稀硫酸
V/mL V/mL V/mL
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 0.50
3 20 0.10 4.0 0.50
A.若用实验1和2探究温度对反应速率的影响,则需,
B.设计该实验的基本原理为控制变量法
C.实验1和3可探究稀硫酸浓度对该反应速率的影响
D.将水更换为溶液,对实验结果无影响
14.对于反应2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反应历程:
第一步:2N2O5 NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反应;
第三步:NO+ NO3 →2NO2 快反应;其中可近似认为第二步反应不影响第一步平衡。下列表述正确的是
A.υ逆(第一步) < υ正(第二步) B.反应的中间产物只有NO
C.第二步中NO2 和NO3 碰撞部分有效 D.第三步正反应的活化能较高
15.对于3Fe+4H2O(g)Fe3O4+4H2(g),反应的化学平衡常数的表达式为
A.K= B.K=
C.K= D.K=
16.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A) ∶ c(B)=3∶5,以C表示的平均速率为下列说法正确的是
A.该反应方程式中,x=2
B.反应速率:
C.2min时,B的物质的量为1.5mol
D.2min时,A的转化率为60%
二、填空题
17.有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(2)压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(3)温度:升高温度→活化分子的百分数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(4)催化剂:使用催化剂→改变了反应的历程,反应的活化能 →活化分子的百分数 →单位时间内有效碰撞的几率 →反应速率 。
18.如图所示,在烧杯A、B中均盛有20 ℃的50 mL水,C与D相通,其中充有红棕色气体,存在平衡:2NO2N2O4(正反应放热)。若向A中加入10 g NaOH固体使其溶解,向B中加入50 g硝酸铵固体也使其溶解,则:
(1)A、B两烧杯中,A烧杯中溶液温度 ,B烧杯中溶液温度 。(填“升高”“降低”或“不变”)
(2)C中气体颜色 ,D中气体颜色 。(填“变深”“变浅”或“不变”)
(3)在测定NO2的相对分子质量时,较为适宜的条件是 (填“较高温度”或“较低温度”)。
19.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)该反应平衡常数K的表达式为 。
(2)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1, CO2和H2的转化率比是
(4)下列措施中能使(3)题中增大的有 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1mol CO2和3mol H2
20.NaNO2溶液和NH4Cl溶液可发生反应:NaNO2+NH4ClN2+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往A中加入一定体积(V)的2.0mol·L-1NaNO2溶液、2.0mol·L-1NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1.0mol·L-1醋酸。当导件口气泡均匀稳定冒出时,开始用排水法收集气体。用种表测量收集1.0mLN2所需时间,重复多次取平均值(t)。
回答下列问题:
(1)仪器A的名称为 。
(2)检验装置气密性的方法:关闭止水夹K, 。
(3)若需控制体系的温度为36℃,采取的合理加热方式为 。
(4)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如下表所示。
实验编号 V/mL t/s
NaNO2溶液 NH4Cl溶液 醋酸 水
1 4.0 V1 4.0 8.0 334
2 V2 4.0 4.0 V3 150
3 8.0 4.0 4.0 4.0 83
4 12.0 4.0 4.0 0.0 38
①V1= ,V3= 。
②该反应的速率方程为v=k·cm(NaNO2)·c(NH4Cl)·c(H+),k为反应速率常数。利用实验数据计算得m= (填整数)。
21.二氧化碳加氢制甲醇的总反应可表示为,用各物质的平衡分压表示总反应的平衡常数,表达式 。
参考答案:
1.D
2.D
3.D
4.A
5.B
6.D
7.A
8.C
9.A
10.C
11.C
12.D
13.A
14.C
15.D
16.A
17.(1) 增多 增加 增大 减小
(2) 增多 增加 增大 减小
(3) 增大 增加 增大 减小
(4) 降低 增大 增加 加快
18.(1) 升高 降低
(2) 变深 变浅
(3)较高温度
19. 增大 0.225 1∶1 CE
20.(1)锥形瓶
(2)通过分液漏斗往A中加水,一段时间后水难以滴入,则气密性良好
(3)水浴加热
(4) 4.0 6.0 2
21.
化学试卷
注意事项:
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
一、单选题
1.已知H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1,则反应HCl(g)= H2(g)+Cl2(g)的ΔH为
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+92.3 kJ·mol-1
2.下列说法中正确的是
A.增加水的量,可以加快镁与水反应的反应速率
B.增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率
C.在反应2H++S2O=S↓+SO2↑+H2O中,增大压强,可以加快硫析出的速率
D.煅烧硫铁矿时,把硫铁矿粉碎或通入纯O2可加快反应的速率
3.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,选用催化剂一定能提高经济效益
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装中加入还原性铁粉,能显著延长茶叶的储存时间
4.反应A(g)+3B(g) 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是
A.v(A)=0.05 mol·L-1·s-1 B.v(B)=0.06 mol·L-1·min-1
C.v(C)=0.04 mol·L-1·s-1 D.v(D)=0.03 mol·L-1·s-1
5.工业上用氨氧化法制硝酸涉及到反应:。下列反应速率的关系式错误的是
A. B.
C. D.
6.下列说法中正确的是
A.0.1mol L-1盐酸和0.1mol L-1硫酸分别与2mol L-1NaOH溶液反应,其反应速率相同
B.相同质量的大理石块与大理石粉分别与0.1mol L-1盐酸反应,反应速率相同
C.Mg、Al在相同条件下分别与0.1mol L-1盐酸反应,反应速率相同
D.0.1mol L-1HCl和0.1mol L-1HNO3分别与相同形状和大小的大理石块反应,反应速率相同
7.下列关于工业合成氨: 的说法正确的是
A.该反应使用催化剂,加快反应速率的原因是降低了活化能,提高了活化分子百分数
B.该反应达平衡状态后,恒温恒容下充入氦气,则正反应速率增大,逆反应速率减小
C.增大氮气的浓度,化学反应速率加快,平衡常数增大
D.该反应中反应物的键能之和大于生成物的键能之和
8.一定温度下,在恒容密闭容器中投入 和 ,发生反应 ,下列叙述能说明反应已达化学平衡状态的是
A.与的物质的量之比保持不变
B.消耗速率与生成速率之比为
C.容器中压强保持不变
D.容器内气体总质量保持不变
9.下列事实中,不能用勒夏特列原理解释的是
A.在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.实验室中常用排饱和食盐水的方法收集Cl2
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
10.已知反应ΔH>0。在一定温度和压强下的密闭容器中,反应达到平衡。下列叙述错误的是
A.升高温度,K增大 B.移出部分水。c(CO2)减小
C.更换高效催化剂,a(CO2)增大 D.充入一定量的氮气,n(H2)不变
11.某温度时,在1L容器中发生A、B两种物质间的转化反应,A、B物质的量随时间变化曲线如图所示。下列叙述正确的是
A.该反应的化学方程式为
B.达到平衡时,A和B浓度一定相等
C.8min时,该反应已处于化学平衡状态
D.0~4min,B的平均反应速率为0.1mol/(L min)
12.下列变化过程的、的是
A.
B.
C.
D.
13.某课外兴趣小组利用硫代硫酸钠()与稀硫酸反应,探究影响化学反应速率的因素(反应方程式为),设计了如表系列实验。下列说法不正确的是
实验序号 反应温度/℃ 稀硫酸
V/mL V/mL V/mL
1 20 10.0 0.10 10.0 0.50 0
2 40 0.10 0.50
3 20 0.10 4.0 0.50
A.若用实验1和2探究温度对反应速率的影响,则需,
B.设计该实验的基本原理为控制变量法
C.实验1和3可探究稀硫酸浓度对该反应速率的影响
D.将水更换为溶液,对实验结果无影响
14.对于反应2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反应历程:
第一步:2N2O5 NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反应;
第三步:NO+ NO3 →2NO2 快反应;其中可近似认为第二步反应不影响第一步平衡。下列表述正确的是
A.υ逆(第一步) < υ正(第二步) B.反应的中间产物只有NO
C.第二步中NO2 和NO3 碰撞部分有效 D.第三步正反应的活化能较高
15.对于3Fe+4H2O(g)Fe3O4+4H2(g),反应的化学平衡常数的表达式为
A.K= B.K=
C.K= D.K=
16.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)=xC(g)+2D(g),经2min后测得D的浓度为0.5mol/L,c(A) ∶ c(B)=3∶5,以C表示的平均速率为下列说法正确的是
A.该反应方程式中,x=2
B.反应速率:
C.2min时,B的物质的量为1.5mol
D.2min时,A的转化率为60%
二、填空题
17.有效碰撞理论对影响化学反应速率因素的解释
(1)浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(2)压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(3)温度:升高温度→活化分子的百分数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
(4)催化剂:使用催化剂→改变了反应的历程,反应的活化能 →活化分子的百分数 →单位时间内有效碰撞的几率 →反应速率 。
18.如图所示,在烧杯A、B中均盛有20 ℃的50 mL水,C与D相通,其中充有红棕色气体,存在平衡:2NO2N2O4(正反应放热)。若向A中加入10 g NaOH固体使其溶解,向B中加入50 g硝酸铵固体也使其溶解,则:
(1)A、B两烧杯中,A烧杯中溶液温度 ,B烧杯中溶液温度 。(填“升高”“降低”或“不变”)
(2)C中气体颜色 ,D中气体颜色 。(填“变深”“变浅”或“不变”)
(3)在测定NO2的相对分子质量时,较为适宜的条件是 (填“较高温度”或“较低温度”)。
19.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)该反应平衡常数K的表达式为 。
(2)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1, CO2和H2的转化率比是
(4)下列措施中能使(3)题中增大的有 。(填字母)
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大
E.再充入1mol CO2和3mol H2
20.NaNO2溶液和NH4Cl溶液可发生反应:NaNO2+NH4ClN2+NaCl+2H2O。为探究反应速率与c(NaNO2)的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往A中加入一定体积(V)的2.0mol·L-1NaNO2溶液、2.0mol·L-1NH4Cl溶液和水,充分搅拌。控制体系温度,通过分液漏斗往A中加入1.0mol·L-1醋酸。当导件口气泡均匀稳定冒出时,开始用排水法收集气体。用种表测量收集1.0mLN2所需时间,重复多次取平均值(t)。
回答下列问题:
(1)仪器A的名称为 。
(2)检验装置气密性的方法:关闭止水夹K, 。
(3)若需控制体系的温度为36℃,采取的合理加热方式为 。
(4)每组实验过程中,反应物浓度变化很小,忽略其对反应速率测定的影响。实验数据如下表所示。
实验编号 V/mL t/s
NaNO2溶液 NH4Cl溶液 醋酸 水
1 4.0 V1 4.0 8.0 334
2 V2 4.0 4.0 V3 150
3 8.0 4.0 4.0 4.0 83
4 12.0 4.0 4.0 0.0 38
①V1= ,V3= 。
②该反应的速率方程为v=k·cm(NaNO2)·c(NH4Cl)·c(H+),k为反应速率常数。利用实验数据计算得m= (填整数)。
21.二氧化碳加氢制甲醇的总反应可表示为,用各物质的平衡分压表示总反应的平衡常数,表达式 。
参考答案:
1.D
2.D
3.D
4.A
5.B
6.D
7.A
8.C
9.A
10.C
11.C
12.D
13.A
14.C
15.D
16.A
17.(1) 增多 增加 增大 减小
(2) 增多 增加 增大 减小
(3) 增大 增加 增大 减小
(4) 降低 增大 增加 加快
18.(1) 升高 降低
(2) 变深 变浅
(3)较高温度
19. 增大 0.225 1∶1 CE
20.(1)锥形瓶
(2)通过分液漏斗往A中加水,一段时间后水难以滴入,则气密性良好
(3)水浴加热
(4) 4.0 6.0 2
21.
同课章节目录
