第1章化学反应与能量转化综合练习(含解析)2023——2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章化学反应与能量转化综合练习(含解析)2023——2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 08:50:12 | ||
图片预览

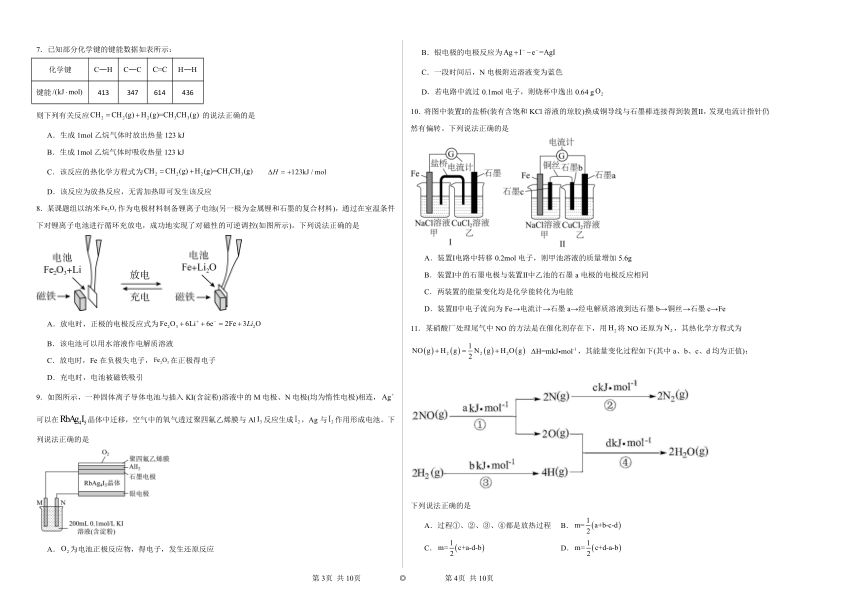
文档简介
第1章化学反应与能量转化综合练习
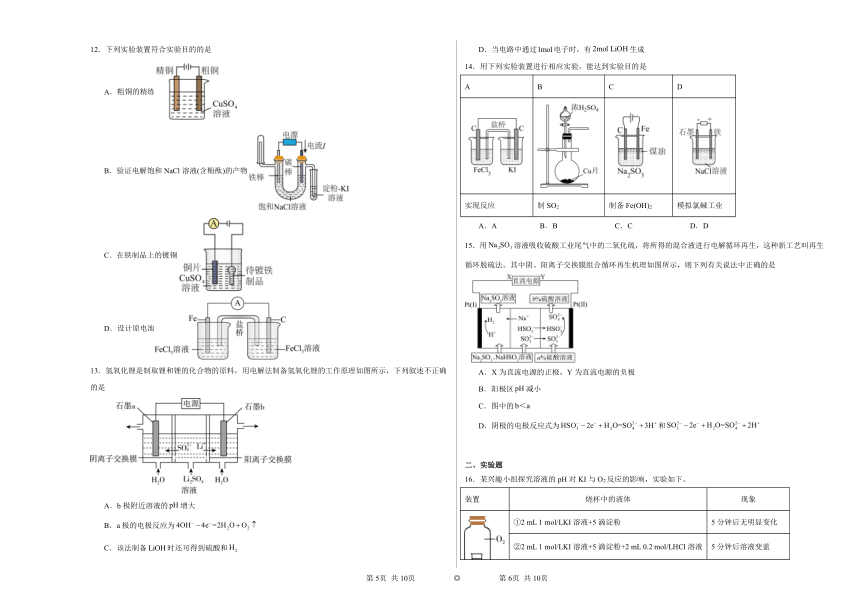
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下图装置可实现一定条件下有机物的电化学储氢(忽略其它有机物)。下列说法不正确的是
A.A为电源负极
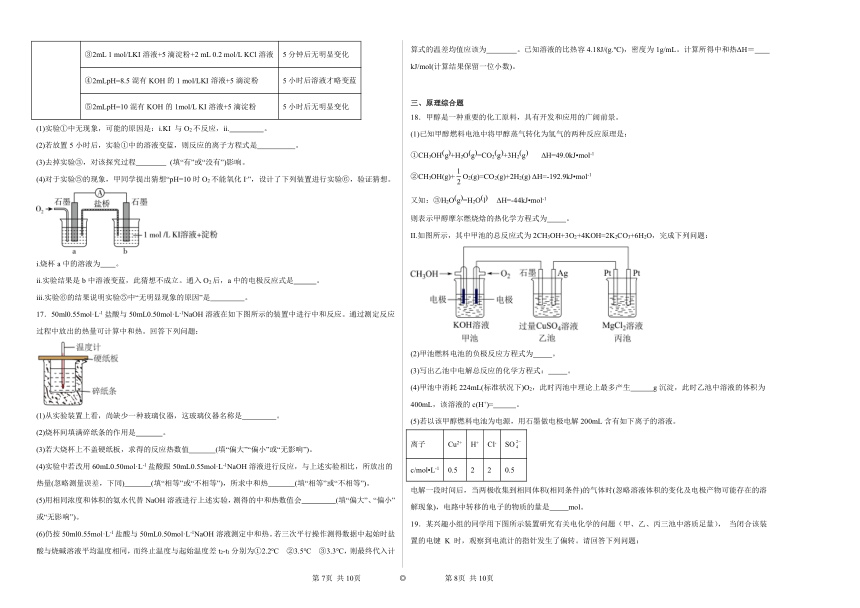
B.情性电极E上有生成
C.电极D上发生的主要反应为:
D.上述过程消耗苯,共转移电子
2.利用膜技术和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图,下列说法正确的是
A.甲装置将电能转化为化学能
B.每转移2mol电子,生成2mol N2O5 和1mol H2SO4
C.乙中电极d上发生氧化反应
D.c电极反应式为: N2O4 – 2e- + H2O = N2O5 + 2H+
3.通过以下反应可获得新型能源二甲醚()。下列说法不正确的是
①
②
③
④
A.反应①②为反应③提供原料气
B.反应③也是资源化利用的方法之一
C.反应的
D.反应的
4.某高能LiFePO4电池工作原理为: (1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC.下列说法不正确的是
A.该电池是二次电池
B.充电时,阳极附近锂元素被氧化
C.放电时Li+主要从负极区通过隔膜移向正极区
D.放电时,正极电极反应式: xFePO4+xLi++xe-=xLiFePO4
5.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是( )
A.一定大于 B.
C.ΔH1+ΔH2+ΔH3=0 D.甲→丙过程的ΔH=ΔH1+ΔH2
6.用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H++2e-= H2↑和 4OH--4e-= 2H2O + O2↑
C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化
D.从开始到Q点时收集到的混合气体的平均摩尔质量为17g·mol-1
7.已知部分化学键的键能数据如表所示:
化学键
键能 413 347 614 436
则下列有关反应的说法正确的是
A.生成1mol乙烷气体时放出热量123 kJ
B.生成1mol乙烷气体时吸收热量123 kJ
C.该反应的热化学方程式为
D.该反应为放热反应,无需加热即可发生该反应
8.某课题组以纳米作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,在正极得电子
D.充电时,电池被磁铁吸引
9.如图所示,一种固体离子导体电池与插入KI(含淀粉)溶液中的M电极、N电极(均为惰性电极)相连,可以在晶体中迁移,空气中的氧气透过聚四氟乙烯膜与Al反应生成,Ag与作用形成电池。下列说法正确的是
A.为电池正极反应物,得电子,发生还原反应
B.银电极的电极反应为
C.一段时间后,N电极附近溶液变为蓝色
D.若电路中流过0.1mol电子,则烧杯中逸出0.64 g
10.将图中装置Ⅰ的盐桥(装有含饱和KCl溶液的琼胶)换成铜导线与石墨棒连接得到装置Ⅱ,发现电流计指针仍然有偏转。下列说法正确的是
A.装置Ⅰ电路中转移0.2mol电子,则甲池溶液的质量增加5.6g
B.装置Ⅰ中的石墨电极与装置Ⅱ中乙池的石墨a电极的电极反应相同
C.两装置的能量变化均是化学能转化为电能
D.装置Ⅱ中电子流向为Fe→电流计→石墨a→经电解质溶液到达石墨b→铜丝→石墨c→Fe
11.某硝酸厂处理尾气中NO的方法是在催化剂存在下,用将NO还原为,其热化学方程式为 ,其能量变化过程如下(其中a、b、c、d均为正值):
下列说法正确的是
A.过程①、②、③、④都是放热过程 B.
C. D.
12.下列实验装置符合实验目的的是
A.粗铜的精练
B.验证电解饱和NaCl溶液(含酚酞)的产物
C.在铁制品上的镀铜
D.设计原电池
13.氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
A.b极附近溶液的增大
B.a极的电极反应为
C.该法制备时还可得到硫酸和
D.当电路中通过电子时,有生成
14.用下列实验装置进行相应实验,能达到实验目的是
A B C D
实现反应 制SO2 制备Fe(OH)2 模拟氯碱工业
A.A B.B C.C D.D
15.用溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是
A.X为直流电源的正极,Y为直流电源的负极
B.阳极区减小
C.图中的
D.阴极的电极反应式为和
二、实验题
16.某兴趣小组探究溶液的pH对KI与O2反应的影响,实验如下。
装置 烧杯中的液体 现象
①2 mL 1 mol/LKI溶液+5滴淀粉 5分钟后无明显变化
②2 mL 1 mol/LKI溶液+5滴淀粉+2 mL 0.2 mol/LHCl溶液 5分钟后溶液变蓝
③2mL 1 mol/LKI溶液+5滴淀粉+2 mL 0.2 mol/L KCl溶液 5分钟后无明显变化
④2mLpH=8.5混有KOH的1 mol/LKI溶液+5滴淀粉 5小时后溶液才略变蓝
⑤2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 5小时后无明显变化
(1)实验①中无现象,可能的原因是:i.KI 与O2不反应,ii. 。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是 。
(3)去掉实验③,对该探究过程 (填“有”或“没有”)影响。
(4)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验⑥,验证猜想。
i.烧杯a中的溶液为 。
ii.实验结果是b中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是 。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是 。
17.50ml0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是 。
(2)烧杯间填满碎纸条的作用是 。
(3)若大烧杯上不盖硬纸板,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同) (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”、“偏小”或“无影响”)。
(6)仍按50ml0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃ ②3.5℃ ③3.3℃,则最终代入计算式的温差均值应该为 。已知溶液的比热容4.18J/(g.℃),密度为1g/mL。计算所得中和热ΔH= kJ/mol(计算结果保留一位小数)。
三、原理综合题
18.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。
(1)已知甲醇燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OHg+H2Og=CO2g+3H2g ΔH=49.0kJ mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ mol-1
又知:③H2Og=H2Ol ΔH=-44kJ mol-1
则表示甲醇摩尔燃烧焓的热化学方程式为 。
II.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:
(2)甲池燃料电池的负极反应方程式为 。
(3)写出乙池中电解总反应的化学方程式: 。
(4)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀,此时乙池中溶液的体积为400mL,该溶液的c(H+)= 。
(5)若以该甲醇燃料电池为电源,用石墨做电极电解200mL含有如下离子的溶液。
离子 Cu2+ H+ Cl- SO
c/mol L-1 0.5 2 2 0.5
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),电路中转移的电子的物质的量是 mol。
19.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量), 当闭合该装置的电键 K 时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)乙池为 (填“原电池”、“电解池”或“电镀池”),B 电极的电极反应式为 。
(2)丙池中 E 电极为 (填“正极”、“负极”、“阴极”或“阳极”),电极的电极反应式为 。该池总反应的化学方程式为 。
(3)当乙池中 C 极质量减轻 54 g 时,甲池中 B 电极理论上消耗 O2的为 L(标准状况)。
(4)一段时间后,断开电键 K,下列物质能使丙池恢复到反应前浓度的是 (填选项字母)。
A Cu B CuO C Cu(OH)2 D Cu2(OH)2CO3
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,A为电源负极,A正确;
B.情性电极E作阳极,水电离出的氢氧根放电生成氧气,即E上有生成,B正确;
C.阴极上苯得电子和氢离子生成环己烷,所以电极D上发生的主要反应为:,C正确;
D.由图可知消耗苯的阴极还有其它物质,消耗1.4mol苯,转移电子物质的量大于8.4mol,D错误;
答案选D。
2.B
【分析】由图可知,甲为原电池,a为负极,电极反应式为, b极为正极,电极反应式为,电池中总反应为,乙为电解池,c极为阳极,电极反应式,d极为阴极,电极反应式为,据此分析解答。
【详解】A.根据上述分析可知,甲为原电池,将化学能转化为电能,A错误;
B.电池中反应为,转移2mol电子,生成1mol H2SO4,c极为阳极,电极反应式为,每转移2mol电子,生成2mol N2O5,B正确;
C.乙为电解池,d极为阴极,发生还原反应,C错误;
D.乙为电解池,c极为阳极,电极反应式,D错误;
故答案选C。
【点睛】本题考查原电池原理和电解池原理,题目难度中等,能依据图象和信息准确判断正、负极和阴、阳极是解题的关键,难点是电极反应式的书写。
3.C
【详解】A.反应①的产物为CO和,反应②的产物为和,反应③的原料为和,A项正确;
B.反应③将温室气体转化为燃料,B项正确;
C.反应④生成物中为气态,C项生成物中为液态,故C项中反应的焓变不为,C项错误;
D.依据盖斯定律可知,由可得所求反应及其焓变,D项正确。
故选C。
4.B
【分析】根据电池工作原理:(1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC可知,放电时为原电池,C的化合价升高,发生失电子的氧化反应,电极反应式为LixCn-xe-=xLi++nC,则LixCn所在电极为负极,FePO4所在电极为正极,发生得电子的还原反应,正极电极反应式为xFePO4+xLi++xe-=xLiFePO4;充电时为电解池,原电池的正、负极分别与电源的正、负极相接、作电解池的阳极、阴极,阳、阴极电极反应与原电池正、负极的恰好相反;原电池中阳离子向正极移动,据此分析解答。
【详解】A.放电时为原电池,充电时为电解池,所以该电池是二次电池,故A正确;
B.充电时,阳极上LiFePO4失电子发生氧化反应,阳极的电极反应为LiFePO4-e-=FePO4+Li+,Li+没发生氧化反应,故B错误;
C.原电池中阳离子向正极移动,所以放电时Li+主要从负极区通过隔膜移向正极区,故C正确;
D.放电时,正极上FePO4发生得电子的还原反应,电极反应为xFePO4+xLi++xe-=xLiFePO4,故D正确;
故选B。
5.A
【分析】根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),以甲为起点,最终又回到甲,整个过程没有能量变化,据此分析解答。
【详解】A.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),则ΔH3= (ΔH1+ΔH2),而和|的大小无法确定,故A项说法错误;
B.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),则ΔH3= (ΔH1+ΔH2),所以,故B项说法正确;
C.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)以甲为起点,最终又回到甲,整个过程没有能量变化,则ΔH1+ΔH2+ΔH3=0,故C项说法正确;
D.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),所以甲→丙的ΔH=ΔH1+ΔH2,故D项说法正确;
综上所述,答案为A。
6.D
【分析】当转移电子的物质的量为0.2mol电子时,两极电极反应为:
【详解】A.电解过程中,a电极表面先有红色物质析出,后有气泡产生,排除
B.a电极上发生的反应方程式为:Cu2++2e-= Cu和4OH-—4e-==2H2O十O2↑,排除
C.曲线0~P段表示O2混合气体的体积变化,曲线P~Q段表示H2和O2的体积变化,排除
D.从开始到Q点时收集到的混合气体共0.2mol,其中氢气与氧气均为0.1mol,故气体的平均摩尔质量为=17g·mol-1
故答案为D。
7.A
【详解】A.根据反应方程式可知,该反应的反应焓变为,则生成1mol乙烷气体时放出的热量为123 kJ,A正确;
B.根据A选项可知,B错误;
C.该反应的热化学方程式,C错误;
D.该反应需在催化剂且加热条件下才能实现,D错误;
答案选A。
8.A
【分析】电池放电的总反应式为,单质锂在负极放电,负极的电极反应式为,由总反应和负极的电极反应式可得到正极的电极反应式,据此分析作答。
【详解】A. 根据上述分析可知,放电时正极反应式为:,A项正确;
B. 因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
C. 放电时,Li在负极失电子,在正极得电子,C项错误;
D. 从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误;
答案选A。
9.D
【详解】A. 氧化AlI3生成,Ag与作用形成电池,故不参与电化学反应,A项错误;
B. Ag与作用形成电池,可在晶体中迁移,故银电极为电池负极,Ag失电子,被氧化成,即,然后移向正极(石墨电极),B项错误;
C. N电极接电池负极,为阴极,发生还原反应,M电极接电池正极,为阳极,发生氧化反应,电解质溶液为KI溶液,故M电极生成,M电极附近溶液变为蓝色,C项错误;
D. 若电路中流过0.1mol电子,由题图可知,烧杯中有0.02mol,完全被氧化转移0.02mol电子,则阳极上放电完全后,放电,即发生反应,转移0.08mol电子,故生成0.02mol(即0.64g),D项正确;
答案选D。
10.B
【详解】A.装置Ⅰ中,Fe电极上发生氧化反应,电路中转移0.2mol电子,则Fe电极溶解生成0.1mol(5.6g)进入甲池,且盐桥中的阴离子也进入甲池,所以甲池溶液质量的增加量大于5.6g,A错误;
B.装置Ⅱ中甲池相当于原电池,发生Fe的吸氧腐蚀,Fe作负极,石墨c作正极,乙池相当于电解池,乙池中石墨a电极连接Fe电极,作阴极,发生还原反应,故装置I中的石墨电极与装置Ⅱ中乙池的石墨a电极的电极反应均为得电子生成Cu,B正确;
C.装置Ⅰ是化学能转化为电能,装置Ⅱ中甲池是化学能转化为电能,乙池则是电能转化为化学能,C错误;
D.电子只能在外电路的导线中流动,不进入溶液中,则装置Ⅱ中电子流向为Fe→电流计→石墨a,石墨b→铜丝→石墨c,D错误;
故答案为:B。
11.B
【详解】分子变为原子是化学键断裂的过程,需要吸收能量,原子结合为分子是化学键形成的过程,需要释放能量,由图可知,过程①为、过程②为、过程③为 、过程④为 ,由盖斯定律可知,(①+②+③+④)可得反应,则,即,故B正确。
12.B
【详解】A.粗铜的精炼装置中,粗铜作阳极,接电源正极,精铜作阴极,接电源负极,A项错误;
B.电流流出的电极为正极,则碳棒电极作阳极,阳极上发生氧化反应生成,氧化生成,使淀粉溶液变蓝,铁棒电极作阴极,阴极上发生还原反应生成,用向下排空气法收集,B项正确;
C.在铁制品上镀铜,则待镀铁制品作阴极,连接电源负极,Cu作阳极,连接电源正极,C项错误;
D.Fe与能发生氧化还原反应生成,左边烧杯中应该是氯化亚铁溶液,右边烧杯中应该是氯化铁溶液,D项错误。
答案选B。
13.D
【分析】由电解液中离子的移动方向可知石墨a为阳极,石墨b为阴极,a极失去电子,发生氧化反应,即,结合移动过来的得到硫酸,b极水电离的得电子放出氢气,即,结合移动过来的生成,结合电解池相关知识解答。
【详解】A.b极反应式为,增大,溶液的增大,A正确;
B.a极为阳极,电极反应式为,B正确;
C.由分析可知,该法制备时还可得到硫酸和,C正确;
D.由得失电子守恒知,电路中通过电子时,得到,D错误;
答案选D。
14.A
【详解】A. 铁离子能氧化碘离子,石墨作正极,因此构成原电池,可实现反应,A正确;
B. 铜和浓硫酸在常温下不反应,需要加热,B错误;
C. 制备氢氧化亚铁,应该把铁作阳极,与电源正极相连,C错误;
D. 模拟氯碱工业时铁应该作阴极,与电源负极相连,D错误;答案选A。
15.B
【分析】根据图示,阴阳离子的移动方向知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源的负极,Y为直流电源的正极,结合图示中电极变化分析解答。
【详解】A.根据阴、阳离子的移动方向知,阳离子向P(I)极移动,阴离子向电极移动,因此为阴极,为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A错误;
B.阳极上、被氧化生成,亚硫酸是弱酸,硫酸是强酸,所以阳极附近增大,溶液的减小,故B正确;
C.阳极室中,被氧化生成,硫酸浓度增大,所以,故C错误;
D.该电解池中阴极上发生还原反应,应该是得电子生成,故D错误;
答案选B。
16. KI与O2反应速率慢 4I -+O2+2H2O=I2+4OH- 有 pH=10的KOH溶液 O2+2H2O+4e- = 4OH- 生成的I2与OH-反应
【详解】(1) 实验①中5 分钟后无明显变化可能是反应并没有发生,也可能是反应速率太慢,时间太短不足以观察到现象,故答案为:KI 与 O2 反应速率慢;
(2)若放置5小时后,实验①中的溶液变蓝,是因为碘离子能被氧气氧化成 I2,反应离子方程式为:4I-+O2+2H2O=I2+4OH-;
(3) 对比实验②和实验③可以排除氯离子对反应的影响,如果去掉实验 ③则不能说明氯离子对反应是否有影响,故答案为:有;
(4) i:因甲同学提出猜想“pH=10时O2不能氧化 I-”,所以通氧气的一侧烧杯中应加pH=10 的 KOH 溶液,故答案为:pH=10 的 KOH 溶液;
ii. 实验结果是b 中溶液变蓝,说明pH=10时,氧气可以氧化碘离子,从而说明猜想不成立,则通入 O2后,a中的电极反应式是O2+2H2O+4e- = 4OH-;
iii.实验⑥的结果说明pH=10时,氧气可以氧化碘离子,而实验 ⑤中“无明显现象的原因”只能是产生的碘单质被碱消耗导致,即生成的I2 与 OH-反应。
17. 环形玻璃搅拌棒 保温(或隔热、或减少热量损失) 偏小 不相等 相等 偏小 3.4℃ -56.8kJ/mol
【详解】(1)为了测得温度的最高值,应在最短的时间内让盐酸和氢氧化钠充分反应,故缺少环形玻璃搅拌棒;
(2)为了测得温度的最高值,应加强保温、隔热和防止热量散失措施,应在大小烧杯间填满碎泡沫(或纸条),并使小烧杯口与大烧杯口相平;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,与原实验相比,用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行上述实验,生成水的量增多,所放出的热量偏高;中和热是指强酸和强碱在稀溶液中反应生成1mol水时放出的热,与酸碱的用量无关,所以与原实验相比,用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行上述实验测得中和热数值相等;
(5)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小;
(6)①2.2℃②3.5℃③3.3℃中,①误差较大,应舍弃,用②③3组数据计算平均值为;50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液反应生成水的物质的量为0.5mol/L×0.05L=0.025mol,溶液质量为100mL×1g/mL=100g,温度变化为3.4℃,该反应放热Q=cm t=4.18J/(g.℃) ×100g×3.4℃=1.4212kJ,故 H=;
18.(1)CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ mol-1
(2)CH3OH-6e-+8OH-=CO+6H2O
(3)2CuSO4+2H2O2Cu+2H2SO4+O2↑
(4) 1.16 0.1mol/L
(5)0.8
【详解】(1)已知:
①CH3OHg+H2Og=CO2g+3H2g ΔH=49.0kJ mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ mol-1
③H2Og=H2Ol ΔH=-44kJ mol-1
则根据盖斯定律②×3-①×2+③×2即得到表示甲醇摩尔燃烧焓的热化学方程式为CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ mol-1。
(2)甲池燃料电池中通入甲醇的是负极,则负极反应方程式为CH3OH-6e-+8OH-=CO+6H2O。
(3)乙池是电解池,石墨电极和电源正极相连,氢氧根放电,银电极是阴极,铜离子放电,则其中电解总反应的化学方程式为2CuSO4+2H2O2Cu+2H2SO4+O2↑。
(4)甲池中消耗224mL(标准状况下)O2,氧气的物质的量是0.01mol,转移0.04mol电子,丙中得到的沉淀是氢氧化镁,根据转移电子守恒可知形成0.02mol氢氧化镁,则此时丙池中理论上最多产生沉淀的质量是0.02mol×58g/mol=1.16g,产生氢离子是0.04mol,因此该溶液的c(H+)=0.04mol÷0.4L=0.1mol/L。
(5)溶液中n(Cu2+)=0.2L×0.5mol/L=0.1mol,n(H+)=0.2L×2mol/L=0.4mol,c(Cl-)=0.2L×2mol/L=0.4mol,开始阶段,阴极电极反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑,电解一段时间后,当两极收集到相同体积(相同条件)的气体,且阳极生成氧气,则阴极还发生反应:2H++2e-=H2↑,阳极还发生:4OH--4e-=2H2O+O2↑,阳极生成氯气为0.2mol,假设氧气为xmol,则氢气为(x+0.2)mol,根据电子转移守恒,则0.1mol×2+(x+0.2)mol×2=0.2mol×2+xmol×4,解得x=0.1,故电路中转移的电子的物质的量是0.1mol×2+(x+0.2)mol×2=0.8mol。
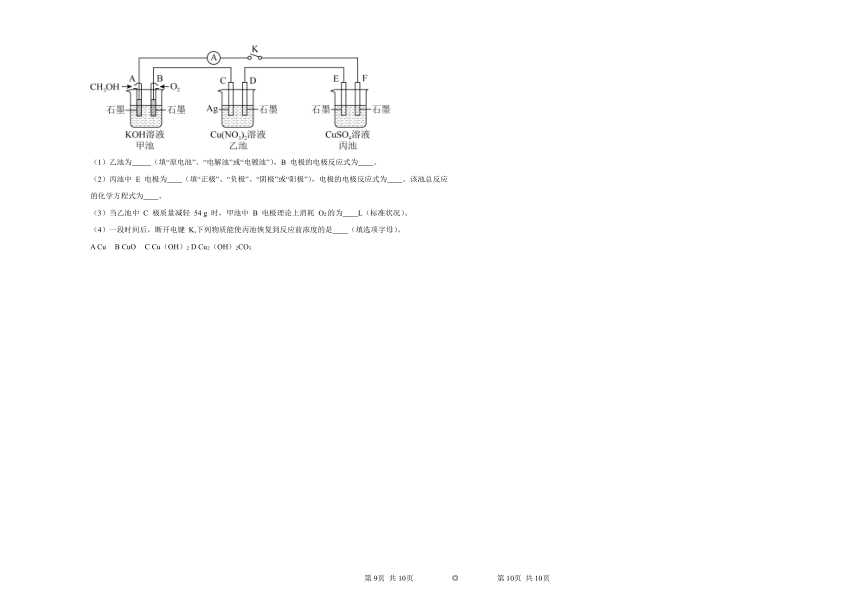
19. 电解池 O2 +4e-+2H2O = 4OH- 阳极 2H2O-4e-= O2↑+4H+ 2CuSO4 + 2H2O2Cu +O2↑+2H2SO4 2.8 B
【分析】由图可知甲图为原电池是一甲醇燃料电池,通甲醇的A为负极、B为正极;乙池为电解池,C为阳极电极反应为:Ag-e-=Ag+,D为阴极,电极反应为Cu2++2e-=Cu;丙池为电解池,E为阳极,电极反应为:2H2O-4e-=O2↑+4H+,F电极为阴极,电极反应为:Cu2++2e-=Cu,总反应方程式为:2CuSO4+2H2O2H2SO4+2Cu+O2↑,一段时间后,断开电键K,要使丙池恢复到反应前浓度需加入CuO或者CuCO3,据此分析解答。
【详解】(1)由图可知乙图为电解池;甲图为原电池,B电极通入氧气,为正极,氧气在碱性条件下得电子产生氢氧根离子,电极反应式为:O2 +4e-+2H2O = 4OH-;
(2)丙池为电解池,其中E电极连接电源正极,为阳极,电极反应式为:2H2O-4e-=O2↑+4H+,F电极连接电源负极,为阴极,发生反应:Cu2++2e-=Cu,总反应方程式为:2CuSO4+2H2O2H2SO4+2Cu+O2↑;
(3)乙池中C为阳极电极反应为:Ag-e-=Ag+,D为阴极,电极反应为Cu2++2e-=Cu;n(Ag)==0.5mol,由于Ag是+1价的金属,所以转移电子的物质的量为0.5mol,由于在同一闭合回路中电子转移数目相等,所以甲池中反应消耗O2的物质的量n(O2)=×0.5mol=0.125mol,则消耗氧气在标准状况下的体积V(O2)=0.125mol×22.4L/mol=2.8L;
(4)一段时间后,断开电键K,根据少什么加什么,丙池一个电极产生Cu单质,另一个电极产生O2,相当于从溶液中出去的物质为Cu与O2反应产生的CuO。
A.Cu与硫酸不能反应,不能达到目的,选项A错误;
B.CuO与硫酸反应,产生硫酸铜和水,能达到目的,选项B正确;
C.Cu(OH)2比CuO多一个水的组成,相当于对溶液进行了稀释,不能使丙池恢复到反应前浓度,选项C错误;
D.Cu2(OH)2CO3与硫酸生成硫酸铜、二氧化碳和水,比等物质的量的CuO多一个水的组成,相当于对溶液进行了稀释,不能使丙池恢复到反应前浓度,选项D错误;
答案选B。
【点睛】本题考查了原电池和电解池,侧重于电极反应式书写和电子守恒在计算中应用的考查,对于多池串联电路,通入燃料的电池为原电池,其它各池为电解池,其中在燃料电池中通入燃料的电极为负极,通入氧气或空气的电极为正极;与负极连接的电极为阴极,与正极连接的电极为阳极,原电池的负极和电解池的阳极发生氧化反应;原电池的正极和电解池的阴极发生还原反应,电极反应式书写时要结合电解质溶液的酸碱性进行。在整个闭合回路中电子转移数目相等。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下图装置可实现一定条件下有机物的电化学储氢(忽略其它有机物)。下列说法不正确的是
A.A为电源负极
B.情性电极E上有生成
C.电极D上发生的主要反应为:
D.上述过程消耗苯,共转移电子
2.利用膜技术和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图,下列说法正确的是
A.甲装置将电能转化为化学能
B.每转移2mol电子,生成2mol N2O5 和1mol H2SO4
C.乙中电极d上发生氧化反应
D.c电极反应式为: N2O4 – 2e- + H2O = N2O5 + 2H+
3.通过以下反应可获得新型能源二甲醚()。下列说法不正确的是
①
②
③
④
A.反应①②为反应③提供原料气
B.反应③也是资源化利用的方法之一
C.反应的
D.反应的
4.某高能LiFePO4电池工作原理为: (1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC.下列说法不正确的是
A.该电池是二次电池
B.充电时,阳极附近锂元素被氧化
C.放电时Li+主要从负极区通过隔膜移向正极区
D.放电时,正极电极反应式: xFePO4+xLi++xe-=xLiFePO4
5.假设反应体系的始态为甲,中间态为乙,终态为丙,它们之间的变化如图所示,则下列说法不正确的是( )
A.一定大于 B.
C.ΔH1+ΔH2+ΔH3=0 D.甲→丙过程的ΔH=ΔH1+ΔH2
6.用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.a电极上发生的反应方程式为:2H++2e-= H2↑和 4OH--4e-= 2H2O + O2↑
C.曲线0~P段表示H2和O2混合气体的体积变化,曲线P~Q段表示O2的体积变化
D.从开始到Q点时收集到的混合气体的平均摩尔质量为17g·mol-1
7.已知部分化学键的键能数据如表所示:
化学键
键能 413 347 614 436
则下列有关反应的说法正确的是
A.生成1mol乙烷气体时放出热量123 kJ
B.生成1mol乙烷气体时吸收热量123 kJ
C.该反应的热化学方程式为
D.该反应为放热反应,无需加热即可发生该反应
8.某课题组以纳米作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,在正极得电子
D.充电时,电池被磁铁吸引
9.如图所示,一种固体离子导体电池与插入KI(含淀粉)溶液中的M电极、N电极(均为惰性电极)相连,可以在晶体中迁移,空气中的氧气透过聚四氟乙烯膜与Al反应生成,Ag与作用形成电池。下列说法正确的是
A.为电池正极反应物,得电子,发生还原反应
B.银电极的电极反应为
C.一段时间后,N电极附近溶液变为蓝色
D.若电路中流过0.1mol电子,则烧杯中逸出0.64 g
10.将图中装置Ⅰ的盐桥(装有含饱和KCl溶液的琼胶)换成铜导线与石墨棒连接得到装置Ⅱ,发现电流计指针仍然有偏转。下列说法正确的是
A.装置Ⅰ电路中转移0.2mol电子,则甲池溶液的质量增加5.6g
B.装置Ⅰ中的石墨电极与装置Ⅱ中乙池的石墨a电极的电极反应相同
C.两装置的能量变化均是化学能转化为电能
D.装置Ⅱ中电子流向为Fe→电流计→石墨a→经电解质溶液到达石墨b→铜丝→石墨c→Fe
11.某硝酸厂处理尾气中NO的方法是在催化剂存在下,用将NO还原为,其热化学方程式为 ,其能量变化过程如下(其中a、b、c、d均为正值):
下列说法正确的是
A.过程①、②、③、④都是放热过程 B.
C. D.
12.下列实验装置符合实验目的的是
A.粗铜的精练
B.验证电解饱和NaCl溶液(含酚酞)的产物
C.在铁制品上的镀铜
D.设计原电池
13.氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
A.b极附近溶液的增大
B.a极的电极反应为
C.该法制备时还可得到硫酸和
D.当电路中通过电子时,有生成
14.用下列实验装置进行相应实验,能达到实验目的是
A B C D
实现反应 制SO2 制备Fe(OH)2 模拟氯碱工业
A.A B.B C.C D.D
15.用溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是
A.X为直流电源的正极,Y为直流电源的负极
B.阳极区减小
C.图中的
D.阴极的电极反应式为和
二、实验题
16.某兴趣小组探究溶液的pH对KI与O2反应的影响,实验如下。
装置 烧杯中的液体 现象
①2 mL 1 mol/LKI溶液+5滴淀粉 5分钟后无明显变化
②2 mL 1 mol/LKI溶液+5滴淀粉+2 mL 0.2 mol/LHCl溶液 5分钟后溶液变蓝
③2mL 1 mol/LKI溶液+5滴淀粉+2 mL 0.2 mol/L KCl溶液 5分钟后无明显变化
④2mLpH=8.5混有KOH的1 mol/LKI溶液+5滴淀粉 5小时后溶液才略变蓝
⑤2mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 5小时后无明显变化
(1)实验①中无现象,可能的原因是:i.KI 与O2不反应,ii. 。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是 。
(3)去掉实验③,对该探究过程 (填“有”或“没有”)影响。
(4)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验⑥,验证猜想。
i.烧杯a中的溶液为 。
ii.实验结果是b中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是 。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是 。
17.50ml0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是 。
(2)烧杯间填满碎纸条的作用是 。
(3)若大烧杯上不盖硬纸板,求得的反应热数值 (填“偏大”“偏小”或“无影响”)。
(4)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同) (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”、“偏小”或“无影响”)。
(6)仍按50ml0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃ ②3.5℃ ③3.3℃,则最终代入计算式的温差均值应该为 。已知溶液的比热容4.18J/(g.℃),密度为1g/mL。计算所得中和热ΔH= kJ/mol(计算结果保留一位小数)。
三、原理综合题
18.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。
(1)已知甲醇燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OHg+H2Og=CO2g+3H2g ΔH=49.0kJ mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ mol-1
又知:③H2Og=H2Ol ΔH=-44kJ mol-1
则表示甲醇摩尔燃烧焓的热化学方程式为 。
II.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,完成下列问题:
(2)甲池燃料电池的负极反应方程式为 。
(3)写出乙池中电解总反应的化学方程式: 。
(4)甲池中消耗224mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀,此时乙池中溶液的体积为400mL,该溶液的c(H+)= 。
(5)若以该甲醇燃料电池为电源,用石墨做电极电解200mL含有如下离子的溶液。
离子 Cu2+ H+ Cl- SO
c/mol L-1 0.5 2 2 0.5
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),电路中转移的电子的物质的量是 mol。
19.某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量), 当闭合该装置的电键 K 时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)乙池为 (填“原电池”、“电解池”或“电镀池”),B 电极的电极反应式为 。
(2)丙池中 E 电极为 (填“正极”、“负极”、“阴极”或“阳极”),电极的电极反应式为 。该池总反应的化学方程式为 。
(3)当乙池中 C 极质量减轻 54 g 时,甲池中 B 电极理论上消耗 O2的为 L(标准状况)。
(4)一段时间后,断开电键 K,下列物质能使丙池恢复到反应前浓度的是 (填选项字母)。
A Cu B CuO C Cu(OH)2 D Cu2(OH)2CO3
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,A为电源负极,A正确;
B.情性电极E作阳极,水电离出的氢氧根放电生成氧气,即E上有生成,B正确;
C.阴极上苯得电子和氢离子生成环己烷,所以电极D上发生的主要反应为:,C正确;
D.由图可知消耗苯的阴极还有其它物质,消耗1.4mol苯,转移电子物质的量大于8.4mol,D错误;
答案选D。
2.B
【分析】由图可知,甲为原电池,a为负极,电极反应式为, b极为正极,电极反应式为,电池中总反应为,乙为电解池,c极为阳极,电极反应式,d极为阴极,电极反应式为,据此分析解答。
【详解】A.根据上述分析可知,甲为原电池,将化学能转化为电能,A错误;
B.电池中反应为,转移2mol电子,生成1mol H2SO4,c极为阳极,电极反应式为,每转移2mol电子,生成2mol N2O5,B正确;
C.乙为电解池,d极为阴极,发生还原反应,C错误;
D.乙为电解池,c极为阳极,电极反应式,D错误;
故答案选C。
【点睛】本题考查原电池原理和电解池原理,题目难度中等,能依据图象和信息准确判断正、负极和阴、阳极是解题的关键,难点是电极反应式的书写。
3.C
【详解】A.反应①的产物为CO和,反应②的产物为和,反应③的原料为和,A项正确;
B.反应③将温室气体转化为燃料,B项正确;
C.反应④生成物中为气态,C项生成物中为液态,故C项中反应的焓变不为,C项错误;
D.依据盖斯定律可知,由可得所求反应及其焓变,D项正确。
故选C。
4.B
【分析】根据电池工作原理:(1-x)LiFePO4+xFePO4+LixCnLiFePO4+nC可知,放电时为原电池,C的化合价升高,发生失电子的氧化反应,电极反应式为LixCn-xe-=xLi++nC,则LixCn所在电极为负极,FePO4所在电极为正极,发生得电子的还原反应,正极电极反应式为xFePO4+xLi++xe-=xLiFePO4;充电时为电解池,原电池的正、负极分别与电源的正、负极相接、作电解池的阳极、阴极,阳、阴极电极反应与原电池正、负极的恰好相反;原电池中阳离子向正极移动,据此分析解答。
【详解】A.放电时为原电池,充电时为电解池,所以该电池是二次电池,故A正确;
B.充电时,阳极上LiFePO4失电子发生氧化反应,阳极的电极反应为LiFePO4-e-=FePO4+Li+,Li+没发生氧化反应,故B错误;
C.原电池中阳离子向正极移动,所以放电时Li+主要从负极区通过隔膜移向正极区,故C正确;
D.放电时,正极上FePO4发生得电子的还原反应,电极反应为xFePO4+xLi++xe-=xLiFePO4,故D正确;
故选B。
5.A
【分析】根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),以甲为起点,最终又回到甲,整个过程没有能量变化,据此分析解答。
【详解】A.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),则ΔH3= (ΔH1+ΔH2),而和|的大小无法确定,故A项说法错误;
B.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),则ΔH3= (ΔH1+ΔH2),所以,故B项说法正确;
C.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)以甲为起点,最终又回到甲,整个过程没有能量变化,则ΔH1+ΔH2+ΔH3=0,故C项说法正确;
D.根据盖斯定律:不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等),所以甲→丙的ΔH=ΔH1+ΔH2,故D项说法正确;
综上所述,答案为A。
6.D
【分析】当转移电子的物质的量为0.2mol电子时,两极电极反应为:
【详解】A.电解过程中,a电极表面先有红色物质析出,后有气泡产生,排除
B.a电极上发生的反应方程式为:Cu2++2e-= Cu和4OH-—4e-==2H2O十O2↑,排除
C.曲线0~P段表示O2混合气体的体积变化,曲线P~Q段表示H2和O2的体积变化,排除
D.从开始到Q点时收集到的混合气体共0.2mol,其中氢气与氧气均为0.1mol,故气体的平均摩尔质量为=17g·mol-1
故答案为D。
7.A
【详解】A.根据反应方程式可知,该反应的反应焓变为,则生成1mol乙烷气体时放出的热量为123 kJ,A正确;
B.根据A选项可知,B错误;
C.该反应的热化学方程式,C错误;
D.该反应需在催化剂且加热条件下才能实现,D错误;
答案选A。
8.A
【分析】电池放电的总反应式为,单质锂在负极放电,负极的电极反应式为,由总反应和负极的电极反应式可得到正极的电极反应式,据此分析作答。
【详解】A. 根据上述分析可知,放电时正极反应式为:,A项正确;
B. 因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
C. 放电时,Li在负极失电子,在正极得电子,C项错误;
D. 从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误;
答案选A。
9.D
【详解】A. 氧化AlI3生成,Ag与作用形成电池,故不参与电化学反应,A项错误;
B. Ag与作用形成电池,可在晶体中迁移,故银电极为电池负极,Ag失电子,被氧化成,即,然后移向正极(石墨电极),B项错误;
C. N电极接电池负极,为阴极,发生还原反应,M电极接电池正极,为阳极,发生氧化反应,电解质溶液为KI溶液,故M电极生成,M电极附近溶液变为蓝色,C项错误;
D. 若电路中流过0.1mol电子,由题图可知,烧杯中有0.02mol,完全被氧化转移0.02mol电子,则阳极上放电完全后,放电,即发生反应,转移0.08mol电子,故生成0.02mol(即0.64g),D项正确;
答案选D。
10.B
【详解】A.装置Ⅰ中,Fe电极上发生氧化反应,电路中转移0.2mol电子,则Fe电极溶解生成0.1mol(5.6g)进入甲池,且盐桥中的阴离子也进入甲池,所以甲池溶液质量的增加量大于5.6g,A错误;
B.装置Ⅱ中甲池相当于原电池,发生Fe的吸氧腐蚀,Fe作负极,石墨c作正极,乙池相当于电解池,乙池中石墨a电极连接Fe电极,作阴极,发生还原反应,故装置I中的石墨电极与装置Ⅱ中乙池的石墨a电极的电极反应均为得电子生成Cu,B正确;
C.装置Ⅰ是化学能转化为电能,装置Ⅱ中甲池是化学能转化为电能,乙池则是电能转化为化学能,C错误;
D.电子只能在外电路的导线中流动,不进入溶液中,则装置Ⅱ中电子流向为Fe→电流计→石墨a,石墨b→铜丝→石墨c,D错误;
故答案为:B。
11.B
【详解】分子变为原子是化学键断裂的过程,需要吸收能量,原子结合为分子是化学键形成的过程,需要释放能量,由图可知,过程①为、过程②为、过程③为 、过程④为 ,由盖斯定律可知,(①+②+③+④)可得反应,则,即,故B正确。
12.B
【详解】A.粗铜的精炼装置中,粗铜作阳极,接电源正极,精铜作阴极,接电源负极,A项错误;
B.电流流出的电极为正极,则碳棒电极作阳极,阳极上发生氧化反应生成,氧化生成,使淀粉溶液变蓝,铁棒电极作阴极,阴极上发生还原反应生成,用向下排空气法收集,B项正确;
C.在铁制品上镀铜,则待镀铁制品作阴极,连接电源负极,Cu作阳极,连接电源正极,C项错误;
D.Fe与能发生氧化还原反应生成,左边烧杯中应该是氯化亚铁溶液,右边烧杯中应该是氯化铁溶液,D项错误。
答案选B。
13.D
【分析】由电解液中离子的移动方向可知石墨a为阳极,石墨b为阴极,a极失去电子,发生氧化反应,即,结合移动过来的得到硫酸,b极水电离的得电子放出氢气,即,结合移动过来的生成,结合电解池相关知识解答。
【详解】A.b极反应式为,增大,溶液的增大,A正确;
B.a极为阳极,电极反应式为,B正确;
C.由分析可知,该法制备时还可得到硫酸和,C正确;
D.由得失电子守恒知,电路中通过电子时,得到,D错误;
答案选D。
14.A
【详解】A. 铁离子能氧化碘离子,石墨作正极,因此构成原电池,可实现反应,A正确;
B. 铜和浓硫酸在常温下不反应,需要加热,B错误;
C. 制备氢氧化亚铁,应该把铁作阳极,与电源正极相连,C错误;
D. 模拟氯碱工业时铁应该作阴极,与电源负极相连,D错误;答案选A。
15.B
【分析】根据图示,阴阳离子的移动方向知,阳离子向Pt(Ⅰ)电极移动,阴离子向Pt(Ⅱ)移动,因此Pt(Ⅰ)为阴极,Pt(Ⅱ)为阳极,所以X为直流电源的负极,Y为直流电源的正极,结合图示中电极变化分析解答。
【详解】A.根据阴、阳离子的移动方向知,阳离子向P(I)极移动,阴离子向电极移动,因此为阴极,为阳极,所以X为直流电源的负极,Y为直流电源的正极,故A错误;
B.阳极上、被氧化生成,亚硫酸是弱酸,硫酸是强酸,所以阳极附近增大,溶液的减小,故B正确;
C.阳极室中,被氧化生成,硫酸浓度增大,所以,故C错误;
D.该电解池中阴极上发生还原反应,应该是得电子生成,故D错误;
答案选B。
16. KI与O2反应速率慢 4I -+O2+2H2O=I2+4OH- 有 pH=10的KOH溶液 O2+2H2O+4e- = 4OH- 生成的I2与OH-反应
【详解】(1) 实验①中5 分钟后无明显变化可能是反应并没有发生,也可能是反应速率太慢,时间太短不足以观察到现象,故答案为:KI 与 O2 反应速率慢;
(2)若放置5小时后,实验①中的溶液变蓝,是因为碘离子能被氧气氧化成 I2,反应离子方程式为:4I-+O2+2H2O=I2+4OH-;
(3) 对比实验②和实验③可以排除氯离子对反应的影响,如果去掉实验 ③则不能说明氯离子对反应是否有影响,故答案为:有;
(4) i:因甲同学提出猜想“pH=10时O2不能氧化 I-”,所以通氧气的一侧烧杯中应加pH=10 的 KOH 溶液,故答案为:pH=10 的 KOH 溶液;
ii. 实验结果是b 中溶液变蓝,说明pH=10时,氧气可以氧化碘离子,从而说明猜想不成立,则通入 O2后,a中的电极反应式是O2+2H2O+4e- = 4OH-;
iii.实验⑥的结果说明pH=10时,氧气可以氧化碘离子,而实验 ⑤中“无明显现象的原因”只能是产生的碘单质被碱消耗导致,即生成的I2 与 OH-反应。
17. 环形玻璃搅拌棒 保温(或隔热、或减少热量损失) 偏小 不相等 相等 偏小 3.4℃ -56.8kJ/mol
【详解】(1)为了测得温度的最高值,应在最短的时间内让盐酸和氢氧化钠充分反应,故缺少环形玻璃搅拌棒;
(2)为了测得温度的最高值,应加强保温、隔热和防止热量散失措施,应在大小烧杯间填满碎泡沫(或纸条),并使小烧杯口与大烧杯口相平;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,与原实验相比,用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行上述实验,生成水的量增多,所放出的热量偏高;中和热是指强酸和强碱在稀溶液中反应生成1mol水时放出的热,与酸碱的用量无关,所以与原实验相比,用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行上述实验测得中和热数值相等;
(5)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小;
(6)①2.2℃②3.5℃③3.3℃中,①误差较大,应舍弃,用②③3组数据计算平均值为;50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液反应生成水的物质的量为0.5mol/L×0.05L=0.025mol,溶液质量为100mL×1g/mL=100g,温度变化为3.4℃,该反应放热Q=cm t=4.18J/(g.℃) ×100g×3.4℃=1.4212kJ,故 H=;
18.(1)CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ mol-1
(2)CH3OH-6e-+8OH-=CO+6H2O
(3)2CuSO4+2H2O2Cu+2H2SO4+O2↑
(4) 1.16 0.1mol/L
(5)0.8
【详解】(1)已知:
①CH3OHg+H2Og=CO2g+3H2g ΔH=49.0kJ mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ mol-1
③H2Og=H2Ol ΔH=-44kJ mol-1
则根据盖斯定律②×3-①×2+③×2即得到表示甲醇摩尔燃烧焓的热化学方程式为CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ mol-1。
(2)甲池燃料电池中通入甲醇的是负极,则负极反应方程式为CH3OH-6e-+8OH-=CO+6H2O。
(3)乙池是电解池,石墨电极和电源正极相连,氢氧根放电,银电极是阴极,铜离子放电,则其中电解总反应的化学方程式为2CuSO4+2H2O2Cu+2H2SO4+O2↑。
(4)甲池中消耗224mL(标准状况下)O2,氧气的物质的量是0.01mol,转移0.04mol电子,丙中得到的沉淀是氢氧化镁,根据转移电子守恒可知形成0.02mol氢氧化镁,则此时丙池中理论上最多产生沉淀的质量是0.02mol×58g/mol=1.16g,产生氢离子是0.04mol,因此该溶液的c(H+)=0.04mol÷0.4L=0.1mol/L。
(5)溶液中n(Cu2+)=0.2L×0.5mol/L=0.1mol,n(H+)=0.2L×2mol/L=0.4mol,c(Cl-)=0.2L×2mol/L=0.4mol,开始阶段,阴极电极反应为:Cu2++2e-=Cu,阳极电极反应为:2Cl--2e-=Cl2↑,电解一段时间后,当两极收集到相同体积(相同条件)的气体,且阳极生成氧气,则阴极还发生反应:2H++2e-=H2↑,阳极还发生:4OH--4e-=2H2O+O2↑,阳极生成氯气为0.2mol,假设氧气为xmol,则氢气为(x+0.2)mol,根据电子转移守恒,则0.1mol×2+(x+0.2)mol×2=0.2mol×2+xmol×4,解得x=0.1,故电路中转移的电子的物质的量是0.1mol×2+(x+0.2)mol×2=0.8mol。
19. 电解池 O2 +4e-+2H2O = 4OH- 阳极 2H2O-4e-= O2↑+4H+ 2CuSO4 + 2H2O2Cu +O2↑+2H2SO4 2.8 B
【分析】由图可知甲图为原电池是一甲醇燃料电池,通甲醇的A为负极、B为正极;乙池为电解池,C为阳极电极反应为:Ag-e-=Ag+,D为阴极,电极反应为Cu2++2e-=Cu;丙池为电解池,E为阳极,电极反应为:2H2O-4e-=O2↑+4H+,F电极为阴极,电极反应为:Cu2++2e-=Cu,总反应方程式为:2CuSO4+2H2O2H2SO4+2Cu+O2↑,一段时间后,断开电键K,要使丙池恢复到反应前浓度需加入CuO或者CuCO3,据此分析解答。
【详解】(1)由图可知乙图为电解池;甲图为原电池,B电极通入氧气,为正极,氧气在碱性条件下得电子产生氢氧根离子,电极反应式为:O2 +4e-+2H2O = 4OH-;
(2)丙池为电解池,其中E电极连接电源正极,为阳极,电极反应式为:2H2O-4e-=O2↑+4H+,F电极连接电源负极,为阴极,发生反应:Cu2++2e-=Cu,总反应方程式为:2CuSO4+2H2O2H2SO4+2Cu+O2↑;
(3)乙池中C为阳极电极反应为:Ag-e-=Ag+,D为阴极,电极反应为Cu2++2e-=Cu;n(Ag)==0.5mol,由于Ag是+1价的金属,所以转移电子的物质的量为0.5mol,由于在同一闭合回路中电子转移数目相等,所以甲池中反应消耗O2的物质的量n(O2)=×0.5mol=0.125mol,则消耗氧气在标准状况下的体积V(O2)=0.125mol×22.4L/mol=2.8L;
(4)一段时间后,断开电键K,根据少什么加什么,丙池一个电极产生Cu单质,另一个电极产生O2,相当于从溶液中出去的物质为Cu与O2反应产生的CuO。
A.Cu与硫酸不能反应,不能达到目的,选项A错误;
B.CuO与硫酸反应,产生硫酸铜和水,能达到目的,选项B正确;
C.Cu(OH)2比CuO多一个水的组成,相当于对溶液进行了稀释,不能使丙池恢复到反应前浓度,选项C错误;
D.Cu2(OH)2CO3与硫酸生成硫酸铜、二氧化碳和水,比等物质的量的CuO多一个水的组成,相当于对溶液进行了稀释,不能使丙池恢复到反应前浓度,选项D错误;
答案选B。
【点睛】本题考查了原电池和电解池,侧重于电极反应式书写和电子守恒在计算中应用的考查,对于多池串联电路,通入燃料的电池为原电池,其它各池为电解池,其中在燃料电池中通入燃料的电极为负极,通入氧气或空气的电极为正极;与负极连接的电极为阴极,与正极连接的电极为阳极,原电池的负极和电解池的阳极发生氧化反应;原电池的正极和电解池的阴极发生还原反应,电极反应式书写时要结合电解质溶液的酸碱性进行。在整个闭合回路中电子转移数目相等。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
