2.1.4碳酸钠、碳酸氢钠的鉴别、转化与除杂课件(共21张ppt)2023-2024学年高一上学期化学人教版(2019)必修第一册+
文档属性
| 名称 | 2.1.4碳酸钠、碳酸氢钠的鉴别、转化与除杂课件(共21张ppt)2023-2024学年高一上学期化学人教版(2019)必修第一册+ |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第四课时
碳酸钠、碳酸氢钠的鉴别、除杂与转化
学习目标 1min
学会Na2CO3、NaHCO3的鉴别、转化、除杂方法
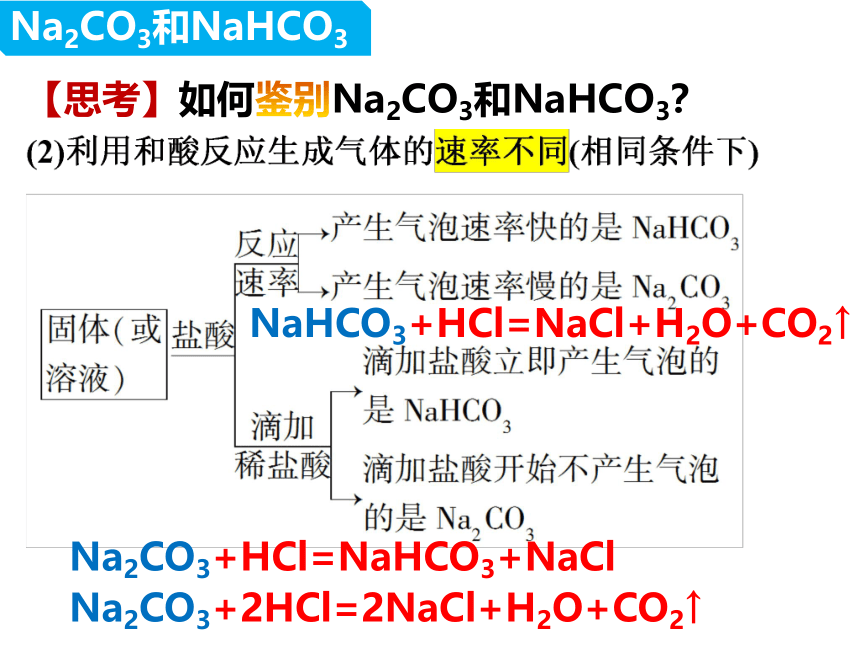
【思考】如何鉴别Na2CO3和NaHCO3?
(1)利用热稳定性不同
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
教师点拨 25min
Na2CO3和NaHCO3
【思考】如何鉴别Na2CO3和NaHCO3?
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+HCl=NaHCO3+NaCl
Na2CO3和NaHCO3
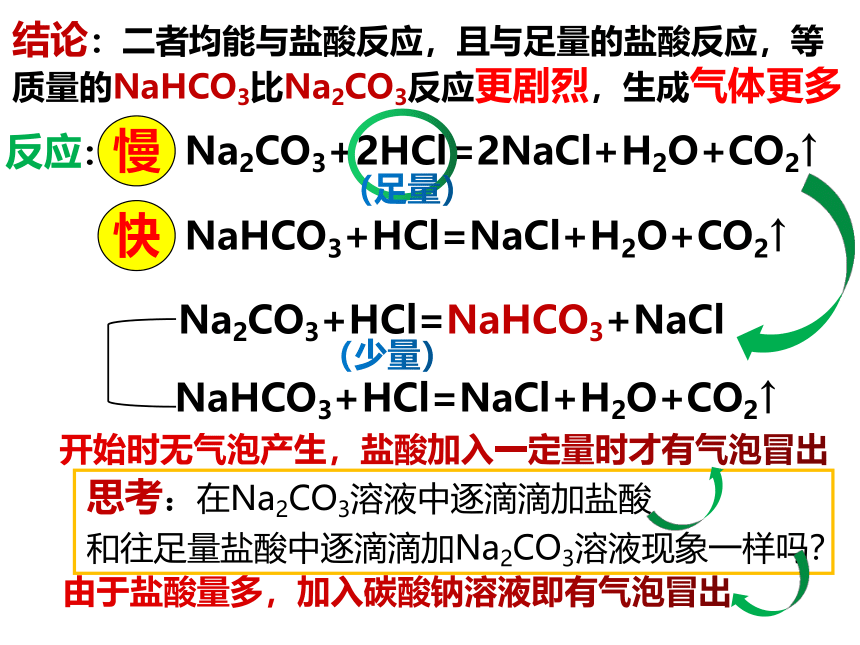
结论:二者均能与盐酸反应,且与足量的盐酸反应,等质量的NaHCO3比Na2CO3反应更剧烈,生成气体更多
反应:
慢
快
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2↑
思考:在Na2CO3溶液中逐滴滴加盐酸
和往足量盐酸中逐滴滴加Na2CO3溶液现象一样吗?
开始时无气泡产生,盐酸加入一定量时才有气泡冒出
由于盐酸量多,加入碳酸钠溶液即有气泡冒出
(少量)
(足量)
【思考】如何鉴别Na2CO3和NaHCO3?
不可以用Ba(OH)2、Ca(OH)2鉴别!!!
Na2CO3+Ba(OH)2=2NaOH+BaCO3↓
NaHCO3+Ba(OH)2(足)=BaCO3↓+NaOH+H2O
2NaHCO3+Ba(OH)2(不足)=BaCO3↓+Na2CO3+2H2O
Na2CO3和NaHCO3
【思考】如何鉴别Na2CO3和NaHCO3?
碱性:Na2CO3>NaHCO3
(4)利用两溶液碱性的不同
溶液
测pH
pH大的是Na2CO3
pH小的是NaHCO3
红色浅的是NaHCO3
红色深的是Na2CO3
滴加无色酚酞
Na2CO3和NaHCO3
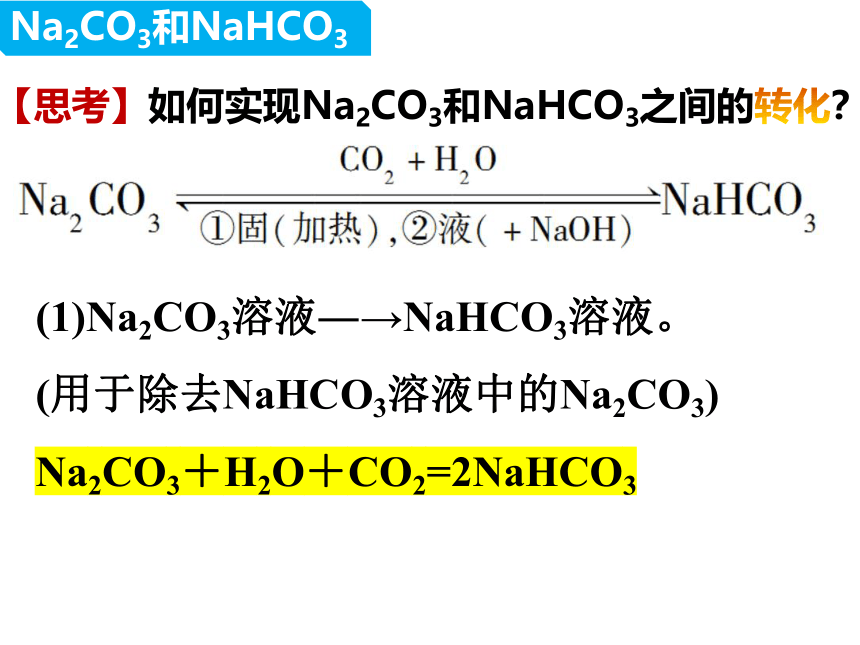
【思考】如何实现Na2CO3和NaHCO3之间的转化?
(1)Na2CO3溶液―→NaHCO3溶液。
(用于除去NaHCO3溶液中的Na2CO3)
Na2CO3+H2O+CO2=2NaHCO3
Na2CO3和NaHCO3
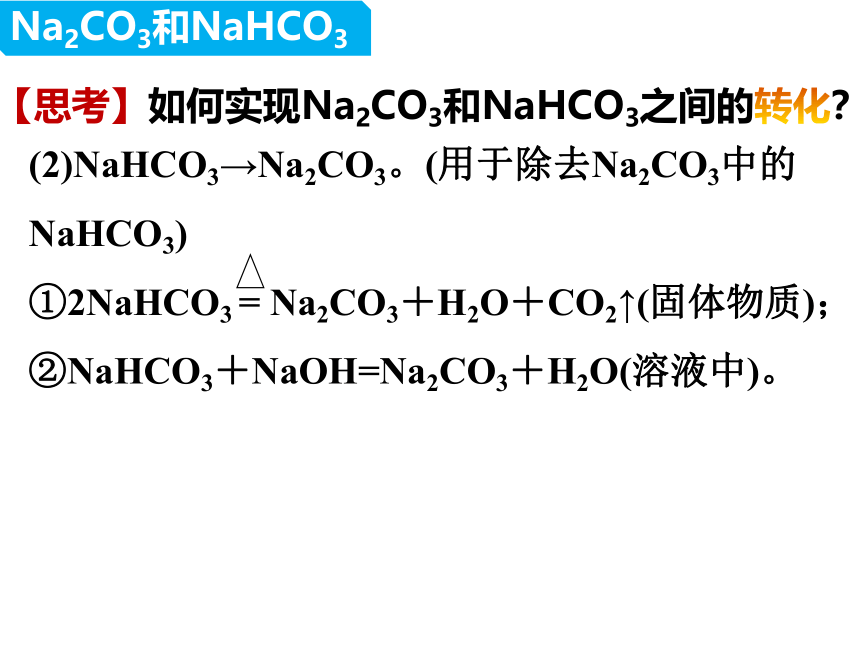
【思考】如何实现Na2CO3和NaHCO3之间的转化?
(2)NaHCO3→Na2CO3。(用于除去Na2CO3中的NaHCO3)
①2NaHCO3 = Na2CO3+H2O+CO2↑(固体物质);
②NaHCO3+NaOH=Na2CO3+H2O(溶液中)。
Na2CO3和NaHCO3
Na2CO3和NaHCO3
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
NH3·H2O+CO2=NH4HCO3
NH4+、HCO3-
Na+、 Cl-
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
原理:
NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
2NaHCO3 = Na2CO3+H2O+CO2↑
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
1.为什么先通NH3后通CO2?
因为CO2在水中的溶解度较小,而NH3易溶于水,且氨气溶于水后生成碱性的NH3·H2O,能与CO2反应,溶解更多的CO2
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
2.最后产物中的饱和食盐水和CO2要如何处理?
循环使用→提高了CO2和饱和食盐水的利用率
(循环使用)
(循环使用)
侯氏制碱法——又称联合制碱法
1.为确认碳酸氢钠固体中是否含有碳酸钠,下列实验操作及判断正确的是( )A.加热,观察是否放出气体B.滴加盐酸,观察是否放出气体C.溶于水中,滴加澄清石灰水,观察是否有白色沉淀生成D.溶于水中,滴加少量氯化钡溶液,观察是否有白色沉淀生成
D
NaHCO3+Ca(OH)2(足)=CaCO3↓+NaOH+H2O
2NaHCO3+Ca(OH)2(不足)=CaCO3↓+Na2CO3+2H2O
实战演练
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了_____,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
H2O
CO2
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
>
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
温度高
温度低
3.下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )A.相同条件下,二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的B.二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的C.等质量的二者与足量盐酸反应生成CO2的量一样多D.二者在一定条件下可以相互转化
D
小于
大于
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
84
106
Na2CO3+CO2+H2O=2NaHCO3
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
4.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
D
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
2Na2O+O2=2Na2O2
5.(实验探究题)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,做了如图所示的实验。
(1) 乙
4.
(2)
(3)
NaHCO3
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
C
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第四课时
碳酸钠、碳酸氢钠的鉴别、除杂与转化
学习目标 1min
学会Na2CO3、NaHCO3的鉴别、转化、除杂方法
【思考】如何鉴别Na2CO3和NaHCO3?
(1)利用热稳定性不同
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
教师点拨 25min
Na2CO3和NaHCO3
【思考】如何鉴别Na2CO3和NaHCO3?
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+HCl=NaHCO3+NaCl
Na2CO3和NaHCO3
结论:二者均能与盐酸反应,且与足量的盐酸反应,等质量的NaHCO3比Na2CO3反应更剧烈,生成气体更多
反应:
慢
快
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+HCl=NaHCO3+NaCl
NaHCO3+HCl=NaCl+H2O+CO2↑
思考:在Na2CO3溶液中逐滴滴加盐酸
和往足量盐酸中逐滴滴加Na2CO3溶液现象一样吗?
开始时无气泡产生,盐酸加入一定量时才有气泡冒出
由于盐酸量多,加入碳酸钠溶液即有气泡冒出
(少量)
(足量)
【思考】如何鉴别Na2CO3和NaHCO3?
不可以用Ba(OH)2、Ca(OH)2鉴别!!!
Na2CO3+Ba(OH)2=2NaOH+BaCO3↓
NaHCO3+Ba(OH)2(足)=BaCO3↓+NaOH+H2O
2NaHCO3+Ba(OH)2(不足)=BaCO3↓+Na2CO3+2H2O
Na2CO3和NaHCO3
【思考】如何鉴别Na2CO3和NaHCO3?
碱性:Na2CO3>NaHCO3
(4)利用两溶液碱性的不同
溶液
测pH
pH大的是Na2CO3
pH小的是NaHCO3
红色浅的是NaHCO3
红色深的是Na2CO3
滴加无色酚酞
Na2CO3和NaHCO3
【思考】如何实现Na2CO3和NaHCO3之间的转化?
(1)Na2CO3溶液―→NaHCO3溶液。
(用于除去NaHCO3溶液中的Na2CO3)
Na2CO3+H2O+CO2=2NaHCO3
Na2CO3和NaHCO3
【思考】如何实现Na2CO3和NaHCO3之间的转化?
(2)NaHCO3→Na2CO3。(用于除去Na2CO3中的NaHCO3)
①2NaHCO3 = Na2CO3+H2O+CO2↑(固体物质);
②NaHCO3+NaOH=Na2CO3+H2O(溶液中)。
Na2CO3和NaHCO3
Na2CO3和NaHCO3
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
NH3·H2O+CO2=NH4HCO3
NH4+、HCO3-
Na+、 Cl-
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
原理:
NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
2NaHCO3 = Na2CO3+H2O+CO2↑
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
1.为什么先通NH3后通CO2?
因为CO2在水中的溶解度较小,而NH3易溶于水,且氨气溶于水后生成碱性的NH3·H2O,能与CO2反应,溶解更多的CO2
侯氏制碱法——又称联合制碱法
饱和食盐水
氨盐水
沉淀
NaHCO3
滤液
NH4Cl
NaCl
CO2
NH3
合成氨工厂
CO2
Na2CO3
NH4Cl
饱和食盐水
洗涤、
过滤
通CO2
通NH3
煅烧
加NaCl细粉
通NH3
冷却、过滤、
洗涤、干燥
2.最后产物中的饱和食盐水和CO2要如何处理?
循环使用→提高了CO2和饱和食盐水的利用率
(循环使用)
(循环使用)
侯氏制碱法——又称联合制碱法
1.为确认碳酸氢钠固体中是否含有碳酸钠,下列实验操作及判断正确的是( )A.加热,观察是否放出气体B.滴加盐酸,观察是否放出气体C.溶于水中,滴加澄清石灰水,观察是否有白色沉淀生成D.溶于水中,滴加少量氯化钡溶液,观察是否有白色沉淀生成
D
NaHCO3+Ca(OH)2(足)=CaCO3↓+NaOH+H2O
2NaHCO3+Ca(OH)2(不足)=CaCO3↓+Na2CO3+2H2O
实战演练
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
请探究下列问题(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了_____,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了________。
H2O
CO2
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3________(填“>”或“<”)NaHCO3。
>
2.用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
温度高
温度低
3.下列关于碳酸钠和碳酸氢钠的比较中,正确的是( )A.相同条件下,二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的B.二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的C.等质量的二者与足量盐酸反应生成CO2的量一样多D.二者在一定条件下可以相互转化
D
小于
大于
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
84
106
Na2CO3+CO2+H2O=2NaHCO3
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
4.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
D
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
2Na2O+O2=2Na2O2
5.(实验探究题)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,做了如图所示的实验。
(1) 乙
4.
(2)
(3)
NaHCO3
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
C
