2023-2024学年河南省部分名校高二(上)第二次月考化学试卷(10月份)(无答案)
文档属性
| 名称 | 2023-2024学年河南省部分名校高二(上)第二次月考化学试卷(10月份)(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 416.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 10:07:34 | ||
图片预览


文档简介
2023年秋季河南省高二第二次联考
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1第一章至第三章第三节。
5.可能用到的相对原子质量:H1 C12 N14 O16 S32 V51
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“嵩岳苍苍,河水泱泱,中原文化悠且长”。河南省是中华民族和华夏文明的重要发祥地,更是我国产粮大省,小麦总产量占全国的四分之一左右,下列有关说法错误的是
A.经常使用铵态氮肥会造成土壤酸化
B.小麦收割机的发动机工作时,包含化学能转化为热能的过程
C.农民伯伯收割小麦会流出大量汗液,汗液属于电解质
D.小麦保存时常常采用低温冷冻技术,原因之一是温度低,腐烂速率会减慢
2.下列诗词中,包含、的化学变化的是
A.日照香炉生紫烟,遥看瀑布挂前川 B.美人首饰侯王印,尽是沙中浪底来
C.日暮北风吹雨去,数峰清瘦出云来 D.千锤万凿出深山,烈火焚烧若等闲
3.25℃时,下列离子组在指定条件下能大量共存的是
A.碳酸钠溶液中:K+、Mg2+、OH-、
B.的溶液中:Fe3+、Cu2+、Cl-、
C.能使甲基橙变红的溶液中:H+、Mg2+、Cl-、
D.水电离出的的溶液中:Na+、Ca2+、、Cl-
4.我国古代哲学认为物质是阴阳组成的对立统一体,下列化学知识正确且最能体现阴阳对立统一的是
A.NaHCO3溶液中既有的转换关系又有的转换关系
B.化学反应伴随能量变化
C.温度升高,纯水中的与均增大
D.绝大多数的化学反应是有限度的,限度越低的反应,化学反应速率越大
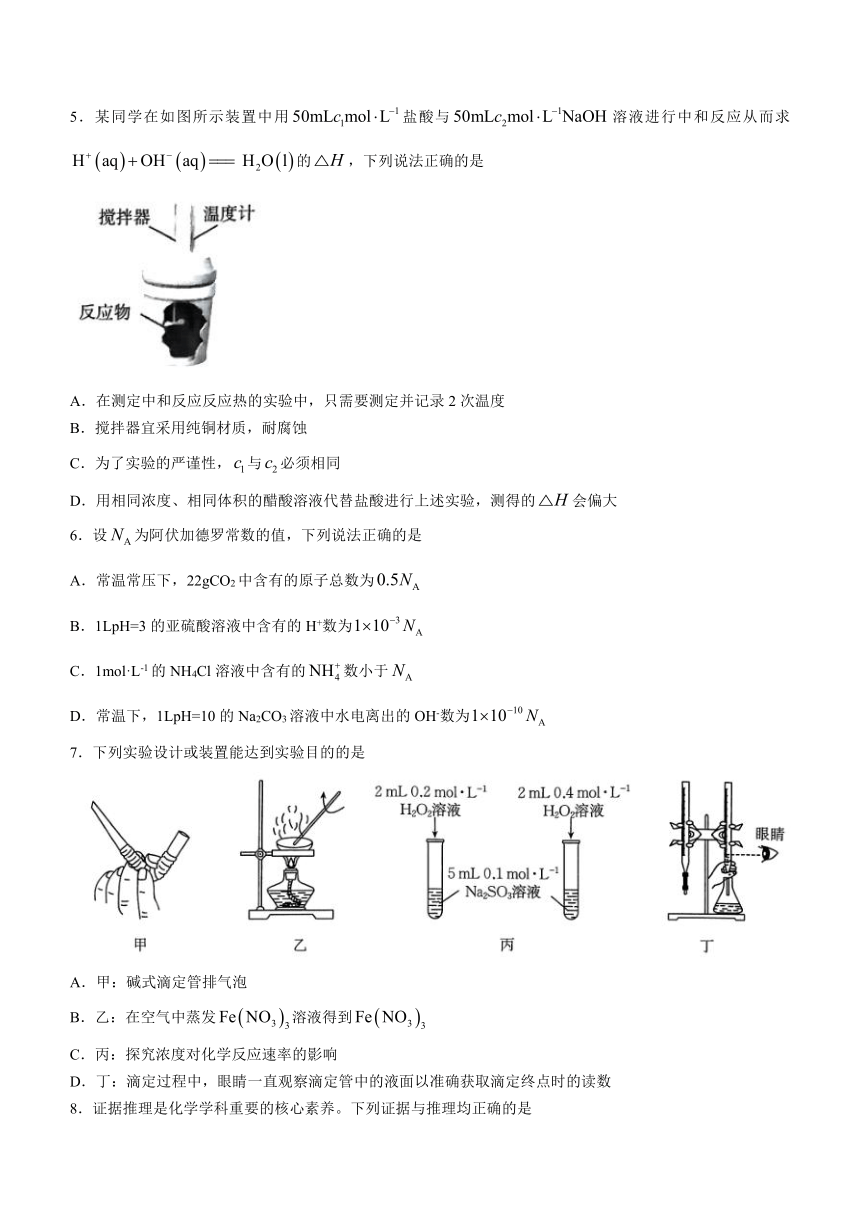
5.某同学在如图所示装置中用盐酸与溶液进行中和反应从而求的,下列说法正确的是
A.在测定中和反应反应热的实验中,只需要测定并记录2次温度
B.搅拌器宜采用纯铜材质,耐腐蚀
C.为了实验的严谨性,与必须相同
D.用相同浓度、相同体积的醋酸溶液代替盐酸进行上述实验,测得的会偏大
6.设为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,22gCO2中含有的原子总数为
B.1LpH=3的亚硫酸溶液中含有的H+数为
C.1mol·L-1的NH4Cl溶液中含有的数小于
D.常温下,1LpH=10的Na2CO3溶液中水电离出的OH-数为
7.下列实验设计或装置能达到实验目的的是
A.甲:碱式滴定管排气泡
B.乙:在空气中蒸发溶液得到
C.丙:探究浓度对化学反应速率的影响
D.丁:滴定过程中,眼睛一直观察滴定管中的液面以准确获取滴定终点时的读数
8.证据推理是化学学科重要的核心素养。下列证据与推理均正确的是
选项 证据 推理
A 室温下,0.1mol·L-1的HA溶液的导电能力比0.1mol·L-1的H2B溶液弱 酸性:HA的酸性弱于H2B
B 增大压强,化学反应速率加快 增大压强,活化分子百分数增多
C 室温下,0.5mol·L-1碳酸氢钠溶液的pH比0.5mol·L-1亚硫酸氢钠溶液的pH大
D 向2mL30%的H2O2溶液中滴加浓硫酸,产生气体的速率加快 H2SO4对H2O2的分解具有催化作用
9.常温下,部分弱电解质的电离平衡常数如表:
弱电解质 HCOOH HCN H2CO3 NH3·H2O
电离平衡常数
下列说法错误的是
A.结合OH-的能力:
B.0.1mol·L-1的NH4HCO3溶液中存在关系:
C.等体积、等浓度的HCN溶液与氨水混合,充分反应后溶液呈碱性
D.25℃时,pH=7的HCOONa与HCOOH的混合溶液中存在关系:
10.一定温度下,反应在密闭容器中达到平衡时,测得、、。相同温度下,按下列4组初始浓度进行实验,下列说法错误的是
① ② ③ ④
0.40 0.20 0.20 0.60
0.60 0.60 0.10 0.40
0 1.20 0.40 0
A.平衡时I2的体积分数:①=②
B.③中:
C.④中反应达到平衡时,I2的转化率为50%
D.该温度下,③中反应的平衡常数
11.下列离子方程式书写正确的是
A.少量的SO2通入NaClO溶液中:
B.NaHCO3溶液与过量的澄清石灰水混合:
C.氯化铵溶液除铁锈:
D.少量乙酸溶液与小苏打溶液混合:
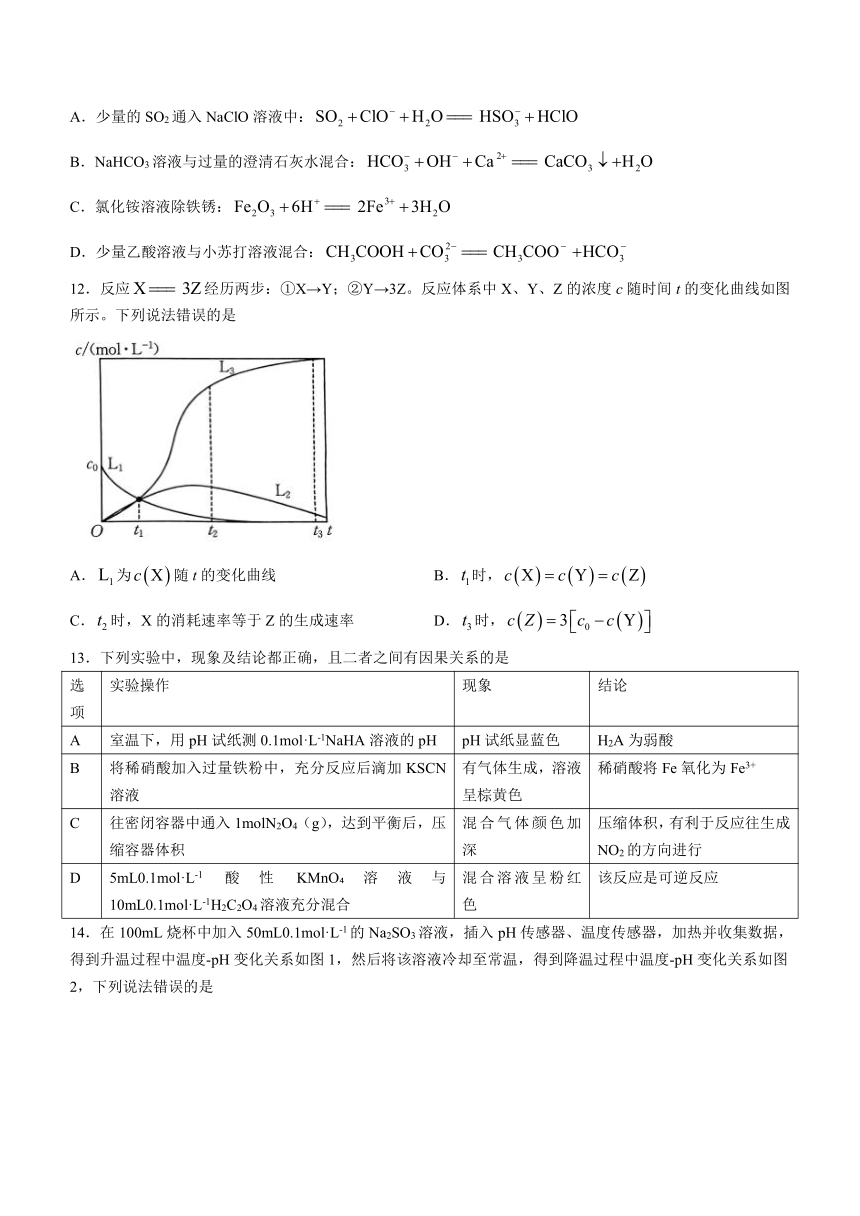
12.反应经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A.为随t的变化曲线 B.时,
C.时,X的消耗速率等于Z的生成速率 D.时,
13.下列实验中,现象及结论都正确,且二者之间有因果关系的是
选项 实验操作 现象 结论
A 室温下,用pH试纸测0.1mol·L-1NaHA溶液的pH pH试纸显蓝色 H2A为弱酸
B 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈棕黄色 稀硝酸将Fe氧化为Fe3+
C 往密闭容器中通入1molN2O4(g),达到平衡后,压缩容器体积 混合气体颜色加深 压缩体积,有利于反应往生成NO2的方向进行
D 5mL0.1mol·L-1酸性KMnO 溶液与10mL0.1mol·L-1H2C2O4溶液充分混合 混合溶液呈粉红色 该反应是可逆反应
14.在100mL烧杯中加入50mL0.1mol·L-1的Na2SO3溶液,插入pH传感器、温度传感器,加热并收集数据,得到升温过程中温度-pH变化关系如图1,然后将该溶液冷却至常温,得到降温过程中温度-pH变化关系如图2,下列说法错误的是
A.温度升高,Na2SO3溶液pH下降的原因之一是水的电离程度增大
B.恢复到室温时,pH比原溶液小的原因是部分Na2SO3被氧化
C.a点溶液中存在关系:
D.降温至25℃的过程中,溶液中始终存在:
二、非选择题:本题共4小题,共58分。
15.(14分)回答下列问题:
(1)可溶性铝盐常用作净水剂,原因是___________(写离子方程式)。
(2)25℃时,纯水中的___________;温度升高至100℃时,纯水的pH=6,此时溶液呈___________(填“酸”、“碱”或“中”)性;100℃时,0.1mol·L-1NaOH溶液的pH=___________。
(3)25℃时,稀盐酸与溶液混合,忽略溶液混合时的体积变化。若,则混合溶液的pH=___________;若混合溶液的pH=12,则____________。(已知溶液pH均为25℃时的pH,)
(4)已知:25℃时,H3PO3的、,H3PO3溶液与过量的NaOH溶液反应生成的盐为Na2HPO3。则25℃时,0.1mol·L-1NaH2PO3溶液的pH___________(填“>”、“<”或“=”)7,__________(填“>”或“<”)。
16.(14分)五氧化二钒(V2O5)用作某些氧化反应的催化剂,具有极高的工业利用价值。一种利用石煤钒矿(主要成分为V2O5、V2O4、SiO2、CaO、Al2O3、Fe2O3等)制备五氧化二钒的工艺流程如图。
已知:
V2O5在稀硫酸中转化为;常温下,部分含钒物质在水中的溶解性见下表:
物质 V2O5 VOSO4 NH4VO3
溶解性 难溶 可溶 易溶 难溶
回答下列问题:
(1)用稀硫酸酸浸时,为了加快酸没速率,可以采取的措施有___________(填一种);加入稀硫酸后,V2O4转化为VOSO4,该反应的离子方程式为__________;滤渣1的主要成分为__________。
(2)调pH时,Fe3+、Al3+会形成相应的沉淀,调pH时可适当加热,目的是__________;调pH后再用双氧水将溶液中的低价钒完全氧化为,该过程温度不宜过高,原因是____________。
(3)“离子交换”和“洗脱”可简单表示为(ROH为阴离子交换树脂)。为了提高洗脱效率,淋洗液可选择___________(填标号)。
A.稀盐酸 B.KOH C.NaOH D.稀硫酸
(4)生成偏钒酸铵(NH4VO3)的离子方程式为____________;偏钒酸铵煅烧完全时,失重率为___________%。(保留小数点后一位,固体失重率=对应温度下样品失重的质量÷样品的初始质量×100%)
17.(15分)为保障人民健康,我国制定了十分严格的SO2使用标准,《食品安全国家标准食品添加剂使用标准》(GB2760-2014)规定含硫类食品添加剂的最大使用量范围为0.01~0.4g·kg-1(以SO2残留量计算)。某化学兴趣小组按照如下步骤测定内黄大枣中SO2的残留量。
i.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2mL·min-1并低于100℃加热,蒸出的SO2用双氧水吸收,实验装置如图所示(夹持和加热装置已省略)。
ii.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
iii.滴加几滴酚酞作指示液,用0.01mol·L-1的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 1 2 3 4
标准液初始读数/mL 0.00 0.10 0.40 0.50
标准液滴定终点读数/mL 8.80 8.95 10.25 9.25
回答下列问题:
(1)持续通N2的作用是_____________;双氧水吸收SO2时的化学方程式为____________。
(2)步骤ii中盛装0.01mol·L-1的NaOH标准液的仪器为_____________(填标号),该仪器使用之前需要进行的操作为_____________。
A. B. C. D.
(3)步骤ii中煮沸的目的可能是__________。
(4)步骤ii滴定终点的现象为___________,下列操作会使测得的SO2含量偏大的是__________(填标号)。
a.滴定前尖嘴处有气泡,滴定后消失
b.盛装0.01mol·L-1的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时仰视刻度线,滴定终点读数时俯视刻度线
d.氮气流速过快
(5)该大枣中SO2的残留量为____________(保留小数点后两位)g·kg-1,____________(填“符合”或“不符合”)国家标准。
18.(15分)化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤气化过程如下:
反应1
反应2
反应3
①_____________。
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为__________;使用催化剂,____________(填“能”或“不能”)改变a的值。
(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应: 。
①下列情况表明反应已达到平衡状态的是_________(填标号)。
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在______(填“高温”、“低温”或“任何温度”)下自发。
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应: 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是_________(填标号)。
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降低温度并加入合适的催化剂
②时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为_________mol·L-1·min-1,该温度下的平衡常数_________(用分数表示);该温度下,改变投料,某时刻容器内、、,则此时__________(填“>”、“<”或“=”)。
化学
本试卷满分100分,考试用时75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:人教版选择性必修1第一章至第三章第三节。
5.可能用到的相对原子质量:H1 C12 N14 O16 S32 V51
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“嵩岳苍苍,河水泱泱,中原文化悠且长”。河南省是中华民族和华夏文明的重要发祥地,更是我国产粮大省,小麦总产量占全国的四分之一左右,下列有关说法错误的是
A.经常使用铵态氮肥会造成土壤酸化
B.小麦收割机的发动机工作时,包含化学能转化为热能的过程
C.农民伯伯收割小麦会流出大量汗液,汗液属于电解质
D.小麦保存时常常采用低温冷冻技术,原因之一是温度低,腐烂速率会减慢
2.下列诗词中,包含、的化学变化的是
A.日照香炉生紫烟,遥看瀑布挂前川 B.美人首饰侯王印,尽是沙中浪底来
C.日暮北风吹雨去,数峰清瘦出云来 D.千锤万凿出深山,烈火焚烧若等闲
3.25℃时,下列离子组在指定条件下能大量共存的是
A.碳酸钠溶液中:K+、Mg2+、OH-、
B.的溶液中:Fe3+、Cu2+、Cl-、
C.能使甲基橙变红的溶液中:H+、Mg2+、Cl-、
D.水电离出的的溶液中:Na+、Ca2+、、Cl-
4.我国古代哲学认为物质是阴阳组成的对立统一体,下列化学知识正确且最能体现阴阳对立统一的是
A.NaHCO3溶液中既有的转换关系又有的转换关系
B.化学反应伴随能量变化
C.温度升高,纯水中的与均增大
D.绝大多数的化学反应是有限度的,限度越低的反应,化学反应速率越大
5.某同学在如图所示装置中用盐酸与溶液进行中和反应从而求的,下列说法正确的是
A.在测定中和反应反应热的实验中,只需要测定并记录2次温度
B.搅拌器宜采用纯铜材质,耐腐蚀
C.为了实验的严谨性,与必须相同
D.用相同浓度、相同体积的醋酸溶液代替盐酸进行上述实验,测得的会偏大
6.设为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,22gCO2中含有的原子总数为
B.1LpH=3的亚硫酸溶液中含有的H+数为
C.1mol·L-1的NH4Cl溶液中含有的数小于
D.常温下,1LpH=10的Na2CO3溶液中水电离出的OH-数为
7.下列实验设计或装置能达到实验目的的是
A.甲:碱式滴定管排气泡
B.乙:在空气中蒸发溶液得到
C.丙:探究浓度对化学反应速率的影响
D.丁:滴定过程中,眼睛一直观察滴定管中的液面以准确获取滴定终点时的读数
8.证据推理是化学学科重要的核心素养。下列证据与推理均正确的是
选项 证据 推理
A 室温下,0.1mol·L-1的HA溶液的导电能力比0.1mol·L-1的H2B溶液弱 酸性:HA的酸性弱于H2B
B 增大压强,化学反应速率加快 增大压强,活化分子百分数增多
C 室温下,0.5mol·L-1碳酸氢钠溶液的pH比0.5mol·L-1亚硫酸氢钠溶液的pH大
D 向2mL30%的H2O2溶液中滴加浓硫酸,产生气体的速率加快 H2SO4对H2O2的分解具有催化作用
9.常温下,部分弱电解质的电离平衡常数如表:
弱电解质 HCOOH HCN H2CO3 NH3·H2O
电离平衡常数
下列说法错误的是
A.结合OH-的能力:
B.0.1mol·L-1的NH4HCO3溶液中存在关系:
C.等体积、等浓度的HCN溶液与氨水混合,充分反应后溶液呈碱性
D.25℃时,pH=7的HCOONa与HCOOH的混合溶液中存在关系:
10.一定温度下,反应在密闭容器中达到平衡时,测得、、。相同温度下,按下列4组初始浓度进行实验,下列说法错误的是
① ② ③ ④
0.40 0.20 0.20 0.60
0.60 0.60 0.10 0.40
0 1.20 0.40 0
A.平衡时I2的体积分数:①=②
B.③中:
C.④中反应达到平衡时,I2的转化率为50%
D.该温度下,③中反应的平衡常数
11.下列离子方程式书写正确的是
A.少量的SO2通入NaClO溶液中:
B.NaHCO3溶液与过量的澄清石灰水混合:
C.氯化铵溶液除铁锈:
D.少量乙酸溶液与小苏打溶液混合:
12.反应经历两步:①X→Y;②Y→3Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是
A.为随t的变化曲线 B.时,
C.时,X的消耗速率等于Z的生成速率 D.时,
13.下列实验中,现象及结论都正确,且二者之间有因果关系的是
选项 实验操作 现象 结论
A 室温下,用pH试纸测0.1mol·L-1NaHA溶液的pH pH试纸显蓝色 H2A为弱酸
B 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 有气体生成,溶液呈棕黄色 稀硝酸将Fe氧化为Fe3+
C 往密闭容器中通入1molN2O4(g),达到平衡后,压缩容器体积 混合气体颜色加深 压缩体积,有利于反应往生成NO2的方向进行
D 5mL0.1mol·L-1酸性KMnO 溶液与10mL0.1mol·L-1H2C2O4溶液充分混合 混合溶液呈粉红色 该反应是可逆反应
14.在100mL烧杯中加入50mL0.1mol·L-1的Na2SO3溶液,插入pH传感器、温度传感器,加热并收集数据,得到升温过程中温度-pH变化关系如图1,然后将该溶液冷却至常温,得到降温过程中温度-pH变化关系如图2,下列说法错误的是
A.温度升高,Na2SO3溶液pH下降的原因之一是水的电离程度增大
B.恢复到室温时,pH比原溶液小的原因是部分Na2SO3被氧化
C.a点溶液中存在关系:
D.降温至25℃的过程中,溶液中始终存在:
二、非选择题:本题共4小题,共58分。
15.(14分)回答下列问题:
(1)可溶性铝盐常用作净水剂,原因是___________(写离子方程式)。
(2)25℃时,纯水中的___________;温度升高至100℃时,纯水的pH=6,此时溶液呈___________(填“酸”、“碱”或“中”)性;100℃时,0.1mol·L-1NaOH溶液的pH=___________。
(3)25℃时,稀盐酸与溶液混合,忽略溶液混合时的体积变化。若,则混合溶液的pH=___________;若混合溶液的pH=12,则____________。(已知溶液pH均为25℃时的pH,)
(4)已知:25℃时,H3PO3的、,H3PO3溶液与过量的NaOH溶液反应生成的盐为Na2HPO3。则25℃时,0.1mol·L-1NaH2PO3溶液的pH___________(填“>”、“<”或“=”)7,__________(填“>”或“<”)。
16.(14分)五氧化二钒(V2O5)用作某些氧化反应的催化剂,具有极高的工业利用价值。一种利用石煤钒矿(主要成分为V2O5、V2O4、SiO2、CaO、Al2O3、Fe2O3等)制备五氧化二钒的工艺流程如图。
已知:
V2O5在稀硫酸中转化为;常温下,部分含钒物质在水中的溶解性见下表:
物质 V2O5 VOSO4 NH4VO3
溶解性 难溶 可溶 易溶 难溶
回答下列问题:
(1)用稀硫酸酸浸时,为了加快酸没速率,可以采取的措施有___________(填一种);加入稀硫酸后,V2O4转化为VOSO4,该反应的离子方程式为__________;滤渣1的主要成分为__________。
(2)调pH时,Fe3+、Al3+会形成相应的沉淀,调pH时可适当加热,目的是__________;调pH后再用双氧水将溶液中的低价钒完全氧化为,该过程温度不宜过高,原因是____________。
(3)“离子交换”和“洗脱”可简单表示为(ROH为阴离子交换树脂)。为了提高洗脱效率,淋洗液可选择___________(填标号)。
A.稀盐酸 B.KOH C.NaOH D.稀硫酸
(4)生成偏钒酸铵(NH4VO3)的离子方程式为____________;偏钒酸铵煅烧完全时,失重率为___________%。(保留小数点后一位,固体失重率=对应温度下样品失重的质量÷样品的初始质量×100%)
17.(15分)为保障人民健康,我国制定了十分严格的SO2使用标准,《食品安全国家标准食品添加剂使用标准》(GB2760-2014)规定含硫类食品添加剂的最大使用量范围为0.01~0.4g·kg-1(以SO2残留量计算)。某化学兴趣小组按照如下步骤测定内黄大枣中SO2的残留量。
i.准确称取10.00g去核大枣装入500mL圆底烧瓶中,将样品用硫酸酸化后加入300mL水并通入氮气,将氮气流速调至0.2mL·min-1并低于100℃加热,蒸出的SO2用双氧水吸收,实验装置如图所示(夹持和加热装置已省略)。
ii.充分反应后,合并乙、丙中的吸收液于锥形瓶中,煮沸一段时间后,冷却。
iii.滴加几滴酚酞作指示液,用0.01mol·L-1的NaOH标准液滴定。重复实验四次,所得数据如表所示:
序号 1 2 3 4
标准液初始读数/mL 0.00 0.10 0.40 0.50
标准液滴定终点读数/mL 8.80 8.95 10.25 9.25
回答下列问题:
(1)持续通N2的作用是_____________;双氧水吸收SO2时的化学方程式为____________。
(2)步骤ii中盛装0.01mol·L-1的NaOH标准液的仪器为_____________(填标号),该仪器使用之前需要进行的操作为_____________。
A. B. C. D.
(3)步骤ii中煮沸的目的可能是__________。
(4)步骤ii滴定终点的现象为___________,下列操作会使测得的SO2含量偏大的是__________(填标号)。
a.滴定前尖嘴处有气泡,滴定后消失
b.盛装0.01mol·L-1的NaOH标准液的仪器未用标准液润洗
c.滴定前读数时仰视刻度线,滴定终点读数时俯视刻度线
d.氮气流速过快
(5)该大枣中SO2的残留量为____________(保留小数点后两位)g·kg-1,____________(填“符合”或“不符合”)国家标准。
18.(15分)化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤气化过程如下:
反应1
反应2
反应3
①_____________。
②反应2在催化剂作用下的反应历程如图(TS表示过渡态,*表示吸附态),历程中决速步的方程式为__________;使用催化剂,____________(填“能”或“不能”)改变a的值。
(2)在一定温度下,向某恒容容器中充入2molCO2(g)和2molH2(g),仅发生反应: 。
①下列情况表明反应已达到平衡状态的是_________(填标号)。
A.CO2的体积分数保持不变 B.混合气体的平均摩尔质量保持不变
C.CO2的转化率保持不变 D.CH3OH与H2O的物质的量之比不再改变
②该反应能在______(填“高温”、“低温”或“任何温度”)下自发。
(3)向2L的恒容密闭容器中充入1molCH3OH(g),发生反应: 。其他条件不变时,CH3OH的平衡转化率随着温度(T)的变化如图所示。
①欲提高CH3OH的平衡转化率且加快反应速率,下列措施可能有效的是_________(填标号)。
a.降低温度并及时分离出产物
b.加入合适的催化剂并分离出产物
c.再向容器中充入1molCH3OH(g)
d.适当降低温度并加入合适的催化剂
②时,反应经过20min达到平衡,用C2H4表示该段时间内的平均速率为_________mol·L-1·min-1,该温度下的平衡常数_________(用分数表示);该温度下,改变投料,某时刻容器内、、,则此时__________(填“>”、“<”或“=”)。
同课章节目录
