第3章物质在水溶液中的行为(含解析)综合练习2023——2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章物质在水溶液中的行为(含解析)综合练习2023——2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 10:11:48 | ||
图片预览



文档简介
第3章物质在水溶液中的行为综合练习
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列说法中正确的是
A.NaHCO3溶液中离子浓度大小顺序为c(Na+)>c(OH–)>c()>c(H+)>c()
B.Na2S的溶液中:c(Na+)+c(H+)=c(S2–)+c(HS-)+c(OH–)
C.向AgBr、AgCl的混合饱和溶液中加入少量AgNO3,溶液中减小
D.浓度均为的①NH4Cl②NH4Fe(SO4)2③CH3COONH4④NH3·H2O,c()由小到大的顺序:④<③<①<②
2.20℃时,用0.100mol/L盐酸滴定20mL0.100mol/L氨水的图像如图所示,下列说法不正确的是
A.a、b、c、d均有c(NH)+c(H+)=c(Cl-)+c(OH-)
B.b点时c(NH)=c(Cl-)=c(H+)=c(OH-)
C.c点表示酸碱恰好完全反应
D.d点时c(Cl-)=2c(NH3 H2O)+2c(NH)
3.设NA为阿伏加德罗常数的值。下列说法正确的是
A.16gCH4含有C—H键的数目为4NA
B.1L1.0mol/L的盐酸含有HCl分子总数为NA
C.标准状况下,22.4LNO与11.2LO2混合后的分子数目为NA
D.23gNa与足量O2反应,转移电子数目为1.5NA
4.同种离子用不同试剂鉴定,灵敏度不同。已知最低浓度是指在一定条件下, 某鉴定反应能检出离子并能得出肯定结果时该离子的最低浓度。检出限量是指在一定条件下,某鉴定反应所能检出离子的最小质量。限界稀度指最低浓度的倒数。若最低浓度越小,该方法越灵敏。表为两种鉴定K+灵敏度的几种表示方式:
试剂 试液体积 检出限量 最 低浓度 限界稀度
方法1 Na3[Co(NO2)6] 0.03 mL m c 2.5×105 g·mL-1
方法2 酒石酸钠 0.05 mL 0.3μg 6×10-6 g·mL-1 G
下列说法不正确的是
A.m=1.2 μ g B.c=4 ×10-6 g·mL-1
C.G=1.67 ×105 g·mL-1 D.方法1更灵敏
5.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下):
①常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度都降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
其归纳正确的是 ( )
A.③⑤ B.④⑤ C.①②④ D.全部
6.20℃时向 20mL 0.1mol·L-1 醋酸溶液中不断滴入0.1mol·L-1 NaOH 溶液,溶液 pH 变化如图所示。此过程中溶液中离子浓度的关系错误的是
A.a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c 点:c(H+)=c(CH3COO-)+c(OH-)
D.d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
7.25℃时,向20 mL 0.1 mol/L四氯金酸(HAuCl4)溶液中滴加0.1 mol/LNaOH 溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随 pH变化关系如图2,则下列说法不正确的是
A.b点溶液中存在关系:2c(H+)+c(HAuCl4)= 2c(OH-)+c()
B.X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C.c点溶液中存在关系:c(Na+)= c()
D.d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
8.已知:25℃时,,。该温度下,下列说法错误的是
A.的水解常数为
B.溶于水形成的饱和溶液中,
C.向悬浊液中加入,溶液中增大
D.的平衡常数
9.向锅炉中注入浸泡液,将水垢中的转化为,再用盐酸除去,下列叙述正确的是
A.温度升高,溶液中增大,减小
B.能转化为,说明Ksp(CaCO3)>Ksp(CaSO4)
C.溶解于盐酸而不溶,是因为硫酸的酸性强于盐酸
D.沉淀转化的离子方程式为
10.某溶液中只可能含有下列离子中的几种(不考虑溶液中含量较少的和):、、、、。取200mL该溶液,分为等体积的两份,分别做下列实验。实验1:第一份中加入足量的烧碱溶液并加热,产生的气体在标准状况下的体积为224mL。实验2:第二份中先加入足量的盐酸,无明显现象,再加入足量的溶液,得到固体2.33g。下列说法正确的是( )
A.该溶液中可能含有
B.该溶液中肯定含有、、、
C.该溶液中一定不含
D.该溶液中定含有,且
11.已知在温度和时水的电离平衡曲线如图所示,下列说法错误的是
A.在A、C两点处,水的离子积常数:
B.升高温度可实现由C点到A点
C.时,的硫酸溶液与的氢氧化钠溶液等体积混合,所得溶液的
D.图中矩形POMA的面积表示时水的离子积常数的值
12.在不同温度下,水溶液中与有如图所示关系。下列关于离子共存的说法正确的是( )
A.a点对应的溶液中大量存在、、、
B.b点对应的溶液中大量存在、、、
C.c点对应的溶液中大量存在、、、
D.d点对应的溶液中大量存在、、、
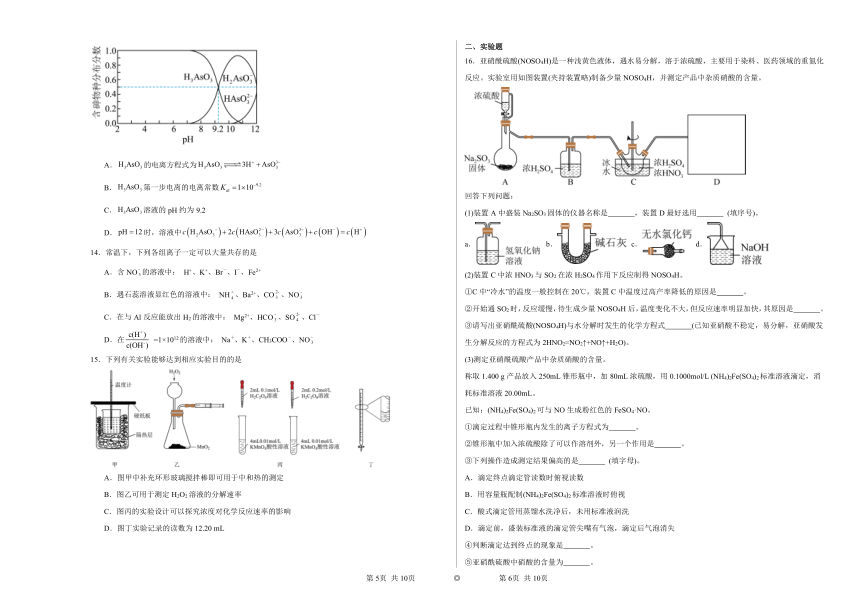
13.亚砷酸()是三元弱酸,可以用于治疗白血病,水溶液中含砷物质的分布分数(平衡时某粒子的浓度占各粒子浓度之和的分数)与pH的关系如图所示,下列说法正确的是( )
A.的电离方程式为
B.第一步电离的电离常数
C.溶液的pH约为9.2
D.时,溶液中
14.常温下,下列各组离子一定可以大量共存的是
A.含NO的溶液中: H+、K+、Br-、I-、Fe2+
B.遇石蕊溶液显红色的溶液中: NH、Ba2+、CO、NO
C.在与Al反应能放出H2的溶液中: Mg2+、HCO、SO、Cl-
D.在 =1×1012的溶液中: Na+、K+、CH3COO-、NO
15.下列有关实验能够达到相应实验目的的是
A.图甲中补充环形玻璃搅拌棒即可用于中和热的测定
B.图乙可用于测定H2O2溶液的分解速率
C.图丙的实验设计可以探究浓度对化学反应速率的影响
D.图丁实验记录的读数为12.20 mL
二、实验题
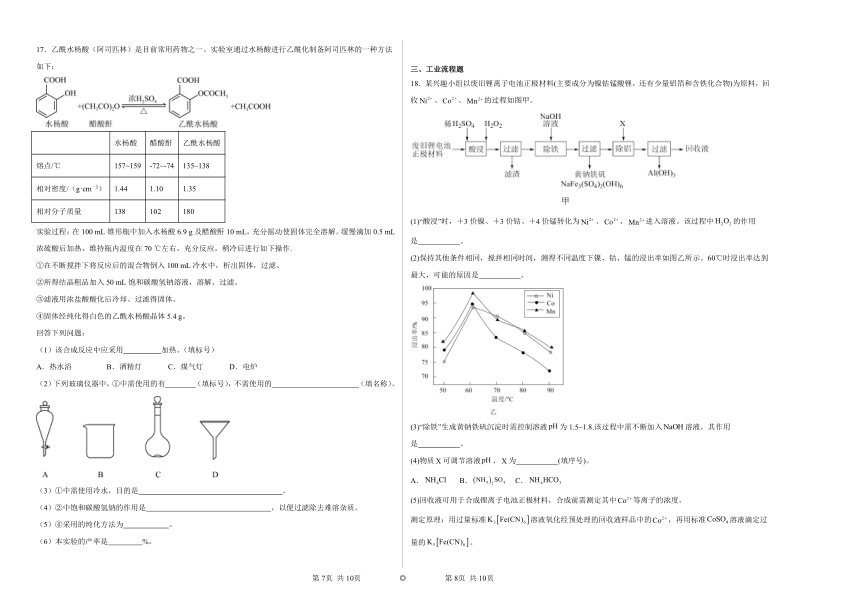
16.亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是 ,装置D最好选用 (填序号)。
a. b. c. d.
(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①C中“冷水”的温度一般控制在20℃,装置C中温度过高产率降低的原因是 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是 。
③请写出亚硝酰硫酸(NOSO4H)与水分解时发生的化学方程式 (已知亚硝酸不稳定,易分解,亚硝酸发生分解反应的方程式为2HNO2=NO2↑+NO↑+H2O)。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250mL锥形瓶中,加80mL浓硫酸,用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①滴定过程中锥形瓶内发生的离子方程式为 。
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是 。
③下列操作造成测定结果偏高的是 (填字母)。
A.滴定终点滴定管读数时俯视读数
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
④判断滴定达到终点的现象是 。
⑤亚硝酰硫酸中硝酸的含量为 。
17.乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸 醋酸酐 乙酰水杨酸
熔点/℃ 157~159 -72~-74 135~138
相对密度/(g·cm﹣3) 1.44 1.10 1.35
相对分子质量 138 102 180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用 加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有 (填标号),不需使用的 (填名称)。
(3)①中需使用冷水,目的是 。
(4)②中饱和碳酸氢钠的作用是 ,以便过滤除去难溶杂质。
(5)④采用的纯化方法为 。
(6)本实验的产率是 %。
三、工业流程题
18.某兴趣小组以废旧锂离子电池正极材料(主要成分为镍钴锰酸锂,还有少量铝箔和含铁化合物)为原料,回收、、的过程如图甲。
(1)“酸浸”时,+3价镍、+3价钴、+4价锰转化为、、进入溶液。该过程中的作用是 。
(2)保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图乙所示。60℃时浸出率达到最大,可能的原因是 。
(3)“除铁”生成黄钠铁矾沉淀时需控制溶液为1.5~1.8.该过程中需不断加入溶液,其作用是 。
(4)物质可调节溶液,为 (填序号)。
A. B. C.
(5)回收液可用于合成锂离子电池正极材料,合成前需测定其中等离子的浓度。
测定原理:用过量标准溶液氧化经预处理的回收液样品中的,再用标准溶液滴定过量的。
反应的离子方程式为。
测定过程:取预处理后的回收液样品,向其中加入溶液,充分反应;再用溶液滴定反应后的溶液,消耗溶液。
数据分析:计算预处理后的回收液样品中的物质的量浓度 (写出计算过程)。
19.铜镉渣主要含锌、铜、铁、镉、钴等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的(金属离子的起始浓度均为)。
氢氧化物
开始沉淀的 1.5 6.5 7.2
沉淀完全的 3.3 9.9 9.5
(1)酸浸时,粉碎铜镉渣的目的是 。
(2)操作Ⅰ产生的滤渣Ⅰ主要成分为 (填化学式)。
(3)①操作Ⅲ中先加入适量,发生反应的离子方程式为 。
②再加入控制反应液的,范围为 。
③若加入的不足,加入后所得的电解液中会含有元素。请设计实验方案加以检验: 。
(4)处理含镉废水时常向其中加入实现沉淀转化,该沉淀转化反应的离子方程式为 ;若反应达到平衡后,溶液中,溶液中 【已知,】。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.NaHCO3溶液中存在着的水解平衡又存在着的电离平衡,且水解大于电离,所以离子浓度大小顺序为c(Na+)> c()>c(OH–)>c(H+)>c(),故A错误;
B.Na2S的溶液中根据可得电荷守恒:c(Na+)+c(H+)=2c(S2–)+c(HS-)+c(OH–),故B错误;
C.向AgBr、AgCl的混合饱和溶液中加入少量AgNO3,溶液中温度不变,该值不变,故C错误;
D.NH3·H2O是弱电解质电离出的c()最小,会抑制的水解,CH3COO-会促进的水解,所以四种溶液中c()由小到大的顺序:④<③<①<②,故D正确;
故选D。
2.B
【详解】A.a、b、c、d均有NH、H+、Cl-和OH-,根据电荷守恒,均有c(NH)+c(H+)=c(Cl-)+c(OH-)故A错误;
B.b点时溶液呈中性,c(H+)=c(OH-),根据电荷守恒c(NH)=c(Cl-),但c(NH)=c(Cl-)>c(H+)=c(OH-),故B正确;
C.c点加入的盐酸为20mL,恰好与氨水完全反应,所以表示酸碱恰好完全反应,故C错误;
D.d点时加入的盐酸为40mL,所得溶液的溶质为等物质的量浓度的氯化铵和盐酸,根据元素质量守恒,c(Cl-)=2c(NH3 H2O)+2c(NH),故D错误;
故选B。
3.A
【详解】A.1个分于含有4个键,1mol含有键,描述正确,符合题意;
B.HCl是强电解质,在水分子作用下会完全电离,盐酸中不存在HCl分子,描述错误,不符题意;
C.NO与反应方程式为:,生成的会产生二聚反应,故混合后的分子数目小于,描述错误,不符题意;
D. 1molNa只能失去1mol电子,描述错误,不符题意;
综上,本题选A。
4.A
【解析】略
5.A
【详解】①加水稀释,c(H+)减小,由于Kw不变,则c(OH-)增大,故①错误;
②由pH=-lgc(H+)可知,pH=2的盐酸和pH=1的盐酸,c(H+)之比为1:10,故②错误;
③溶度积只与温度有关,与溶液的浓度和类型无关,由于溶度积是常数,故氯离子浓度大,则25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同,故③正确;
④pH=7,c(H+)=c(OH-),由电荷守恒可知,溶液中应存在c(Na+)+c(NH)=2c(SO),故④错误;
⑤水解和电离为可逆过程,Ka=,Kh=,则有Ka Kh=Kw,故⑤正确;
综上③⑤正确,答案选A。
6.C
【详解】A.a 点:20mL 0.1mol·L-1 醋酸溶液中滴入10mL 0.1mol·L-1 NaOH 溶液,反应后,溶液中c(CH3COOH)=c(CH3COONa),溶液的pH<7,则表明主要发生CH3COOH电离,c(CH3COO-)增大,但电离程度很小,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),A正确;
B.b 点:溶液的pH=7,此时可认为CH3COOH不电离,CH3COO-不水解,溶液中的c(H+)、c(OH-)主要来自水的微弱电离,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),B正确;
C.c 点:醋酸与NaOH刚好完全反应,生成醋酸钠和水,依据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(H+)≠c(CH3COO-)+c(OH-),C错误;
D.d 点:NaOH过量,此时n(CH3COONa)=2n(NaOH),而CH3COO-水解程度很小,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D正确;
故选C。
7.B
【解析】由图中信息可知,滴加20mL 0.1 mol/LNaOH 溶液时恰好中和,则滴加10mL时恰好中和一半。
【详解】A. b点加入了10mL 0.1 mol/LNaOH 溶液,恰好中和了一半的四氯金酸,根据电荷守恒可知,2c(H+)+2c(Na+)= 2c(OH-)+2c();根据物料守恒可知,2c(Na+)= c(HAuCl4)+c(),联立两式可得2c(H+)+c(HAuCl4)= 2c(OH-)+c(),A正确;
B. 由图中信息可知,X点 c(HAuCl4)=c(),由图1的曲线起点可知, 0.1 mol/L四氯金酸的pH=3,说明四氯金酸是弱酸,则其存在电离平衡,而b点四氯金酸只中和了一半,故b点c(HAuCl4)与c()不相等,B不正确;
C. c点溶液的pH=7,c(H+)= c(OH-)根据电荷守恒可知,c(H+)+c(Na+)= c(OH-)+c(),因此,c(Na+)= c(),C正确;
D. d点时恰好中和,溶液为NaAuCl4溶液,会发生水解而使溶液呈碱性,因此,微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确。
综上所述,说法不正确的是B,故选B。
8.B
【详解】A.在溶液中存在水解平衡:,则水解常数,故A正确;
B.溶于水形成的饱和溶液中,,则有,故B错误;
C.向悬浊液中加入,发生中和反应消耗,溶解平衡正向移动,溶液中增大,故C正确;
D.该反应的平衡常数为,故D正确;
故答案为B。
9.D
【详解】A.温度升高,水的电离平衡H2OH++OH-和的水解平衡+H2O+OH-,均正向移动,则和均增大,故A错误;
B.沉淀之间的转化符合溶解度小的电解质向溶解度更小的电解质转化,能转化为,说明Ksp(CaCO3)<Ksp(CaSO4),故B错误;
C.CaCO3与盐酸反应生成可溶性的氯化钙、水和二氧化碳,即CaCO3+2HCl=CaCl2+CO2↑+H2O,与盐酸不满足复分解反应进行的条件,与、的酸性强弱无关,故C错误;
D.向锅炉中注入浸泡液,水垢中的转化为,离子方程式为,故D正确;
答案为D。
10.D
【分析】实验1可证明原溶液中含有,且其物质的量为0.01mol;实验2可证明原溶液中一定不含有,一定含有,且的物质的量为,根据溶液中的电荷守恒,则一定含有,且的浓度。
【详解】A.由分析可知,溶液中一定含Na+,A错误;
B.结合分析可知,溶液中一定没有,若的浓度为,则根据电荷守恒可知无,若的浓度>,则必有,B错误;
C.结合B可知,溶液可能含,C错误;
D.由分析可知,溶液中一定含有,且,D正确。
答案选D。
11.A
【详解】A. A点对应的、均大于C点对应的、,故水的离子积常数:,A项错误;
B. 升高温度,水的电离平衡正向移动,、增大,可实现由C点到A点,B项正确;
C. 时,的硫酸溶液中,的氢氧化钠溶液中,等体积混合时,二者恰好完全反应,所得溶液的,C项正确;
D. 时,水的离子积常数等于,即,为矩形POMA的面积,D项正确;
故选A。
12.D
【详解】A.a点对应的溶液显中性,而水解使溶液显酸性,故不能大量存在,故A错误;
B.b点对应的溶液显酸性,不能大量存在,且与反应生成一水合氨,二者不能大量共存,故B错误;
C.c点对应的溶液显中性,而水解使溶液显碱性,故不能大量存在,故C错误;
D.d点对应的溶液显碱性,、、、能大量共存,故D项正确;
故选D。
13.B
【详解】A. 是三元弱酸,分步发生电离,第一步电离方程式为,A项错误;
B. 第一步电离的电离常数,由图可知,时,,则,B项正确;
C. 是三元弱酸,其水溶液的pH小于7,C项错误;
D. 时,溶液呈碱性,则有,从而可得,D项错误;
故选B。
14.D
【详解】A.酸性条件下,NO与I-、Fe2+发生氧化还原反应而不能大量共存,A不符合;
B.遇石蕊溶液显红色的溶液是酸性溶液,含有大量H+,与CO发生反应生成CO2而不能大量共存,Ba2+与CO反应生成BaCO3沉淀而不能大量共存,B不符合;
C.在与Al反应能放出H2的溶液可酸可碱,Mg2+在碱性条件下不能大量共存,HCO在酸性和碱性条件下均不能大量共存,C不符合;
D. =1×10-12的溶液为碱性溶液, Na+、K+、CH3COO-、NO均能大量共存,D符合;
故选D。
15.C
【详解】A.图甲中补充环形玻璃搅拌棒,大小烧杯的上沿齐平,中间填充满碎纸屑才可用于中和热的测定,故A不选;
B.图乙中长颈漏斗应换为分液漏斗后,可用于测定H2O2溶液的分解速率,故B不选;
C.图丙的实验设计,只有草酸的浓度不同,其它条件相同,可以探究浓度对化学反应速率的影响,故C选;
D.图丁的装置是酸式滴定管,0刻度在上,大刻度在下,所以实验记录的读数为11.80 mL,故D不选;
答案为C。
16.(1) 蒸馏烧瓶 b
(2) 温度过高,浓硝酸分解,SO2溶解度下降逸出 产物NOSO4H对该反应起催化作用
(3) 作吸水剂,防止亚硝酰硫酸遇水分解 CD 滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色 3%
【分析】A装置用Na2SO3固体和浓硫酸反应制备SO2,制得的气体中会混有水蒸气,用装置B中的浓硫酸来干燥除水,使得干燥纯净的SO2进入装置C来制备少量NOSO4H。装置D需要能尾气吸收SO2,并防止空气中水蒸气进入三颈烧瓶使产物水解,应该为盛装碱石灰的装置。
【详解】(1)该仪器为带支管的烧瓶,故为蒸馏烧瓶,由分析知,装置D的作用吸收SO2,并防止空气中水蒸气进入三颈烧瓶,则装置D应该为盛装碱石灰的装置,选项b正确,故答案为:蒸馏烧瓶;b。
(2)①由于反应物浓硝酸受热易挥发易分解,且温度高不利于SO2溶解,故答案为:温度过高,浓硝酸分解,SO2溶解度下降逸出;
②由于SO2通入速率不变,且温度变化不大,但反应速率明显加快,考虑可能是因为反应受到催化剂的作用,由于是生成少量NOSO4H后反应明显加快,说明此时起催化作用的物质应该为NOSO4H,故答案为:产物NOSO4H对该反应起催化作用。
③结合已知可写出亚硝酰硫酸(NOSO4H)遇水分解时发生的化学方程式:。故答案为:。
(3)①滴定过程中滴定原理是亚铁离子与硝酸反应,锥形瓶内发生的离子方程式为:,故答案为:。
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是作吸水剂,防止亚硝酰硫酸遇水分解,故答案为:作吸水剂,防止亚硝酰硫酸遇水分解;
③标准液的体积和硝酸的含量成正比:
A.滴定终点俯视滴定管读数使滴定后读数偏小,所代入计算的标准液用量偏低,所以结果偏低,故A不选;
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视会使得加水量少,配得的标准液浓度高,则滴定时用量减少,代数得到的结果偏低,故B不选;
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗,标准液被稀释,用量偏大,使测定结果偏高,故C选;
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失在滴定前没有气泡,则代入计算的标准液多一个气泡的用量,所以结果偏高,故D选。
故答案为:CD。
④当滴定达终点后再加入标准液,此时过量的(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO,则判断滴定终点的现象是:滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色,故答案为:滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色。
⑤根据得失电子守恒得关系式:3(NH4)2Fe(SO4)2~HNO3,故,则HNO的含量,故答案为:3%。
17. A BD 分液漏斗、容量瓶 充分析出乙酰水杨酸固体(结晶) 生成可溶的乙酰水杨酸钠 重结晶 60
【详解】(1)因为反应温度在70℃,低于水的沸点,且需维温度不变,故采用热水浴的方法加热;
(2)操作①需将反应物倒入冷水,需要用烧杯量取和存放冷水,过滤的操作中还需要漏斗,则答案为:B、D;分液漏斗主要用于分离互不相容的液体混合物,容量瓶用于配制一定浓度的溶液,这两个仪器用不到。
(3)反应时温度较高,所以用冷水的目的是使得乙酰水杨酸晶体充分析出;
(4)乙酰水杨酸难溶于水,为了除去其中的杂质,可将生成的乙酰水杨酸与碳酸氢钠反应生成可溶性的乙酰水杨酸钠,以便过滤除去杂质;
(5)每次结晶过程中会有少量杂质一起析出,可以通过多次结晶的方法进行纯化,也就是重结晶;
(6)水杨酸分子式为C7H6O3,乙酰水杨酸分子式为C9H8O4,根据关系式法计算得:
C7H6O3~ C9H8O4
138 180
6.9g m
m( C9H8O4)=(6.9g×180)/138=9g,则产率为。
18.(1)作还原剂
(2)温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快
(3)提供以生成沉淀;消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀
(4)C
(5)0.0194mol/L
【分析】废旧锂离子电池正极材料的主要成分为镍钴锰酸锂,还有少量铝箔和含铁化合物,酸浸时+3价镍、+3价钴、+4价锰转化为、、进入溶液,铝箔和含铁化合物转化为 ,也进入溶液,“除铁”生成黄钠铁矾沉淀除去铁元素后,再调节pH沉淀除去铝元素,过滤后回收到、、的溶液。
【详解】(1)酸浸时+3价镍、+3价钴、+4价锰转化为、、进入溶液,金属元素的化合价降低,则作还原剂,故答案为:作还原剂。
(2)高温会加快分解,温度太低反应速率太慢,所以60°C时浸出率达到最大,可能的原因是温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快,故答案为:温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快。
(3)“除铁”时生成的是黄钠铁矾沉淀,不断加入溶液既能提供以生成沉淀;由会消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀,故答案为:提供以生成沉淀;消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀。
(4)加入后可调节溶液,与发生双水解反应生成沉淀和气体,C项符合题意。故答案为:C。
(5)加入的总物质的量,与溶液反应的的物质的量,与样品反应的的物质的量,,故答案为:0.0194mol/L。
19.(1)增大与硫酸的接触面积,加快反应速率,提高原料的浸出率
(2)
(3) 加入无现象,再加入,溶液变血红色,则含有铁元素
(4)
【分析】用湿法炼锌产生的铜镉渣生产金属镉的流程:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,加入稀硫酸,铜不溶,过滤,滤液含有Zn2+、Fe2+、Cd2+、Co2+,向滤液加入锌,活化剂Sb2O3,锌粉会与Sb2O3产生合金CoSb除去钴,向除钴后的溶液中加入H2O2溶液氧化Fe2+为Fe3+,加入氧化锌调节pH使Fe3+沉淀后经过滤除去,电解含有Zn2+、Co2+的溶液,可得镉单质,据此解答。
(1)
酸浸时粉碎铜镉渣的目的是增大与酸的接触面积,加快反应速率,提高原料的浸出率,故答案为:增大与硫酸的接触面积,加快反应速率,提高原料的浸出率;
(2)
铜与稀硫酸不反应,则操作Ⅰ产生的滤渣主要成分为Cu,故答案为:Cu;
(3)
①双氧水具有氧化性,能把亚铁离子氧化为铁离子,发生反应的离子方程式为,故答案为:;
②根据表格中的信息可知在3.3≤pH<7.2时,能确保Fe3+沉淀完全,而Cd2+不会沉淀,因此pH范围为3.3≤pH<7.2,故答案为:3.3≤pH<7.2;
③若加入的双氧水不足,则待电解溶液中有亚铁离子残余,检验亚铁离子即可,方法为:取待电解液少量与试管中,加入无现象,再加入,溶液变血红色,则含有铁元素,故答案为:加入无现象,再加入,溶液变血红色,则含有铁元素;
(4)
根据溶度积常数大小可知Ksp越小,溶解度越小,沉淀越完全,因此处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为;除去工业废水中的Cd2+时,若反应达到平衡后溶液中,则Ksp(CaCO3)=c(Ca2+)×c(CO)=2.8×10-9,可知溶液中碳酸根浓度是2.8×10-8mol/L,再根据Ksp(CdCO3)=c(Cd2+)×c(CO)=5.6×10-12,可知2.0×10-4mol L-1,故答案为:;2.0×10-4。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、选择题
1.下列说法中正确的是
A.NaHCO3溶液中离子浓度大小顺序为c(Na+)>c(OH–)>c()>c(H+)>c()
B.Na2S的溶液中:c(Na+)+c(H+)=c(S2–)+c(HS-)+c(OH–)
C.向AgBr、AgCl的混合饱和溶液中加入少量AgNO3,溶液中减小
D.浓度均为的①NH4Cl②NH4Fe(SO4)2③CH3COONH4④NH3·H2O,c()由小到大的顺序:④<③<①<②
2.20℃时,用0.100mol/L盐酸滴定20mL0.100mol/L氨水的图像如图所示,下列说法不正确的是
A.a、b、c、d均有c(NH)+c(H+)=c(Cl-)+c(OH-)
B.b点时c(NH)=c(Cl-)=c(H+)=c(OH-)
C.c点表示酸碱恰好完全反应
D.d点时c(Cl-)=2c(NH3 H2O)+2c(NH)
3.设NA为阿伏加德罗常数的值。下列说法正确的是
A.16gCH4含有C—H键的数目为4NA
B.1L1.0mol/L的盐酸含有HCl分子总数为NA
C.标准状况下,22.4LNO与11.2LO2混合后的分子数目为NA
D.23gNa与足量O2反应,转移电子数目为1.5NA
4.同种离子用不同试剂鉴定,灵敏度不同。已知最低浓度是指在一定条件下, 某鉴定反应能检出离子并能得出肯定结果时该离子的最低浓度。检出限量是指在一定条件下,某鉴定反应所能检出离子的最小质量。限界稀度指最低浓度的倒数。若最低浓度越小,该方法越灵敏。表为两种鉴定K+灵敏度的几种表示方式:
试剂 试液体积 检出限量 最 低浓度 限界稀度
方法1 Na3[Co(NO2)6] 0.03 mL m c 2.5×105 g·mL-1
方法2 酒石酸钠 0.05 mL 0.3μg 6×10-6 g·mL-1 G
下列说法不正确的是
A.m=1.2 μ g B.c=4 ×10-6 g·mL-1
C.G=1.67 ×105 g·mL-1 D.方法1更灵敏
5.某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下):
①常温下,pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度都降低
②pH=2的盐酸与pH=1的盐酸,c(H+)之比为2∶1
③25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw,则三者关系为:Ka·Kh=Kw
其归纳正确的是 ( )
A.③⑤ B.④⑤ C.①②④ D.全部
6.20℃时向 20mL 0.1mol·L-1 醋酸溶液中不断滴入0.1mol·L-1 NaOH 溶液,溶液 pH 变化如图所示。此过程中溶液中离子浓度的关系错误的是
A.a 点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.b 点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C.c 点:c(H+)=c(CH3COO-)+c(OH-)
D.d 点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
7.25℃时,向20 mL 0.1 mol/L四氯金酸(HAuCl4)溶液中滴加0.1 mol/LNaOH 溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随 pH变化关系如图2,则下列说法不正确的是
A.b点溶液中存在关系:2c(H+)+c(HAuCl4)= 2c(OH-)+c()
B.X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系
C.c点溶液中存在关系:c(Na+)= c()
D.d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
8.已知:25℃时,,。该温度下,下列说法错误的是
A.的水解常数为
B.溶于水形成的饱和溶液中,
C.向悬浊液中加入,溶液中增大
D.的平衡常数
9.向锅炉中注入浸泡液,将水垢中的转化为,再用盐酸除去,下列叙述正确的是
A.温度升高,溶液中增大,减小
B.能转化为,说明Ksp(CaCO3)>Ksp(CaSO4)
C.溶解于盐酸而不溶,是因为硫酸的酸性强于盐酸
D.沉淀转化的离子方程式为
10.某溶液中只可能含有下列离子中的几种(不考虑溶液中含量较少的和):、、、、。取200mL该溶液,分为等体积的两份,分别做下列实验。实验1:第一份中加入足量的烧碱溶液并加热,产生的气体在标准状况下的体积为224mL。实验2:第二份中先加入足量的盐酸,无明显现象,再加入足量的溶液,得到固体2.33g。下列说法正确的是( )
A.该溶液中可能含有
B.该溶液中肯定含有、、、
C.该溶液中一定不含
D.该溶液中定含有,且
11.已知在温度和时水的电离平衡曲线如图所示,下列说法错误的是
A.在A、C两点处,水的离子积常数:
B.升高温度可实现由C点到A点
C.时,的硫酸溶液与的氢氧化钠溶液等体积混合,所得溶液的
D.图中矩形POMA的面积表示时水的离子积常数的值
12.在不同温度下,水溶液中与有如图所示关系。下列关于离子共存的说法正确的是( )
A.a点对应的溶液中大量存在、、、
B.b点对应的溶液中大量存在、、、
C.c点对应的溶液中大量存在、、、
D.d点对应的溶液中大量存在、、、
13.亚砷酸()是三元弱酸,可以用于治疗白血病,水溶液中含砷物质的分布分数(平衡时某粒子的浓度占各粒子浓度之和的分数)与pH的关系如图所示,下列说法正确的是( )
A.的电离方程式为
B.第一步电离的电离常数
C.溶液的pH约为9.2
D.时,溶液中
14.常温下,下列各组离子一定可以大量共存的是
A.含NO的溶液中: H+、K+、Br-、I-、Fe2+
B.遇石蕊溶液显红色的溶液中: NH、Ba2+、CO、NO
C.在与Al反应能放出H2的溶液中: Mg2+、HCO、SO、Cl-
D.在 =1×1012的溶液中: Na+、K+、CH3COO-、NO
15.下列有关实验能够达到相应实验目的的是
A.图甲中补充环形玻璃搅拌棒即可用于中和热的测定
B.图乙可用于测定H2O2溶液的分解速率
C.图丙的实验设计可以探究浓度对化学反应速率的影响
D.图丁实验记录的读数为12.20 mL
二、实验题
16.亚硝酰硫酸(NOSO4H)是一种浅黄色液体,遇水易分解,溶于浓硫酸,主要用于染料、医药领域的重氮化反应。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品中杂质硝酸的含量。
回答下列问题:
(1)装置A中盛装Na2SO3固体的仪器名称是 ,装置D最好选用 (填序号)。
a. b. c. d.
(2)装置C中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①C中“冷水”的温度一般控制在20℃,装置C中温度过高产率降低的原因是 。
②开始通SO2时,反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因是 。
③请写出亚硝酰硫酸(NOSO4H)与水分解时发生的化学方程式 (已知亚硝酸不稳定,易分解,亚硝酸发生分解反应的方程式为2HNO2=NO2↑+NO↑+H2O)。
(3)测定亚硝酰硫酸产品中杂质硝酸的含量。
称取1.400 g产品放入250mL锥形瓶中,加80mL浓硫酸,用0.1000mol/L (NH4)2Fe(SO4)2标准溶液滴定,消耗标准溶液20.00mL。
已知:(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO。
①滴定过程中锥形瓶内发生的离子方程式为 。
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是 。
③下列操作造成测定结果偏高的是 (填字母)。
A.滴定终点滴定管读数时俯视读数
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
④判断滴定达到终点的现象是 。
⑤亚硝酰硫酸中硝酸的含量为 。
17.乙酰水杨酸(阿司匹林)是目前常用药物之一。实验室通过水杨酸进行乙酰化制备阿司匹林的一种方法如下:
水杨酸 醋酸酐 乙酰水杨酸
熔点/℃ 157~159 -72~-74 135~138
相对密度/(g·cm﹣3) 1.44 1.10 1.35
相对分子质量 138 102 180
实验过程:在100 mL锥形瓶中加入水杨酸6.9 g及醋酸酐10 mL,充分摇动使固体完全溶解。缓慢滴加0.5 mL浓硫酸后加热,维持瓶内温度在70 ℃左右,充分反应。稍冷后进行如下操作.
①在不断搅拌下将反应后的混合物倒入100 mL冷水中,析出固体,过滤。
②所得结晶粗品加入50 mL饱和碳酸氢钠溶液,溶解、过滤。
③滤液用浓盐酸酸化后冷却、过滤得固体。
④固体经纯化得白色的乙酰水杨酸晶体5.4 g。
回答下列问题:
(1)该合成反应中应采用 加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
(2)下列玻璃仪器中,①中需使用的有 (填标号),不需使用的 (填名称)。
(3)①中需使用冷水,目的是 。
(4)②中饱和碳酸氢钠的作用是 ,以便过滤除去难溶杂质。
(5)④采用的纯化方法为 。
(6)本实验的产率是 %。
三、工业流程题
18.某兴趣小组以废旧锂离子电池正极材料(主要成分为镍钴锰酸锂,还有少量铝箔和含铁化合物)为原料,回收、、的过程如图甲。
(1)“酸浸”时,+3价镍、+3价钴、+4价锰转化为、、进入溶液。该过程中的作用是 。
(2)保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图乙所示。60℃时浸出率达到最大,可能的原因是 。
(3)“除铁”生成黄钠铁矾沉淀时需控制溶液为1.5~1.8.该过程中需不断加入溶液,其作用是 。
(4)物质可调节溶液,为 (填序号)。
A. B. C.
(5)回收液可用于合成锂离子电池正极材料,合成前需测定其中等离子的浓度。
测定原理:用过量标准溶液氧化经预处理的回收液样品中的,再用标准溶液滴定过量的。
反应的离子方程式为。
测定过程:取预处理后的回收液样品,向其中加入溶液,充分反应;再用溶液滴定反应后的溶液,消耗溶液。
数据分析:计算预处理后的回收液样品中的物质的量浓度 (写出计算过程)。
19.铜镉渣主要含锌、铜、铁、镉、钴等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的(金属离子的起始浓度均为)。
氢氧化物
开始沉淀的 1.5 6.5 7.2
沉淀完全的 3.3 9.9 9.5
(1)酸浸时,粉碎铜镉渣的目的是 。
(2)操作Ⅰ产生的滤渣Ⅰ主要成分为 (填化学式)。
(3)①操作Ⅲ中先加入适量,发生反应的离子方程式为 。
②再加入控制反应液的,范围为 。
③若加入的不足,加入后所得的电解液中会含有元素。请设计实验方案加以检验: 。
(4)处理含镉废水时常向其中加入实现沉淀转化,该沉淀转化反应的离子方程式为 ;若反应达到平衡后,溶液中,溶液中 【已知,】。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A.NaHCO3溶液中存在着的水解平衡又存在着的电离平衡,且水解大于电离,所以离子浓度大小顺序为c(Na+)> c()>c(OH–)>c(H+)>c(),故A错误;
B.Na2S的溶液中根据可得电荷守恒:c(Na+)+c(H+)=2c(S2–)+c(HS-)+c(OH–),故B错误;
C.向AgBr、AgCl的混合饱和溶液中加入少量AgNO3,溶液中温度不变,该值不变,故C错误;
D.NH3·H2O是弱电解质电离出的c()最小,会抑制的水解,CH3COO-会促进的水解,所以四种溶液中c()由小到大的顺序:④<③<①<②,故D正确;
故选D。
2.B
【详解】A.a、b、c、d均有NH、H+、Cl-和OH-,根据电荷守恒,均有c(NH)+c(H+)=c(Cl-)+c(OH-)故A错误;
B.b点时溶液呈中性,c(H+)=c(OH-),根据电荷守恒c(NH)=c(Cl-),但c(NH)=c(Cl-)>c(H+)=c(OH-),故B正确;
C.c点加入的盐酸为20mL,恰好与氨水完全反应,所以表示酸碱恰好完全反应,故C错误;
D.d点时加入的盐酸为40mL,所得溶液的溶质为等物质的量浓度的氯化铵和盐酸,根据元素质量守恒,c(Cl-)=2c(NH3 H2O)+2c(NH),故D错误;
故选B。
3.A
【详解】A.1个分于含有4个键,1mol含有键,描述正确,符合题意;
B.HCl是强电解质,在水分子作用下会完全电离,盐酸中不存在HCl分子,描述错误,不符题意;
C.NO与反应方程式为:,生成的会产生二聚反应,故混合后的分子数目小于,描述错误,不符题意;
D. 1molNa只能失去1mol电子,描述错误,不符题意;
综上,本题选A。
4.A
【解析】略
5.A
【详解】①加水稀释,c(H+)减小,由于Kw不变,则c(OH-)增大,故①错误;
②由pH=-lgc(H+)可知,pH=2的盐酸和pH=1的盐酸,c(H+)之比为1:10,故②错误;
③溶度积只与温度有关,与溶液的浓度和类型无关,由于溶度积是常数,故氯离子浓度大,则25 ℃时,AgCl固体在等体积、等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不同,故③正确;
④pH=7,c(H+)=c(OH-),由电荷守恒可知,溶液中应存在c(Na+)+c(NH)=2c(SO),故④错误;
⑤水解和电离为可逆过程,Ka=,Kh=,则有Ka Kh=Kw,故⑤正确;
综上③⑤正确,答案选A。
6.C
【详解】A.a 点:20mL 0.1mol·L-1 醋酸溶液中滴入10mL 0.1mol·L-1 NaOH 溶液,反应后,溶液中c(CH3COOH)=c(CH3COONa),溶液的pH<7,则表明主要发生CH3COOH电离,c(CH3COO-)增大,但电离程度很小,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-),A正确;
B.b 点:溶液的pH=7,此时可认为CH3COOH不电离,CH3COO-不水解,溶液中的c(H+)、c(OH-)主要来自水的微弱电离,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),B正确;
C.c 点:醋酸与NaOH刚好完全反应,生成醋酸钠和水,依据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(H+)≠c(CH3COO-)+c(OH-),C错误;
D.d 点:NaOH过量,此时n(CH3COONa)=2n(NaOH),而CH3COO-水解程度很小,所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D正确;
故选C。
7.B
【解析】由图中信息可知,滴加20mL 0.1 mol/LNaOH 溶液时恰好中和,则滴加10mL时恰好中和一半。
【详解】A. b点加入了10mL 0.1 mol/LNaOH 溶液,恰好中和了一半的四氯金酸,根据电荷守恒可知,2c(H+)+2c(Na+)= 2c(OH-)+2c();根据物料守恒可知,2c(Na+)= c(HAuCl4)+c(),联立两式可得2c(H+)+c(HAuCl4)= 2c(OH-)+c(),A正确;
B. 由图中信息可知,X点 c(HAuCl4)=c(),由图1的曲线起点可知, 0.1 mol/L四氯金酸的pH=3,说明四氯金酸是弱酸,则其存在电离平衡,而b点四氯金酸只中和了一半,故b点c(HAuCl4)与c()不相等,B不正确;
C. c点溶液的pH=7,c(H+)= c(OH-)根据电荷守恒可知,c(H+)+c(Na+)= c(OH-)+c(),因此,c(Na+)= c(),C正确;
D. d点时恰好中和,溶液为NaAuCl4溶液,会发生水解而使溶液呈碱性,因此,微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+),D正确。
综上所述,说法不正确的是B,故选B。
8.B
【详解】A.在溶液中存在水解平衡:,则水解常数,故A正确;
B.溶于水形成的饱和溶液中,,则有,故B错误;
C.向悬浊液中加入,发生中和反应消耗,溶解平衡正向移动,溶液中增大,故C正确;
D.该反应的平衡常数为,故D正确;
故答案为B。
9.D
【详解】A.温度升高,水的电离平衡H2OH++OH-和的水解平衡+H2O+OH-,均正向移动,则和均增大,故A错误;
B.沉淀之间的转化符合溶解度小的电解质向溶解度更小的电解质转化,能转化为,说明Ksp(CaCO3)<Ksp(CaSO4),故B错误;
C.CaCO3与盐酸反应生成可溶性的氯化钙、水和二氧化碳,即CaCO3+2HCl=CaCl2+CO2↑+H2O,与盐酸不满足复分解反应进行的条件,与、的酸性强弱无关,故C错误;
D.向锅炉中注入浸泡液,水垢中的转化为,离子方程式为,故D正确;
答案为D。
10.D
【分析】实验1可证明原溶液中含有,且其物质的量为0.01mol;实验2可证明原溶液中一定不含有,一定含有,且的物质的量为,根据溶液中的电荷守恒,则一定含有,且的浓度。
【详解】A.由分析可知,溶液中一定含Na+,A错误;
B.结合分析可知,溶液中一定没有,若的浓度为,则根据电荷守恒可知无,若的浓度>,则必有,B错误;
C.结合B可知,溶液可能含,C错误;
D.由分析可知,溶液中一定含有,且,D正确。
答案选D。
11.A
【详解】A. A点对应的、均大于C点对应的、,故水的离子积常数:,A项错误;
B. 升高温度,水的电离平衡正向移动,、增大,可实现由C点到A点,B项正确;
C. 时,的硫酸溶液中,的氢氧化钠溶液中,等体积混合时,二者恰好完全反应,所得溶液的,C项正确;
D. 时,水的离子积常数等于,即,为矩形POMA的面积,D项正确;
故选A。
12.D
【详解】A.a点对应的溶液显中性,而水解使溶液显酸性,故不能大量存在,故A错误;
B.b点对应的溶液显酸性,不能大量存在,且与反应生成一水合氨,二者不能大量共存,故B错误;
C.c点对应的溶液显中性,而水解使溶液显碱性,故不能大量存在,故C错误;
D.d点对应的溶液显碱性,、、、能大量共存,故D项正确;
故选D。
13.B
【详解】A. 是三元弱酸,分步发生电离,第一步电离方程式为,A项错误;
B. 第一步电离的电离常数,由图可知,时,,则,B项正确;
C. 是三元弱酸,其水溶液的pH小于7,C项错误;
D. 时,溶液呈碱性,则有,从而可得,D项错误;
故选B。
14.D
【详解】A.酸性条件下,NO与I-、Fe2+发生氧化还原反应而不能大量共存,A不符合;
B.遇石蕊溶液显红色的溶液是酸性溶液,含有大量H+,与CO发生反应生成CO2而不能大量共存,Ba2+与CO反应生成BaCO3沉淀而不能大量共存,B不符合;
C.在与Al反应能放出H2的溶液可酸可碱,Mg2+在碱性条件下不能大量共存,HCO在酸性和碱性条件下均不能大量共存,C不符合;
D. =1×10-12的溶液为碱性溶液, Na+、K+、CH3COO-、NO均能大量共存,D符合;
故选D。
15.C
【详解】A.图甲中补充环形玻璃搅拌棒,大小烧杯的上沿齐平,中间填充满碎纸屑才可用于中和热的测定,故A不选;
B.图乙中长颈漏斗应换为分液漏斗后,可用于测定H2O2溶液的分解速率,故B不选;
C.图丙的实验设计,只有草酸的浓度不同,其它条件相同,可以探究浓度对化学反应速率的影响,故C选;
D.图丁的装置是酸式滴定管,0刻度在上,大刻度在下,所以实验记录的读数为11.80 mL,故D不选;
答案为C。
16.(1) 蒸馏烧瓶 b
(2) 温度过高,浓硝酸分解,SO2溶解度下降逸出 产物NOSO4H对该反应起催化作用
(3) 作吸水剂,防止亚硝酰硫酸遇水分解 CD 滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色 3%
【分析】A装置用Na2SO3固体和浓硫酸反应制备SO2,制得的气体中会混有水蒸气,用装置B中的浓硫酸来干燥除水,使得干燥纯净的SO2进入装置C来制备少量NOSO4H。装置D需要能尾气吸收SO2,并防止空气中水蒸气进入三颈烧瓶使产物水解,应该为盛装碱石灰的装置。
【详解】(1)该仪器为带支管的烧瓶,故为蒸馏烧瓶,由分析知,装置D的作用吸收SO2,并防止空气中水蒸气进入三颈烧瓶,则装置D应该为盛装碱石灰的装置,选项b正确,故答案为:蒸馏烧瓶;b。
(2)①由于反应物浓硝酸受热易挥发易分解,且温度高不利于SO2溶解,故答案为:温度过高,浓硝酸分解,SO2溶解度下降逸出;
②由于SO2通入速率不变,且温度变化不大,但反应速率明显加快,考虑可能是因为反应受到催化剂的作用,由于是生成少量NOSO4H后反应明显加快,说明此时起催化作用的物质应该为NOSO4H,故答案为:产物NOSO4H对该反应起催化作用。
③结合已知可写出亚硝酰硫酸(NOSO4H)遇水分解时发生的化学方程式:。故答案为:。
(3)①滴定过程中滴定原理是亚铁离子与硝酸反应,锥形瓶内发生的离子方程式为:,故答案为:。
②锥形瓶中加入浓硫酸除了可以作溶剂外,另一个作用是作吸水剂,防止亚硝酰硫酸遇水分解,故答案为:作吸水剂,防止亚硝酰硫酸遇水分解;
③标准液的体积和硝酸的含量成正比:
A.滴定终点俯视滴定管读数使滴定后读数偏小,所代入计算的标准液用量偏低,所以结果偏低,故A不选;
B.用容量瓶配制(NH4)2Fe(SO4)2标准溶液时俯视会使得加水量少,配得的标准液浓度高,则滴定时用量减少,代数得到的结果偏低,故B不选;
C.酸式滴定管用蒸馏水洗净后,未用标准液润洗,标准液被稀释,用量偏大,使测定结果偏高,故C选;
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失在滴定前没有气泡,则代入计算的标准液多一个气泡的用量,所以结果偏高,故D选。
故答案为:CD。
④当滴定达终点后再加入标准液,此时过量的(NH4)2Fe(SO4)2可与NO生成粉红色的FeSO4·NO,则判断滴定终点的现象是:滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色,故答案为:滴入最后半滴(NH4)2Fe(SO4)2标准液,溶液突变为粉红色,且30s内不变色。
⑤根据得失电子守恒得关系式:3(NH4)2Fe(SO4)2~HNO3,故,则HNO的含量,故答案为:3%。
17. A BD 分液漏斗、容量瓶 充分析出乙酰水杨酸固体(结晶) 生成可溶的乙酰水杨酸钠 重结晶 60
【详解】(1)因为反应温度在70℃,低于水的沸点,且需维温度不变,故采用热水浴的方法加热;
(2)操作①需将反应物倒入冷水,需要用烧杯量取和存放冷水,过滤的操作中还需要漏斗,则答案为:B、D;分液漏斗主要用于分离互不相容的液体混合物,容量瓶用于配制一定浓度的溶液,这两个仪器用不到。
(3)反应时温度较高,所以用冷水的目的是使得乙酰水杨酸晶体充分析出;
(4)乙酰水杨酸难溶于水,为了除去其中的杂质,可将生成的乙酰水杨酸与碳酸氢钠反应生成可溶性的乙酰水杨酸钠,以便过滤除去杂质;
(5)每次结晶过程中会有少量杂质一起析出,可以通过多次结晶的方法进行纯化,也就是重结晶;
(6)水杨酸分子式为C7H6O3,乙酰水杨酸分子式为C9H8O4,根据关系式法计算得:
C7H6O3~ C9H8O4
138 180
6.9g m
m( C9H8O4)=(6.9g×180)/138=9g,则产率为。
18.(1)作还原剂
(2)温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快
(3)提供以生成沉淀;消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀
(4)C
(5)0.0194mol/L
【分析】废旧锂离子电池正极材料的主要成分为镍钴锰酸锂,还有少量铝箔和含铁化合物,酸浸时+3价镍、+3价钴、+4价锰转化为、、进入溶液,铝箔和含铁化合物转化为 ,也进入溶液,“除铁”生成黄钠铁矾沉淀除去铁元素后,再调节pH沉淀除去铝元素,过滤后回收到、、的溶液。
【详解】(1)酸浸时+3价镍、+3价钴、+4价锰转化为、、进入溶液,金属元素的化合价降低,则作还原剂,故答案为:作还原剂。
(2)高温会加快分解,温度太低反应速率太慢,所以60°C时浸出率达到最大,可能的原因是温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快,故答案为:温度低于60℃时,酸浸反应速率较慢;温度高于60℃时,分解反应速率较快。
(3)“除铁”时生成的是黄钠铁矾沉淀,不断加入溶液既能提供以生成沉淀;由会消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀,故答案为:提供以生成沉淀;消耗,控制在1.5~1.8内,促进黄钠铁矾沉淀。
(4)加入后可调节溶液,与发生双水解反应生成沉淀和气体,C项符合题意。故答案为:C。
(5)加入的总物质的量,与溶液反应的的物质的量,与样品反应的的物质的量,,故答案为:0.0194mol/L。
19.(1)增大与硫酸的接触面积,加快反应速率,提高原料的浸出率
(2)
(3) 加入无现象,再加入,溶液变血红色,则含有铁元素
(4)
【分析】用湿法炼锌产生的铜镉渣生产金属镉的流程:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质,加入稀硫酸,铜不溶,过滤,滤液含有Zn2+、Fe2+、Cd2+、Co2+,向滤液加入锌,活化剂Sb2O3,锌粉会与Sb2O3产生合金CoSb除去钴,向除钴后的溶液中加入H2O2溶液氧化Fe2+为Fe3+,加入氧化锌调节pH使Fe3+沉淀后经过滤除去,电解含有Zn2+、Co2+的溶液,可得镉单质,据此解答。
(1)
酸浸时粉碎铜镉渣的目的是增大与酸的接触面积,加快反应速率,提高原料的浸出率,故答案为:增大与硫酸的接触面积,加快反应速率,提高原料的浸出率;
(2)
铜与稀硫酸不反应,则操作Ⅰ产生的滤渣主要成分为Cu,故答案为:Cu;
(3)
①双氧水具有氧化性,能把亚铁离子氧化为铁离子,发生反应的离子方程式为,故答案为:;
②根据表格中的信息可知在3.3≤pH<7.2时,能确保Fe3+沉淀完全,而Cd2+不会沉淀,因此pH范围为3.3≤pH<7.2,故答案为:3.3≤pH<7.2;
③若加入的双氧水不足,则待电解溶液中有亚铁离子残余,检验亚铁离子即可,方法为:取待电解液少量与试管中,加入无现象,再加入,溶液变血红色,则含有铁元素,故答案为:加入无现象,再加入,溶液变血红色,则含有铁元素;
(4)
根据溶度积常数大小可知Ksp越小,溶解度越小,沉淀越完全,因此处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为;除去工业废水中的Cd2+时,若反应达到平衡后溶液中,则Ksp(CaCO3)=c(Ca2+)×c(CO)=2.8×10-9,可知溶液中碳酸根浓度是2.8×10-8mol/L,再根据Ksp(CdCO3)=c(Cd2+)×c(CO)=5.6×10-12,可知2.0×10-4mol L-1,故答案为:;2.0×10-4。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
