高一化学人教版必修一(2019)2.3.1 物质的量 摩尔质量(课件)(共27张ppt)
文档属性
| 名称 | 高一化学人教版必修一(2019)2.3.1 物质的量 摩尔质量(课件)(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 00:00:00 | ||
图片预览








文档简介
(共27张PPT)
第三节 物质的量
第1课时 物质的量 摩尔质量
第二章 海水中的重要元素——钠和氯
[学习目标]
1.认识物质的量是描述微观粒子集体的一个物理量(重点)。
2.了解阿伏加德罗常数、摩尔质量的含义(重点)。
3.通过N、NA、n、M、m等之间的计算关系,体会物质的量是联系微观
粒子与宏观物质的桥梁(难点)。
导入新课
你知道一滴水有多少水分子吗?
水的质量 水分子数
宏 观
(质量)
微 观
(微粒数目)
物质的量
资料:一滴水中所含的水分子数,让全世界65亿人去数,每人每分钟数100个,日夜不停的数,需要5千年才能数完。
1.7万亿个水分子
导入新课
国际计量大会CGPM是最高的权力机构,每四年召开一次。1971年第14届国际计量大会正式通过物质的量的单位———摩尔
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
一、物质的量的单位——摩尔
1.物质的量
(1) 一个物理量,它表示含有一定数目粒子的集合体,符号n
(2) 单位——摩尔(mol)
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
1打铅笔 1双袜子 1世纪
12支 2只 100年
1 mol某种微粒是多少个呢?
(如:1 mol水分子有多少个水分子呢?)
1.物质的量
(1) 一个物理量,它表示含有一定数目粒子的集合体,符号n
(2) 单位——摩尔(mol)
标 准
计量对象
1 mol粒子集合体所含的粒子数约6.02×1023个
原子、分子、离子、原子团、电子、质子、中子等微观粒子
(3) 表示
a mol CO2
数值
单位
指定化学式或微粒符号或名称
例如:1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子。不能说1 mol氢,指代不明确。
一、物质的量的单位——摩尔
2.阿伏加德罗常数(NA)
1 mol任何粒子的粒子数,符号NA,通常用6.02×1023 mol-1表示
3.物质的量、阿伏加德罗常数与粒子数(N)之间的关系
(1)关系式:
(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比
Amedeo Avogadro
1776~1856
阿伏加德罗
= ——
N
微粒数(单位:个)
NA
阿伏加德罗常数(单位:个/mol)
n
物质的量
(单位:mol)
一、物质的量的单位——摩尔
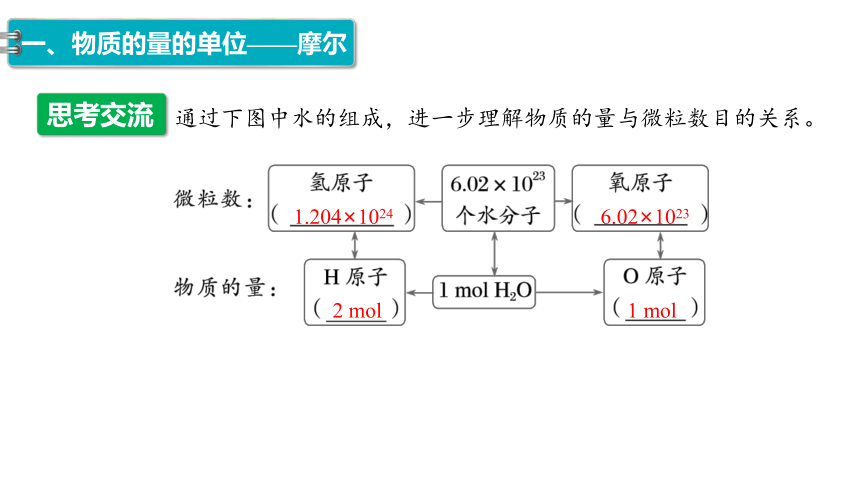
思考交流
通过下图中水的组成,进一步理解物质的量与微粒数目的关系。
1.204×1024
6.02×1023
2 mol
1 mol
一、物质的量的单位——摩尔
运用物质的量与微粒数目的关系,分析下列问题。
(1)①1 mol CO2中有 mol C和 mol O;
②0.5 mol CO2中有 mol C和 mol O;
③ mol CO2含有0.5 mol氧原子。
(2)①1 mol Na2SO4中含有Na+的数目是 , mol NaCl含有相同Na+数目。
②0.2 mol NH3与 H2O中所含H原子一样多。若用NA表示阿伏加德罗常数,0.3 mol H2O中含 个电子。
练习巩固
一、物质的量的单位——摩尔
1
2
0.5
1
0.25
1.204×1024
2
0.3 mol
3NA
1.判断正误
(1)物质的量可以理解为物质的数量
(2)1 mol任何粒子所含有的粒子数相等
(3)阿伏加德罗常数就是6.02×1023
(4)1 mol水中含有2 mol氢和1 mol氧
×
√
×
×
应用体验
一、物质的量的单位——摩尔
2.下列叙述正确的是
A.摩尔是表示物质所含微粒数量以及物质质量的具有双重意义的单位
B.摩尔是国际单位制中7个基本物理量之一
C.含有6.02×1023个氧原子的H3PO4的物质的量是0.25 mol
D.2H既可以表示2个氢原子又可以表示2 mol氢原子
√
应用体验
1个H3PO4分子中含有4个O
1 mol H3PO4中含有4 mol O
一、物质的量的单位——摩尔
3.(1)2 mol O2与1 mol H2SO4所含O______(填“相等”或“不相等”)。
(2)1 mol OH-含____________________个原子,____________________个
质子,____________________个电子。
(3)已知0.25 mol甲烷中所含原子数为a,则阿伏加德罗常数可表示为
__________。
相等
1.204×1024(或2NA)
5.418×1024(或9NA)
6.02×1024(或10NA)
应用体验
一、物质的量的单位——摩尔
a mol-1
物质的量的理解——“四化”
一、物质的量的单位——摩尔
归纳总结
二、摩尔质量
18 g H2O
58.5 g NaCl
56 g Fe
342 g 蔗糖
你知道1 mol H2O、1 mol Fe、1 mol NaCl、1 mol蔗糖的质量吗?
O Al H2 H2O
物质的量 1 mol 1 mol 1 mol 1 mol
相对原子(分子)质量 16 27 2 18
1mol物质的质量 16 g 27 g 2 g 18 g
1 mol 任何粒子或物质的质量以 g 为单位,其数值都与该粒子的相对原子(分子)质量相等。
1. 摩尔质量
符号:M ,常用单位:g· mol-1 或 kg· mol-1
概念:单位物质的量的物质所具有的质量,
数值:1mol 任何粒子或物质的质量以 g 为单位时,其数值
都与该粒子的相对原子(分子)质量相等
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
2. n、m和M之间的关系
3. n为联系宏观物质m与微观N间的桥梁
—— = n
M
m
= ——
NA
N
二、摩尔质量
思考交流
(1)摩尔质量与相对分子质量(或相对原子质量)是否等同,为什么?
不等同,摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。
当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
二、摩尔质量
思考交流
(2)结合下列问题,总结摩尔质量的计算方法。
①已知氨气的相对分子质量为17,则氨气的摩尔质量为___________。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为
____________。
③已知一个铁原子的质量为b g,则铁的摩尔质量为______________。
④已知一个碳原子(12C)质量为a g,1 个某气体质量b g,则该气体摩尔质量
为____________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
二、摩尔质量
g·mol-1
前提条件 公式
任意状态的任意物质
已知一个分子的质量 M=m(分子)×NA
已知一个分子的质量和 一个12C原子的质量
二、摩尔质量
归纳总结
应用体验
1.判断正误
(1)氯化氢的摩尔质量是36.5 g
(2)氮的摩尔质量是28 g·mol-1
(3)Na+的摩尔质量是22 g·mol-1
(4)CH4的摩尔质量和NA个CH4分子的质量相等
(5)2NA个CO2的摩尔质量为88 g·mol-1
(6)Fe的摩尔质量为56 g·mol-1,则1个Fe原子质量为
×
×
×
×
×
√
二、摩尔质量
应用体验
2.下列说法正确的是
A.二氧化碳的摩尔质量为44 g
B.1 mol氧原子的质量就是氧的相对原子质量
C.H2SO4的摩尔质量为96 g·mol-1
D.1 mol CO2的分子数为NA
√
44 g·mol-1
在数值上相等,但单位不同
98 g·mol-1
二、摩尔质量
应用体验
3.我国科学家屠呦呦发现青蒿素,它是一种用于治疗疟疾的药物,2015年10月获得诺贝尔生理学或医学奖。下列有关青蒿素(化学式:C15H22O5)的叙述正确的是
A.青蒿素的摩尔质量为282
B.6.02×1023个青蒿素分子的质量约为282 g
C.1 mol青蒿素的质量为282 g·mol-1
D.282 g青蒿素中含有15个碳原子
√
二、摩尔质量
二、摩尔质量
归纳总结
自我测试
1.下列说法正确的是
①物质的量是联系宏观的物质和微观的粒子之间的桥梁 ②物质的量是摩尔的单位 ③1 mol氧所含的粒子个数约为6.02×1023 ④摩尔是描述微观粒子多少的物理量 ⑤3.01×1023个H2O分子的物质的量为0.5 mol
A.①②⑤ B.①②④
C.①⑤ D.①③⑤
√
摩尔是物质的量的单位
没有指明具体粒子是什么
物质的量是描述微观粒子多少的物理量
自我测试
2.“物质的量”是国际单位制中的一个基本物理量,下列有关说法正确的是
A.2 g H2含有1 mol氢分子
B.2 mol氧气的摩尔质量为64 g·mol-1
C.1 mol任何物质都含有6.02×1023个分子
D.质量相等的CO和CO2,物质的量之比为2∶3
√
氧气的摩尔质量与其物质的量无关
并不是所有物质都是由分子构成,如NaCl由离子构成
1 g CO mol,1 g CO2 mol,二者物质的量之比 ∶=11∶7
自我测试
3.40.5 g某金属氯化物RCl2含有0.6 mol 氯离子,则金属R的摩尔质量为
A.135 g B.135 g·mol-1
C.64 g D.64 g·mol-1
√
含0.6 mol氯离子的RCl2的物质的量为×0.6 mol=0.3 mol,
RCl2的摩尔质量为=135 g·mol-1,
R的摩尔质量为(135-35.5×2) g·mol-1=64 g·mol-1。
自我测试
4.按要求填写下列空白:
(1)6.02×1023个Na+约含____ mol Na+,其质量为_____ g。
(2)4.5 mol CH4约含有____________________个CH4,其质量为_____g。
(3)3.01×1023个约含_____mol ,其质量为______ g;49 g H2SO4约含有________________个H,共含有______________________个原子。
23
1
0.5
48
6.02×1023(或NA)
2.107×1024(或3.5NA)
72
2.709×1024(或4.5NA)
本节内容结束
第三节 物质的量
第1课时 物质的量 摩尔质量
第二章 海水中的重要元素——钠和氯
[学习目标]
1.认识物质的量是描述微观粒子集体的一个物理量(重点)。
2.了解阿伏加德罗常数、摩尔质量的含义(重点)。
3.通过N、NA、n、M、m等之间的计算关系,体会物质的量是联系微观
粒子与宏观物质的桥梁(难点)。
导入新课
你知道一滴水有多少水分子吗?
水的质量 水分子数
宏 观
(质量)
微 观
(微粒数目)
物质的量
资料:一滴水中所含的水分子数,让全世界65亿人去数,每人每分钟数100个,日夜不停的数,需要5千年才能数完。
1.7万亿个水分子
导入新课
国际计量大会CGPM是最高的权力机构,每四年召开一次。1971年第14届国际计量大会正式通过物质的量的单位———摩尔
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
一、物质的量的单位——摩尔
1.物质的量
(1) 一个物理量,它表示含有一定数目粒子的集合体,符号n
(2) 单位——摩尔(mol)
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
1打铅笔 1双袜子 1世纪
12支 2只 100年
1 mol某种微粒是多少个呢?
(如:1 mol水分子有多少个水分子呢?)
1.物质的量
(1) 一个物理量,它表示含有一定数目粒子的集合体,符号n
(2) 单位——摩尔(mol)
标 准
计量对象
1 mol粒子集合体所含的粒子数约6.02×1023个
原子、分子、离子、原子团、电子、质子、中子等微观粒子
(3) 表示
a mol CO2
数值
单位
指定化学式或微粒符号或名称
例如:1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子。不能说1 mol氢,指代不明确。
一、物质的量的单位——摩尔
2.阿伏加德罗常数(NA)
1 mol任何粒子的粒子数,符号NA,通常用6.02×1023 mol-1表示
3.物质的量、阿伏加德罗常数与粒子数(N)之间的关系
(1)关系式:
(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比
Amedeo Avogadro
1776~1856
阿伏加德罗
= ——
N
微粒数(单位:个)
NA
阿伏加德罗常数(单位:个/mol)
n
物质的量
(单位:mol)
一、物质的量的单位——摩尔
思考交流
通过下图中水的组成,进一步理解物质的量与微粒数目的关系。
1.204×1024
6.02×1023
2 mol
1 mol
一、物质的量的单位——摩尔
运用物质的量与微粒数目的关系,分析下列问题。
(1)①1 mol CO2中有 mol C和 mol O;
②0.5 mol CO2中有 mol C和 mol O;
③ mol CO2含有0.5 mol氧原子。
(2)①1 mol Na2SO4中含有Na+的数目是 , mol NaCl含有相同Na+数目。
②0.2 mol NH3与 H2O中所含H原子一样多。若用NA表示阿伏加德罗常数,0.3 mol H2O中含 个电子。
练习巩固
一、物质的量的单位——摩尔
1
2
0.5
1
0.25
1.204×1024
2
0.3 mol
3NA
1.判断正误
(1)物质的量可以理解为物质的数量
(2)1 mol任何粒子所含有的粒子数相等
(3)阿伏加德罗常数就是6.02×1023
(4)1 mol水中含有2 mol氢和1 mol氧
×
√
×
×
应用体验
一、物质的量的单位——摩尔
2.下列叙述正确的是
A.摩尔是表示物质所含微粒数量以及物质质量的具有双重意义的单位
B.摩尔是国际单位制中7个基本物理量之一
C.含有6.02×1023个氧原子的H3PO4的物质的量是0.25 mol
D.2H既可以表示2个氢原子又可以表示2 mol氢原子
√
应用体验
1个H3PO4分子中含有4个O
1 mol H3PO4中含有4 mol O
一、物质的量的单位——摩尔
3.(1)2 mol O2与1 mol H2SO4所含O______(填“相等”或“不相等”)。
(2)1 mol OH-含____________________个原子,____________________个
质子,____________________个电子。
(3)已知0.25 mol甲烷中所含原子数为a,则阿伏加德罗常数可表示为
__________。
相等
1.204×1024(或2NA)
5.418×1024(或9NA)
6.02×1024(或10NA)
应用体验
一、物质的量的单位——摩尔
a mol-1
物质的量的理解——“四化”
一、物质的量的单位——摩尔
归纳总结
二、摩尔质量
18 g H2O
58.5 g NaCl
56 g Fe
342 g 蔗糖
你知道1 mol H2O、1 mol Fe、1 mol NaCl、1 mol蔗糖的质量吗?
O Al H2 H2O
物质的量 1 mol 1 mol 1 mol 1 mol
相对原子(分子)质量 16 27 2 18
1mol物质的质量 16 g 27 g 2 g 18 g
1 mol 任何粒子或物质的质量以 g 为单位,其数值都与该粒子的相对原子(分子)质量相等。
1. 摩尔质量
符号:M ,常用单位:g· mol-1 或 kg· mol-1
概念:单位物质的量的物质所具有的质量,
数值:1mol 任何粒子或物质的质量以 g 为单位时,其数值
都与该粒子的相对原子(分子)质量相等
物质的量 n
(mol)
m 物质的质量 (g)
M 摩尔质量 (g/mol)
= ——
2. n、m和M之间的关系
3. n为联系宏观物质m与微观N间的桥梁
—— = n
M
m
= ——
NA
N
二、摩尔质量
思考交流
(1)摩尔质量与相对分子质量(或相对原子质量)是否等同,为什么?
不等同,摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。
当摩尔质量以“g·mol-1”为单位时,两者在数值上相等,但前者单位是g·mol-1,后者单位是1,故两者不等同。
二、摩尔质量
思考交流
(2)结合下列问题,总结摩尔质量的计算方法。
①已知氨气的相对分子质量为17,则氨气的摩尔质量为___________。
②1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为
____________。
③已知一个铁原子的质量为b g,则铁的摩尔质量为______________。
④已知一个碳原子(12C)质量为a g,1 个某气体质量b g,则该气体摩尔质量
为____________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
二、摩尔质量
g·mol-1
前提条件 公式
任意状态的任意物质
已知一个分子的质量 M=m(分子)×NA
已知一个分子的质量和 一个12C原子的质量
二、摩尔质量
归纳总结
应用体验
1.判断正误
(1)氯化氢的摩尔质量是36.5 g
(2)氮的摩尔质量是28 g·mol-1
(3)Na+的摩尔质量是22 g·mol-1
(4)CH4的摩尔质量和NA个CH4分子的质量相等
(5)2NA个CO2的摩尔质量为88 g·mol-1
(6)Fe的摩尔质量为56 g·mol-1,则1个Fe原子质量为
×
×
×
×
×
√
二、摩尔质量
应用体验
2.下列说法正确的是
A.二氧化碳的摩尔质量为44 g
B.1 mol氧原子的质量就是氧的相对原子质量
C.H2SO4的摩尔质量为96 g·mol-1
D.1 mol CO2的分子数为NA
√
44 g·mol-1
在数值上相等,但单位不同
98 g·mol-1
二、摩尔质量
应用体验
3.我国科学家屠呦呦发现青蒿素,它是一种用于治疗疟疾的药物,2015年10月获得诺贝尔生理学或医学奖。下列有关青蒿素(化学式:C15H22O5)的叙述正确的是
A.青蒿素的摩尔质量为282
B.6.02×1023个青蒿素分子的质量约为282 g
C.1 mol青蒿素的质量为282 g·mol-1
D.282 g青蒿素中含有15个碳原子
√
二、摩尔质量
二、摩尔质量
归纳总结
自我测试
1.下列说法正确的是
①物质的量是联系宏观的物质和微观的粒子之间的桥梁 ②物质的量是摩尔的单位 ③1 mol氧所含的粒子个数约为6.02×1023 ④摩尔是描述微观粒子多少的物理量 ⑤3.01×1023个H2O分子的物质的量为0.5 mol
A.①②⑤ B.①②④
C.①⑤ D.①③⑤
√
摩尔是物质的量的单位
没有指明具体粒子是什么
物质的量是描述微观粒子多少的物理量
自我测试
2.“物质的量”是国际单位制中的一个基本物理量,下列有关说法正确的是
A.2 g H2含有1 mol氢分子
B.2 mol氧气的摩尔质量为64 g·mol-1
C.1 mol任何物质都含有6.02×1023个分子
D.质量相等的CO和CO2,物质的量之比为2∶3
√
氧气的摩尔质量与其物质的量无关
并不是所有物质都是由分子构成,如NaCl由离子构成
1 g CO mol,1 g CO2 mol,二者物质的量之比 ∶=11∶7
自我测试
3.40.5 g某金属氯化物RCl2含有0.6 mol 氯离子,则金属R的摩尔质量为
A.135 g B.135 g·mol-1
C.64 g D.64 g·mol-1
√
含0.6 mol氯离子的RCl2的物质的量为×0.6 mol=0.3 mol,
RCl2的摩尔质量为=135 g·mol-1,
R的摩尔质量为(135-35.5×2) g·mol-1=64 g·mol-1。
自我测试
4.按要求填写下列空白:
(1)6.02×1023个Na+约含____ mol Na+,其质量为_____ g。
(2)4.5 mol CH4约含有____________________个CH4,其质量为_____g。
(3)3.01×1023个约含_____mol ,其质量为______ g;49 g H2SO4约含有________________个H,共含有______________________个原子。
23
1
0.5
48
6.02×1023(或NA)
2.107×1024(或3.5NA)
72
2.709×1024(或4.5NA)
本节内容结束
