高一化学人教版必修一(2019)2.1.1活泼的金属单质——钠(共31张ppt)
文档属性
| 名称 | 高一化学人教版必修一(2019)2.1.1活泼的金属单质——钠(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 53.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 10:12:20 | ||
图片预览










文档简介
(共31张PPT)
第一节 钠及其化合物
第1课时 活泼的金属单质——钠
第二章 海水中的重要元素——钠和氯
1.能从钠原子的微观结构认识钠的主要宏观性质(重点)。
2.能依据研究目的设计实验探究钠与氧气、水的反应(重点),会分析
钠与酸、碱、盐溶液的反应,形成证据推理意识(难点)。
3.通过学习钠在生活中的应用,感受化学的魅力,加强社会参与意识。
[学习目标]
导入新课
海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯是其中含量较高的元素。钠单质具有怎样的性质
钠为什么如此活泼?
试从原子结构角度分析
一、钠的原子结构、钠与非金属单质的反应
1.钠元素的存在及原子结构
易失去1个电子
具有强还原性
Na
Na+
钠元素在自然界中都以化合物形式存在,如NaCl、Na2SO4、 Na2CO3等。
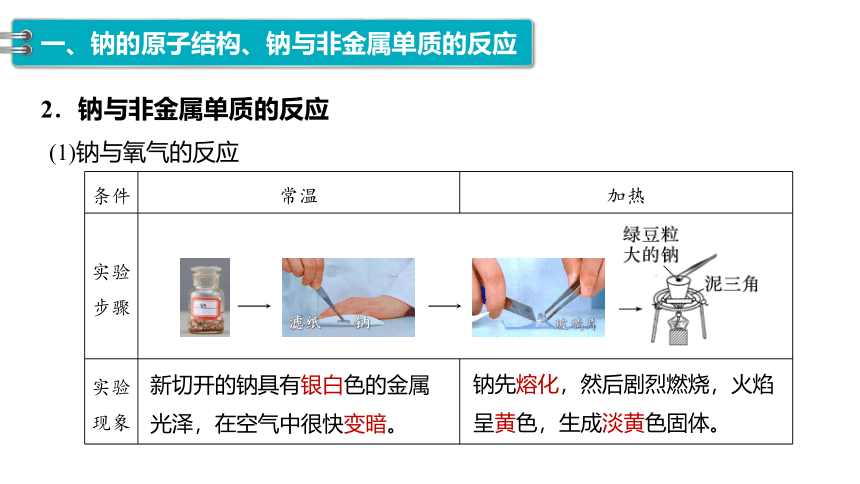
(1)钠与氧气的反应
注意条件对反应的影响
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
(1)钠与氧气的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
条件 常温 加热
实验步骤 实验现象
滤纸 钠
玻璃片
新切开的钠具有银白色的金属光泽,在空气中很快变暗。
钠先熔化,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体。
(1)钠与氧气的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
条件 常温 加热
实验现象
反应原理
4Na+O2===2Na2O
钠与O2反应,条件不同,现象不同,产物也不同。
2Na+O2===Na2O2
1.根据以上实验中的实验操作及现象,分析总结钠的物理性质、钠在常温和加热条件下与氧气反应的原理及特点,填写下列空格。
(1)物理性质:钠具有_____色的金属光泽,硬度____,熔点_____,密度_____于煤油,通常保存在________________中。
(2)写出钠与氧气在不同条件下反应的化学方程式,对比分析反应特点。
常温下:__________________;加热时:____________________。
钠与氧气反应的特点:反应条件不同,钠与氧气反应的产物_____同。
银白
小
低
大
煤油或石蜡油
4Na+O2===2Na2O
不
思考交流
一、钠的原子结构、钠与非金属单质的反应
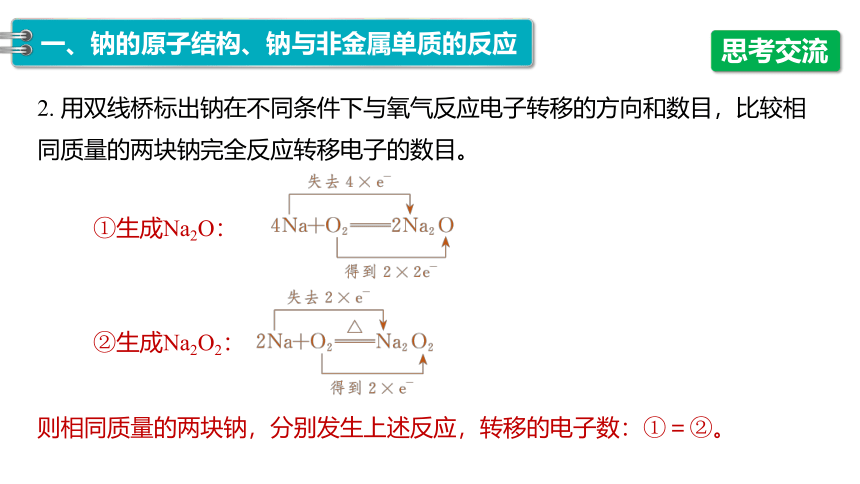
2. 用双线桥标出钠在不同条件下与氧气反应电子转移的方向和数目,比较相同质量的两块钠完全反应转移电子的数目。
①生成Na2O:
②生成Na2O2:
则相同质量的两块钠,分别发生上述反应,转移的电子数:①=②。
一、钠的原子结构、钠与非金属单质的反应
思考交流
(2)钠与其他非金属单质的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
钠与其他非金属单质化合生成的化合物中钠只显+1价。
2Na+Cl2====2NaCl
点燃
金属钠与氯气、硫的反应
2Na+S===Na2S
应用体验
1.判断正误
(1)钠元素在自然界中有的以单质的形式存在
(2)金属钠能存放于煤油中,也可存放于石蜡油中
(3)实验中取出的药品都不能再放回原试剂瓶
(4)常温下,钠与氧气反应生成淡黄色固体
(5)在坩埚中加热钠时,可以近距离俯视坩埚观察现象
(6)钠与氧气反应时,条件不同,产物也不同
×
√
×
×
×
√
一、钠的原子结构、钠与非金属单质的反应
2.取一小块金属钠放在燃烧匙中加热,下列对实验现象描述正确的是
①金属钠熔化
②在空气中燃烧,火焰为蓝紫色
③燃烧后得到白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体
A.①② B.①②③ C.①④⑤ D.④⑤
√
熔点低,反应放热
黄色
过氧化钠淡黄色
一、钠的原子结构、钠与非金属单质的反应
应用体验
3.A、B、C是中学化学中常见的三种物质,它们之间的相互
转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为______________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_____,B→C反应的化学方程式为___________________。
A和C反应的化学方程式:___________________(若不能,此空不填)。
Na2O
Na2O2
CO2
C
CO2
一、钠的原子结构、钠与非金属单质的反应
C+CO2====2CO
高温
2CO+O2====2CO2
高温
2Na+O2===Na2O2
应用体验
1.预测
二、钠与水的反应探究
Na + H2O →
0
+1 -2
NaOH + H2↑
+1
0
2.实验
实验操作 实验现象 分析及结论
钠在水中的位置:
钠的变化:
钠的运动状态:
反应剧烈程度:
溶液颜色变化:
实验操作 实验现象 分析及结论
钠在水中的位置:
钠的变化:
钠的运动状态:
反应剧烈程度:
溶液颜色变化:
浮在水面上
熔化成闪亮小球
四处游动
发出“嘶嘶”响声
逐渐变红
钠密度比水小
钠熔点低,反应放热
生成氢气推动钠来回游动
剧烈反应产生气体
有碱性物质生成
二、钠与水的反应探究
2.实验
1.预测
Na + H2O →
NaOH + H2↑
2Na + 2H2O=== 2NaOH + H2↑
2Na+2H2O===2Na++2OH-+H2↑
特别提醒 钠与水反应的实质是钠置换水电离出的H+生成H2。
还原剂
0
+1
+1
0
氧化剂
二、钠与水的反应探究
3.结论
思考交流
某同学设计实验探究钠与酸、碱、盐溶液的反应,将一块绿豆粒
大小的钠分别投入盛有①稀盐酸、②饱和澄清石灰水和③CuSO4溶液
的三个烧杯中,回答下列问题。
(1)实验①中,钠与稀盐酸反应比钠与水反应更剧烈,试写出钠与稀盐酸反应的化学方程式。若稀盐酸不足量,金属钠能否剩余,为什么?
2Na+2HCl===2NaCl+H2↑。
不能;稀盐酸不足,过量的钠会与溶剂水继续反应生成NaOH和H2。
二、钠与水的反应探究
思考交流
(2)实验②中,饱和澄清石灰水出现白色浑浊,试结合离子方程式分析原因。
二、钠与水的反应探究
2Na+2H2O===2Na++2OH-+H2↑;
Ca(OH)2溶解度随温度升高而降低,钠与水反应放出热量且消耗溶剂水,
石灰水过饱和,析出Ca(OH)2固体,出现白色浑浊。
思考交流
(3)实验③中,产生蓝色絮状沉淀,未观察到产生紫红色金属铜。请结合化学方程式分析产生上述现象的原因。
二、钠与水的反应探究
钠先与水反应:2Na+2H2O===2NaOH+H2↑,NaOH再与CuSO4发生复分解反应生成Cu(OH)2蓝色沉淀:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
归纳总结
钠与溶液的反应
二、钠与水的反应探究
特 别 提 醒
(1)钠遇水记五点:浮熔游响红。遇酸酸优先,遇盐水在前。
(2)高温下,钠在无水环境中可以置换出某些不活泼金属。
例如,工业上常用钠作还原剂来冶炼金属Ti等:TiCl4+4Na===4NaCl+Ti。
高温
二、钠与水的反应探究
1.判断正误
(1)钠的密度比水小,比煤油大
(2)钠与水反应的离子方程式为Na+H2O===Na++OH-+H2↑
(3)取用钠时,不能用手直接接触钠
(4)钠失火时不能用水扑灭,应该用干燥的沙土盖灭
(5)钠投入NaOH溶液中,无明显现象
√
×
√
√
×
应用体验
二、钠与水的反应探究
应用体验
2.将一块金属钠投入盛有冷水的滴有紫色石蕊溶液的烧杯中,
甲同学认为可观察到下列现象,其中正确的有
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生 ③反应后溶液变红
④钠熔化成闪亮的小球 ⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
√
应浮在水面上
紫色石蕊溶液变蓝色
二、钠与水的反应探究
自我测试
1.(2023·浙江高一学考)做钠在氧气中加热的实验时,下列仪器不需要用到的是
√
钠放入坩埚中,酒精灯作热源,坩埚放在泥三角上加热
自我测试
2.将绿豆大小的金属钠投入干燥的热坩埚中,继续加热,片刻钠熔化,然后立即撤掉酒精灯,观察到:钠剧烈燃烧,发出黄色火焰,得到一种淡黄色固体。下列说法不正确的是
A.用干燥的坩埚是为了避免钠与水反应
B.金属钠熔化说明其熔点低于坩埚
C.黄色火焰说明燃烧升温已使钠气化
D.得到淡黄色固体说明发生了物理变化
√
生成了新物质,化学变化
自我测试
3.(2023·上海浦东新区高一检测)在探究钠与冷水的反应实验中,无法体现的性质是
A.钠的密度小于水
B.金属钠具有良好的导热性
C.金属钠的熔点低
D.钠具有很强的还原性
√
和冷水反应说明性质很活泼,易失电子
浮
熔
自我测试
4.向下列溶液中分别加入一小块金属钠,对应的现象正确的是
A.饱和NaOH溶液:产生气体,恢复至室温后溶液的pH变大
B.稀CuSO4溶液:产生气体,有紫红色固体析出
C.NH4NO3溶液:产生无色有刺激性气味的气体
D.饱和NaHCO3溶液:产生气体,有白色沉淀产生
√
生成的碳酸钠溶解度更大
仍为饱和溶液, pH不变
生成蓝色沉淀
生成的OH-和铵根离子反应生成氨气
自我测试
5.(2023·重庆渝中区高一检测)某课外活动小组为了探究钠与MgSO4溶液的反应,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒金属钠,再从U形管左端加入MgSO4溶液,一段时间后加热铜丝。回答下列问题:
(1)从试剂瓶中取出使用后剩余的Na____
(填“能”或“否”)放回原试剂瓶。
能
钠是活泼金属
自我测试
(2)U形管中出现的现象是_____(填字母)。
A.有气泡生成,钠熔化成小球
B.钠在煤油液面上四处游动
C.溶液中有银白色金属生成
D.溶液变浑浊
AD
ρ煤油<ρ钠<ρ水,界面处上下跳动
钠先和水生成氢氧化钠和氢气,氢氧化钠再和硫酸镁反应生成氢氧化镁沉淀
自我测试
(3)写出钠与MgSO4溶液反应的化学方程式:
___________________________________________________。
(4)铜丝的变化是________________,
写出该反应的化学方程式:______________________。
2Na+2H2O+MgSO4===Mg(OH)2↓+Na2SO4+H2↑
由黑色变为红色
H2+CuO ===Cu+H2O
本节内容结束
第一节 钠及其化合物
第1课时 活泼的金属单质——钠
第二章 海水中的重要元素——钠和氯
1.能从钠原子的微观结构认识钠的主要宏观性质(重点)。
2.能依据研究目的设计实验探究钠与氧气、水的反应(重点),会分析
钠与酸、碱、盐溶液的反应,形成证据推理意识(难点)。
3.通过学习钠在生活中的应用,感受化学的魅力,加强社会参与意识。
[学习目标]
导入新课
海洋是一个巨大的化学资源宝库,含有80多种元素,钠和氯是其中含量较高的元素。钠单质具有怎样的性质
钠为什么如此活泼?
试从原子结构角度分析
一、钠的原子结构、钠与非金属单质的反应
1.钠元素的存在及原子结构
易失去1个电子
具有强还原性
Na
Na+
钠元素在自然界中都以化合物形式存在,如NaCl、Na2SO4、 Na2CO3等。
(1)钠与氧气的反应
注意条件对反应的影响
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
(1)钠与氧气的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
条件 常温 加热
实验步骤 实验现象
滤纸 钠
玻璃片
新切开的钠具有银白色的金属光泽,在空气中很快变暗。
钠先熔化,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体。
(1)钠与氧气的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
条件 常温 加热
实验现象
反应原理
4Na+O2===2Na2O
钠与O2反应,条件不同,现象不同,产物也不同。
2Na+O2===Na2O2
1.根据以上实验中的实验操作及现象,分析总结钠的物理性质、钠在常温和加热条件下与氧气反应的原理及特点,填写下列空格。
(1)物理性质:钠具有_____色的金属光泽,硬度____,熔点_____,密度_____于煤油,通常保存在________________中。
(2)写出钠与氧气在不同条件下反应的化学方程式,对比分析反应特点。
常温下:__________________;加热时:____________________。
钠与氧气反应的特点:反应条件不同,钠与氧气反应的产物_____同。
银白
小
低
大
煤油或石蜡油
4Na+O2===2Na2O
不
思考交流
一、钠的原子结构、钠与非金属单质的反应
2. 用双线桥标出钠在不同条件下与氧气反应电子转移的方向和数目,比较相同质量的两块钠完全反应转移电子的数目。
①生成Na2O:
②生成Na2O2:
则相同质量的两块钠,分别发生上述反应,转移的电子数:①=②。
一、钠的原子结构、钠与非金属单质的反应
思考交流
(2)钠与其他非金属单质的反应
一、钠的原子结构、钠与非金属单质的反应
2.钠与非金属单质的反应
钠与其他非金属单质化合生成的化合物中钠只显+1价。
2Na+Cl2====2NaCl
点燃
金属钠与氯气、硫的反应
2Na+S===Na2S
应用体验
1.判断正误
(1)钠元素在自然界中有的以单质的形式存在
(2)金属钠能存放于煤油中,也可存放于石蜡油中
(3)实验中取出的药品都不能再放回原试剂瓶
(4)常温下,钠与氧气反应生成淡黄色固体
(5)在坩埚中加热钠时,可以近距离俯视坩埚观察现象
(6)钠与氧气反应时,条件不同,产物也不同
×
√
×
×
×
√
一、钠的原子结构、钠与非金属单质的反应
2.取一小块金属钠放在燃烧匙中加热,下列对实验现象描述正确的是
①金属钠熔化
②在空气中燃烧,火焰为蓝紫色
③燃烧后得到白色固体
④燃烧时火焰为黄色
⑤燃烧后生成淡黄色固体
A.①② B.①②③ C.①④⑤ D.④⑤
√
熔点低,反应放热
黄色
过氧化钠淡黄色
一、钠的原子结构、钠与非金属单质的反应
应用体验
3.A、B、C是中学化学中常见的三种物质,它们之间的相互
转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为______________________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为_____,B→C反应的化学方程式为___________________。
A和C反应的化学方程式:___________________(若不能,此空不填)。
Na2O
Na2O2
CO2
C
CO2
一、钠的原子结构、钠与非金属单质的反应
C+CO2====2CO
高温
2CO+O2====2CO2
高温
2Na+O2===Na2O2
应用体验
1.预测
二、钠与水的反应探究
Na + H2O →
0
+1 -2
NaOH + H2↑
+1
0
2.实验
实验操作 实验现象 分析及结论
钠在水中的位置:
钠的变化:
钠的运动状态:
反应剧烈程度:
溶液颜色变化:
实验操作 实验现象 分析及结论
钠在水中的位置:
钠的变化:
钠的运动状态:
反应剧烈程度:
溶液颜色变化:
浮在水面上
熔化成闪亮小球
四处游动
发出“嘶嘶”响声
逐渐变红
钠密度比水小
钠熔点低,反应放热
生成氢气推动钠来回游动
剧烈反应产生气体
有碱性物质生成
二、钠与水的反应探究
2.实验
1.预测
Na + H2O →
NaOH + H2↑
2Na + 2H2O=== 2NaOH + H2↑
2Na+2H2O===2Na++2OH-+H2↑
特别提醒 钠与水反应的实质是钠置换水电离出的H+生成H2。
还原剂
0
+1
+1
0
氧化剂
二、钠与水的反应探究
3.结论
思考交流
某同学设计实验探究钠与酸、碱、盐溶液的反应,将一块绿豆粒
大小的钠分别投入盛有①稀盐酸、②饱和澄清石灰水和③CuSO4溶液
的三个烧杯中,回答下列问题。
(1)实验①中,钠与稀盐酸反应比钠与水反应更剧烈,试写出钠与稀盐酸反应的化学方程式。若稀盐酸不足量,金属钠能否剩余,为什么?
2Na+2HCl===2NaCl+H2↑。
不能;稀盐酸不足,过量的钠会与溶剂水继续反应生成NaOH和H2。
二、钠与水的反应探究
思考交流
(2)实验②中,饱和澄清石灰水出现白色浑浊,试结合离子方程式分析原因。
二、钠与水的反应探究
2Na+2H2O===2Na++2OH-+H2↑;
Ca(OH)2溶解度随温度升高而降低,钠与水反应放出热量且消耗溶剂水,
石灰水过饱和,析出Ca(OH)2固体,出现白色浑浊。
思考交流
(3)实验③中,产生蓝色絮状沉淀,未观察到产生紫红色金属铜。请结合化学方程式分析产生上述现象的原因。
二、钠与水的反应探究
钠先与水反应:2Na+2H2O===2NaOH+H2↑,NaOH再与CuSO4发生复分解反应生成Cu(OH)2蓝色沉淀:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
归纳总结
钠与溶液的反应
二、钠与水的反应探究
特 别 提 醒
(1)钠遇水记五点:浮熔游响红。遇酸酸优先,遇盐水在前。
(2)高温下,钠在无水环境中可以置换出某些不活泼金属。
例如,工业上常用钠作还原剂来冶炼金属Ti等:TiCl4+4Na===4NaCl+Ti。
高温
二、钠与水的反应探究
1.判断正误
(1)钠的密度比水小,比煤油大
(2)钠与水反应的离子方程式为Na+H2O===Na++OH-+H2↑
(3)取用钠时,不能用手直接接触钠
(4)钠失火时不能用水扑灭,应该用干燥的沙土盖灭
(5)钠投入NaOH溶液中,无明显现象
√
×
√
√
×
应用体验
二、钠与水的反应探究
应用体验
2.将一块金属钠投入盛有冷水的滴有紫色石蕊溶液的烧杯中,
甲同学认为可观察到下列现象,其中正确的有
①钠投入水中,先沉入水底,后浮出水面
②钠立即与水反应,并有气体产生 ③反应后溶液变红
④钠熔化成闪亮的小球 ⑤小球在水面上四处游动
⑥有“嘶嘶”的响声发出
A.①②③④ B.②③④⑤ C.②④⑤⑥ D.③④⑥
√
应浮在水面上
紫色石蕊溶液变蓝色
二、钠与水的反应探究
自我测试
1.(2023·浙江高一学考)做钠在氧气中加热的实验时,下列仪器不需要用到的是
√
钠放入坩埚中,酒精灯作热源,坩埚放在泥三角上加热
自我测试
2.将绿豆大小的金属钠投入干燥的热坩埚中,继续加热,片刻钠熔化,然后立即撤掉酒精灯,观察到:钠剧烈燃烧,发出黄色火焰,得到一种淡黄色固体。下列说法不正确的是
A.用干燥的坩埚是为了避免钠与水反应
B.金属钠熔化说明其熔点低于坩埚
C.黄色火焰说明燃烧升温已使钠气化
D.得到淡黄色固体说明发生了物理变化
√
生成了新物质,化学变化
自我测试
3.(2023·上海浦东新区高一检测)在探究钠与冷水的反应实验中,无法体现的性质是
A.钠的密度小于水
B.金属钠具有良好的导热性
C.金属钠的熔点低
D.钠具有很强的还原性
√
和冷水反应说明性质很活泼,易失电子
浮
熔
自我测试
4.向下列溶液中分别加入一小块金属钠,对应的现象正确的是
A.饱和NaOH溶液:产生气体,恢复至室温后溶液的pH变大
B.稀CuSO4溶液:产生气体,有紫红色固体析出
C.NH4NO3溶液:产生无色有刺激性气味的气体
D.饱和NaHCO3溶液:产生气体,有白色沉淀产生
√
生成的碳酸钠溶解度更大
仍为饱和溶液, pH不变
生成蓝色沉淀
生成的OH-和铵根离子反应生成氨气
自我测试
5.(2023·重庆渝中区高一检测)某课外活动小组为了探究钠与MgSO4溶液的反应,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒金属钠,再从U形管左端加入MgSO4溶液,一段时间后加热铜丝。回答下列问题:
(1)从试剂瓶中取出使用后剩余的Na____
(填“能”或“否”)放回原试剂瓶。
能
钠是活泼金属
自我测试
(2)U形管中出现的现象是_____(填字母)。
A.有气泡生成,钠熔化成小球
B.钠在煤油液面上四处游动
C.溶液中有银白色金属生成
D.溶液变浑浊
AD
ρ煤油<ρ钠<ρ水,界面处上下跳动
钠先和水生成氢氧化钠和氢气,氢氧化钠再和硫酸镁反应生成氢氧化镁沉淀
自我测试
(3)写出钠与MgSO4溶液反应的化学方程式:
___________________________________________________。
(4)铜丝的变化是________________,
写出该反应的化学方程式:______________________。
2Na+2H2O+MgSO4===Mg(OH)2↓+Na2SO4+H2↑
由黑色变为红色
H2+CuO ===Cu+H2O
本节内容结束
