2.1.4碳酸钠与碳酸氢钠的鉴别与转化、计算与测定 课件(共25张PPT)
文档属性
| 名称 | 2.1.4碳酸钠与碳酸氢钠的鉴别与转化、计算与测定 课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 947.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 10:19:03 | ||
图片预览






文档简介
(共25张PPT)
第二章 第一节
第4课时 碳酸钠与碳酸氢钠的
鉴别与转化、计算与
测定
1.基于已学知识鉴别碳酸钠和碳酸氢钠,并通过不同方法实现碳酸钠和碳酸
氢钠的相互转化(重点)。
2.掌握碳酸钠和碳酸氢钠的相关计算,并学会对碳酸钠和碳酸氢钠的图像
进行分析(难点)。
学习目标
碳酸钠与碳酸氢钠的鉴别、转化与除杂
一
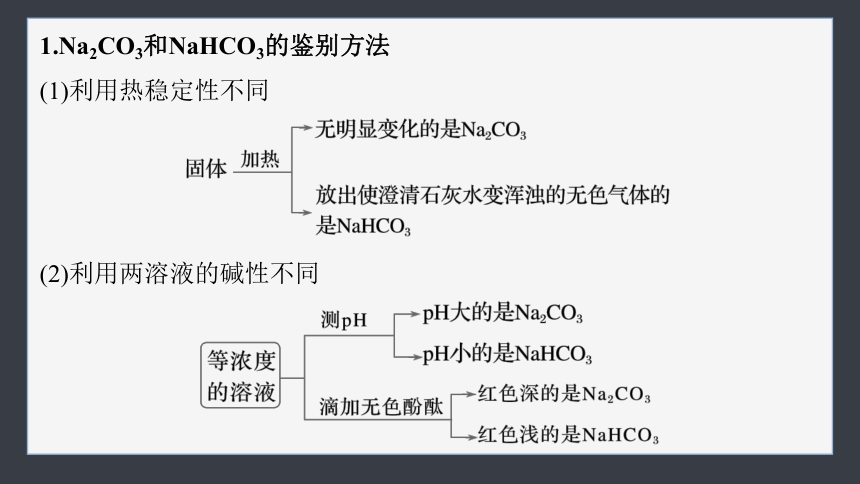
1.Na2CO3和NaHCO3的鉴别方法
(1)利用热稳定性不同
(2)利用两溶液的碱性不同
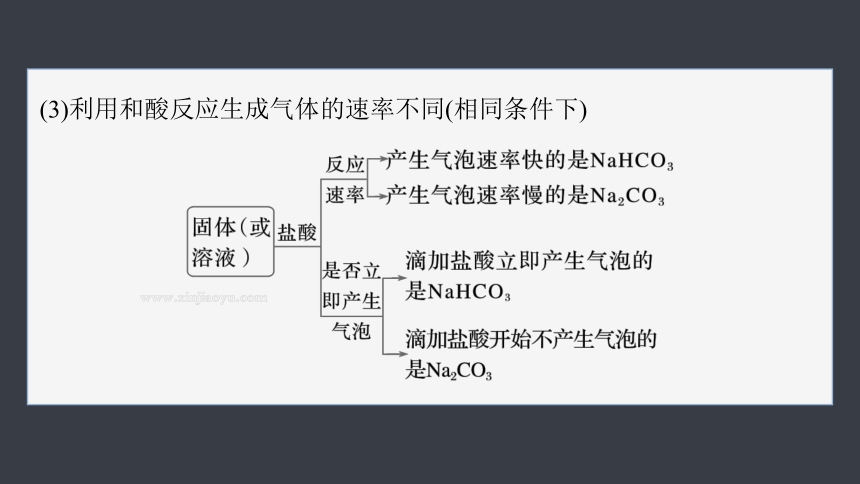
(3)利用和酸反应生成气体的速率不同(相同条件下)
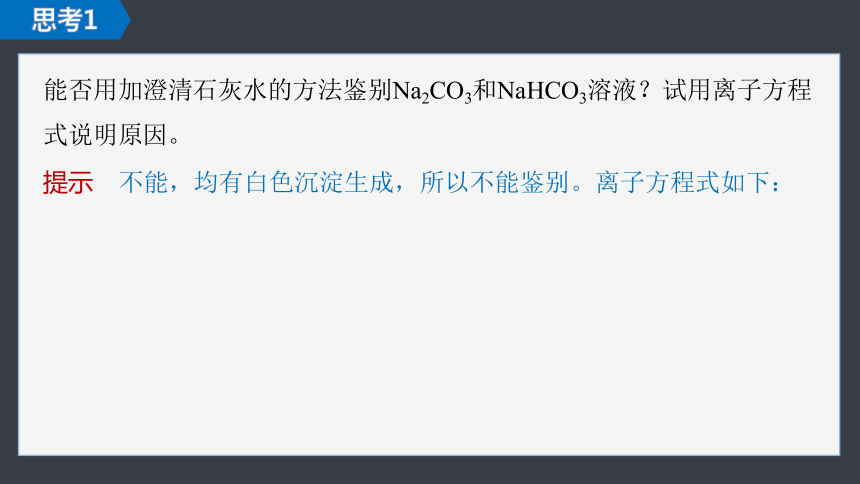
能否用加澄清石灰水的方法鉴别Na2CO3和NaHCO3溶液?试用离子方程式说明原因。
思考1
提示 不能,均有白色沉淀生成,所以不能鉴别。离子方程式如下:
思考2
2.Na2CO3与NaHCO3的相互转化
从物质的类别来看,碳酸钠是正盐而碳酸氢钠是酸式盐,通过哪些方法能够实现它们之间的转化?并写出相应的化学方程式。
①Na2CO3+CO2+H2O===2NaHCO3(溶液);
③NaHCO3+NaOH===Na2CO3+H2O(溶液)。
提示 Na2CO3 NaHCO3,①②③的化学方程式如下:
3.常用的除杂(提纯)方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
应用体验
1.判断正误
(1)向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出
(2)Na2CO3和NaHCO3溶液分别和Ca(OH)2溶液反应,现象相同
(3)用加热的方法可除去碳酸氢钠固体中的碳酸钠
(4)不用其他试剂不能鉴别Na2CO3溶液与盐酸
√
×
×
√
应用体验
2.某课外小组为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如图几种实验方法。下列说法不正确的是
A.装置Ⅰ中的Na2CO3和NaHCO3
均能与盐酸反应,产生气体速
率快的是NaHCO3
B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是NaHCO3
C.加热装置Ⅱ,使澄清石灰水变浑浊一侧的白色固体是NaHCO3
D.装置Ⅲ也可以鉴别Na2CO3和NaHCO3
√
碳酸钠和碳酸氢钠均与盐酸反应生成二氧化碳气体,盛放碳酸氢钠的气球鼓得更快,说明产生气体速率快的是碳酸氢钠,A正确;
等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸氢钠产生的二氧化碳的量多,故气球鼓起体积较大的是碳酸氢钠,B错误;
碳酸氢钠受热分解生成二氧化碳,使澄清石灰水变浑浊,而碳酸钠加热不反应,C、D正确。
应用体验
3.(2022·长沙高一检测)为除去括号内的杂质,所选用的试剂或方法错误的是
A.CO2气体(HCl),饱和NaHCO3溶液
B.Na2CO3固体(NaHCO3),加热至不再产生气体
C.NaHCO3溶液(Na2CO3),通入过量的CO2后微热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
√
HCl与NaHCO3反应生成CO2,洗气可分离,故A正确;
加热NaHCO3可分解生成Na2CO3,故B正确;
Na2CO3可以和CO2、H2O反应生成NaHCO3,微热可除去溶解的CO2,故C正确;
Na2SO4与Ba(OH)2反应生成BaSO4沉淀和NaOH,引入了新杂质,故D错误。
返回
碳酸钠与碳酸氢钠的相关计算与测定
二
1.Na2CO3、NaHCO3与足量盐酸反应的定量关系
a g Na2CO3与足量盐酸反应,消耗HCl的质量为_____ g,生成CO2的质
量为_____ g;
a g NaHCO3与足量盐酸反应,消耗HCl的质量为______ g,生成CO2的质量为______ g。
结论:
耗酸量 等质量 Na2CO3耗酸多
生成CO2的体积 等质量 NaHCO3产生的CO2多
2.图像分析法
请根据V(CO2)随V(盐酸)变化的坐标图写出下列过程中反应的化学方程式。
(1)向Na2CO3溶液中逐滴滴入盐酸
Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
(3)向NaOH、Na2CO3混合液中逐滴滴入盐酸
NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
(4)向Na2CO3、NaHCO3混合液中逐滴滴入盐酸
Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
3.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
若将84 g碳酸氢钠和78 g过氧化钠置于密闭容器中,加热一段时间后,容器中的固体是什么?固体的质量是多少?
例
84 g 53 g 22 g 9 g
2CO2+2Na2O2===2Na2CO3+O2
22 g 39 g 53 g
2H2O+2Na2O2===4NaOH+O2↑
9 g 39 g 40 g
综上所述,加热一段时间后,容器中的固体及质量分别是碳酸钠106 g、氢氧化钠40 g。
应用体验
1.(2022·湖北黄冈高一期中)实验室可通过沉淀重量法测量样品纯度,按如图装置测定纯碱(含少量NaCl)的纯度,下列说法正确的是
A.装置A中药品应为浓硫酸,C中试剂应该为
BaCl2溶液
B.在B~C之间应增添盛有饱和NaHCO3溶液的洗气
装置,以除去氯化氢气体
C.只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钠的质量分数
D.反应结束后,需经过过滤、洗涤、干燥、称量等操作测定C中沉淀质量
√
应用体验
2.(2023·北京延庆高一期末)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数的是
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量氢氧化钠充分反应,加热、蒸干、灼烧,得b g固体
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g
固体
√
第二章 第一节
第4课时 碳酸钠与碳酸氢钠的
鉴别与转化、计算与
测定
1.基于已学知识鉴别碳酸钠和碳酸氢钠,并通过不同方法实现碳酸钠和碳酸
氢钠的相互转化(重点)。
2.掌握碳酸钠和碳酸氢钠的相关计算,并学会对碳酸钠和碳酸氢钠的图像
进行分析(难点)。
学习目标
碳酸钠与碳酸氢钠的鉴别、转化与除杂
一
1.Na2CO3和NaHCO3的鉴别方法
(1)利用热稳定性不同
(2)利用两溶液的碱性不同
(3)利用和酸反应生成气体的速率不同(相同条件下)
能否用加澄清石灰水的方法鉴别Na2CO3和NaHCO3溶液?试用离子方程式说明原因。
思考1
提示 不能,均有白色沉淀生成,所以不能鉴别。离子方程式如下:
思考2
2.Na2CO3与NaHCO3的相互转化
从物质的类别来看,碳酸钠是正盐而碳酸氢钠是酸式盐,通过哪些方法能够实现它们之间的转化?并写出相应的化学方程式。
①Na2CO3+CO2+H2O===2NaHCO3(溶液);
③NaHCO3+NaOH===Na2CO3+H2O(溶液)。
提示 Na2CO3 NaHCO3,①②③的化学方程式如下:
3.常用的除杂(提纯)方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
应用体验
1.判断正误
(1)向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出
(2)Na2CO3和NaHCO3溶液分别和Ca(OH)2溶液反应,现象相同
(3)用加热的方法可除去碳酸氢钠固体中的碳酸钠
(4)不用其他试剂不能鉴别Na2CO3溶液与盐酸
√
×
×
√
应用体验
2.某课外小组为了鉴别Na2CO3和NaHCO3两种白色固体,设计了如图几种实验方法。下列说法不正确的是
A.装置Ⅰ中的Na2CO3和NaHCO3
均能与盐酸反应,产生气体速
率快的是NaHCO3
B.当稀盐酸足量时,装置Ⅰ中气球鼓起体积较小的是NaHCO3
C.加热装置Ⅱ,使澄清石灰水变浑浊一侧的白色固体是NaHCO3
D.装置Ⅲ也可以鉴别Na2CO3和NaHCO3
√
碳酸钠和碳酸氢钠均与盐酸反应生成二氧化碳气体,盛放碳酸氢钠的气球鼓得更快,说明产生气体速率快的是碳酸氢钠,A正确;
等质量的碳酸钠和碳酸氢钠与足量盐酸反应时,碳酸氢钠产生的二氧化碳的量多,故气球鼓起体积较大的是碳酸氢钠,B错误;
碳酸氢钠受热分解生成二氧化碳,使澄清石灰水变浑浊,而碳酸钠加热不反应,C、D正确。
应用体验
3.(2022·长沙高一检测)为除去括号内的杂质,所选用的试剂或方法错误的是
A.CO2气体(HCl),饱和NaHCO3溶液
B.Na2CO3固体(NaHCO3),加热至不再产生气体
C.NaHCO3溶液(Na2CO3),通入过量的CO2后微热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
√
HCl与NaHCO3反应生成CO2,洗气可分离,故A正确;
加热NaHCO3可分解生成Na2CO3,故B正确;
Na2CO3可以和CO2、H2O反应生成NaHCO3,微热可除去溶解的CO2,故C正确;
Na2SO4与Ba(OH)2反应生成BaSO4沉淀和NaOH,引入了新杂质,故D错误。
返回
碳酸钠与碳酸氢钠的相关计算与测定
二
1.Na2CO3、NaHCO3与足量盐酸反应的定量关系
a g Na2CO3与足量盐酸反应,消耗HCl的质量为_____ g,生成CO2的质
量为_____ g;
a g NaHCO3与足量盐酸反应,消耗HCl的质量为______ g,生成CO2的质量为______ g。
结论:
耗酸量 等质量 Na2CO3耗酸多
生成CO2的体积 等质量 NaHCO3产生的CO2多
2.图像分析法
请根据V(CO2)随V(盐酸)变化的坐标图写出下列过程中反应的化学方程式。
(1)向Na2CO3溶液中逐滴滴入盐酸
Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
(3)向NaOH、Na2CO3混合液中逐滴滴入盐酸
NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
(4)向Na2CO3、NaHCO3混合液中逐滴滴入盐酸
Na2CO3+HCl===NaCl+NaHCO3、NaHCO3+HCl===NaCl+H2O+CO2↑。
3.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
若将84 g碳酸氢钠和78 g过氧化钠置于密闭容器中,加热一段时间后,容器中的固体是什么?固体的质量是多少?
例
84 g 53 g 22 g 9 g
2CO2+2Na2O2===2Na2CO3+O2
22 g 39 g 53 g
2H2O+2Na2O2===4NaOH+O2↑
9 g 39 g 40 g
综上所述,加热一段时间后,容器中的固体及质量分别是碳酸钠106 g、氢氧化钠40 g。
应用体验
1.(2022·湖北黄冈高一期中)实验室可通过沉淀重量法测量样品纯度,按如图装置测定纯碱(含少量NaCl)的纯度,下列说法正确的是
A.装置A中药品应为浓硫酸,C中试剂应该为
BaCl2溶液
B.在B~C之间应增添盛有饱和NaHCO3溶液的洗气
装置,以除去氯化氢气体
C.只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钠的质量分数
D.反应结束后,需经过过滤、洗涤、干燥、称量等操作测定C中沉淀质量
√
应用体验
2.(2023·北京延庆高一期末)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3的质量分数的是
A.取a g混合物充分加热,减重b g
B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
C.取a g混合物与足量氢氧化钠充分反应,加热、蒸干、灼烧,得b g固体
D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g
固体
√
