高一化学人教版必修一(2019) 第二章 第一节 第5课时 钠及其化合物的转化关系与侯氏制碱法(共30张PPT)
文档属性
| 名称 | 高一化学人教版必修一(2019) 第二章 第一节 第5课时 钠及其化合物的转化关系与侯氏制碱法(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 12:07:15 | ||
图片预览






文档简介
(共30张PPT)
第二章 第一节
第5课时 钠及其化合物的转化
关系与侯氏制碱法
1.通过构建钠及其化合物的转化关系,解决关于钠及其化合物的框图与推断
问题(重点)。
2.了解纯碱的生产历史和侯氏制碱法(难点)。
学习目标
钠及其化合物的转化关系及推断
一
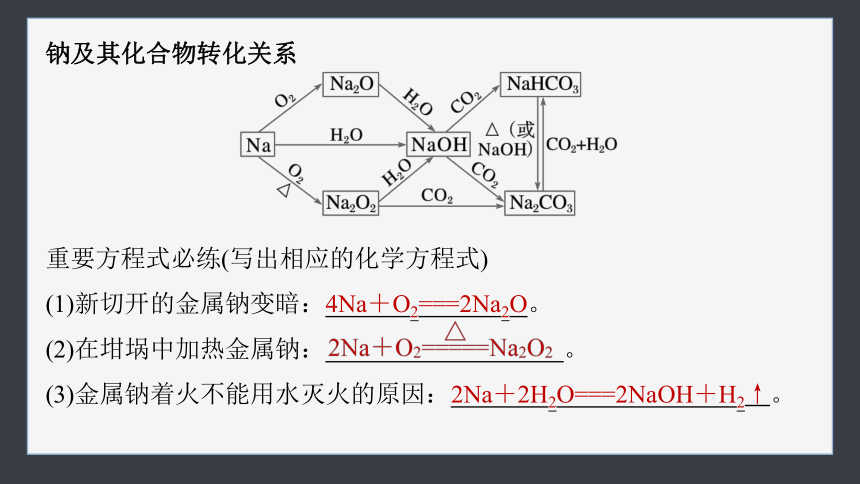
钠及其化合物转化关系
重要方程式必练(写出相应的化学方程式)
(1)新切开的金属钠变暗:4Na+O2===2Na2O。
(2)在坩埚中加热金属钠: 。
(3)金属钠着火不能用水灭火的原因:2Na+2H2O===2NaOH+H2↑。
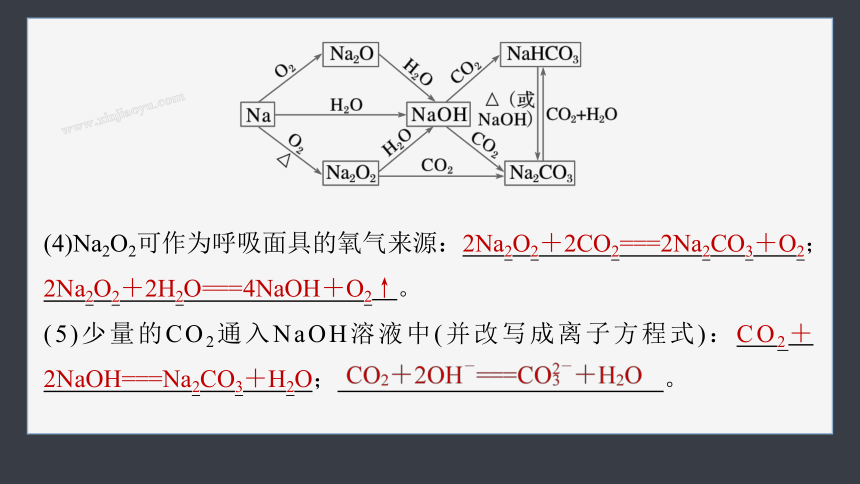
(4)Na2O2可作为呼吸面具的氧气来源:2Na2O2+2CO2===2Na2CO3+O2;2Na2O2+2H2O===4NaOH+O2↑。
(5)少量的CO2通入NaOH溶液中(并改写成离子方程式):CO2+2NaOH===Na2CO3+H2O; 。
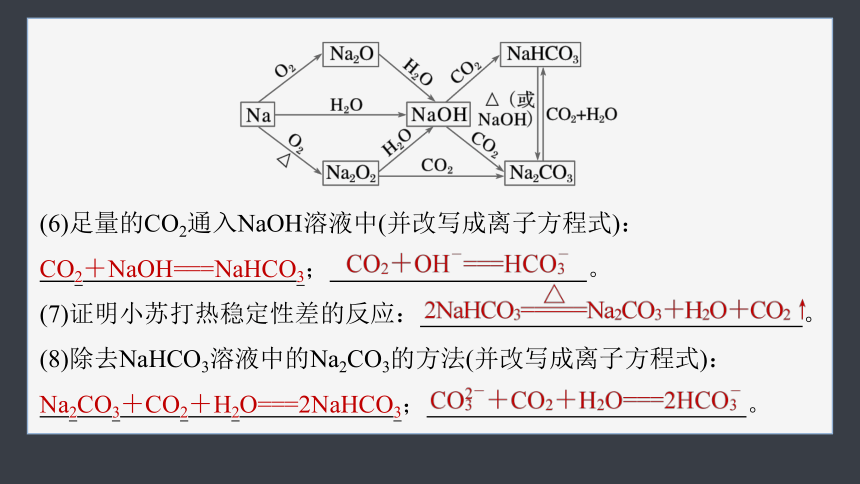
(6)足量的CO2通入NaOH溶液中(并改写成离子方程式):
CO2+NaOH===NaHCO3; 。
(7)证明小苏打热稳定性差的反应: 。
(8)除去NaHCO3溶液中的Na2CO3的方法(并改写成离子方程式):
Na2CO3+CO2+H2O===2NaHCO3; 。
应用体验
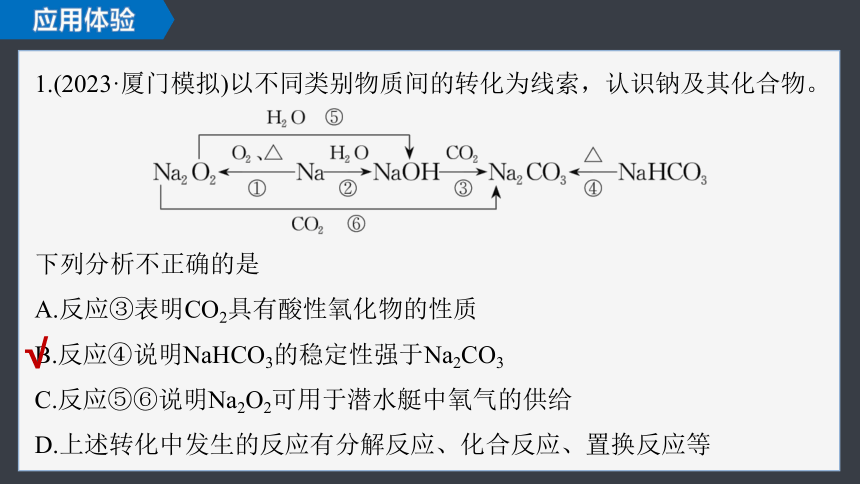
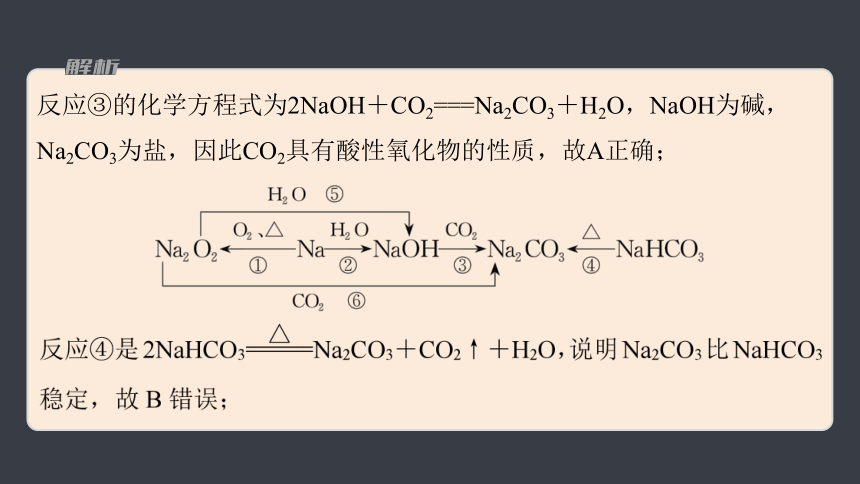
1.(2023·厦门模拟)以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
√
反应③的化学方程式为2NaOH+CO2===Na2CO3+H2O,NaOH为碱,Na2CO3为盐,因此CO2具有酸性氧化物的性质,故A正确;
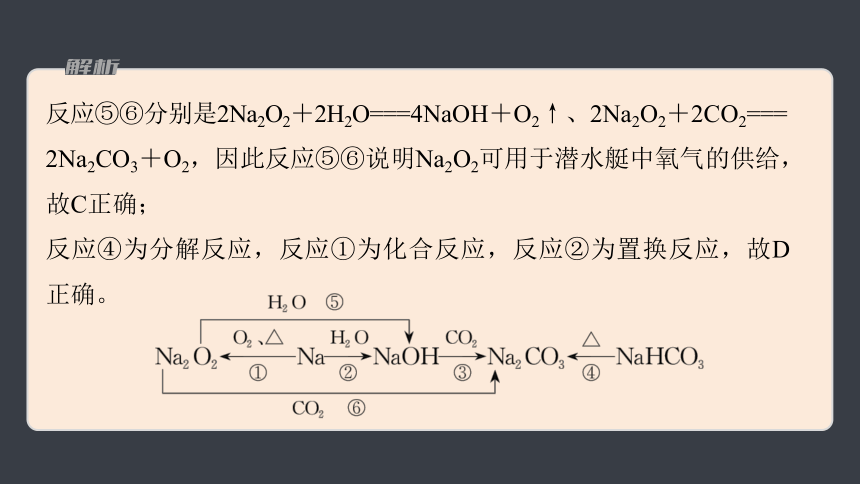
反应⑤⑥分别是2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===
2Na2CO3+O2,因此反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给,故C正确;
反应④为分解反应,反应①为化合反应,反应②为置换反应,故D正确。
应用体验
2.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,图为钠的价类二维图:
请回答以下问题:
(1)写出①表示的某种淡黄色固体能做供氧剂的原因:_________________
_____________________________________________(用化学方程式表示,写一个即可)。
2Na2O2+2CO2===
2Na2CO3+O2(或2Na2O2+2H2O===4NaOH+O2↑)
根据元素的价类二维图,①是钠的氧化物,钠的氧化物中显淡黄色的是Na2O2,过氧化钠能与CO2、H2O反应,化学方程式为2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑。
应用体验
(2)图中缺失的物质类别是____。
(3)NaH在野外可用作生氢剂,其与水反应的化学方程式为__________
_______________。
盐
NaH+H2O
===NaOH+H2↑
NaH与水反应生成氢氧化钠和氢气,反应的化学方程式为NaH+H2O
===NaOH+H2↑。
应用体验
3.(2023·陕西汉中高一期末)在如图所示的物质转化关系中,已知B为碱性氧化物,D为淡黄色固体粉末,F为医疗上治疗胃酸过多的一种药剂。请回答下列问题:
(1)请写出下列物质的化学式:A_____;E__________。
Na
Na2CO3
D为淡黄色固体粉末,则D为Na2O2,A为Na;B为碱性氧化物,则B为Na2O;根据图示可知,C为NaOH, E为Na2CO3;F为医疗上治疗胃酸过多的一种药剂,且F在加热的条件下能转化为E,则F为NaHCO3。
应用体验
(2)请写出下列反应的化学方程式:
A→C:__________________________。
D→E:_____________________________。
F→E:___________________________________。
2Na+2H2O===2NaOH+H2↑
2Na2O2+2CO2===2Na2CO3+O2
返回
A→C是钠与水反应生成氢氧化钠和氢气的过程,其反应的化学方程式为2Na+2H2O===2NaOH+H2↑;D→E是过氧化钠和二氧化碳反应生成碳酸钠和氧气的过程,其反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2;F→E是碳酸氢钠加热分解生成碳酸钠、水和二氧化碳的过程,其反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O。
纯碱的生产历史与侯氏制碱法
二
1.路布兰制碱法(1791年)
原料:NaCl、H2SO4、C、CaCO3
反应:
缺点:硫酸为原料,价格昂贵,设备腐蚀严重,且产品不纯。
2.索尔维法(氨碱法,1861年)
原料:NaCl、NH3、CaCO3。
流程:
反应:
①NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
优点:此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
3.侯氏制碱法(联合制碱法)
原料:NaCl、NH3、CO2。
流程:
反应:
①NH3+H2O+CO2===NH4HCO3
NH4HCO3+NaCl===NH4Cl+NaHCO3↓
优点:NaCl利用率提高到96%以上。
(1)侯氏制碱法中,向饱和食盐水中是先通NH3还是先通CO2?为什么?
思考
(2)低温下,向母液中通入NH3并加入NaCl细粒,为什么可促使NH4Cl析出?
提示 低温下,NH4Cl的溶解度比NaCl的小,通入NH3并加入NaCl细粒,可生成更多的NH4Cl,促使该物质析出,也提高了NaCl的利用率。
应用体验
1.(2022·北京高一期末)“侯氏制碱法”的主要过程如图(部分物质已略去)。
下列说法错误的是
A.气体X为CO2
B.操作b为过滤
C.悬浊液a中的不溶物主要是NH4Cl
D.氨盐水中通入气体X后,溶液中Na+大量减少
√
侯氏制碱法是向饱和食盐水中先通入NH3,再通入CO2,发生的反应为NaCl+H2O+NH3+CO2===NaHCO3↓+NH4Cl,得到悬浊液a,过滤得到滤渣主要成分为NaHCO3,滤液的主要成分是NH4Cl,对滤渣进行高温煅烧得到Na2CO3、H2O和CO2。
应用体验
2.(2022·广州高一期中)1942年,我国化工专家侯德榜以NaCl、NH3(氨气)、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
某同学模拟工艺流程制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。
请回答:
(1)写出甲装置中发生反应的离子方程式:
________________________________。
CaCO3+2H+===Ca2++H2O+CO2↑
甲装置中为碳酸钙和盐酸反应制取CO2,发生反应的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
应用体验
(2)乙装置中的试剂是_________________。
饱和NaHCO3溶液
乙装置中的试剂是饱和NaHCO3溶液,以除去CO2中的HCl。
应用体验
(3)实验结束后,分离出NaHCO3晶体的操作是_____(填分离操作的名称)。
过滤
碳酸氢钠的溶解度相对较小,易结晶析出,实验结束后,NaHCO3结晶析出,则分离此固体与液体的操作是过滤。
应用体验
(4)装置丙中析出NaHCO3的原因是___
(填字母)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以
在溶液中首先结晶析出
c
碳酸氢钠易溶于水,a不符合题意;
碳酸氢钠固态时受热易分解,对制碱反应不产生影响,b不符合题意;
碳酸氢钠的溶解度相对较小,易结晶析出,c符合题意。
应用体验
(5)请写出从NaHCO3晶体获得纯碱的化学方程式:______________________
______________。
+CO2↑+H2O
应用体验
(6)检验产品碳酸钠中含有氯化钠,请你把以下实验方案补充完整:
操作:取少量试样溶于水中,再滴加_______________________。现象:_____________。
检验产品碳酸钠中含有氯化钠即检验产品含氯离子。
硝酸酸化的硝酸银溶液
产生白色沉淀
第二章 第一节
第5课时 钠及其化合物的转化
关系与侯氏制碱法
1.通过构建钠及其化合物的转化关系,解决关于钠及其化合物的框图与推断
问题(重点)。
2.了解纯碱的生产历史和侯氏制碱法(难点)。
学习目标
钠及其化合物的转化关系及推断
一
钠及其化合物转化关系
重要方程式必练(写出相应的化学方程式)
(1)新切开的金属钠变暗:4Na+O2===2Na2O。
(2)在坩埚中加热金属钠: 。
(3)金属钠着火不能用水灭火的原因:2Na+2H2O===2NaOH+H2↑。
(4)Na2O2可作为呼吸面具的氧气来源:2Na2O2+2CO2===2Na2CO3+O2;2Na2O2+2H2O===4NaOH+O2↑。
(5)少量的CO2通入NaOH溶液中(并改写成离子方程式):CO2+2NaOH===Na2CO3+H2O; 。
(6)足量的CO2通入NaOH溶液中(并改写成离子方程式):
CO2+NaOH===NaHCO3; 。
(7)证明小苏打热稳定性差的反应: 。
(8)除去NaHCO3溶液中的Na2CO3的方法(并改写成离子方程式):
Na2CO3+CO2+H2O===2NaHCO3; 。
应用体验
1.(2023·厦门模拟)以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
√
反应③的化学方程式为2NaOH+CO2===Na2CO3+H2O,NaOH为碱,Na2CO3为盐,因此CO2具有酸性氧化物的性质,故A正确;
反应⑤⑥分别是2Na2O2+2H2O===4NaOH+O2↑、2Na2O2+2CO2===
2Na2CO3+O2,因此反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给,故C正确;
反应④为分解反应,反应①为化合反应,反应②为置换反应,故D正确。
应用体验
2.元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,图为钠的价类二维图:
请回答以下问题:
(1)写出①表示的某种淡黄色固体能做供氧剂的原因:_________________
_____________________________________________(用化学方程式表示,写一个即可)。
2Na2O2+2CO2===
2Na2CO3+O2(或2Na2O2+2H2O===4NaOH+O2↑)
根据元素的价类二维图,①是钠的氧化物,钠的氧化物中显淡黄色的是Na2O2,过氧化钠能与CO2、H2O反应,化学方程式为2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑。
应用体验
(2)图中缺失的物质类别是____。
(3)NaH在野外可用作生氢剂,其与水反应的化学方程式为__________
_______________。
盐
NaH+H2O
===NaOH+H2↑
NaH与水反应生成氢氧化钠和氢气,反应的化学方程式为NaH+H2O
===NaOH+H2↑。
应用体验
3.(2023·陕西汉中高一期末)在如图所示的物质转化关系中,已知B为碱性氧化物,D为淡黄色固体粉末,F为医疗上治疗胃酸过多的一种药剂。请回答下列问题:
(1)请写出下列物质的化学式:A_____;E__________。
Na
Na2CO3
D为淡黄色固体粉末,则D为Na2O2,A为Na;B为碱性氧化物,则B为Na2O;根据图示可知,C为NaOH, E为Na2CO3;F为医疗上治疗胃酸过多的一种药剂,且F在加热的条件下能转化为E,则F为NaHCO3。
应用体验
(2)请写出下列反应的化学方程式:
A→C:__________________________。
D→E:_____________________________。
F→E:___________________________________。
2Na+2H2O===2NaOH+H2↑
2Na2O2+2CO2===2Na2CO3+O2
返回
A→C是钠与水反应生成氢氧化钠和氢气的过程,其反应的化学方程式为2Na+2H2O===2NaOH+H2↑;D→E是过氧化钠和二氧化碳反应生成碳酸钠和氧气的过程,其反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2;F→E是碳酸氢钠加热分解生成碳酸钠、水和二氧化碳的过程,其反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O。
纯碱的生产历史与侯氏制碱法
二
1.路布兰制碱法(1791年)
原料:NaCl、H2SO4、C、CaCO3
反应:
缺点:硫酸为原料,价格昂贵,设备腐蚀严重,且产品不纯。
2.索尔维法(氨碱法,1861年)
原料:NaCl、NH3、CaCO3。
流程:
反应:
①NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl
优点:此法食盐利用率比路布兰制碱法高,产品较纯净,成本低。
缺点:原料中一半成分未能转化为产品。
3.侯氏制碱法(联合制碱法)
原料:NaCl、NH3、CO2。
流程:
反应:
①NH3+H2O+CO2===NH4HCO3
NH4HCO3+NaCl===NH4Cl+NaHCO3↓
优点:NaCl利用率提高到96%以上。
(1)侯氏制碱法中,向饱和食盐水中是先通NH3还是先通CO2?为什么?
思考
(2)低温下,向母液中通入NH3并加入NaCl细粒,为什么可促使NH4Cl析出?
提示 低温下,NH4Cl的溶解度比NaCl的小,通入NH3并加入NaCl细粒,可生成更多的NH4Cl,促使该物质析出,也提高了NaCl的利用率。
应用体验
1.(2022·北京高一期末)“侯氏制碱法”的主要过程如图(部分物质已略去)。
下列说法错误的是
A.气体X为CO2
B.操作b为过滤
C.悬浊液a中的不溶物主要是NH4Cl
D.氨盐水中通入气体X后,溶液中Na+大量减少
√
侯氏制碱法是向饱和食盐水中先通入NH3,再通入CO2,发生的反应为NaCl+H2O+NH3+CO2===NaHCO3↓+NH4Cl,得到悬浊液a,过滤得到滤渣主要成分为NaHCO3,滤液的主要成分是NH4Cl,对滤渣进行高温煅烧得到Na2CO3、H2O和CO2。
应用体验
2.(2022·广州高一期中)1942年,我国化工专家侯德榜以NaCl、NH3(氨气)、CO2等为原料先制得NaHCO3,进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。
某同学模拟工艺流程制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。
已知:NH3极易溶于水,溶液呈碱性。
请回答:
(1)写出甲装置中发生反应的离子方程式:
________________________________。
CaCO3+2H+===Ca2++H2O+CO2↑
甲装置中为碳酸钙和盐酸反应制取CO2,发生反应的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
应用体验
(2)乙装置中的试剂是_________________。
饱和NaHCO3溶液
乙装置中的试剂是饱和NaHCO3溶液,以除去CO2中的HCl。
应用体验
(3)实验结束后,分离出NaHCO3晶体的操作是_____(填分离操作的名称)。
过滤
碳酸氢钠的溶解度相对较小,易结晶析出,实验结束后,NaHCO3结晶析出,则分离此固体与液体的操作是过滤。
应用体验
(4)装置丙中析出NaHCO3的原因是___
(填字母)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以
在溶液中首先结晶析出
c
碳酸氢钠易溶于水,a不符合题意;
碳酸氢钠固态时受热易分解,对制碱反应不产生影响,b不符合题意;
碳酸氢钠的溶解度相对较小,易结晶析出,c符合题意。
应用体验
(5)请写出从NaHCO3晶体获得纯碱的化学方程式:______________________
______________。
+CO2↑+H2O
应用体验
(6)检验产品碳酸钠中含有氯化钠,请你把以下实验方案补充完整:
操作:取少量试样溶于水中,再滴加_______________________。现象:_____________。
检验产品碳酸钠中含有氯化钠即检验产品含氯离子。
硝酸酸化的硝酸银溶液
产生白色沉淀
