高一化学人教版必修一(2019) 第二章海水中的重要元素——钠和氯 章末复习(共22张PPT)
文档属性
| 名称 | 高一化学人教版必修一(2019) 第二章海水中的重要元素——钠和氯 章末复习(共22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 12:09:04 | ||
图片预览



文档简介
(共22张PPT)
第二章 海水中的重要元素——钠和氯
章末复习
1.以钠、氯及其化合物知识的学习为线索,逐步形成金属、非金属及其化合物
的研究思路(重点)。
2.能基于物质的量认识物质组成及其化学变化;从定量的角度认识宏观物质和
微观粒子的相互关系(难点)。
3.学会配制一定物质的量浓度溶液的方法和技能,发展定量研究的意识(重点)。
学习目标
物质的性质与转化
一
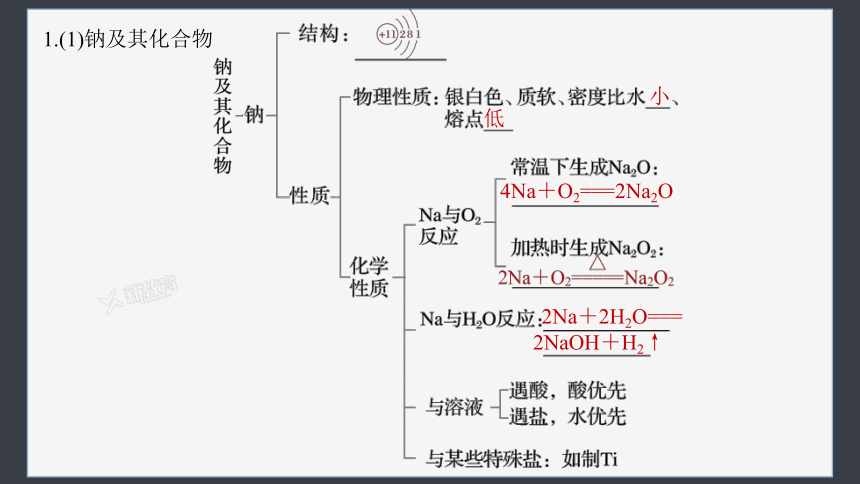
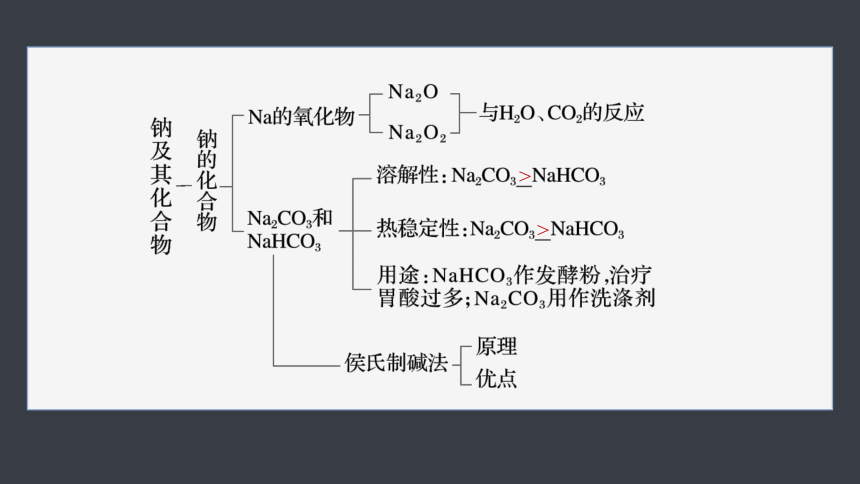
1.(1)钠及其化合物
小
低
4Na+O2===2Na2O
2Na+2H2O===
2NaOH+H2↑
>
>
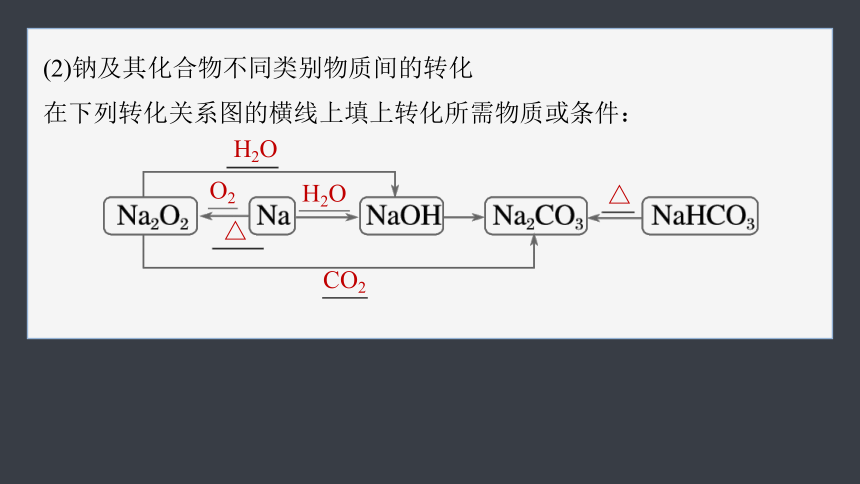
(2)钠及其化合物不同类别物质间的转化
在下列转化关系图的横线上填上转化所需物质或条件:
H2O
O2
H2O
△
△
CO2
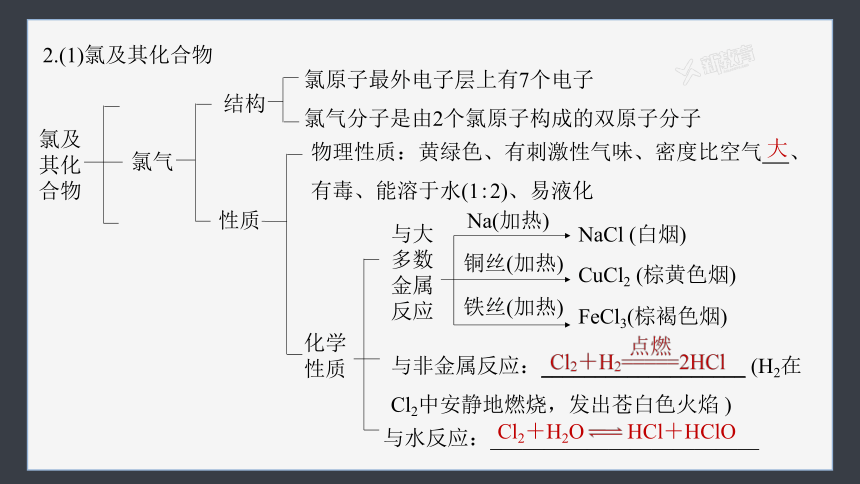
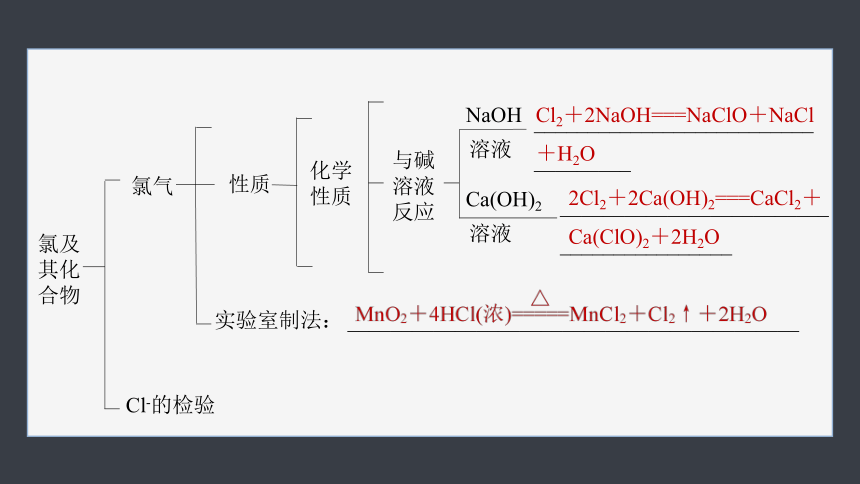
2.(1)氯及其化合物
氯及其化合物
氯气
结构
氯原子最外电子层上有7个电子
氯气分子是由2个氯原子构成的双原子分子
物理性质:黄绿色、有刺激性气味、密度比空气 、有毒、能溶于水(1:2)、易液化
性质
化学
性质
与大
多数
金属
反应
Na(加热)
铜丝(加热)
铁丝(加热)
NaCl (白烟)
CuCl2 (棕黄色烟)
FeCl3(棕褐色烟)
与非金属反应:___________________ (H2在Cl2中安静地燃烧,发出苍白色火焰 )
与水反应:_________________________
大
Cl2+H2O HCl+HClO
氯气
性质
化学
性质
NaOH
溶液
与碱溶液反应
___________________________________
Ca(OH)2
溶液
_________________________
________________
实验室制法:
__________________________________________
Cl-的检验
Cl2+2NaOH===NaClO+NaCl+H2O
2Cl2+2Ca(OH)2===CaCl2+
Ca(ClO)2+2H2O
氯及其化合物
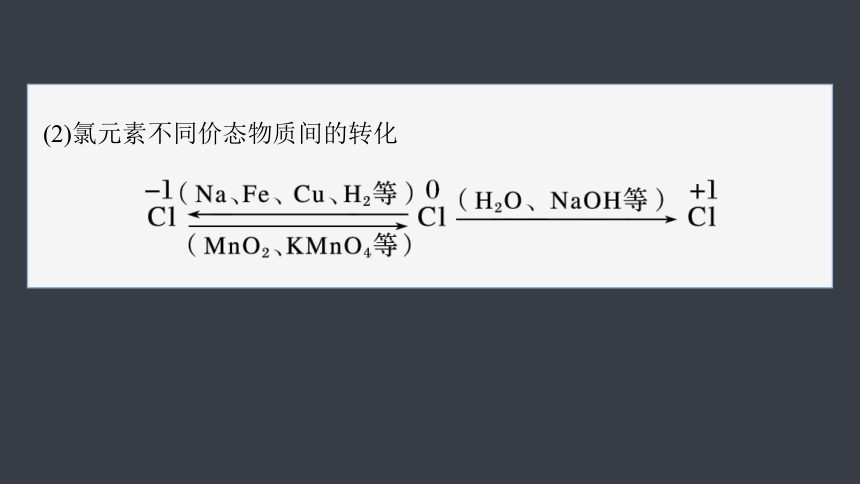
(2)氯元素不同价态物质间的转化
应用体验
1.下列有关钠及其化合物的说法正确的是
A.一小块钠置于空气中足够长的时间,最终会变成Na2O2
B.在饱和Na2CO3溶液中通入足量CO2有沉淀析出
C.用洁净的铂丝蘸取某溶液放置于酒精灯火焰上灼烧,焰色为黄色,该
溶液为钠盐溶液
D.7.8 g Na2O2和6.2 g Na2O分别溶于100 g水中,得到溶质的质量分数前
者更大
√
2.A、B、C、D、F五种物质的焰色试验均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体,C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、C、F的化学式:
A__________;C__________;F________。
(2)写出F和H反应的化学方程式:______________________________。
NaOH
Na2CO3
Na2O2
2Na2O2+2CO2===2Na2CO3+O2
应用体验
(3)写出下列反应的离子方程式:
①D+盐酸:__________________________;
②B+水:________________________________。
2Na+2H2O===2Na++2OH-+H2↑
由焰色试验为黄色,且A、B、C、D均与盐酸反应生成E,知E为NaCl,B还生成一种可燃性气体,知B为Na,C、D还生成使澄清石灰水变浑浊的无色无味的气体H,知C、D为Na2CO3或NaHCO3中的一种,F和H(CO2)反应生成C和另一种气体,则F为Na2O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成Na2CO3,则A为NaOH。
应用体验
应用体验
3.氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C.先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
√
4.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为棕黄色,E溶液为无色,请回答:
(1)A是____,B是_____,C是____(填化学式)。
(2)反应①的化学方程式为_____________________。
(3)反应③的化学方程式为_______________________。
(4)反应④的化学方程式为_____________________。
Fe
Cl2
H2
Fe+2HCl===FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
应用体验
物质的量
二
应用体验
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下NA个Cl2分子所占有的体积为22.4 L
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.23 g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在
0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28 g,转移电子数2NA
√
2. Ⅰ.如图所示为常见仪器的部分结构。
(1)写出下列仪器的名称:A______,B_________,C_________。
量筒
容量瓶
温度计
应用体验
(2)仪器B上标有________(填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
②③⑤
应用体验
Ⅱ.现用质量分数为98%的浓硫酸(密度为1.84 g·cm-3)来配制220 mL 0.2 mol·L-1的稀硫酸。
有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是______mL。
2.7
应用体验
(4)第③步中稀释浓硫酸的操作是_______________________________
________________________。
将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
应用体验
(5)将所配制的稀硫酸进行测定,发现实际浓度大于0.2 mol·L-1。下列操作会引起所配溶液浓度偏大的是_________(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液向容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
ACE
应用体验
第二章 海水中的重要元素——钠和氯
章末复习
1.以钠、氯及其化合物知识的学习为线索,逐步形成金属、非金属及其化合物
的研究思路(重点)。
2.能基于物质的量认识物质组成及其化学变化;从定量的角度认识宏观物质和
微观粒子的相互关系(难点)。
3.学会配制一定物质的量浓度溶液的方法和技能,发展定量研究的意识(重点)。
学习目标
物质的性质与转化
一
1.(1)钠及其化合物
小
低
4Na+O2===2Na2O
2Na+2H2O===
2NaOH+H2↑
>
>
(2)钠及其化合物不同类别物质间的转化
在下列转化关系图的横线上填上转化所需物质或条件:
H2O
O2
H2O
△
△
CO2
2.(1)氯及其化合物
氯及其化合物
氯气
结构
氯原子最外电子层上有7个电子
氯气分子是由2个氯原子构成的双原子分子
物理性质:黄绿色、有刺激性气味、密度比空气 、有毒、能溶于水(1:2)、易液化
性质
化学
性质
与大
多数
金属
反应
Na(加热)
铜丝(加热)
铁丝(加热)
NaCl (白烟)
CuCl2 (棕黄色烟)
FeCl3(棕褐色烟)
与非金属反应:___________________ (H2在Cl2中安静地燃烧,发出苍白色火焰 )
与水反应:_________________________
大
Cl2+H2O HCl+HClO
氯气
性质
化学
性质
NaOH
溶液
与碱溶液反应
___________________________________
Ca(OH)2
溶液
_________________________
________________
实验室制法:
__________________________________________
Cl-的检验
Cl2+2NaOH===NaClO+NaCl+H2O
2Cl2+2Ca(OH)2===CaCl2+
Ca(ClO)2+2H2O
氯及其化合物
(2)氯元素不同价态物质间的转化
应用体验
1.下列有关钠及其化合物的说法正确的是
A.一小块钠置于空气中足够长的时间,最终会变成Na2O2
B.在饱和Na2CO3溶液中通入足量CO2有沉淀析出
C.用洁净的铂丝蘸取某溶液放置于酒精灯火焰上灼烧,焰色为黄色,该
溶液为钠盐溶液
D.7.8 g Na2O2和6.2 g Na2O分别溶于100 g水中,得到溶质的质量分数前
者更大
√
2.A、B、C、D、F五种物质的焰色试验均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体,C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、C、F的化学式:
A__________;C__________;F________。
(2)写出F和H反应的化学方程式:______________________________。
NaOH
Na2CO3
Na2O2
2Na2O2+2CO2===2Na2CO3+O2
应用体验
(3)写出下列反应的离子方程式:
①D+盐酸:__________________________;
②B+水:________________________________。
2Na+2H2O===2Na++2OH-+H2↑
由焰色试验为黄色,且A、B、C、D均与盐酸反应生成E,知E为NaCl,B还生成一种可燃性气体,知B为Na,C、D还生成使澄清石灰水变浑浊的无色无味的气体H,知C、D为Na2CO3或NaHCO3中的一种,F和H(CO2)反应生成C和另一种气体,则F为Na2O2、C为Na2CO3,因而D为NaHCO3,D和A反应可生成Na2CO3,则A为NaOH。
应用体验
应用体验
3.氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是
A.加入有色布条,一会儿有色布条褪色,说明有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C.先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
√
4.室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可按下面框图进行反应。又知D溶液为棕黄色,E溶液为无色,请回答:
(1)A是____,B是_____,C是____(填化学式)。
(2)反应①的化学方程式为_____________________。
(3)反应③的化学方程式为_______________________。
(4)反应④的化学方程式为_____________________。
Fe
Cl2
H2
Fe+2HCl===FeCl2+H2↑
2FeCl2+Cl2===2FeCl3
应用体验
物质的量
二
应用体验
1.设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温下NA个Cl2分子所占有的体积为22.4 L
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.23 g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在
0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28 g,转移电子数2NA
√
2. Ⅰ.如图所示为常见仪器的部分结构。
(1)写出下列仪器的名称:A______,B_________,C_________。
量筒
容量瓶
温度计
应用体验
(2)仪器B上标有________(填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
②③⑤
应用体验
Ⅱ.现用质量分数为98%的浓硫酸(密度为1.84 g·cm-3)来配制220 mL 0.2 mol·L-1的稀硫酸。
有关操作:①计算所需浓硫酸的体积;②量取一定体积的浓硫酸;③稀释、冷却;④转移、洗涤;⑤定容;⑥摇匀。
(3)用量筒量取的浓硫酸的体积是______mL。
2.7
应用体验
(4)第③步中稀释浓硫酸的操作是_______________________________
________________________。
将浓硫酸沿烧杯内壁慢慢加入水中,边加边用玻璃棒搅拌
应用体验
(5)将所配制的稀硫酸进行测定,发现实际浓度大于0.2 mol·L-1。下列操作会引起所配溶液浓度偏大的是_________(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.烧杯中稀溶液向容量瓶中转移时,有少量液体溅出
E.定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
ACE
应用体验
