专题2第二单元溶液组成的定量研究同步练习(含解析)2023——2024学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题2第二单元溶液组成的定量研究同步练习(含解析)2023——2024学年高一化学苏教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 511.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 13:13:46 | ||
图片预览




文档简介
专题2第二单元溶液组成的定量研究同步练习
姓名 班级
一、选择题
1.硫酸铝溶液中含有,则溶液中的物质的量浓度为
A. B. C. D.
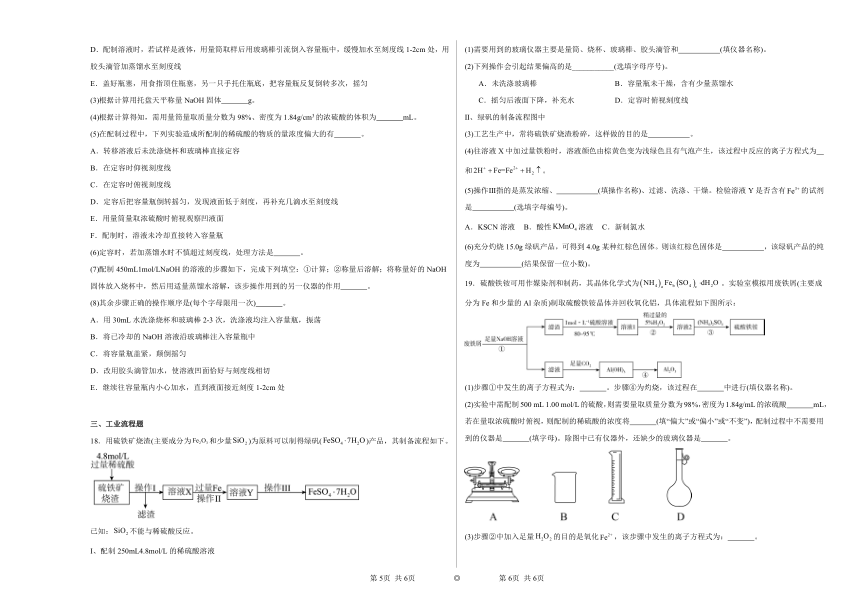
2.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①~③。下列说法正确的是
A.固体W的溶解度曲线是图乙中的b
B.①~③溶液中,只有②是饱和溶液
C.若将②升温至t2℃,固体不能全部溶解
D.①~③溶液中,溶质质量分数的大小关系是③>②>①
3.10%的硝酸钾溶液20g,为使它的质量分数增大一倍,可采用的方法是
A.再加入2g硝酸钾 B.蒸发水分浓缩为10g的溶液
C.蒸发掉水分的一半 D.加入20g25%硝酸钾溶液
4.实验是学习化学、体验化学和探究化学过程的重要途径。下列实验操作符合规范的是
A B C D
试剂的存放 溶液的转移 气体的收集 浓硫酸的稀释
A.A B.B C.C D.D
5.下列有关实验原理或操作正确的是
A.用量筒量取酒精,加水,配制质量分数为的酒精溶液
B.在某硫酸盐溶液中,含有个硫酸根离子和个金属离子,则该硫酸盐的物质的量浓度为
C.实验中需用溶液,配制时称取的的质量为201.4g
D.实验室配制硫酸亚铁溶液,其操作是:用天平称绿矾,放入小烧杯中加水溶解,转移到容量瓶,洗涤、稀释、定容、摇匀
6.汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现用98%(密度1.84g/cm3)的浓硫酸配制该稀硫酸。下列说法中正确的是
A.28%的稀硫酸中溶质与溶剂的质量比为28:100
B.若配制3.5kg28%的稀硫酸,用托盘天平称量10kg98%的浓硫酸即可
C.配制该稀硫酸时,把水沿容器内壁缓慢注入浓硫酸中
D.若用该浓硫酸与水体积比1:1混合后得到的溶液溶质的质量分数大于49%
7.VmLAl2SO43溶液中含有Al3mg,取mL该溶液用水稀释至VmL,则稀释后SO物质的量浓度为
A.mol/L B.mol/L C.mol/L D.mol/L
8.Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL4.5mol·L-1的NaOH溶液,则该H2SO4的物质的量浓度为
A.2.25mol·L-1 B.2.00mol·L-1 C.3.00mol·L-1 D.0.60mol·L-1
9.易水解,实验室利用固体配制溶液。下列说法正确的是
A.配制溶液时容量瓶需要干燥
B.配制溶液过程中,玻璃棒只起到引流的作用
C.需用托盘天平称量固体
D.溶解固体时需要用浓盐酸代替蒸馏水
10.下列溶液与溶液中物质的量浓度相等的是
A.溶液 B.溶液
C.溶液 D.溶液
11.V mL Al2(SO4)3溶液中含有Al3+a g,取V mL溶液稀释到4V mL,则稀释后溶液中SO的物质的量浓度是
A. mol/L B. mol/L
C. mol/L D. mol/L
12.现需用到80mL 1.0mol·L-1 NaOH溶液,现以NaOH固体配制该溶液,下列说法正确的是
A.使用的玻璃仪器主要有烧杯、玻璃棒、100mL容量瓶、胶头滴管
B.需用托盘天平称取3.2g NaOH固体
C.在溶解固体和转移溶液时均用到玻璃棒,且玻璃棒作用相同
D.定容并摇匀后,发现凹液面低于刻度线,需补充滴加蒸馏水至刻度线为止
13.实验室配制50g溶质质量分数为10%的氯化钠溶液,下列说法正确的是
A.计算得出所需氯化钠固体的质量为5g
B.将氯化钠固体直接放在托盘天平的右盘进行称量
C.溶解氯化钠时用玻璃棒搅拌,其目的是增大氯化钠的溶解度
D.将配制好的溶液装瓶时,有少量液体洒出,会造成溶液的溶质质量分数偏小
14.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取浓盐酸
C.用托盘天平称取药品时药品和砝码位置颠倒,药品质量一定偏小
D.定容时,为防止液滴飞溅,胶头滴管应紧贴容量瓶内壁
15.设NA代表阿伏加德罗常数,下列说法正确的是
A.0oC、101kPa下,11.2LN2和O2的混合气体中所含原子数为NA
B.18gH2O在标况下的体积为22.4L
C.物质的量浓度为2mol/L的Ba(NO3)2溶液中,含有NO个数为4NA
D.标况下,22.4L氨气溶于1L水制得氨水,氨气的物质的量浓度为1mol·L-1
二、实验题
16.某同学配制50g15%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号,后同),其中操作错误的是 。
(2)该实验中所需食盐的质量是 g。
(3)溶解过程中玻璃棒的作用是 。
(4)对配置的溶液进行检测,发现溶质质量分数偏小,其原因可能是___________(选填字母)。
A.氯化钠固体不纯
B.转移配制好的溶液时,有少量液体洒出
C.量取水的体积时,俯视读数
D.称量时,药品与砝码放反了
(5)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
(6)用氯化钠和碳酸氢铵(NH4HCO3)可制备碳酸氢钠和氯化铵(NH4Cl),该反应可表示为:NaCl+NH4HCO3=NaHCO3+NH4Cl。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8gNH4HCO3。理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质 NaCl NH4HCO3 NH4Cl NaHCO3
溶液度/g 36.0 21.6 37.2 9.6
17.实验室需要1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,除图中已有仪器外,配制上述溶液还需要的玻璃仪器是玻璃棒, 和 。
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,需干燥后再配制溶液
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)根据计算用托盘天平称量NaOH固体 g。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL。
(5)在配制过程中,下列实验造成所配制的稀硫酸的物质的量浓度偏大的有 。
A.转移溶液后未洗涤烧杯和玻璃棒直接定容
B.在定容时仰视刻度线
C.在定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线
E.用量筒量取浓硫酸时俯视观察凹液面
F.配制时,溶液未冷却直接转入容量瓶
(6)定容时,若加蒸馏水时不慎超过刻度线,处理方法是 。
(7)配制450mL1mol/LNaOH的溶液的步骤如下,完成下列填空:①计算;②称量后溶解;将称量好的NaOH固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用 。
(8)其余步骤正确的操作顺序是(每个字母限用一次) 。
A.用30mL水洗涤烧杯和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
C.将容量瓶盖紧,颠倒摇匀
D.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
E.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
三、工业流程题
18.用硫铁矿烧渣(主要成分为和少量)为原料可以制得绿矾()产品,其制备流程如下。
已知:不能与稀硫酸反应。
Ⅰ、配制250mL4.8mol/L的稀硫酸溶液
(1)需要用到的玻璃仪器主要是量筒、烧杯、玻璃棒、胶头滴管和 (填仪器名称)。
(2)下列操作会引起结果偏高的是___________(选填字母序号)。
A.未洗涤玻璃棒 B.容量瓶未干燥,含有少量蒸馏水
C.摇匀后液面下降,补充水 D.定容时俯视刻度线
Ⅱ、绿矾的制备流程图中
(3)工艺生产中,常将硫铁矿烧渣粉碎,这样做的目的是 。
(4)往溶液X中加过量铁粉时,溶液颜色由棕黄色变为浅绿色且有气泡产生,该过程中反应的离子方程式为 和。
(5)操作Ⅲ指的是蒸发浓缩、 (填操作名称)、过滤、洗涤、干燥。检验溶液Y是否含有的试剂是 (选填字母编号)。
A.KSCN溶液 B.酸性溶液 C.新制氯水
(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是 ,该绿矾产品的纯度为 (结果保留一位小数)。
19.硫酸铁铵可用作媒染剂和制药,其晶体化学式为。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
(1)步骤①中发生的离子方程式为: 。步骤④为灼烧,该过程在 中进行(填仪器名称)。
(2)实验中需配制500 mL 1.00 mol/L的硫酸,则需要量取质量分数为98%,密度为1.84g/mL的浓硫酸 mL,若在量取浓硫酸时俯视,则配制的稀硫酸的浓度将 (填“偏大”或“偏小”或“不变”),配制过程中不需要用到的仪器是 (填字母)。除图中已有仪器外,还缺少的玻璃仪器是 。
(3)步骤②中加入足量的目的是氧化,该步骤中发生的离子方程式为: 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】Al3+的物质的量为,由硫酸铝的化学式Al2(SO4)3,则的物质的量浓度为,故选:A。
2.C
【分析】t3℃,150g-50g=100g水溶解W质量为50g,结合图像可知,W的溶解度曲线为a,且③为t3℃时a溶液的恰好饱和溶液;
【详解】A.由分析可知,固体W的溶解度曲线是图乙中的a,A错误;
B.由图可知,t1℃时a的溶解度为20g,则150g水此时恰好溶解30g的a,故①为恰好饱和溶液,且③也为t3℃的a溶液的恰好饱和溶液,B错误;
C.t2℃,a的溶解度为30g,150g水最多溶解45g的a,故若将②升温至t2℃,固体不能全部溶解,C正确;
D.结合B分析可知,①②均为t1℃时a的饱和溶液,故①~③溶液中,溶质质量分数的大小关系是③>②=①,D错误;
故选C。
3.B
【分析】20g10%的硝酸钾溶液含溶质的质量为20g×10%=2g,含溶剂20g 2g=18g;
【详解】A.设需要再溶解该物质的质量为a,(20g+a)×20%=2g+a,a=2.5g,A错误;
B.设需要蒸发水的质量为a,(20g a)×20%=2g,a=10g,蒸发水分浓缩为20g-10g=10g的溶液,故B正确;
C.由B分析可知,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,C错误;
D.加入20g25%的硝酸钾溶液,所得溶液中溶质质量分数为,D错误;
故选B。
4.C
【详解】A.乙醇易燃烧,盐酸、NaOH不易燃烧,试剂不能放在一起,故A错误;
B.转移需要玻璃棒引流,图中缺少玻璃棒,故B错误;
C.二氧化碳的密度大于空气的密度,则长导管进气可收集,故C正确;
D.混合时将密度大的液体注入密度小的液体中,且浓硫酸稀释放热,应将浓硫酸注入水中,故D错误;
故选:C。
5.B
【详解】A.不能在量筒中配溶液,酒精的密度比水的密度小,15mL酒精和5mL水配制的酒精溶液的质量分数小于75%,A项错误;
B.在200mL某硫酸盐溶液中含有1.5NA个硫酸根离子和NA个金属离子,根据电荷守恒,该硫酸盐的化学式为M2(SO4)3(M为金属),该溶液中含M2(SO4)3物质的量为0.5mol,该硫酸盐的物质的量浓度为=2.5mol/L,B项正确;
C.根据“大而近”的原则,配制950mL2mol/LNa2CO3溶液选用1000mL容量瓶,配制时需称取Na2CO3的质量为2mol/L×1L×106g/mol=212g,C项错误;
D.实验室配制500mL0.2mol/L硫酸亚铁溶液,需称取绿矾的质量为0.2mol/L×0.5L×278g/mol=27.8g,D项错误;
答案选B。
6.D
【详解】A.28%的稀硫酸中硫酸的质量分数为28%,即100g溶液中有硫酸28g,水72g,溶质与溶剂的质量比为28:72,A错误;
B.配制3.5kg28%的稀硫酸,需要硫酸0.98kg,则需要98%的浓硫酸1kg,B错误;
C.配制稀硫酸时,将浓硫酸沿容器内壁缓慢注入水中,C错误;
D.该浓硫酸与水体积比1:1混合,浓硫酸密度大于水,因此浓硫酸的质量大于水,两者混合所得溶液溶质的质量分数大于49%,D正确;
故答案选D。
7.B
【详解】VmLAl2(SO4)3溶液中含有Al3+mg,则SO的物质的量为mol,取mL该溶液稀释至VmL,则SO的物质的量为mol,则其物质的量浓度为mol÷(V×10-3)L= mol/L,故B正确。
故选:B。
8.C
【详解】Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,为了中和过量的硫酸,而且使FeSO4完全转化成Fe(OH)2,说明反应后的溶液溶质只有Na2SO4,根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=n(NaOH),则有:n(H2SO4)=n(Na2SO4)=n(NaOH)=×4.5mol/L×0.2L=0.45mol,故该硫酸的物质的量浓度为:c(H2SO4)==3.00mol/L,故选:C。
9.D
【详解】A.配制溶液时,实验室没有490mL规格的容量瓶,为了使操作规范、减小误差,应该使用容量瓶,但无需干燥,A错误;
B.配制溶液过程中,按照实验操作的顺序,玻璃棒分别起了搅拌和引流的作用,B错误;
C.用托盘天平称量固体质量时,需称量固体,C错误;
D.容易水解生成沉淀,所以溶解时需要把固体溶解在浓盐酸中,D正确;
故选:D。
10.C
【分析】20 mL 2 mol/LNaNO3溶液中物质的量浓度c=2 mol/L×1=2 mol/L。
【详解】A.10 mL 2 mol/L Mg(NO3)2溶液中物质的量浓度c=2 mol/L×2=4 mol/L,选项A不符合题意;
B.5 mL 0.4 mol/L Al(NO3)3溶液中物质的量浓度c=0.4 mol/L×3=1.2 mol/L,选项B不符合题意;
C.10 mL2 mol/L AgNO3溶液中物质的量浓度c=2 mol/L×1=2 mol/L,选项C符合题意;
D.10 mL 0.5 mol/L Cu(NO3)2溶液中物质的量浓度c=0.5 mol/L×1=1 mol/L,选项D不符合题意;
故选C。
11.C
【详解】V mL Al2(SO4)3溶液中含有Al3+a g,Al3+物质的量为:=mol;取V mL溶液稀释到4V mL,则稀释后Al3+的物质的量为mol×=mol;则稀释后SO的物质的量为 mol×=mol;则稀释后溶液中SO的物质的量浓度是=mol/L,故选C。
12.A
【详解】A.配制80mL 1.0mol·L-1 NaOH溶液,应选用100mL容量瓶,即使用的玻璃仪器主要有烧杯、玻璃棒、100mL容量瓶、胶头滴管,故A正确;
B.需要的NaOH物质的量为n=0.1L×1.0mol·L-1 =0.1mol,质量为:0.1mol×40g/mol=4g,故B错误;
C.在溶解固体时,用玻璃棒搅拌,在转移溶液时,用玻璃棒引流,作用不同,故C错误;
D.定容并摇匀后,发现凹液面低于刻度线,是因为容量瓶内壁上有液体未流下,无需处理,故D错误;
故选A。
13.A
【详解】A.溶质质量=溶液质量×溶质的质量分数,实验室配制50g溶质质量分数为10%的氯化钠溶液,需氯化钠的质量=50g×10%=5g,A正确;
B.托盘天平的使用要遵循“左物右码”的原则,应将氯化钠固体放在托盘天平的左盘的纸片上进行称量,B错误;
C.溶解氯化钠时用玻璃棒搅拌,其目的是加快溶解速率,不能增大氯化钠的溶解度,C错误;
D.将配制好的溶液装瓶时,有少量液体洒出,溶液具有均一性,溶质质量分数不变,D错误;
故选A。
14.A
【详解】A.容量瓶上标有温度、容积和唯一刻度线,表示在所指温度下,液体的凹液面与容量瓶颈部的刻度线相切时,液体体积恰好与容量瓶上标注的容积相等,配制一定物质的量浓度的溶液过程中需要加蒸馏水,故容量瓶用蒸馏水洗净后,不要干燥直接用于配制溶液,A项正确;
B.量筒精确度达不到0.01mL,配制一定物质的量浓度的稀盐酸时,用量筒量取9.8mL浓盐酸,不能量取9.82mL,B项错误;
C.用托盘天平称取药品时药品和砝码位置颠倒,若不使用游码时,则药品质量不变,C项错误;
D.定容时,胶头滴管应垂直悬空于容量瓶口正上方,不能紧贴容量瓶内壁,D项错误;
答案选A。
15.A
【详解】A.0oC、101kPa下为标况,11.2LN2和O2的混合气体中分子为,1分子氮气和1分子氧气均含2个原子,则共所含原子数为NA,A正确;
B.标况下水不是气体,不能使用气体摩尔体积,B错误;
C.溶液体积未知,无法计算硝酸根离子个数,C错误;
D.应该为配成1L溶液,而不是加入1L的水,D错误;
故选A。
16.(1) ②①⑤③④ ①
(2)7.5
(3)加快溶解
(4)AD
(5)100
(6)7.2
【分析】配制配制50g 15%氯化钠溶液步骤为计算、称量、溶解、转移;
【详解】(1)配制配制50g 15%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,配制溶液的正确操作顺序为②①⑤③④,在称量药品是应“左物右码”,图中所示操作砝码与药品位置放反了,所以其中操作错误的是①。
(2)配制50g 15%氯化钠溶液,需氯化钠的质量是:50g×15%=7.5g。
(3)溶解过程中玻璃棒的作用是搅拌,其目的是加快溶解。
(4)A.氯化钠固体不纯,溶质减小,会使配制的溶液溶质质量分数偏小;
B.溶液具有均一性,转移配制好的溶液时,有少量溶液洒出,不会改变溶质的质量分数;
C.量取水的体积时,俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大;
D.称量时,药品与砝码放反了,实际药品质量等于砝码减游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
故选AD;
(5)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,设需要水的质量是a,50g×15%=(50g+a)×5%,解得:a=100g;
(6)向100g水中加入11.7gNaCl(为0.2mol)和15.8gNH4HCO3(为0.2mol),反应生成0.2mol NaHCO3(质量为16.8g)、0.2mol NH4Cl(10.7g),结合图表可知,理论上从溶液中析出晶体为碳酸氢钠晶体,质量为16.8g-9.6g=7.2g。
17.(1) 500mL容量瓶 烧杯
(2)BCD
(3)20.0
(4)13.6
(5)CF
(6)重新配置
(7)搅拌,加速固体溶解
(8)BAEDC
【详解】(1)配制溶液时,除了图中已有的仪器外,还需要的玻璃仪器有500mL容量瓶和烧杯。
(2)A.使用容量瓶之前需检验其是否漏水,A正确;
B.容量瓶用水洗干净后,不需要等到干燥后再配制溶液,B错误;
C.固体的溶解不能在容量瓶中进行,需要在烧杯中溶解再转移到容量瓶中,C错误;
D.若试样是液体,则用量筒量取后先在烧杯中进行稀释,等冷却后转移到容量瓶中,D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀,E正确;
故错误的为BCD。
(3)需要1mol/L的NaOH溶液450mL,则需要配制1mol/L的NaOH溶液500mL,需要的NaOH的物质的量为0.5mol,质量为20.0g。
(4)配制0.5mol/L的硫酸溶液500mL,硫酸的物质的量为0.25mol,质量为24.5g,则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为24.5g÷0.98÷1.84g/cm3=13.6mL。
(5)A.转移溶液后未洗涤烧杯和玻璃棒,造成部分溶质损失,所配制稀硫酸的浓度偏小,A错误;
B.定容时仰视刻度线,溶液的体积偏大,浓度偏低,B错误;
C.定容时俯视刻度线,溶液的体积偏小,浓度偏大,C正确;
D.定容时发现液面低于刻度,再补充几滴水至刻度线,溶液的体积偏大,浓度偏小,D错误;
E.用量筒量取浓硫酸时俯视观察凹液面,导致量取的硫酸的体积偏小,配制的硫酸的浓度偏小,E错误;
F.配制溶液时溶液未冷却就直接转入容量瓶,此时溶液的体积偏大,导致所加水的量偏少,冷却后溶液的体积偏小,浓度偏大,F正确;
故答案选CF。
(6)定容时,加蒸馏水不慎超过刻度线,则需要重新配制。
(7)将称量好的NaOH固体加入烧杯中,用适量蒸馏水溶解,该步骤用到的另一仪器为玻璃棒,作用为搅拌,加速固体溶解。
(8)溶解后将冷却的NaOH溶液沿玻璃棒注入容量瓶中,用水洗涤烧杯和玻璃棒,洗涤液转移到容量瓶中,继续往容量瓶中加入水,至离刻度线1-2cm处,改用胶头滴管加水,使凹液面与刻度线正好相切,最后将容量瓶盖紧,颠倒摇匀,故顺序为BAEDC。
18.(1)250mL容量瓶
(2)D
(3)增大接触面积,使反应更充分(或加快反应速率)
(4)
(5) 冷却结晶(或降温结晶) A
(6) 92.7%
【分析】烧渣与硫酸反应时,Fe2O3转化为Fe2(SO4)3,SiO2不反应,经过过滤(操作I)后,得到的溶液X中主要含有Fe2(SO4)3和过量的H2SO4,滤渣为SiO2,溶液X中加入过量Fe,发生反应Fe2(SO4)3+Fe=3FeSO4、Fe+ H2SO4= FeSO4+H2↑,故溶液Y溶质为FeSO4,操作Ⅱ为过滤,除去过量Fe,溶液Y经过蒸发浓缩、冷却结晶、过滤洗涤干燥得到绿矾晶体。
【详解】(1)配制一定物质的量浓度的溶液需用到相应规格的容量瓶,故此处填250 mL容量瓶;
(2)A.未洗涤烧杯、玻璃棒,则溶质损失,即容量瓶中溶质偏少,所配溶液浓度偏低;
B.由于定容时需要继续加水,故容量瓶中原有少量水对实验结果无影响;
C.摇匀后液面下降是正常现象,因为残留在刻度线上方的溶液未及时回流,此时不需要进行任何操作,若补充水,则溶液体积偏大,所配溶液浓度偏低;
D.俯视标线,会导致溶液体积偏小,所配溶液浓度偏高;
故选D;
(3)粉碎铁矿烧渣后可以增大接触面积,加快反应速率;
(4)根据分析,溶液X中加入过量Fe,先发生的反应为Fe2(SO4)3+Fe=3FeSO4,离子方程式为2Fe3++Fe=3Fe2+;
(5)根据分析,操作Ⅲ为蒸发浓缩、冷却结晶、过滤洗涤干燥;Fe3+与SCN-反应生成红色的Fe(SCN)3,因此可以使用KSCN检验Fe3+,Fe3+不能与KMnO4或氯水反应,故选A;
(6)绿矾中的Fe2+在空气中易被氧化为Fe3+,结合固体的颜色可知,灼烧后的产物为Fe2O3;n(Fe2O3)= =0.025mol,根据关系式2FeSO4 7H2O~ Fe2O3可知,n(FeSO4 7H2O)=2×0.025mol=0.05mol,m(FeSO4 7H2O)= 278g/mol×0.05mol=13.9g,绿矾的质量分数为×100%≈92.7%。
19.(1) 2Al+2OH-+2H2O=2AlO+3H2↑ 坩埚
(2) 27.2mL 偏小 A 胶头滴管
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
【分析】废铁屑加入足量氢氧化钠溶液,Al溶于氢氧化钠溶液生成偏铝酸钠,过滤,滤渣是铁,滤液是偏铝酸钠溶液;用1mol/L的硫酸溶解铁粉得到硫酸亚铁溶液,用双氧水把硫酸亚铁氧化为硫酸铁,再加入硫酸铵溶液生成硫酸铁铵;偏铝酸钠溶液中通入足量二氧化碳生成氢氧化铝沉淀,氢氧化铝加热分解为氧化铝。
【详解】(1)步骤①是废铁屑加入足量氢氧化钠溶液,Al溶于氢氧化钠溶液生成偏铝酸钠和氢气,发生的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑;步骤④为灼烧,灼烧固体物质在坩埚中进行;故答案为:2Al+2OH-+2H2O=2AlO+3H2↑;坩埚;
(2)质量分数为98%,密度为1.84g·mL-1的浓硫酸的物质的量浓度是,实验中需配制500mL1.00mol·L-1的硫酸,根据稀释前后硫酸物质的量不变,实验需要量取浓硫酸的体积为;若在量取浓硫酸时俯视,将使所取浓硫酸体积偏小,则配制的稀硫酸的浓度将偏小;配制过程中需用量筒量取浓硫酸,用烧杯、玻璃棒稀释浓硫酸,用500mL容量瓶定容,定容时用胶头滴管滴加蒸馏水,所以不需要用到的仪器是托盘天平,选A,除图中已有仪器外,还缺少的一种玻璃仪器是胶头滴管,故答案为:27.2mL;偏小;A;胶头滴管;
(3)步骤②中加入足量H2O2的目的是把Fe2+氧化为Fe3+,该步骤中发生的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O。
答案第1页,共2页
答案第1页,共2页
姓名 班级
一、选择题
1.硫酸铝溶液中含有,则溶液中的物质的量浓度为
A. B. C. D.
2.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①~③。下列说法正确的是
A.固体W的溶解度曲线是图乙中的b
B.①~③溶液中,只有②是饱和溶液
C.若将②升温至t2℃,固体不能全部溶解
D.①~③溶液中,溶质质量分数的大小关系是③>②>①
3.10%的硝酸钾溶液20g,为使它的质量分数增大一倍,可采用的方法是
A.再加入2g硝酸钾 B.蒸发水分浓缩为10g的溶液
C.蒸发掉水分的一半 D.加入20g25%硝酸钾溶液
4.实验是学习化学、体验化学和探究化学过程的重要途径。下列实验操作符合规范的是
A B C D
试剂的存放 溶液的转移 气体的收集 浓硫酸的稀释
A.A B.B C.C D.D
5.下列有关实验原理或操作正确的是
A.用量筒量取酒精,加水,配制质量分数为的酒精溶液
B.在某硫酸盐溶液中,含有个硫酸根离子和个金属离子,则该硫酸盐的物质的量浓度为
C.实验中需用溶液,配制时称取的的质量为201.4g
D.实验室配制硫酸亚铁溶液,其操作是:用天平称绿矾,放入小烧杯中加水溶解,转移到容量瓶,洗涤、稀释、定容、摇匀
6.汽车、电动车一般使用铅酸蓄电池,某铅酸蓄电池用的是28%的稀硫酸,现用98%(密度1.84g/cm3)的浓硫酸配制该稀硫酸。下列说法中正确的是
A.28%的稀硫酸中溶质与溶剂的质量比为28:100
B.若配制3.5kg28%的稀硫酸,用托盘天平称量10kg98%的浓硫酸即可
C.配制该稀硫酸时,把水沿容器内壁缓慢注入浓硫酸中
D.若用该浓硫酸与水体积比1:1混合后得到的溶液溶质的质量分数大于49%
7.VmLAl2SO43溶液中含有Al3mg,取mL该溶液用水稀释至VmL,则稀释后SO物质的量浓度为
A.mol/L B.mol/L C.mol/L D.mol/L
8.Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL4.5mol·L-1的NaOH溶液,则该H2SO4的物质的量浓度为
A.2.25mol·L-1 B.2.00mol·L-1 C.3.00mol·L-1 D.0.60mol·L-1
9.易水解,实验室利用固体配制溶液。下列说法正确的是
A.配制溶液时容量瓶需要干燥
B.配制溶液过程中,玻璃棒只起到引流的作用
C.需用托盘天平称量固体
D.溶解固体时需要用浓盐酸代替蒸馏水
10.下列溶液与溶液中物质的量浓度相等的是
A.溶液 B.溶液
C.溶液 D.溶液
11.V mL Al2(SO4)3溶液中含有Al3+a g,取V mL溶液稀释到4V mL,则稀释后溶液中SO的物质的量浓度是
A. mol/L B. mol/L
C. mol/L D. mol/L
12.现需用到80mL 1.0mol·L-1 NaOH溶液,现以NaOH固体配制该溶液,下列说法正确的是
A.使用的玻璃仪器主要有烧杯、玻璃棒、100mL容量瓶、胶头滴管
B.需用托盘天平称取3.2g NaOH固体
C.在溶解固体和转移溶液时均用到玻璃棒,且玻璃棒作用相同
D.定容并摇匀后,发现凹液面低于刻度线,需补充滴加蒸馏水至刻度线为止
13.实验室配制50g溶质质量分数为10%的氯化钠溶液,下列说法正确的是
A.计算得出所需氯化钠固体的质量为5g
B.将氯化钠固体直接放在托盘天平的右盘进行称量
C.溶解氯化钠时用玻璃棒搅拌,其目的是增大氯化钠的溶解度
D.将配制好的溶液装瓶时,有少量液体洒出,会造成溶液的溶质质量分数偏小
14.配制一定物质的量浓度的溶液是一个重要的定量实验,下列有关说法正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.配制一定物质的量浓度的稀盐酸时,用量筒量取浓盐酸
C.用托盘天平称取药品时药品和砝码位置颠倒,药品质量一定偏小
D.定容时,为防止液滴飞溅,胶头滴管应紧贴容量瓶内壁
15.设NA代表阿伏加德罗常数,下列说法正确的是
A.0oC、101kPa下,11.2LN2和O2的混合气体中所含原子数为NA
B.18gH2O在标况下的体积为22.4L
C.物质的量浓度为2mol/L的Ba(NO3)2溶液中,含有NO个数为4NA
D.标况下,22.4L氨气溶于1L水制得氨水,氨气的物质的量浓度为1mol·L-1
二、实验题
16.某同学配制50g15%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号,后同),其中操作错误的是 。
(2)该实验中所需食盐的质量是 g。
(3)溶解过程中玻璃棒的作用是 。
(4)对配置的溶液进行检测,发现溶质质量分数偏小,其原因可能是___________(选填字母)。
A.氯化钠固体不纯
B.转移配制好的溶液时,有少量液体洒出
C.量取水的体积时,俯视读数
D.称量时,药品与砝码放反了
(5)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
(6)用氯化钠和碳酸氢铵(NH4HCO3)可制备碳酸氢钠和氯化铵(NH4Cl),该反应可表示为:NaCl+NH4HCO3=NaHCO3+NH4Cl。20℃时,按上述化学方程式中反应物的质量比,向100g水中加入11.7gNaCl和15.8gNH4HCO3。理论上从溶液中析出晶体的质量为 g。
资料:20℃时四种物质的溶解度如下,假设它们同时溶解在水中各自的溶解度不变。
物质 NaCl NH4HCO3 NH4Cl NaHCO3
溶液度/g 36.0 21.6 37.2 9.6
17.实验室需要1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,除图中已有仪器外,配制上述溶液还需要的玻璃仪器是玻璃棒, 和 。
(2)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,需干燥后再配制溶液
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)根据计算用托盘天平称量NaOH固体 g。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为 mL。
(5)在配制过程中,下列实验造成所配制的稀硫酸的物质的量浓度偏大的有 。
A.转移溶液后未洗涤烧杯和玻璃棒直接定容
B.在定容时仰视刻度线
C.在定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度线
E.用量筒量取浓硫酸时俯视观察凹液面
F.配制时,溶液未冷却直接转入容量瓶
(6)定容时,若加蒸馏水时不慎超过刻度线,处理方法是 。
(7)配制450mL1mol/LNaOH的溶液的步骤如下,完成下列填空:①计算;②称量后溶解;将称量好的NaOH固体放入烧杯中,然后用适量蒸馏水溶解,该步操作用到的另一仪器的作用 。
(8)其余步骤正确的操作顺序是(每个字母限用一次) 。
A.用30mL水洗涤烧杯和玻璃棒2-3次,洗涤液均注入容量瓶,振荡
B.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
C.将容量瓶盖紧,颠倒摇匀
D.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
E.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
三、工业流程题
18.用硫铁矿烧渣(主要成分为和少量)为原料可以制得绿矾()产品,其制备流程如下。
已知:不能与稀硫酸反应。
Ⅰ、配制250mL4.8mol/L的稀硫酸溶液
(1)需要用到的玻璃仪器主要是量筒、烧杯、玻璃棒、胶头滴管和 (填仪器名称)。
(2)下列操作会引起结果偏高的是___________(选填字母序号)。
A.未洗涤玻璃棒 B.容量瓶未干燥,含有少量蒸馏水
C.摇匀后液面下降,补充水 D.定容时俯视刻度线
Ⅱ、绿矾的制备流程图中
(3)工艺生产中,常将硫铁矿烧渣粉碎,这样做的目的是 。
(4)往溶液X中加过量铁粉时,溶液颜色由棕黄色变为浅绿色且有气泡产生,该过程中反应的离子方程式为 和。
(5)操作Ⅲ指的是蒸发浓缩、 (填操作名称)、过滤、洗涤、干燥。检验溶液Y是否含有的试剂是 (选填字母编号)。
A.KSCN溶液 B.酸性溶液 C.新制氯水
(6)充分灼烧15.0g绿矾产品,可得到4.0g某种红棕色固体。则该红棕色固体是 ,该绿矾产品的纯度为 (结果保留一位小数)。
19.硫酸铁铵可用作媒染剂和制药,其晶体化学式为。实验室模拟用废铁屑(主要成分为Fe和少量的Al杂质)制取硫酸铁铵晶体并回收氧化铝,具体流程如下图所示:
(1)步骤①中发生的离子方程式为: 。步骤④为灼烧,该过程在 中进行(填仪器名称)。
(2)实验中需配制500 mL 1.00 mol/L的硫酸,则需要量取质量分数为98%,密度为1.84g/mL的浓硫酸 mL,若在量取浓硫酸时俯视,则配制的稀硫酸的浓度将 (填“偏大”或“偏小”或“不变”),配制过程中不需要用到的仪器是 (填字母)。除图中已有仪器外,还缺少的玻璃仪器是 。
(3)步骤②中加入足量的目的是氧化,该步骤中发生的离子方程式为: 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】Al3+的物质的量为,由硫酸铝的化学式Al2(SO4)3,则的物质的量浓度为,故选:A。
2.C
【分析】t3℃,150g-50g=100g水溶解W质量为50g,结合图像可知,W的溶解度曲线为a,且③为t3℃时a溶液的恰好饱和溶液;
【详解】A.由分析可知,固体W的溶解度曲线是图乙中的a,A错误;
B.由图可知,t1℃时a的溶解度为20g,则150g水此时恰好溶解30g的a,故①为恰好饱和溶液,且③也为t3℃的a溶液的恰好饱和溶液,B错误;
C.t2℃,a的溶解度为30g,150g水最多溶解45g的a,故若将②升温至t2℃,固体不能全部溶解,C正确;
D.结合B分析可知,①②均为t1℃时a的饱和溶液,故①~③溶液中,溶质质量分数的大小关系是③>②=①,D错误;
故选C。
3.B
【分析】20g10%的硝酸钾溶液含溶质的质量为20g×10%=2g,含溶剂20g 2g=18g;
【详解】A.设需要再溶解该物质的质量为a,(20g+a)×20%=2g+a,a=2.5g,A错误;
B.设需要蒸发水的质量为a,(20g a)×20%=2g,a=10g,蒸发水分浓缩为20g-10g=10g的溶液,故B正确;
C.由B分析可知,应将溶剂蒸发掉溶液质量的一半,而不是溶剂质量的一半,C错误;
D.加入20g25%的硝酸钾溶液,所得溶液中溶质质量分数为,D错误;
故选B。
4.C
【详解】A.乙醇易燃烧,盐酸、NaOH不易燃烧,试剂不能放在一起,故A错误;
B.转移需要玻璃棒引流,图中缺少玻璃棒,故B错误;
C.二氧化碳的密度大于空气的密度,则长导管进气可收集,故C正确;
D.混合时将密度大的液体注入密度小的液体中,且浓硫酸稀释放热,应将浓硫酸注入水中,故D错误;
故选:C。
5.B
【详解】A.不能在量筒中配溶液,酒精的密度比水的密度小,15mL酒精和5mL水配制的酒精溶液的质量分数小于75%,A项错误;
B.在200mL某硫酸盐溶液中含有1.5NA个硫酸根离子和NA个金属离子,根据电荷守恒,该硫酸盐的化学式为M2(SO4)3(M为金属),该溶液中含M2(SO4)3物质的量为0.5mol,该硫酸盐的物质的量浓度为=2.5mol/L,B项正确;
C.根据“大而近”的原则,配制950mL2mol/LNa2CO3溶液选用1000mL容量瓶,配制时需称取Na2CO3的质量为2mol/L×1L×106g/mol=212g,C项错误;
D.实验室配制500mL0.2mol/L硫酸亚铁溶液,需称取绿矾的质量为0.2mol/L×0.5L×278g/mol=27.8g,D项错误;
答案选B。
6.D
【详解】A.28%的稀硫酸中硫酸的质量分数为28%,即100g溶液中有硫酸28g,水72g,溶质与溶剂的质量比为28:72,A错误;
B.配制3.5kg28%的稀硫酸,需要硫酸0.98kg,则需要98%的浓硫酸1kg,B错误;
C.配制稀硫酸时,将浓硫酸沿容器内壁缓慢注入水中,C错误;
D.该浓硫酸与水体积比1:1混合,浓硫酸密度大于水,因此浓硫酸的质量大于水,两者混合所得溶液溶质的质量分数大于49%,D正确;
故答案选D。
7.B
【详解】VmLAl2(SO4)3溶液中含有Al3+mg,则SO的物质的量为mol,取mL该溶液稀释至VmL,则SO的物质的量为mol,则其物质的量浓度为mol÷(V×10-3)L= mol/L,故B正确。
故选:B。
8.C
【详解】Fe和Fe2O3的混合物与稀H2SO4反应,Fe和Fe2O3均无剩余,且有H2生成,说明反应生成FeSO4,为了中和过量的硫酸,而且使FeSO4完全转化成Fe(OH)2,说明反应后的溶液溶质只有Na2SO4,根据硫酸根守恒,则n(H2SO4)=n(Na2SO4),根据钠离子守恒,则n(Na2SO4)=n(NaOH),则有:n(H2SO4)=n(Na2SO4)=n(NaOH)=×4.5mol/L×0.2L=0.45mol,故该硫酸的物质的量浓度为:c(H2SO4)==3.00mol/L,故选:C。
9.D
【详解】A.配制溶液时,实验室没有490mL规格的容量瓶,为了使操作规范、减小误差,应该使用容量瓶,但无需干燥,A错误;
B.配制溶液过程中,按照实验操作的顺序,玻璃棒分别起了搅拌和引流的作用,B错误;
C.用托盘天平称量固体质量时,需称量固体,C错误;
D.容易水解生成沉淀,所以溶解时需要把固体溶解在浓盐酸中,D正确;
故选:D。
10.C
【分析】20 mL 2 mol/LNaNO3溶液中物质的量浓度c=2 mol/L×1=2 mol/L。
【详解】A.10 mL 2 mol/L Mg(NO3)2溶液中物质的量浓度c=2 mol/L×2=4 mol/L,选项A不符合题意;
B.5 mL 0.4 mol/L Al(NO3)3溶液中物质的量浓度c=0.4 mol/L×3=1.2 mol/L,选项B不符合题意;
C.10 mL2 mol/L AgNO3溶液中物质的量浓度c=2 mol/L×1=2 mol/L,选项C符合题意;
D.10 mL 0.5 mol/L Cu(NO3)2溶液中物质的量浓度c=0.5 mol/L×1=1 mol/L,选项D不符合题意;
故选C。
11.C
【详解】V mL Al2(SO4)3溶液中含有Al3+a g,Al3+物质的量为:=mol;取V mL溶液稀释到4V mL,则稀释后Al3+的物质的量为mol×=mol;则稀释后SO的物质的量为 mol×=mol;则稀释后溶液中SO的物质的量浓度是=mol/L,故选C。
12.A
【详解】A.配制80mL 1.0mol·L-1 NaOH溶液,应选用100mL容量瓶,即使用的玻璃仪器主要有烧杯、玻璃棒、100mL容量瓶、胶头滴管,故A正确;
B.需要的NaOH物质的量为n=0.1L×1.0mol·L-1 =0.1mol,质量为:0.1mol×40g/mol=4g,故B错误;
C.在溶解固体时,用玻璃棒搅拌,在转移溶液时,用玻璃棒引流,作用不同,故C错误;
D.定容并摇匀后,发现凹液面低于刻度线,是因为容量瓶内壁上有液体未流下,无需处理,故D错误;
故选A。
13.A
【详解】A.溶质质量=溶液质量×溶质的质量分数,实验室配制50g溶质质量分数为10%的氯化钠溶液,需氯化钠的质量=50g×10%=5g,A正确;
B.托盘天平的使用要遵循“左物右码”的原则,应将氯化钠固体放在托盘天平的左盘的纸片上进行称量,B错误;
C.溶解氯化钠时用玻璃棒搅拌,其目的是加快溶解速率,不能增大氯化钠的溶解度,C错误;
D.将配制好的溶液装瓶时,有少量液体洒出,溶液具有均一性,溶质质量分数不变,D错误;
故选A。
14.A
【详解】A.容量瓶上标有温度、容积和唯一刻度线,表示在所指温度下,液体的凹液面与容量瓶颈部的刻度线相切时,液体体积恰好与容量瓶上标注的容积相等,配制一定物质的量浓度的溶液过程中需要加蒸馏水,故容量瓶用蒸馏水洗净后,不要干燥直接用于配制溶液,A项正确;
B.量筒精确度达不到0.01mL,配制一定物质的量浓度的稀盐酸时,用量筒量取9.8mL浓盐酸,不能量取9.82mL,B项错误;
C.用托盘天平称取药品时药品和砝码位置颠倒,若不使用游码时,则药品质量不变,C项错误;
D.定容时,胶头滴管应垂直悬空于容量瓶口正上方,不能紧贴容量瓶内壁,D项错误;
答案选A。
15.A
【详解】A.0oC、101kPa下为标况,11.2LN2和O2的混合气体中分子为,1分子氮气和1分子氧气均含2个原子,则共所含原子数为NA,A正确;
B.标况下水不是气体,不能使用气体摩尔体积,B错误;
C.溶液体积未知,无法计算硝酸根离子个数,C错误;
D.应该为配成1L溶液,而不是加入1L的水,D错误;
故选A。
16.(1) ②①⑤③④ ①
(2)7.5
(3)加快溶解
(4)AD
(5)100
(6)7.2
【分析】配制配制50g 15%氯化钠溶液步骤为计算、称量、溶解、转移;
【详解】(1)配制配制50g 15%氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解,配制溶液的正确操作顺序为②①⑤③④,在称量药品是应“左物右码”,图中所示操作砝码与药品位置放反了,所以其中操作错误的是①。
(2)配制50g 15%氯化钠溶液,需氯化钠的质量是:50g×15%=7.5g。
(3)溶解过程中玻璃棒的作用是搅拌,其目的是加快溶解。
(4)A.氯化钠固体不纯,溶质减小,会使配制的溶液溶质质量分数偏小;
B.溶液具有均一性,转移配制好的溶液时,有少量溶液洒出,不会改变溶质的质量分数;
C.量取水的体积时,俯视读数,会造成实际量取的水的体积偏小,则使溶质质量分数偏大;
D.称量时,药品与砝码放反了,实际药品质量等于砝码减游码,会造成实际所取的溶质的质量偏小,则使溶质质量分数偏小。
故选AD;
(5)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,设需要水的质量是a,50g×15%=(50g+a)×5%,解得:a=100g;
(6)向100g水中加入11.7gNaCl(为0.2mol)和15.8gNH4HCO3(为0.2mol),反应生成0.2mol NaHCO3(质量为16.8g)、0.2mol NH4Cl(10.7g),结合图表可知,理论上从溶液中析出晶体为碳酸氢钠晶体,质量为16.8g-9.6g=7.2g。
17.(1) 500mL容量瓶 烧杯
(2)BCD
(3)20.0
(4)13.6
(5)CF
(6)重新配置
(7)搅拌,加速固体溶解
(8)BAEDC
【详解】(1)配制溶液时,除了图中已有的仪器外,还需要的玻璃仪器有500mL容量瓶和烧杯。
(2)A.使用容量瓶之前需检验其是否漏水,A正确;
B.容量瓶用水洗干净后,不需要等到干燥后再配制溶液,B错误;
C.固体的溶解不能在容量瓶中进行,需要在烧杯中溶解再转移到容量瓶中,C错误;
D.若试样是液体,则用量筒量取后先在烧杯中进行稀释,等冷却后转移到容量瓶中,D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀,E正确;
故错误的为BCD。
(3)需要1mol/L的NaOH溶液450mL,则需要配制1mol/L的NaOH溶液500mL,需要的NaOH的物质的量为0.5mol,质量为20.0g。
(4)配制0.5mol/L的硫酸溶液500mL,硫酸的物质的量为0.25mol,质量为24.5g,则需要质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为24.5g÷0.98÷1.84g/cm3=13.6mL。
(5)A.转移溶液后未洗涤烧杯和玻璃棒,造成部分溶质损失,所配制稀硫酸的浓度偏小,A错误;
B.定容时仰视刻度线,溶液的体积偏大,浓度偏低,B错误;
C.定容时俯视刻度线,溶液的体积偏小,浓度偏大,C正确;
D.定容时发现液面低于刻度,再补充几滴水至刻度线,溶液的体积偏大,浓度偏小,D错误;
E.用量筒量取浓硫酸时俯视观察凹液面,导致量取的硫酸的体积偏小,配制的硫酸的浓度偏小,E错误;
F.配制溶液时溶液未冷却就直接转入容量瓶,此时溶液的体积偏大,导致所加水的量偏少,冷却后溶液的体积偏小,浓度偏大,F正确;
故答案选CF。
(6)定容时,加蒸馏水不慎超过刻度线,则需要重新配制。
(7)将称量好的NaOH固体加入烧杯中,用适量蒸馏水溶解,该步骤用到的另一仪器为玻璃棒,作用为搅拌,加速固体溶解。
(8)溶解后将冷却的NaOH溶液沿玻璃棒注入容量瓶中,用水洗涤烧杯和玻璃棒,洗涤液转移到容量瓶中,继续往容量瓶中加入水,至离刻度线1-2cm处,改用胶头滴管加水,使凹液面与刻度线正好相切,最后将容量瓶盖紧,颠倒摇匀,故顺序为BAEDC。
18.(1)250mL容量瓶
(2)D
(3)增大接触面积,使反应更充分(或加快反应速率)
(4)
(5) 冷却结晶(或降温结晶) A
(6) 92.7%
【分析】烧渣与硫酸反应时,Fe2O3转化为Fe2(SO4)3,SiO2不反应,经过过滤(操作I)后,得到的溶液X中主要含有Fe2(SO4)3和过量的H2SO4,滤渣为SiO2,溶液X中加入过量Fe,发生反应Fe2(SO4)3+Fe=3FeSO4、Fe+ H2SO4= FeSO4+H2↑,故溶液Y溶质为FeSO4,操作Ⅱ为过滤,除去过量Fe,溶液Y经过蒸发浓缩、冷却结晶、过滤洗涤干燥得到绿矾晶体。
【详解】(1)配制一定物质的量浓度的溶液需用到相应规格的容量瓶,故此处填250 mL容量瓶;
(2)A.未洗涤烧杯、玻璃棒,则溶质损失,即容量瓶中溶质偏少,所配溶液浓度偏低;
B.由于定容时需要继续加水,故容量瓶中原有少量水对实验结果无影响;
C.摇匀后液面下降是正常现象,因为残留在刻度线上方的溶液未及时回流,此时不需要进行任何操作,若补充水,则溶液体积偏大,所配溶液浓度偏低;
D.俯视标线,会导致溶液体积偏小,所配溶液浓度偏高;
故选D;
(3)粉碎铁矿烧渣后可以增大接触面积,加快反应速率;
(4)根据分析,溶液X中加入过量Fe,先发生的反应为Fe2(SO4)3+Fe=3FeSO4,离子方程式为2Fe3++Fe=3Fe2+;
(5)根据分析,操作Ⅲ为蒸发浓缩、冷却结晶、过滤洗涤干燥;Fe3+与SCN-反应生成红色的Fe(SCN)3,因此可以使用KSCN检验Fe3+,Fe3+不能与KMnO4或氯水反应,故选A;
(6)绿矾中的Fe2+在空气中易被氧化为Fe3+,结合固体的颜色可知,灼烧后的产物为Fe2O3;n(Fe2O3)= =0.025mol,根据关系式2FeSO4 7H2O~ Fe2O3可知,n(FeSO4 7H2O)=2×0.025mol=0.05mol,m(FeSO4 7H2O)= 278g/mol×0.05mol=13.9g,绿矾的质量分数为×100%≈92.7%。
19.(1) 2Al+2OH-+2H2O=2AlO+3H2↑ 坩埚
(2) 27.2mL 偏小 A 胶头滴管
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
【分析】废铁屑加入足量氢氧化钠溶液,Al溶于氢氧化钠溶液生成偏铝酸钠,过滤,滤渣是铁,滤液是偏铝酸钠溶液;用1mol/L的硫酸溶解铁粉得到硫酸亚铁溶液,用双氧水把硫酸亚铁氧化为硫酸铁,再加入硫酸铵溶液生成硫酸铁铵;偏铝酸钠溶液中通入足量二氧化碳生成氢氧化铝沉淀,氢氧化铝加热分解为氧化铝。
【详解】(1)步骤①是废铁屑加入足量氢氧化钠溶液,Al溶于氢氧化钠溶液生成偏铝酸钠和氢气,发生的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑;步骤④为灼烧,灼烧固体物质在坩埚中进行;故答案为:2Al+2OH-+2H2O=2AlO+3H2↑;坩埚;
(2)质量分数为98%,密度为1.84g·mL-1的浓硫酸的物质的量浓度是,实验中需配制500mL1.00mol·L-1的硫酸,根据稀释前后硫酸物质的量不变,实验需要量取浓硫酸的体积为;若在量取浓硫酸时俯视,将使所取浓硫酸体积偏小,则配制的稀硫酸的浓度将偏小;配制过程中需用量筒量取浓硫酸,用烧杯、玻璃棒稀释浓硫酸,用500mL容量瓶定容,定容时用胶头滴管滴加蒸馏水,所以不需要用到的仪器是托盘天平,选A,除图中已有仪器外,还缺少的一种玻璃仪器是胶头滴管,故答案为:27.2mL;偏小;A;胶头滴管;
(3)步骤②中加入足量H2O2的目的是把Fe2+氧化为Fe3+,该步骤中发生的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O。
答案第1页,共2页
答案第1页,共2页
