高中化学鲁科版(2019)选择性必修一同步课件 2.3.3 催化剂对化学反应速率的影响 催化机理 课件(共24张PPT)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修一同步课件 2.3.3 催化剂对化学反应速率的影响 催化机理 课件(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 826.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 18:03:38 | ||
图片预览







文档简介
(共24张PPT)
第3课时 催化剂对化学反应速
率的影响 催化机理
第2章 第3节
1.了解催化剂的特点及催化机理。
2.掌握对化学反应速率的影响因素(重、难点)。
学习目标
催化剂对化学反应速率的影响
一
1.催化剂的概念
(1)催化剂是能改变化学反应速率而在反应前后本身的质量和化学性质不变的物质。
(2)催化剂的活性与自身成分、粒径、合成方法、压强、温度等有关。催化剂发挥作用需要维持在活性温度范围内。此外,有些物质的存在会使催化剂明显失效,这种现象称为催化剂中毒。
2.催化剂对化学反应速率的影响
分析课本表2-3-6,可得出以下结论:
(1)使用催化剂,反应的活化能降低,化学反应速率常数大幅增大,能大幅度加快化学反应速率。
(2)比温度、压强、浓度对化学反应速率影响的程度更大。
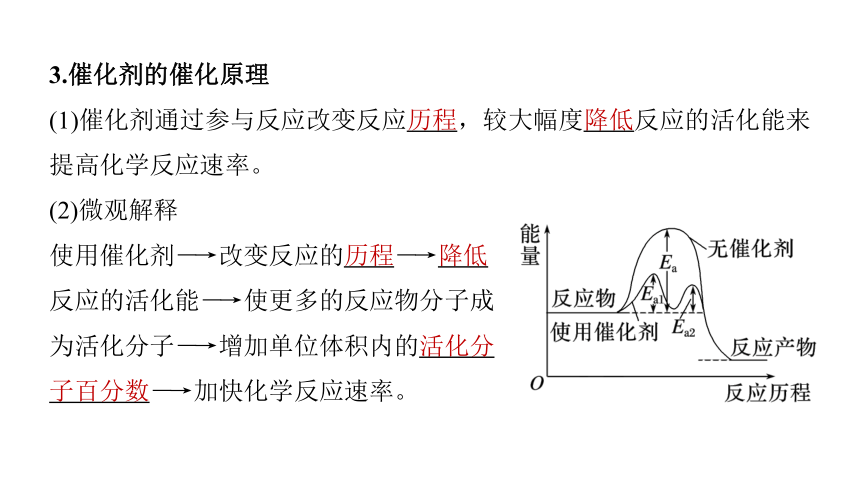
3.催化剂的催化原理
(1)催化剂通过参与反应改变反应历程,较大幅度降低反应的活化能来提高化学反应速率。
(2)微观解释
使用催化剂―→改变反应的历程―→降低
反应的活化能―→使更多的反应物分子成
为活化分子―→增加单位体积内的活化分
子百分数―→加快化学反应速率。
4.催化剂的特点
(1)选择性:某种催化剂对某一反应可能是活性很强的催化剂,但对其他反应就不一定是有催化作用。
(2)高效性:可以较大幅度地降低反应的活化能,从而有效地提高化学反应速率。
(3)催化剂不能改变化学反应的平衡常数,不能改变平衡转化率,不能改变反应热,只能改变化学反应速率。
思考交流
1.正误判断
(1)催化剂能使不起反应的物质发生反应
(2)催化剂在化学反应前后化学性质发生改变,但质量不变
(3)双氧水中加入MnO2,可以使生成O2的速率增大,是因为MnO2的催化作用
(4)电解水时,往水中加少量NaOH,可使电解速率明显加快,故NaOH是这个反应的催化剂
×
×
√
×
电解水时,加少量NaOH可增大水中离子浓度,加快电荷移动速率,NaOH并没有改变反应历程,故不是催化剂。
思考交流
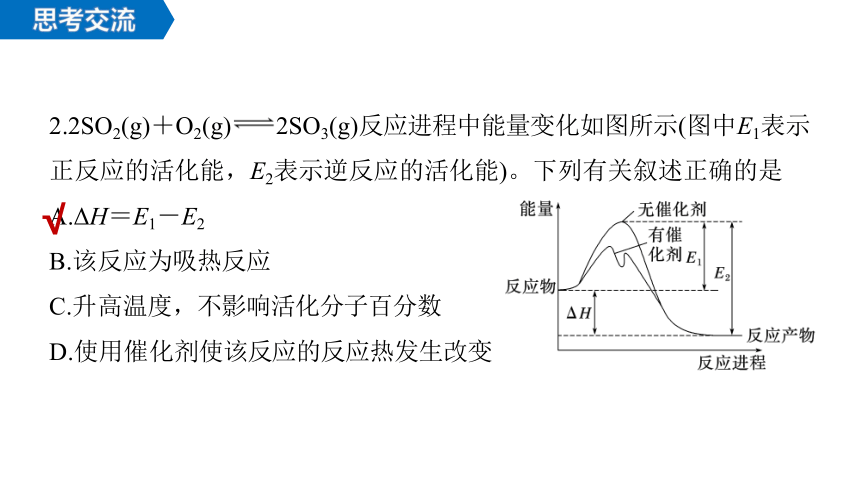
2.2SO2(g)+O2(g) 2SO3(g)反应进程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
A.ΔH=E1-E2
B.该反应为吸热反应
C.升高温度,不影响活化分子百分数
D.使用催化剂使该反应的反应热发生改变
√
思考交流
3.在气体参与的反应中,①增大反应物浓度;②升高温度;③增大压强(压缩体积);④加入催化剂,若以上四种方法均可使反应速率增大,完成下列问题:
(1)降低反应活化能的是____(填序号,下同)。
(2)增加活化分子百分比的是______。
(3)未改变活化分子百分比,增加单位体积内分子总数的是______。
(4)增加单位体积内活化分子数的是__________。
④
②④
①③
①②③④
常见催化机理图分析
二
1.化学变化的宏观特征就是有新物质生成,并伴有能量的变化,从微观来说就是有旧键的断裂和新键的形成。催化反应机理图是以实际科研成果为载体,常设置如下三种考查角度:
(1)反应物、反应产物、催化剂、中间体的辨识。
(2)从微观的视角分析物质转化过程中电子的转移、化学键的断裂与形成。
(3)应用化学反应原理,结合原子守恒、能量守恒思想、平衡观念分析解决实际问题的能力。
2.试题的呈现形式通常有两种:(1)催化循环转化图,(2)物质转化过程能量(能垒)图像。
类型1 催化循环转化图
1.利用某分子筛作催化剂,NH3
可脱除废气中的NO和NO2,生
成两种无毒物质,其反应历程
如图所示:
(1)X是 。
N2、H2O
(2)上述历程的总反应为 。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的 。
中间产物
由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
2.(2023·湖南衡阳联考)由于水氧化反应包含多个电子/质子转移,而且其动力学过程缓慢,水氧化催化机理四步反应如图所示。下列叙述错误的是
A.(L3-)Co能降低水氧化
反应的活化能
B.该机理总反应式为2H2O
O2↑+4H++4e-
C.氧化性:(L2-)CoOOH<(L2-)CoOH
D.催化剂参与反应过程,从而加快反应速率
√
归纳总结
在催化循环反应体系中:
催化剂首先直接和反应物反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
类型2 物质转化过程能量(能垒)图像
3.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2,下列说法正确的是
A.每活化一个氧分子吸收0.29 eV能量
B.水可使氧分子活化反应的活化能降低
0.42 eV
C.氧分子的活化是C—O键的断裂与O—O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
√
4.甲酸被认为是理想的氢能载体,
我国科技工作者运用DFT计算研究
单分子HCOOH在催化剂表面分解
产生H2的反应历程如图所示,其中
吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=______eV,该步骤的反应方程式为_______________________。
0.98
HCOOH*===HCOO*+H*
(2)该历程中甲酸分解制氢气的热化学方程式为____________________
_______________________________。
HCOOH(g)===CO2(g)
+H2(g) ΔH=-0.15NA eV·mol-1
由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)=== CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1。
特别提醒
反应机理能垒图既能反映化学反应中的物质变化,又能反映能量变化。解答此类问题时应注意:
(1)能垒图中涉及物质的能量往往是指一个分子变化过程的能量变化,其单位一般为eV(电子伏特)。活化能Ea一般指每摩尔物质反应的能量变化,其单位多为kJ·mol-1。
(2)催化反应历程一般为扩散→吸附→断键→成键→脱附。要关注断键和成键的部位及元素化合价的变化。
(3)复杂反应的反应速率由基元反应中活化能(能垒)最大的慢反应决定。
自我测试
1
2
3
1.(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
√
自我测试
1
2
3
2.科学家结合实验与计算机模拟结果,研究出了均相催化的思维模型。
总反应:A+B―→AB(K为催化剂)
反应①:A+K―→AK Ea1
反应②:AK+B―→AB+K Ea2
下列说法正确的是
A.第①步为快反应,第②步为慢反应
B.升高温度使反应①的速率加快,反应②的速率减慢
C.该反应的ΔH=-Ea kJ·mol-1
D.催化剂增大了活化分子百分数,加快了反应速率
√
自我测试
1
2
3
3.中国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol-1)如图所示,下列说法错误的是
A.生成NH3的各基元反应中,N元素均被还原
B.在Pd/SVG催化剂上,NO更容易被H2还原为NH3
C.决定NO生成NH3速率的基元反应为NH2NO―→
NHNOH
√
第3课时 催化剂对化学反应速
率的影响 催化机理
第2章 第3节
1.了解催化剂的特点及催化机理。
2.掌握对化学反应速率的影响因素(重、难点)。
学习目标
催化剂对化学反应速率的影响
一
1.催化剂的概念
(1)催化剂是能改变化学反应速率而在反应前后本身的质量和化学性质不变的物质。
(2)催化剂的活性与自身成分、粒径、合成方法、压强、温度等有关。催化剂发挥作用需要维持在活性温度范围内。此外,有些物质的存在会使催化剂明显失效,这种现象称为催化剂中毒。
2.催化剂对化学反应速率的影响
分析课本表2-3-6,可得出以下结论:
(1)使用催化剂,反应的活化能降低,化学反应速率常数大幅增大,能大幅度加快化学反应速率。
(2)比温度、压强、浓度对化学反应速率影响的程度更大。
3.催化剂的催化原理
(1)催化剂通过参与反应改变反应历程,较大幅度降低反应的活化能来提高化学反应速率。
(2)微观解释
使用催化剂―→改变反应的历程―→降低
反应的活化能―→使更多的反应物分子成
为活化分子―→增加单位体积内的活化分
子百分数―→加快化学反应速率。
4.催化剂的特点
(1)选择性:某种催化剂对某一反应可能是活性很强的催化剂,但对其他反应就不一定是有催化作用。
(2)高效性:可以较大幅度地降低反应的活化能,从而有效地提高化学反应速率。
(3)催化剂不能改变化学反应的平衡常数,不能改变平衡转化率,不能改变反应热,只能改变化学反应速率。
思考交流
1.正误判断
(1)催化剂能使不起反应的物质发生反应
(2)催化剂在化学反应前后化学性质发生改变,但质量不变
(3)双氧水中加入MnO2,可以使生成O2的速率增大,是因为MnO2的催化作用
(4)电解水时,往水中加少量NaOH,可使电解速率明显加快,故NaOH是这个反应的催化剂
×
×
√
×
电解水时,加少量NaOH可增大水中离子浓度,加快电荷移动速率,NaOH并没有改变反应历程,故不是催化剂。
思考交流
2.2SO2(g)+O2(g) 2SO3(g)反应进程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
A.ΔH=E1-E2
B.该反应为吸热反应
C.升高温度,不影响活化分子百分数
D.使用催化剂使该反应的反应热发生改变
√
思考交流
3.在气体参与的反应中,①增大反应物浓度;②升高温度;③增大压强(压缩体积);④加入催化剂,若以上四种方法均可使反应速率增大,完成下列问题:
(1)降低反应活化能的是____(填序号,下同)。
(2)增加活化分子百分比的是______。
(3)未改变活化分子百分比,增加单位体积内分子总数的是______。
(4)增加单位体积内活化分子数的是__________。
④
②④
①③
①②③④
常见催化机理图分析
二
1.化学变化的宏观特征就是有新物质生成,并伴有能量的变化,从微观来说就是有旧键的断裂和新键的形成。催化反应机理图是以实际科研成果为载体,常设置如下三种考查角度:
(1)反应物、反应产物、催化剂、中间体的辨识。
(2)从微观的视角分析物质转化过程中电子的转移、化学键的断裂与形成。
(3)应用化学反应原理,结合原子守恒、能量守恒思想、平衡观念分析解决实际问题的能力。
2.试题的呈现形式通常有两种:(1)催化循环转化图,(2)物质转化过程能量(能垒)图像。
类型1 催化循环转化图
1.利用某分子筛作催化剂,NH3
可脱除废气中的NO和NO2,生
成两种无毒物质,其反应历程
如图所示:
(1)X是 。
N2、H2O
(2)上述历程的总反应为 。
(3)由反应历程可知,[(NH4)(HNO2)]+是该反应的 。
中间产物
由反应历程可知,[(NH4)(HNO2)]+是该反应的中间产物。
2.(2023·湖南衡阳联考)由于水氧化反应包含多个电子/质子转移,而且其动力学过程缓慢,水氧化催化机理四步反应如图所示。下列叙述错误的是
A.(L3-)Co能降低水氧化
反应的活化能
B.该机理总反应式为2H2O
O2↑+4H++4e-
C.氧化性:(L2-)CoOOH<(L2-)CoOH
D.催化剂参与反应过程,从而加快反应速率
√
归纳总结
在催化循环反应体系中:
催化剂首先直接和反应物反应,反应前后存在,反应过程中不存在,催化剂可循环再生,即“失而复得”;而中间体(中间产物)只在反应过程中出现。
类型2 物质转化过程能量(能垒)图像
3.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2,下列说法正确的是
A.每活化一个氧分子吸收0.29 eV能量
B.水可使氧分子活化反应的活化能降低
0.42 eV
C.氧分子的活化是C—O键的断裂与O—O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
√
4.甲酸被认为是理想的氢能载体,
我国科技工作者运用DFT计算研究
单分子HCOOH在催化剂表面分解
产生H2的反应历程如图所示,其中
吸附在催化剂表面的物种用*标注。
回答下列问题:
(1)该历程中决定正反应速率步骤的能垒(活化能)E正=______eV,该步骤的反应方程式为_______________________。
0.98
HCOOH*===HCOO*+H*
(2)该历程中甲酸分解制氢气的热化学方程式为____________________
_______________________________。
HCOOH(g)===CO2(g)
+H2(g) ΔH=-0.15NA eV·mol-1
由图可知,甲酸分解生成二氧化碳和氢气的反应为放热反应,反应热ΔH=-0.15NA eV·mol-1,则反应的热化学方程式为HCOOH(g)=== CO2(g)+H2(g) ΔH=-0.15NA eV·mol-1。
特别提醒
反应机理能垒图既能反映化学反应中的物质变化,又能反映能量变化。解答此类问题时应注意:
(1)能垒图中涉及物质的能量往往是指一个分子变化过程的能量变化,其单位一般为eV(电子伏特)。活化能Ea一般指每摩尔物质反应的能量变化,其单位多为kJ·mol-1。
(2)催化反应历程一般为扩散→吸附→断键→成键→脱附。要关注断键和成键的部位及元素化合价的变化。
(3)复杂反应的反应速率由基元反应中活化能(能垒)最大的慢反应决定。
自我测试
1
2
3
1.(2022·广东,15)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则
A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 mol·L-1·min-1
√
自我测试
1
2
3
2.科学家结合实验与计算机模拟结果,研究出了均相催化的思维模型。
总反应:A+B―→AB(K为催化剂)
反应①:A+K―→AK Ea1
反应②:AK+B―→AB+K Ea2
下列说法正确的是
A.第①步为快反应,第②步为慢反应
B.升高温度使反应①的速率加快,反应②的速率减慢
C.该反应的ΔH=-Ea kJ·mol-1
D.催化剂增大了活化分子百分数,加快了反应速率
√
自我测试
1
2
3
3.中国科学家研究在Pd/SVG催化剂上H2还原NO生成N2和NH3的路径,各基元反应及活化能Ea(kJ·mol-1)如图所示,下列说法错误的是
A.生成NH3的各基元反应中,N元素均被还原
B.在Pd/SVG催化剂上,NO更容易被H2还原为NH3
C.决定NO生成NH3速率的基元反应为NH2NO―→
NHNOH
√
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
