高中化学鲁科版(2019)选择性必修一同步课件 2.3.1 化学反应历程与化学反应速率 课件(共34张PPT)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修一同步课件 2.3.1 化学反应历程与化学反应速率 课件(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 18:05:27 | ||
图片预览









文档简介
(共34张PPT)
第1课时 化学反应历程与化学反应速率
第2章 第3节
1.了解反应历程、基元反应的概念。
2.掌握化学反应速率的表示方法及简单计算(重、难点)。
3.了解常用的化学反应速率测定原理及方法。
学习目标
化学反应是有历程的
一
联想·质疑
化学反应的限度越大,是否意味着化学反应的速率越大?
常温常压下,反应:2H2(g) +O2(g)===2H2O(l)
化学平衡常数(K )数量级高达1083。
表明:常温常压下,该反应正向进行的趋势极大。
事实:
1. 常温常压下,即使经过几千年,氢气和氧气的混合气也不会发生反应。
2. 点燃条件下,混合气发生爆炸,反应瞬间完成。
这说明,在研究化学反应时,只关注反应的方向和限度是不够的,还要考虑化学反应的速率。
化学反应为何什么会有快有慢?化学反应是怎样进行的?怎样定量地表示化学反应速率?反应条件的改变是怎样影响化学反应速率的?
石油的形成
思考讨论
气体爆炸
绝大多数的化学反应,并不是简单一步就完成的,化学反应是有历程的。
Na2S2O3与H2SO4反应
2H2(g)+O2(g) ====== 2H2O(l)
点燃或催化剂
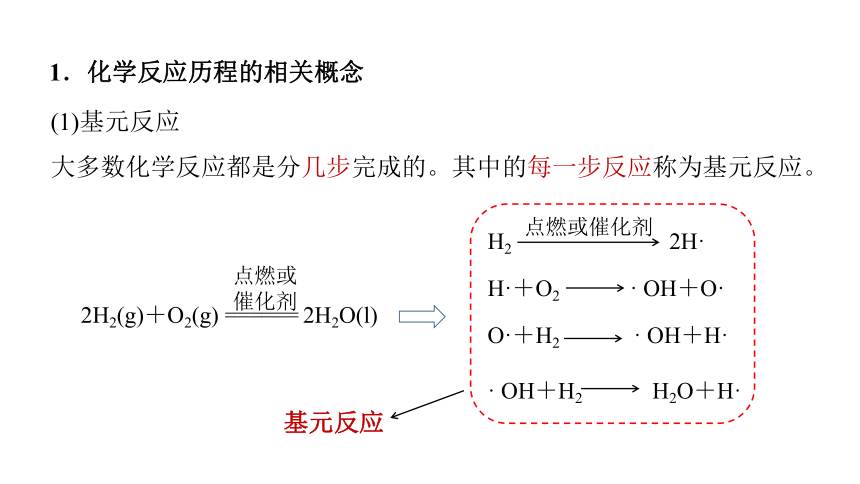
1.化学反应历程的相关概念
(1)基元反应
大多数化学反应都是分几步完成的。其中的每一步反应称为基元反应。
基元反应
H2 2H·
点燃或催化剂
H·+O2 · OH+O·
O·+H2 · OH+H·
· OH+H2 H2O+H·
(3)复杂反应和简单反应
总反应
复杂反应
简单反应
基元反应的总和
由几个基元反应组成的总反应。
平常所写的化学方程式是总反应的化学方程式
反应物一步直接转化为反应产物的化学反应,
其总反应就是基元反应(例:H++OH-===H2O)
(2)反应历程
基元反应构成的反应序列称为反应历程(又称反应机理)。
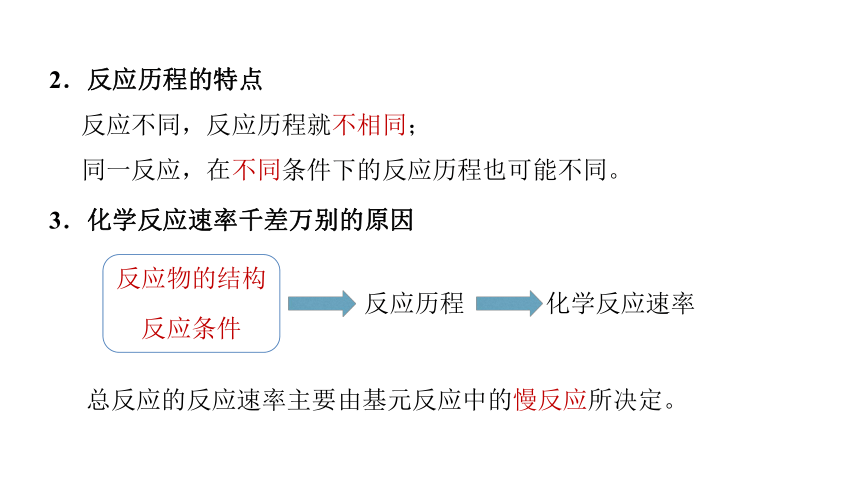
2.反应历程的特点
反应不同,反应历程就不相同;
同一反应,在不同条件下的反应历程也可能不同。
3.化学反应速率千差万别的原因
总反应的反应速率主要由基元反应中的慢反应所决定。
反应物的结构
反应条件
反应历程
化学反应速率
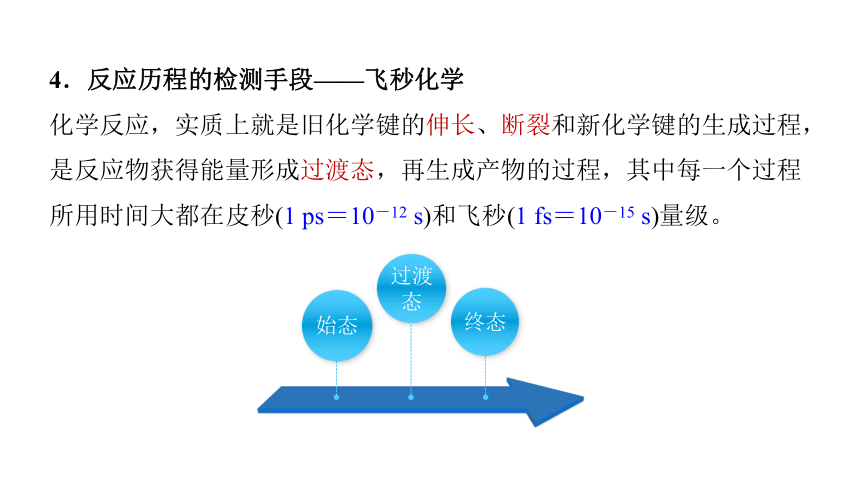
4.反应历程的检测手段——飞秒化学
化学反应,实质上就是旧化学键的伸长、断裂和新化学键的生成过程,是反应物获得能量形成过渡态,再生成产物的过程,其中每一个过程所用时间大都在皮秒(1 ps=10-12 s)和飞秒(1 fs=10-15 s)量级。
过渡态
终态
始态
要实现对反应过程的检测,必须使用时间标度为飞秒量级的手段,如超短脉冲激光技术。
艾哈迈德·泽维尔
国际著名的物理化学专家和飞秒化学学科的创始人。
1999年诺贝尔化学奖授予埃及出生的科学家艾哈迈德·泽维尔(Ahmed H.Zewail),以表彰他应用超短激光闪光成照技术观看到分子中的原子在化学反应中如何运动,从而有助于人们理解和预期重要的化学反应,为整个化学及其相关科学带来了一场革命。
思考交流
1.正误判断
(1)所有的化学反应,都是反应物先断键变成单个原子,然后原子再重新结合成新的物质
(2)同一化学反应,不同条件下,可能有不同的反应历程
(3)若一个化学反应分多步完成,总反应的快慢由基元反应中最慢的一步决定
(4)H++OH-===H2O既是基元反应又是总反应
×
√
√
√
思考交流
2.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)Mn2+反应前后都存在,是该反应的_______。
(2)该反应的中间体有_____________。
(3)该反应的总反应的方程式为__________________________。
催化剂
Mn3+、Mn4+
思考交流
3.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+H·;
②___________________________;
③CH4+H·―→·CH3+H2;
④·CH3+H·―→CH4。
补充反应②的方程式。
·CH3+CH4―→CH3—CH3+H·
烷烃的热分解反应是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷。
化学反应速率的表示方法与简单计算
二
活动·探究
化学反应速率的表示方法
截取三根镁条,分别称重,再让它们分别与浓度不同的过量盐酸反应,你认为可以有哪些方式表示该化学反应的速率呢?
镁条消失的快慢
产生气泡的快慢
H+浓度减小的快慢
Mg2+浓度增加的快慢
1.化学反应速率的表示方法
(1)表示方法
对于反应体系体积不变的化学反应aA+bB===dD+eE,可以用单位时间内某物质浓度(或质量、物质的量等)的改变量(取绝对值)来表示。
(2)数学表达式及单位
v(A)=
单位:mol·L-1·s-1或mol·L-1·min-1
表达式:
提醒
①不能用固体或纯液体的浓度变化表示反应速率。
②反应速率表示一段时间内反应的平均速率。
②各物质表示的化学反应速率的数值之比等于化学方程式中各物质化学式前的系数之比。
(3)特点
①同一反应选用不同的反应物或反应产物表示化学反应速率,数值可能不同,但表示的意义相同。
v(A)∶v(B)∶v(D)∶v(E)=a∶b∶d∶e
aA+bB===dD+eE
(4)统一起见的化学反应速率
①定义式
②优点:对于一个化学反应来说,无论用哪一种物质表示,化学反应速率都相同。
2.化学反应速率计算的常用方法
(1)列“三段式”法
利用转化量之比等于化学计量数之比建立各数据间的关系。如:
mA(g)+nB(g) pC(g)
起始/(mol·L-1) a b c
v(A)= mol·L-1·s-1;
v(B)= mol·L-1·s-1;
v(C)= mol·L-1·s-1。
(2)利用速率之比=化学计量数之比计算。
2.化学反应速率计算的常用方法
(1)列“三段式”法
思考交流
1.正误判断
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显
(3)测定某化学反应从开始到8秒末的反应速率,指的是8秒末的瞬时速率
(4)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越大
×
×
×
×
思考交流
2.根据如图所示图像填空:
(1)反应物是______,反应产物是___。
(2)在2 min内用A、B、C表示的化学反应速率
分别为_______________、_______________、
________________。
(3)该化学反应的反应速率v=________________。
A、B
C
3 mol·L-1·min-1
2 mol·L-1·min-1
3 mol·L-1·min-1
1 mol·L-1·min-1
思考交流
3.在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g)。在0~3 min内,各物质的物质的量变化如下表所示:
物质 时间 X Y Z Q
起始/mol 0.7 1
2 min末/mol 0.8 2.7 0.8 2.7
3 min末/mol 0.8
(1)起始时n(Y)=_______,n(Q)=_______。
2.3 mol
3.0 mol
|Δn(Q)|=0.3 mol
→
思考交流
(2)化学方程式中m=___,n=___,p=___,q=___。
1
4
2
3
物质 时间 X Y Z Q
起始/mol 0.7 1
2 min末/mol 0.8 2.7 0.8 2.7
3 min末/mol 0.8
3
2.3
(3)用Z表示2 min内的反应速率为__________________。
0.05 mol·L-1·min-1
=
v(Q)=0.075 mol·L-1·min-1
(4)2 min末Q的转化率为_____。
10%
化学反应速率的测定
三
思考交流
除浓度外,还可以通过测定哪些物理量来表示化学反应速率?
气体的体积
体系的压强
颜色的深浅
导电能力
光的吸收
化学反应速率如何测定?
v(A)=
1.测定原理
由于物质的某些物理性质(如压强、体积、吸光度、电导率等)与其物质的量或浓度存在函数关系,因此人们常用物理方法,通过准确而快速地测定反应物或反应产物浓度的变化来确定化学反应速率。
2.测定方法
(1)量气法:通过测量释放出一定体积的气体的时间来测定反应速率,或测定一定时间内气体压强的变化来测定反应速率。
(2)比色法:用分光光度计测量物质对特定波长光波的吸光度,从而测定参与反应的某一物质的浓度,据此计算化学反应速率。
(3)电导法:根据离子导电能力的差异,可以通过电导率的变化测定反应物中离子浓度的变化,进而计算化学反应速率。
思考交流
1.下列方法能实现对应化学反应速率测定的是__________(填序号)。
化学反应 一定时间内
① CO(g)+H2O(g)===CO2(g)+H2(g) 用压力传感器测量反应前后体系压强变化
② Mg+2HCl===MgCl2+H2↑ 用分析天平称量镁条反应前后的质量变化
③ H2O2+2HI===2H2O+I2 用比色计测量反应前后颜色深浅
④ Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O 用浊度计测量反应前后浊度变化
⑤ 2H2O2 2H2O+O2↑ 用注射器收集反应后气体体积
②③④⑤
反应前后压强不变
思考交流
2.某温度下6.5 g锌粒与40 mL 2.5 mol·L-1的硫酸反应,用时10 s时恰好收集H2体积44.8 mL (0 ℃、101 kPa条件下)。
(1)请计算用H+、Zn2+变化表示的化学反应速率。
思考交流
依据离子方程式可知:Zn~2H+~Zn2+~H2,
|Δn(Zn2+)|=|Δn(H2)|=0.002 mol,|Δn(H+)|=2|Δn(H2)|=0.004 mol,
思考交流
0.000 2
2.某温度下6.5 g锌粒与40 mL 2.5 mol·L-1的硫酸反应,用时10 s时恰好收集H2体积44.8 mL (0 ℃、101 kPa条件下)。
(2)为了方便也可以用单位时间内产生H2的物质的量表示该反应的反应速率,则10 s内该反应的速率v(H2)= mol·s-1。
思考交流
3.密闭容器中有气体参与的化学反应,通常可测量气体压强变化来测定化学反应的速率。
如某温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48 kPa,发生反应CO2(g)+H2(g) HCOOH(g),6 min时容器压强变为36 kPa,则0~6 min内用H2分压表示的化学反应速率为___kPa·min-1(气体分压=总压×物质的量分数)。
2
第1课时 化学反应历程与化学反应速率
第2章 第3节
1.了解反应历程、基元反应的概念。
2.掌握化学反应速率的表示方法及简单计算(重、难点)。
3.了解常用的化学反应速率测定原理及方法。
学习目标
化学反应是有历程的
一
联想·质疑
化学反应的限度越大,是否意味着化学反应的速率越大?
常温常压下,反应:2H2(g) +O2(g)===2H2O(l)
化学平衡常数(K )数量级高达1083。
表明:常温常压下,该反应正向进行的趋势极大。
事实:
1. 常温常压下,即使经过几千年,氢气和氧气的混合气也不会发生反应。
2. 点燃条件下,混合气发生爆炸,反应瞬间完成。
这说明,在研究化学反应时,只关注反应的方向和限度是不够的,还要考虑化学反应的速率。
化学反应为何什么会有快有慢?化学反应是怎样进行的?怎样定量地表示化学反应速率?反应条件的改变是怎样影响化学反应速率的?
石油的形成
思考讨论
气体爆炸
绝大多数的化学反应,并不是简单一步就完成的,化学反应是有历程的。
Na2S2O3与H2SO4反应
2H2(g)+O2(g) ====== 2H2O(l)
点燃或催化剂
1.化学反应历程的相关概念
(1)基元反应
大多数化学反应都是分几步完成的。其中的每一步反应称为基元反应。
基元反应
H2 2H·
点燃或催化剂
H·+O2 · OH+O·
O·+H2 · OH+H·
· OH+H2 H2O+H·
(3)复杂反应和简单反应
总反应
复杂反应
简单反应
基元反应的总和
由几个基元反应组成的总反应。
平常所写的化学方程式是总反应的化学方程式
反应物一步直接转化为反应产物的化学反应,
其总反应就是基元反应(例:H++OH-===H2O)
(2)反应历程
基元反应构成的反应序列称为反应历程(又称反应机理)。
2.反应历程的特点
反应不同,反应历程就不相同;
同一反应,在不同条件下的反应历程也可能不同。
3.化学反应速率千差万别的原因
总反应的反应速率主要由基元反应中的慢反应所决定。
反应物的结构
反应条件
反应历程
化学反应速率
4.反应历程的检测手段——飞秒化学
化学反应,实质上就是旧化学键的伸长、断裂和新化学键的生成过程,是反应物获得能量形成过渡态,再生成产物的过程,其中每一个过程所用时间大都在皮秒(1 ps=10-12 s)和飞秒(1 fs=10-15 s)量级。
过渡态
终态
始态
要实现对反应过程的检测,必须使用时间标度为飞秒量级的手段,如超短脉冲激光技术。
艾哈迈德·泽维尔
国际著名的物理化学专家和飞秒化学学科的创始人。
1999年诺贝尔化学奖授予埃及出生的科学家艾哈迈德·泽维尔(Ahmed H.Zewail),以表彰他应用超短激光闪光成照技术观看到分子中的原子在化学反应中如何运动,从而有助于人们理解和预期重要的化学反应,为整个化学及其相关科学带来了一场革命。
思考交流
1.正误判断
(1)所有的化学反应,都是反应物先断键变成单个原子,然后原子再重新结合成新的物质
(2)同一化学反应,不同条件下,可能有不同的反应历程
(3)若一个化学反应分多步完成,总反应的快慢由基元反应中最慢的一步决定
(4)H++OH-===H2O既是基元反应又是总反应
×
√
√
√
思考交流
2.由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现:①Ce4++Mn2+―→Ce3++Mn3+;②Ce4++Mn3+―→Ce3++Mn4+;③Ti++Mn4+―→Ti3++Mn2+。由此可知:
(1)Mn2+反应前后都存在,是该反应的_______。
(2)该反应的中间体有_____________。
(3)该反应的总反应的方程式为__________________________。
催化剂
Mn3+、Mn4+
思考交流
3.甲烷气相热分解反应的化学方程式为2CH4―→CH3—CH3+H2,该反应的机理如下:
①CH4―→·CH3+H·;
②___________________________;
③CH4+H·―→·CH3+H2;
④·CH3+H·―→CH4。
补充反应②的方程式。
·CH3+CH4―→CH3—CH3+H·
烷烃的热分解反应是典型的自由基反应,自由基反应一般经历链引发、链传递、链终止的过程,故第二步反应属于链传递环节,产物中还有自由基生成,且生成物有乙烷。
化学反应速率的表示方法与简单计算
二
活动·探究
化学反应速率的表示方法
截取三根镁条,分别称重,再让它们分别与浓度不同的过量盐酸反应,你认为可以有哪些方式表示该化学反应的速率呢?
镁条消失的快慢
产生气泡的快慢
H+浓度减小的快慢
Mg2+浓度增加的快慢
1.化学反应速率的表示方法
(1)表示方法
对于反应体系体积不变的化学反应aA+bB===dD+eE,可以用单位时间内某物质浓度(或质量、物质的量等)的改变量(取绝对值)来表示。
(2)数学表达式及单位
v(A)=
单位:mol·L-1·s-1或mol·L-1·min-1
表达式:
提醒
①不能用固体或纯液体的浓度变化表示反应速率。
②反应速率表示一段时间内反应的平均速率。
②各物质表示的化学反应速率的数值之比等于化学方程式中各物质化学式前的系数之比。
(3)特点
①同一反应选用不同的反应物或反应产物表示化学反应速率,数值可能不同,但表示的意义相同。
v(A)∶v(B)∶v(D)∶v(E)=a∶b∶d∶e
aA+bB===dD+eE
(4)统一起见的化学反应速率
①定义式
②优点:对于一个化学反应来说,无论用哪一种物质表示,化学反应速率都相同。
2.化学反应速率计算的常用方法
(1)列“三段式”法
利用转化量之比等于化学计量数之比建立各数据间的关系。如:
mA(g)+nB(g) pC(g)
起始/(mol·L-1) a b c
v(A)= mol·L-1·s-1;
v(B)= mol·L-1·s-1;
v(C)= mol·L-1·s-1。
(2)利用速率之比=化学计量数之比计算。
2.化学反应速率计算的常用方法
(1)列“三段式”法
思考交流
1.正误判断
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显
(3)测定某化学反应从开始到8秒末的反应速率,指的是8秒末的瞬时速率
(4)同一化学反应,相同条件下用不同物质表示的反应速率,数值越大,表示化学反应速率越大
×
×
×
×
思考交流
2.根据如图所示图像填空:
(1)反应物是______,反应产物是___。
(2)在2 min内用A、B、C表示的化学反应速率
分别为_______________、_______________、
________________。
(3)该化学反应的反应速率v=________________。
A、B
C
3 mol·L-1·min-1
2 mol·L-1·min-1
3 mol·L-1·min-1
1 mol·L-1·min-1
思考交流
3.在2 L密闭容器中进行反应:mX(g)+nY(g) pZ(g)+qQ(g)。在0~3 min内,各物质的物质的量变化如下表所示:
物质 时间 X Y Z Q
起始/mol 0.7 1
2 min末/mol 0.8 2.7 0.8 2.7
3 min末/mol 0.8
(1)起始时n(Y)=_______,n(Q)=_______。
2.3 mol
3.0 mol
|Δn(Q)|=0.3 mol
→
思考交流
(2)化学方程式中m=___,n=___,p=___,q=___。
1
4
2
3
物质 时间 X Y Z Q
起始/mol 0.7 1
2 min末/mol 0.8 2.7 0.8 2.7
3 min末/mol 0.8
3
2.3
(3)用Z表示2 min内的反应速率为__________________。
0.05 mol·L-1·min-1
=
v(Q)=0.075 mol·L-1·min-1
(4)2 min末Q的转化率为_____。
10%
化学反应速率的测定
三
思考交流
除浓度外,还可以通过测定哪些物理量来表示化学反应速率?
气体的体积
体系的压强
颜色的深浅
导电能力
光的吸收
化学反应速率如何测定?
v(A)=
1.测定原理
由于物质的某些物理性质(如压强、体积、吸光度、电导率等)与其物质的量或浓度存在函数关系,因此人们常用物理方法,通过准确而快速地测定反应物或反应产物浓度的变化来确定化学反应速率。
2.测定方法
(1)量气法:通过测量释放出一定体积的气体的时间来测定反应速率,或测定一定时间内气体压强的变化来测定反应速率。
(2)比色法:用分光光度计测量物质对特定波长光波的吸光度,从而测定参与反应的某一物质的浓度,据此计算化学反应速率。
(3)电导法:根据离子导电能力的差异,可以通过电导率的变化测定反应物中离子浓度的变化,进而计算化学反应速率。
思考交流
1.下列方法能实现对应化学反应速率测定的是__________(填序号)。
化学反应 一定时间内
① CO(g)+H2O(g)===CO2(g)+H2(g) 用压力传感器测量反应前后体系压强变化
② Mg+2HCl===MgCl2+H2↑ 用分析天平称量镁条反应前后的质量变化
③ H2O2+2HI===2H2O+I2 用比色计测量反应前后颜色深浅
④ Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O 用浊度计测量反应前后浊度变化
⑤ 2H2O2 2H2O+O2↑ 用注射器收集反应后气体体积
②③④⑤
反应前后压强不变
思考交流
2.某温度下6.5 g锌粒与40 mL 2.5 mol·L-1的硫酸反应,用时10 s时恰好收集H2体积44.8 mL (0 ℃、101 kPa条件下)。
(1)请计算用H+、Zn2+变化表示的化学反应速率。
思考交流
依据离子方程式可知:Zn~2H+~Zn2+~H2,
|Δn(Zn2+)|=|Δn(H2)|=0.002 mol,|Δn(H+)|=2|Δn(H2)|=0.004 mol,
思考交流
0.000 2
2.某温度下6.5 g锌粒与40 mL 2.5 mol·L-1的硫酸反应,用时10 s时恰好收集H2体积44.8 mL (0 ℃、101 kPa条件下)。
(2)为了方便也可以用单位时间内产生H2的物质的量表示该反应的反应速率,则10 s内该反应的速率v(H2)= mol·s-1。
思考交流
3.密闭容器中有气体参与的化学反应,通常可测量气体压强变化来测定化学反应的速率。
如某温度下,在一刚性密闭容器中,充入等物质的量的CO2和H2,此时容器的压强为48 kPa,发生反应CO2(g)+H2(g) HCOOH(g),6 min时容器压强变为36 kPa,则0~6 min内用H2分压表示的化学反应速率为___kPa·min-1(气体分压=总压×物质的量分数)。
2
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
