高中化学鲁科版(2019)选择性必修一同步课件2.2 化学反应速率与化学平衡综合图像 课件(共20张PPT)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修一同步课件2.2 化学反应速率与化学平衡综合图像 课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 900.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 18:10:55 | ||
图片预览







文档简介
(共20张PPT)
第2课时 化学反应速率与化学
平衡综合图像
第2章 章末复习
1.了解几种常考特殊图像。
2.能提取有效信息综合分析多曲线图像,正确解答相关问题(重、难点)。
学习目标
几种特殊曲线分析
一
例1
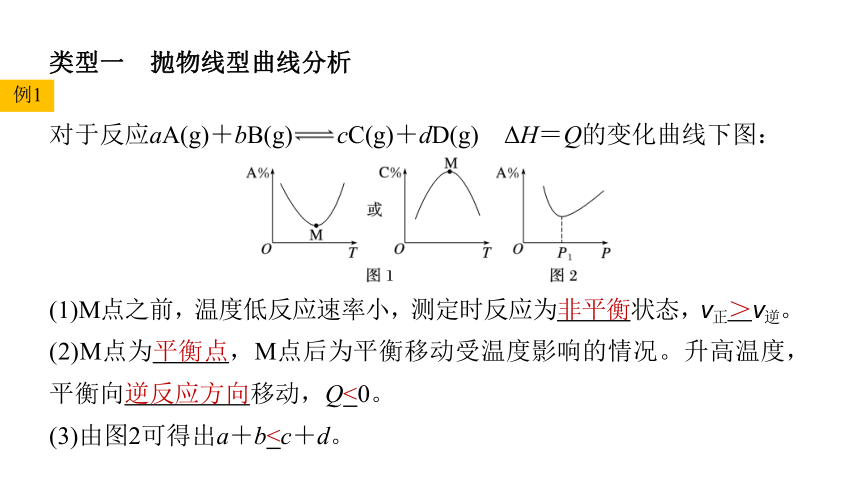
类型一 抛物线型曲线分析
对于反应aA(g)+bB(g) cC(g)+dD(g) ΔH=Q的变化曲线下图:
(1)M点之前,温度低反应速率小,测定时反应为非平衡状态,v正>v逆。
(2)M点为平衡点,M点后为平衡移动受温度影响的情况。升高温度,平衡向逆反应方向移动,Q<0。
(3)由图2可得出a+b例2
向绝热恒容密闭容器中通入SO2和NO2,一定条件下反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示:
(1)反应过程中压强增大(填“增大”“减小”或
“不变”)。
(2)反应物浓度:a点>b点(填“>”“<”或“=”,
下同)。
(3)该反应的焓变ΔH<0。
(4)c点是否是平衡状态:否(填“是”或“否”)。
例3
(1)a=3∶1。
(2)A、B、C三点H2的平衡转化率由大
到小的顺序:αA(H2)>αB(H2)>αC(H2),
三点的平衡常数大小关系:相等。
例4
类型二 曲线及曲线外标记特殊点图像
对于化学反应mA(g)+nB(g) pC(g)+qD(g)(如图),
分析E、F点反应进行的方向。
(1)L线上所有的点都是平衡点,L线上方(E点),A%大于平衡体系的A%,则E点Qv逆。
(2)同理分析,F点Q>K,反应逆向进行,v正对点训练
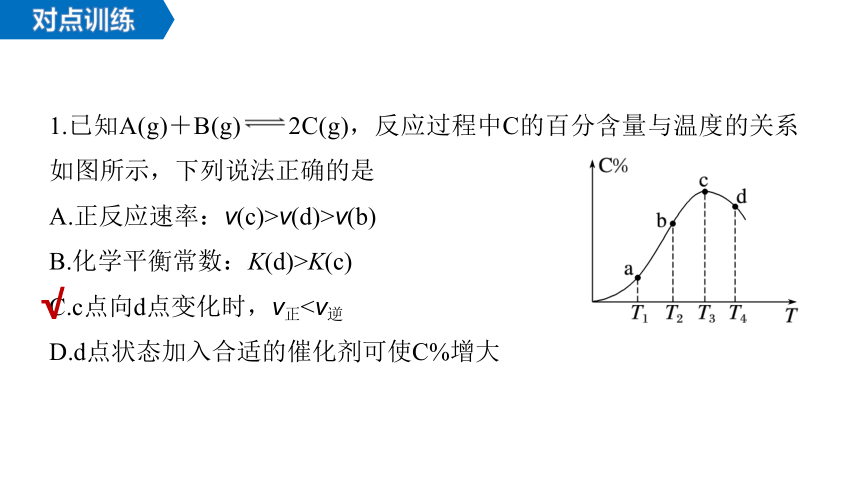
1.已知A(g)+B(g) 2C(g),反应过程中C的百分含量与温度的关系
如图所示,下列说法正确的是
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正D.d点状态加入合适的催化剂可使C%增大
√
对点训练
2.如图是在其他条件一定时,反应:2NO(g)+O2(g) 2NO2(g)中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点。
(1)其中表示已达平衡状态,v正=v逆的点是 。
(2)其中表示未达平衡状态,v正>v逆的点是 。
(3)其中表示未达平衡状态,v正(4)该反应的ΔH 0。
BD
C
AE
<
对点训练
3.如图表示500 ℃、60.0 MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的___点,平衡时N2的体积分数为____。
P
8%
多曲线复杂图像的分析
二
例1
类型一 与平衡移动有关的多曲线图像分析
X代表温度,A1>(填“>”“<”或“=”)A2,判断依据是温度相同时,增大CS2(g)的投料,平衡正向移动,H2O(g)的平衡转化率升高。
例2
2HI(g) H2(g)+I2(g) ΔH>0,v正~x(HI)和v逆~x(H2)的关系可用如图表示。
当升高到某一温度时,反应重新达到平衡,相应的点分别为____(填字母)。
答案 AE
当v正=v逆时为平衡状态,升高温度正、逆反应速率均增大,对应两点在1.6上面,升高温度,平衡向正反应方向移动,x(HI)减小(A点符合),x(H2)增大(E点符合)。
例3
类型二 根据图像判断催化效率或反应的选择性
采用一种新型的催化剂(主要成分是Cu-Mn
的合金),利用CO和H2制备二甲醚(DME)。
主反应:2CO(g)+4H2(g) CH3OCH3(g)
+H2O(g)
副反应:CO(g)+H2O(g) CO2(g)+H2(g)、CO(g)+2H2(g)===CH3OH(g)
例4
丙烷催化直接脱氢反应:
主反应:C3H8(g) C3H6(g)+H2(g) ΔH1=+124.3 kJ·mol -1 (ⅰ)
副反应:C3H8(g) C2H4(g)+CH4(g) ΔH2(ⅱ)
(1)反应ⅰ的平衡常数、产物
丙烯选择性、副产物乙烯选
择性与温度的关系如图所示,
分析工业生产中采用的温度
为650 ℃左右的原因是____。
答案 丙烯选择性高,反应速率快,平衡常数大
答案 50
归纳总结
分析复杂图像要做到四看
一看横纵坐标、二看是否平衡态、三看曲线走势关键点、四看方程式的特点(系数、热效应)。
自我测试
1
2
3
1.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高
NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,
则平衡常数K>2 000 mol-1·L
√
自我测试
1
2
3
2.已知:无CO时反应2NO(g) N2(g)+O2(g),有CO时反应2CO(g)+2NO(g) 2CO2(g)+N2(g)。某研究小组以AgZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示。下列说法不正确的是
A.反应2NO(g) N2(g)+O2(g)的ΔH<0
B.X点可以通过更换高效催化剂提高NO的反应速率
C.Y点再通入CO、N2各0.01 mol,此时v正(CO)√
自我测试
1
2
3
3.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)。已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率如图:
放热
不变
当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡左移,正反应为放热反应。平衡常数只与温度有关,不随投料比的变化而变化。
返回
第2课时 化学反应速率与化学
平衡综合图像
第2章 章末复习
1.了解几种常考特殊图像。
2.能提取有效信息综合分析多曲线图像,正确解答相关问题(重、难点)。
学习目标
几种特殊曲线分析
一
例1
类型一 抛物线型曲线分析
对于反应aA(g)+bB(g) cC(g)+dD(g) ΔH=Q的变化曲线下图:
(1)M点之前,温度低反应速率小,测定时反应为非平衡状态,v正>v逆。
(2)M点为平衡点,M点后为平衡移动受温度影响的情况。升高温度,平衡向逆反应方向移动,Q<0。
(3)由图2可得出a+b
向绝热恒容密闭容器中通入SO2和NO2,一定条件下反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示:
(1)反应过程中压强增大(填“增大”“减小”或
“不变”)。
(2)反应物浓度:a点>b点(填“>”“<”或“=”,
下同)。
(3)该反应的焓变ΔH<0。
(4)c点是否是平衡状态:否(填“是”或“否”)。
例3
(1)a=3∶1。
(2)A、B、C三点H2的平衡转化率由大
到小的顺序:αA(H2)>αB(H2)>αC(H2),
三点的平衡常数大小关系:相等。
例4
类型二 曲线及曲线外标记特殊点图像
对于化学反应mA(g)+nB(g) pC(g)+qD(g)(如图),
分析E、F点反应进行的方向。
(1)L线上所有的点都是平衡点,L线上方(E点),A%大于平衡体系的A%,则E点Q
(2)同理分析,F点Q>K,反应逆向进行,v正
1.已知A(g)+B(g) 2C(g),反应过程中C的百分含量与温度的关系
如图所示,下列说法正确的是
A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>K(c)
C.c点向d点变化时,v正
√
对点训练
2.如图是在其他条件一定时,反应:2NO(g)+O2(g) 2NO2(g)中NO的最大转化率与温度的关系曲线。图中坐标有A、B、C、D、E 5点。
(1)其中表示已达平衡状态,v正=v逆的点是 。
(2)其中表示未达平衡状态,v正>v逆的点是 。
(3)其中表示未达平衡状态,v正
BD
C
AE
<
对点训练
3.如图表示500 ℃、60.0 MPa条件下,平衡时NH3的体积分数与原料气投料比的关系。若投料比为4时,氨气的体积分数为40%,NH3的体积分数可能为图中的___点,平衡时N2的体积分数为____。
P
8%
多曲线复杂图像的分析
二
例1
类型一 与平衡移动有关的多曲线图像分析
X代表温度,A1>(填“>”“<”或“=”)A2,判断依据是温度相同时,增大CS2(g)的投料,平衡正向移动,H2O(g)的平衡转化率升高。
例2
2HI(g) H2(g)+I2(g) ΔH>0,v正~x(HI)和v逆~x(H2)的关系可用如图表示。
当升高到某一温度时,反应重新达到平衡,相应的点分别为____(填字母)。
答案 AE
当v正=v逆时为平衡状态,升高温度正、逆反应速率均增大,对应两点在1.6上面,升高温度,平衡向正反应方向移动,x(HI)减小(A点符合),x(H2)增大(E点符合)。
例3
类型二 根据图像判断催化效率或反应的选择性
采用一种新型的催化剂(主要成分是Cu-Mn
的合金),利用CO和H2制备二甲醚(DME)。
主反应:2CO(g)+4H2(g) CH3OCH3(g)
+H2O(g)
副反应:CO(g)+H2O(g) CO2(g)+H2(g)、CO(g)+2H2(g)===CH3OH(g)
例4
丙烷催化直接脱氢反应:
主反应:C3H8(g) C3H6(g)+H2(g) ΔH1=+124.3 kJ·mol -1 (ⅰ)
副反应:C3H8(g) C2H4(g)+CH4(g) ΔH2(ⅱ)
(1)反应ⅰ的平衡常数、产物
丙烯选择性、副产物乙烯选
择性与温度的关系如图所示,
分析工业生产中采用的温度
为650 ℃左右的原因是____。
答案 丙烯选择性高,反应速率快,平衡常数大
答案 50
归纳总结
分析复杂图像要做到四看
一看横纵坐标、二看是否平衡态、三看曲线走势关键点、四看方程式的特点(系数、热效应)。
自我测试
1
2
3
1.在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g) 2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高
NO的转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO的转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO的平衡转化率为50%,
则平衡常数K>2 000 mol-1·L
√
自我测试
1
2
3
2.已知:无CO时反应2NO(g) N2(g)+O2(g),有CO时反应2CO(g)+2NO(g) 2CO2(g)+N2(g)。某研究小组以AgZSM为催化剂,在容积为1 L的容器中,相同时间下测得0.1 mol NO转化为N2的转化率随温度变化如图所示。下列说法不正确的是
A.反应2NO(g) N2(g)+O2(g)的ΔH<0
B.X点可以通过更换高效催化剂提高NO的反应速率
C.Y点再通入CO、N2各0.01 mol,此时v正(CO)
自我测试
1
2
3
3.将燃煤废气中的CO2转化为二甲醚的反应原理为2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)。已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率如图:
放热
不变
当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡左移,正反应为放热反应。平衡常数只与温度有关,不随投料比的变化而变化。
返回
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
