高中化学鲁科版(2019)选择性必修一同步课件 2.3.2 浓度、压强、温度对化学反应速率的影响 课件(共37张PPT)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修一同步课件 2.3.2 浓度、压强、温度对化学反应速率的影响 课件(共37张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
第2课时 浓度、压强、温度对
化学反应速率的影响
第2章 第3节
1.掌握浓度、压强、温度对化学反应速率的影响规律(重点)。
2.了解速率常数、活化能、活化分子、有效碰撞的含义。
3.能用速率方程、过渡态理论解释浓度、压强、温度对化学反应速率的影响(难点)。
学习目标
安全气囊弹出时间约为0.03s
钟乳石每年平均增长3毫米
新课导入
气泡溢出的快慢
温度变化的快慢
质量变化的快慢
颜色变化的快慢
哪些现象可以描述反应的快慢?
基于经验思考影响化学反应快慢的因素有哪些呢?
浓度、压强对化学反应速率的影响
一
1.浓度对化学反应速率影响的定性规律
对于很多化学反应,只改变浓度:
增大反应物的浓度可以加快化学反应速率
减小反应物的浓度可以减慢化学反应速率
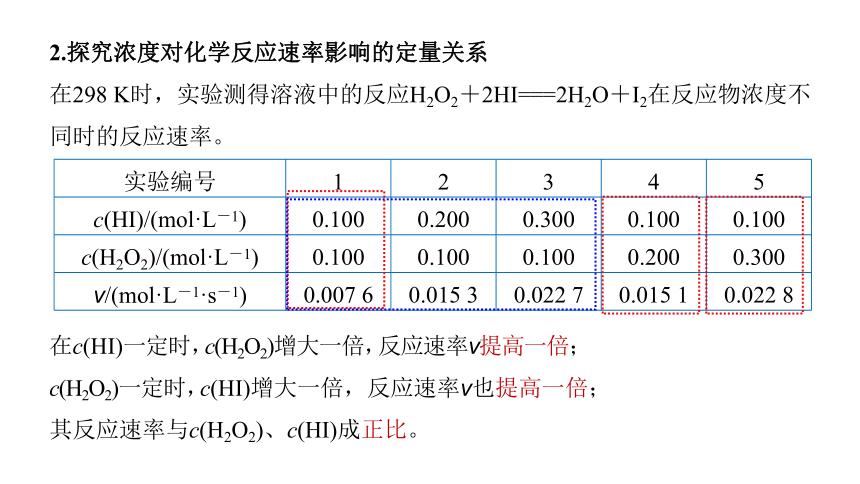
2.探究浓度对化学反应速率影响的定量关系
在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在反应物浓度不同时的反应速率。
实验编号 1 2 3 4 5
c(HI)/(mol·L-1) 0.100 0.200 0.300 0.100 0.100
c(H2O2)/(mol·L-1) 0.100 0.100 0.100 0.200 0.300
v/(mol·L-1·s-1) 0.007 6 0.015 3 0.022 7 0.015 1 0.022 8
在c(HI)一定时,c(H2O2)增大一倍,反应速率v提高一倍;
c(H2O2)一定时,c(HI)增大一倍,反应速率v也提高一倍;
其反应速率与c(H2O2)、c(HI)成正比。
3.速率方程和速率常数
(1)速率方程可以表示化学反应速率与反应物浓度之间的定量关系。
v=kc(H2O2)·c(HI)
其中k为反应速率常数
注意:①速率方程表示的速率是某时刻的速率,不是平均速率。
②速率方程是由实验测定的结果,与化学方程式的系数无确定的关系。增大不同反应物的浓度,对反应速率的影响程度不一定相同。
(2)反应速率常数(k)
含义:
意义:
影响因素:
表示单位浓度下的化学反应速率。
通常反应速率常数k越大,反应进行得越快。
与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
4.压强对化学反应速率的影响
(1)对于气体参与的化学反应,在温度、体积一定的条件下,压强与浓度成正比。
压缩体积,压强增大
化学反应速率增大
实质:反应物浓度发生变化
反应物浓度增大
反之,压强减小,化学反应速率减小。
(2)压强对化学反应速率的影响规律
(3)对于只涉及液体和固体的反应,压强的改变对反应速率几乎没有影响。
思考交流
1.正误判断
(1)在其他条件不变时,增大反应物的浓度,正反应速率增大,逆反应速率减小,平衡正向移动
(2)任何反应,增大压强,反应速率一定增大
(3)在恒温、恒容条件下,H2(g)+Cl2(g)===2HCl(g),v=kc(H2)· ,充入相同物质的量的H2或Cl2,对化学反应速率的影响程度相同
(4)压强对反应速率的影响是通过浓度的改变影响的
(5)一定温度下,用相同质量的锌粉和锌片与同浓度的足量盐酸反应,前者反应速率常数较大
(6)依据方程式CO+NO2===CO2+NO,可知反应速率方程为v=kc(CO)·c(NO2)
×
×
×
√
√
×
思考交流
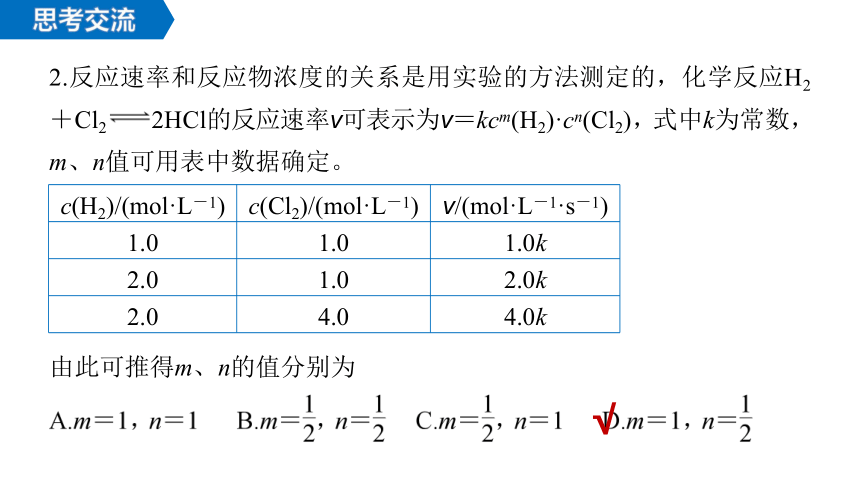
2.反应速率和反应物浓度的关系是用实验的方法测定的,化学反应H2+Cl2 2HCl的反应速率v可表示为v=kcm(H2)·cn(Cl2),式中k为常数,m、n值可用表中数据确定。
c(H2)/(mol·L-1) c(Cl2)/(mol·L-1) v/(mol·L-1·s-1)
1.0 1.0 1.0k
2.0 1.0 2.0k
2.0 4.0 4.0k
由此可推得m、n的值分别为
√
思考交流
3.对于反应:N2(g)+3H2(g) 2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率_____,原因是_____
___________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,容器内总压强_____,反应速率_____,原因是容积不变,充入氦气,______________________________
_____________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率_____,原因是压强不变,充入氦气,容积_____,反应物_________________________________。
(4)恒温条件下,增大容器体积,正反应速率减小,逆反应速率_____。
增大
容积
不变,充入氮气,反应物氮气的浓度增大,反应速率增大
增大
不变
反应物氮气、氢气的浓度均未变,
反应速率不变
减小
增大
氮气、氢气的浓度减小,反应速率减小
减小
归纳总结
充入惰性气体对化学反应速率的影响
温度对化学反应速率的影响
二
1.温度对化学反应速率影响的经验规律
(1)对于大多数反应,当其他条件不变时,升高温度,化学反应速率加快,降低温度,化学反应速率减慢。
(2)范托夫近似规律:对于在溶液中发生的反应,
温度每升高10 K,反应速率提高到原来的2~4倍。
利用这个经验规律,可以对一些化学反应的速率
做粗略的估计。
雅各布斯·亨里克斯·范托夫
(3)阿伦尼乌斯经验公式:
当Ea>0时,升高温度,反应速率常数增大,化学反应速率随之提高。
Ea值越大,改变温度对反应速率的影响程度越大。
k为反应速率常数
Ea为活化能
k=
2.探究温度对化学反应速率影响的科学规律
下表列出了一些反应在308 K和298 K时的反应速率常数之比。
化学反应
NO+O3===NO2+O2 1.15
H2+I2===2HI(气体反应) 8.99
NH4CNO===CO(NH2)2 3.58
(1)温度会影响反应速率常数(k),从而影响化学反应速率。
(2) 对于大多数反应,当其他条件不变时,升高温度,k增大,化学反应速率增大,降低温度,k减小,化学反应速率减小。温度对不同反应的反应速率的影响程度不同。
3.基元反应过渡态理论解释“温度对化学反应速率的影响”
(1)基元反应过渡态理论认为:基元反应在从反应物到产物的变化过程中要经历一个高能量的中间状态,这个状态称为过渡态。此时旧键没有完全断裂、新键没有完全形成,如
(2)活化能
概念:
过渡态的能量与反应物的平均能量之差,用Ea表示。
单位:
J·mol-1或kJ·mol-1
意义:
活化能的存在是化学反应通常需要获得能量才能实际发生的原因。
与反应速率之间的关系:
不同的基元反应活化能(Ea)大小不同,因此化学反应速率不同。活化能越高,反应越难发生
如图
活化能
释放的能量
反应热
(3)解释温度对化学反应速率的影响
升高温度可以提高反应物分子的能量,增大反应物之间的碰撞频率,增大反应物分子形成过渡态的比例,因此升高温度可以提高化学反应速率。
思考交流
1.正误判断
(1)升高温度,反应的活化能减小,反应速率加快
(2)温度升高时,对放热反应和吸热反应速率的影响程度是一样的
(3)温度越高单位时间内反应物之间的碰撞频率越大,越过渡态的分子比例越大,反应速率越大
(4)对于COCl2(g) CO(g)+Cl2(g) ΔH>0,升温能加快正反应速率,降低逆反应速率
×
×
√
×
思考交流
2.反应A+B―→C的反应速率方程为v=kc(A)·c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1 mol·L-1时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c(A)时,v值增大 B.只增大c(A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
√
思考交流
3.某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,得到如下数据和图像。已知:反应速率为反应物浓度和速率常数k的函数,Ea为活化能。对于所研究的三个反应,下列说法错误的是
反应 Ea/(kJ·mol-1)
As+N2O―→AsO+N2 78.45
As+NO2―→AsO+NO 2.58
As+NO―→AsO+N 155.85
思考交流
A.相同条件下的氧化性:NO2>NO
B.相同条件下,As与NO的反应速率最慢
C.升高温度能增大As与N2O反应的活化能
D.其他条件不变,改变温度不能显著改变
As与NO2的反应速率
√
拓展延伸
基元反应碰撞理论简介
1.有效碰撞理论
(1)基元反应发生的先决条件:反应物的分子之间必须发生碰撞。
但并不是每一次碰撞都能发生化学反应。
(2)有效碰撞
拓展延伸
(2)有效碰撞
①概念:能够发生化学反应的碰撞
②条件:足够的能量;合适的取向
③与反应速率的关系:
碰撞频率越高,反应速率越快。
能量不足
取向不合适
有效碰撞
(3) 活化分子:能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,
反应物分子中活化分子的百分数是一定的。
拓展延伸
2.有效碰撞与反应速率的关系
改变条件
单位时间内、单位体积内有效碰撞次数增多或减少
化学反应速率增大或减小
问题思考:
化学反应速率与活化分子有什么关系?根据有效碰撞理论,联系化学反应速率的影响因素,讨论各因素是如何影响化学反应速率的。
拓展延伸
3.用有效碰撞理论解释影响化学反应速率的因素
(1)浓度、压强对化学反应速率的影响
增大反应物浓度
单位体积内分子总数增多,活化分子百分数不变,单位体积内活化分子数增多
单位时间内、
单位体积内有效碰撞
次数增加
化学反应速率增大
增大压强
(相当于增大浓度)
拓展延伸
(2)温度对化学反应速率的影响
升温
(体系能量升高)
单位体积内分子总数不变,活化分子百分数增多,活化分子数增加
单位时间内、
单位体积内
有效碰撞
次数增加
化学反应速率增大
思考交流
1.正误判断
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应
(2)减小反应物的浓度,使活化分子百分数减小,化学反应速率减小
(3)温度不变,减小气体的压强,单位体积内活化分子数减小,化学反应速率一定减小
(4)降低放热反应体系的温度,活化分子百分数减小,化学反应速率一定减小
√
×
√
√
思考交流
2.一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大:_____,原因是_________________________
_______________________。
(2)恒容充入He:_____,原因是_________________________。
增大
单位体积内活化分子数目增
多,有效碰撞的次数增加
不变
单位体积内活化分子数不变
自我测试
1
2
3
4
1.下列反应中,温度不变时,缩小容器的体积,化学反应速率不受影响的是
A.(NH4)2SO4(aq)+BaCl2(aq) B.H2(g)+I2(g)
C.NO2(g)+H2O(l) D.Ca(OH)2(aq)+CO2(g)
√
自我测试
1
2
3
4
2.在一密闭容器中充入1 mol H2和1 mol I2,压强为p Pa,并在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0,改变下列条件能加快化学反应速率的是
A.保持容器容积不变,向其中加入1 mol N2(N2不参加反应)
B.保持容器容积不变,向其中加入1 mol H2(g)
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应)
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g)
√
自我测试
1
2
3
4
3.已知C+CO2 2CO的正反应是吸热反应,反应速率为v1;N2+3H2
2NH3的正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
A.都增大 B.都减小
C.v1增大,v2减小 D.v1减小,v2增大
√
温度升高,反应速率增大,与热效应无关,故A正确。
自我测试
1
2
3
4
4.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)=== CO2(g)+NO(g)的反应历程如下,下列有关说法正确的是
A.第二步活化配合物之间的碰撞一定
是有效碰撞
B.活化配合物的能量越高,第一步的
反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
√
第2课时 浓度、压强、温度对
化学反应速率的影响
第2章 第3节
1.掌握浓度、压强、温度对化学反应速率的影响规律(重点)。
2.了解速率常数、活化能、活化分子、有效碰撞的含义。
3.能用速率方程、过渡态理论解释浓度、压强、温度对化学反应速率的影响(难点)。
学习目标
安全气囊弹出时间约为0.03s
钟乳石每年平均增长3毫米
新课导入
气泡溢出的快慢
温度变化的快慢
质量变化的快慢
颜色变化的快慢
哪些现象可以描述反应的快慢?
基于经验思考影响化学反应快慢的因素有哪些呢?
浓度、压强对化学反应速率的影响
一
1.浓度对化学反应速率影响的定性规律
对于很多化学反应,只改变浓度:
增大反应物的浓度可以加快化学反应速率
减小反应物的浓度可以减慢化学反应速率
2.探究浓度对化学反应速率影响的定量关系
在298 K时,实验测得溶液中的反应H2O2+2HI===2H2O+I2在反应物浓度不同时的反应速率。
实验编号 1 2 3 4 5
c(HI)/(mol·L-1) 0.100 0.200 0.300 0.100 0.100
c(H2O2)/(mol·L-1) 0.100 0.100 0.100 0.200 0.300
v/(mol·L-1·s-1) 0.007 6 0.015 3 0.022 7 0.015 1 0.022 8
在c(HI)一定时,c(H2O2)增大一倍,反应速率v提高一倍;
c(H2O2)一定时,c(HI)增大一倍,反应速率v也提高一倍;
其反应速率与c(H2O2)、c(HI)成正比。
3.速率方程和速率常数
(1)速率方程可以表示化学反应速率与反应物浓度之间的定量关系。
v=kc(H2O2)·c(HI)
其中k为反应速率常数
注意:①速率方程表示的速率是某时刻的速率,不是平均速率。
②速率方程是由实验测定的结果,与化学方程式的系数无确定的关系。增大不同反应物的浓度,对反应速率的影响程度不一定相同。
(2)反应速率常数(k)
含义:
意义:
影响因素:
表示单位浓度下的化学反应速率。
通常反应速率常数k越大,反应进行得越快。
与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
4.压强对化学反应速率的影响
(1)对于气体参与的化学反应,在温度、体积一定的条件下,压强与浓度成正比。
压缩体积,压强增大
化学反应速率增大
实质:反应物浓度发生变化
反应物浓度增大
反之,压强减小,化学反应速率减小。
(2)压强对化学反应速率的影响规律
(3)对于只涉及液体和固体的反应,压强的改变对反应速率几乎没有影响。
思考交流
1.正误判断
(1)在其他条件不变时,增大反应物的浓度,正反应速率增大,逆反应速率减小,平衡正向移动
(2)任何反应,增大压强,反应速率一定增大
(3)在恒温、恒容条件下,H2(g)+Cl2(g)===2HCl(g),v=kc(H2)· ,充入相同物质的量的H2或Cl2,对化学反应速率的影响程度相同
(4)压强对反应速率的影响是通过浓度的改变影响的
(5)一定温度下,用相同质量的锌粉和锌片与同浓度的足量盐酸反应,前者反应速率常数较大
(6)依据方程式CO+NO2===CO2+NO,可知反应速率方程为v=kc(CO)·c(NO2)
×
×
×
√
√
×
思考交流
2.反应速率和反应物浓度的关系是用实验的方法测定的,化学反应H2+Cl2 2HCl的反应速率v可表示为v=kcm(H2)·cn(Cl2),式中k为常数,m、n值可用表中数据确定。
c(H2)/(mol·L-1) c(Cl2)/(mol·L-1) v/(mol·L-1·s-1)
1.0 1.0 1.0k
2.0 1.0 2.0k
2.0 4.0 4.0k
由此可推得m、n的值分别为
√
思考交流
3.对于反应:N2(g)+3H2(g) 2NH3(g)
(1)恒温恒容条件下,向反应体系中充入氮气,反应速率_____,原因是_____
___________________________________________________。
(2)恒温恒容条件下,向反应体系中充入氦气,容器内总压强_____,反应速率_____,原因是容积不变,充入氦气,______________________________
_____________。
(3)恒温恒压条件下,向反应体系中充入氦气,反应速率_____,原因是压强不变,充入氦气,容积_____,反应物_________________________________。
(4)恒温条件下,增大容器体积,正反应速率减小,逆反应速率_____。
增大
容积
不变,充入氮气,反应物氮气的浓度增大,反应速率增大
增大
不变
反应物氮气、氢气的浓度均未变,
反应速率不变
减小
增大
氮气、氢气的浓度减小,反应速率减小
减小
归纳总结
充入惰性气体对化学反应速率的影响
温度对化学反应速率的影响
二
1.温度对化学反应速率影响的经验规律
(1)对于大多数反应,当其他条件不变时,升高温度,化学反应速率加快,降低温度,化学反应速率减慢。
(2)范托夫近似规律:对于在溶液中发生的反应,
温度每升高10 K,反应速率提高到原来的2~4倍。
利用这个经验规律,可以对一些化学反应的速率
做粗略的估计。
雅各布斯·亨里克斯·范托夫
(3)阿伦尼乌斯经验公式:
当Ea>0时,升高温度,反应速率常数增大,化学反应速率随之提高。
Ea值越大,改变温度对反应速率的影响程度越大。
k为反应速率常数
Ea为活化能
k=
2.探究温度对化学反应速率影响的科学规律
下表列出了一些反应在308 K和298 K时的反应速率常数之比。
化学反应
NO+O3===NO2+O2 1.15
H2+I2===2HI(气体反应) 8.99
NH4CNO===CO(NH2)2 3.58
(1)温度会影响反应速率常数(k),从而影响化学反应速率。
(2) 对于大多数反应,当其他条件不变时,升高温度,k增大,化学反应速率增大,降低温度,k减小,化学反应速率减小。温度对不同反应的反应速率的影响程度不同。
3.基元反应过渡态理论解释“温度对化学反应速率的影响”
(1)基元反应过渡态理论认为:基元反应在从反应物到产物的变化过程中要经历一个高能量的中间状态,这个状态称为过渡态。此时旧键没有完全断裂、新键没有完全形成,如
(2)活化能
概念:
过渡态的能量与反应物的平均能量之差,用Ea表示。
单位:
J·mol-1或kJ·mol-1
意义:
活化能的存在是化学反应通常需要获得能量才能实际发生的原因。
与反应速率之间的关系:
不同的基元反应活化能(Ea)大小不同,因此化学反应速率不同。活化能越高,反应越难发生
如图
活化能
释放的能量
反应热
(3)解释温度对化学反应速率的影响
升高温度可以提高反应物分子的能量,增大反应物之间的碰撞频率,增大反应物分子形成过渡态的比例,因此升高温度可以提高化学反应速率。
思考交流
1.正误判断
(1)升高温度,反应的活化能减小,反应速率加快
(2)温度升高时,对放热反应和吸热反应速率的影响程度是一样的
(3)温度越高单位时间内反应物之间的碰撞频率越大,越过渡态的分子比例越大,反应速率越大
(4)对于COCl2(g) CO(g)+Cl2(g) ΔH>0,升温能加快正反应速率,降低逆反应速率
×
×
√
×
思考交流
2.反应A+B―→C的反应速率方程为v=kc(A)·c(B),v为反应速率,k为速率常数。当c(A)=c(B)=1 mol·L-1时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c(A)时,v值增大 B.只增大c(A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
√
思考交流
3.某课题组研究煤燃烧过程中氮氧化物与砷反应的微观机理,得到如下数据和图像。已知:反应速率为反应物浓度和速率常数k的函数,Ea为活化能。对于所研究的三个反应,下列说法错误的是
反应 Ea/(kJ·mol-1)
As+N2O―→AsO+N2 78.45
As+NO2―→AsO+NO 2.58
As+NO―→AsO+N 155.85
思考交流
A.相同条件下的氧化性:NO2>NO
B.相同条件下,As与NO的反应速率最慢
C.升高温度能增大As与N2O反应的活化能
D.其他条件不变,改变温度不能显著改变
As与NO2的反应速率
√
拓展延伸
基元反应碰撞理论简介
1.有效碰撞理论
(1)基元反应发生的先决条件:反应物的分子之间必须发生碰撞。
但并不是每一次碰撞都能发生化学反应。
(2)有效碰撞
拓展延伸
(2)有效碰撞
①概念:能够发生化学反应的碰撞
②条件:足够的能量;合适的取向
③与反应速率的关系:
碰撞频率越高,反应速率越快。
能量不足
取向不合适
有效碰撞
(3) 活化分子:能够发生有效碰撞的分子。
对于某一化学反应来说,在一定条件下,
反应物分子中活化分子的百分数是一定的。
拓展延伸
2.有效碰撞与反应速率的关系
改变条件
单位时间内、单位体积内有效碰撞次数增多或减少
化学反应速率增大或减小
问题思考:
化学反应速率与活化分子有什么关系?根据有效碰撞理论,联系化学反应速率的影响因素,讨论各因素是如何影响化学反应速率的。
拓展延伸
3.用有效碰撞理论解释影响化学反应速率的因素
(1)浓度、压强对化学反应速率的影响
增大反应物浓度
单位体积内分子总数增多,活化分子百分数不变,单位体积内活化分子数增多
单位时间内、
单位体积内有效碰撞
次数增加
化学反应速率增大
增大压强
(相当于增大浓度)
拓展延伸
(2)温度对化学反应速率的影响
升温
(体系能量升高)
单位体积内分子总数不变,活化分子百分数增多,活化分子数增加
单位时间内、
单位体积内
有效碰撞
次数增加
化学反应速率增大
思考交流
1.正误判断
(1)当碰撞的分子具有足够的能量和适当的取向时才能发生化学反应
(2)减小反应物的浓度,使活化分子百分数减小,化学反应速率减小
(3)温度不变,减小气体的压强,单位体积内活化分子数减小,化学反应速率一定减小
(4)降低放热反应体系的温度,活化分子百分数减小,化学反应速率一定减小
√
×
√
√
思考交流
2.一定温度下,反应N2(g)+O2(g) 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大:_____,原因是_________________________
_______________________。
(2)恒容充入He:_____,原因是_________________________。
增大
单位体积内活化分子数目增
多,有效碰撞的次数增加
不变
单位体积内活化分子数不变
自我测试
1
2
3
4
1.下列反应中,温度不变时,缩小容器的体积,化学反应速率不受影响的是
A.(NH4)2SO4(aq)+BaCl2(aq) B.H2(g)+I2(g)
C.NO2(g)+H2O(l) D.Ca(OH)2(aq)+CO2(g)
√
自我测试
1
2
3
4
2.在一密闭容器中充入1 mol H2和1 mol I2,压强为p Pa,并在一定温度下使其发生反应:H2(g)+I2(g) 2HI(g) ΔH<0,改变下列条件能加快化学反应速率的是
A.保持容器容积不变,向其中加入1 mol N2(N2不参加反应)
B.保持容器容积不变,向其中加入1 mol H2(g)
C.保持容器内气体压强不变,向其中加入1 mol N2(N2不参加反应)
D.保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g)
√
自我测试
1
2
3
4
3.已知C+CO2 2CO的正反应是吸热反应,反应速率为v1;N2+3H2
2NH3的正反应是放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
A.都增大 B.都减小
C.v1增大,v2减小 D.v1减小,v2增大
√
温度升高,反应速率增大,与热效应无关,故A正确。
自我测试
1
2
3
4
4.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)=== CO2(g)+NO(g)的反应历程如下,下列有关说法正确的是
A.第二步活化配合物之间的碰撞一定
是有效碰撞
B.活化配合物的能量越高,第一步的
反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
√
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
