高中化学鲁科版(2019)选择性必修一同步课件 2.2.4 反应条件对化学平衡的影响(二) 课件(共38张PPT)
文档属性
| 名称 | 高中化学鲁科版(2019)选择性必修一同步课件 2.2.4 反应条件对化学平衡的影响(二) 课件(共38张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 38.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 18:12:56 | ||
图片预览










文档简介
(共38张PPT)
第4课时 反应条件对化学平衡的影响(二)
第2章 第2节
1.通过实验探究掌握浓度、压强对化学平衡的影响规律(重点)。
2.能从浓度商与平衡常数的视角定量解释浓度、压强对化学平衡的影响(难点)。
学习目标
浓度对化学平衡的影响
一
一定温度下,平衡状态
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Q减小
Q<K
平衡正向移动
Q减小
Q<K
平衡正向移动
Q增大
Q>K
平衡逆向移动
Q增大
Q>K
平衡逆向移动
温度一定时,反应aA+bB cC+dD的平衡常数是一个定值。
1.浓度对化学平衡的影响
2.实验探究浓度对化学平衡的影响
实验原理 Fe3++3SCN- Fe(SCN)3(红色)
步骤1 向盛有5 mL 0.01 mol·L-1 FeCl3溶液的试管中加入5 mL 0.01 mol·L-1 KSCN溶液,将上述溶液平均分装在两支试管中
现象
步骤2 向其中一支试管滴加1 mol· L-1 FeCl3溶液4滴,振荡 向另一支试管中滴加1 mol·
L-1 KSCN溶液4滴,振荡
现象
溶液显红色
溶液红色加深
溶液红色加深
实验原理 Fe3++3SCN- Fe(SCN)3(红色)
步骤3 向上述两支试管中各加入少量铁粉,振荡
现象
实验结论
两试管中溶液的红色均变浅
对Fe3++3SCN- Fe(SCN)3的化学平衡,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动;加入铁粉,Fe+2Fe3+=== 3Fe2+,Fe3+浓度减小,平衡逆向移动
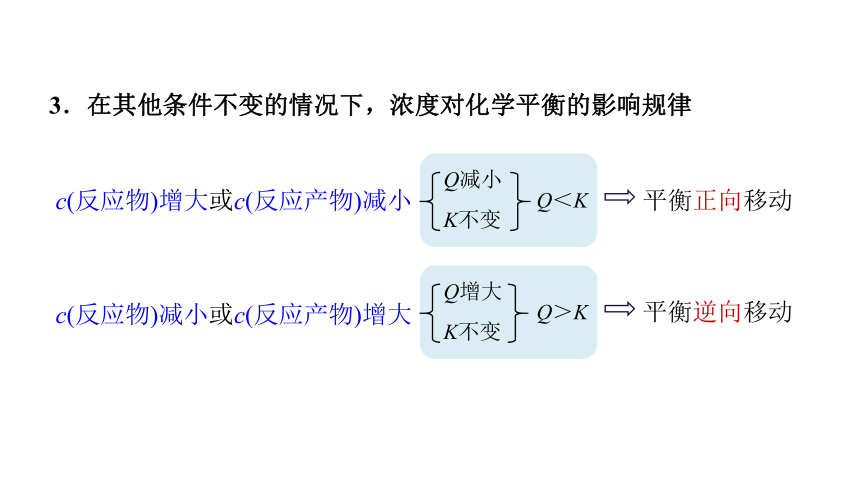
3.在其他条件不变的情况下,浓度对化学平衡的影响规律
c(反应物)增大或c(反应产物)减小
c(反应物)减小或c(反应产物)增大
平衡正向移动
Q减小
K不变
Q<K
平衡逆向移动
Q>K
Q增大
K不变
为了提高产率,生产过程中常常将反应产物及时从体系中移走,使反应所建立的化学平衡不断地正向移动。
4.工业生产中的应用
在化工生产中,常常通过增加某一价廉、易得的反应物的浓度来提高另一昂贵、稀缺的反应物的转化率,从而降低生产成本。
2NH3
N2 +3H2
催化剂
高温、高压
思考:对于工业合成氨的反应,为了降低成本、提高产率可以采取哪些措施?
①适当提高N2的比例
②及时将NH3从反应混合物中分离出去
(1)增加固体或纯液体的量平衡不移动。
(2)只要是增大浓度,新平衡状态下的反应速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。
(3)反应物有两种或两种以上,增加一种物质的浓度,该物质的平衡转化率降低, 而其他物质的转化率提高。
(4)只有改变实际参加反应的离子浓度对平衡才有影响,如:
增加KCl固体的量平衡不移动。
FeCl3+3KSCN Fe(SCN)3+3KCl
Fe3++3SCN- Fe(SCN)3
思考交流
1.正误判断
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本
(2)C(s)+H2O(g) CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动
(3)恒容密闭容器中充入He,可使N2(g)+3H2(g) 2NH3(g)平衡向正反应方向移动
(4)化学平衡向正反应方向移动,v逆一定比v正小
√
×
×
√
思考交流
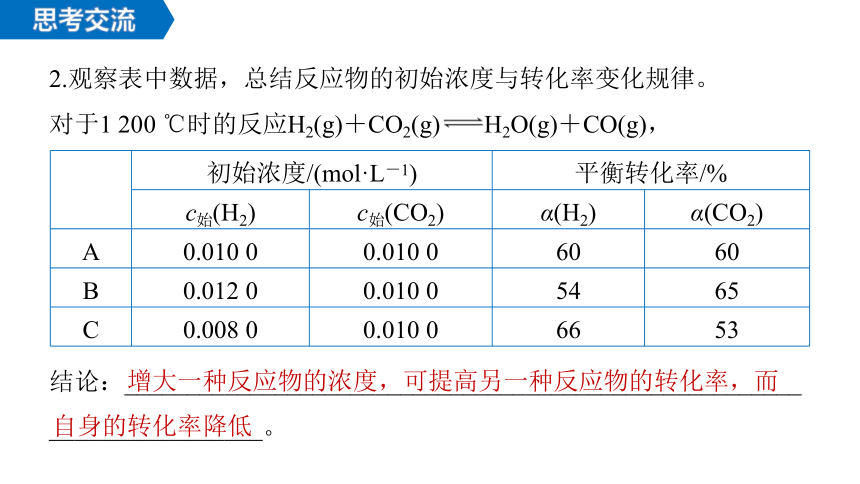
2.观察表中数据,总结反应物的初始浓度与转化率变化规律。
对于1 200 ℃时的反应H2(g)+CO2(g) H2O(g)+CO(g),
初始浓度/(mol·L-1) 平衡转化率/%
c始(H2) c始(CO2) α(H2) α(CO2)
A 0.010 0 0.010 0 60 60
B 0.012 0 0.010 0 54 65
C 0.008 0 0.010 0 66 53
结论:______________________________________________________
_________________。
增大一种反应物的浓度,可提高另一种反应物的转化率,而自身的转化率降低
思考交流
3.从速率变化的视角,理解浓度改变与平衡移动方向。以一定温度下,可逆反应2SO2(g)+O2(g) 2SO3(g)为例:
(1)图1为上述反应建立平衡状态Ⅰ后,t1时刻只
增大O2浓度的v-t图像。
由图像获得如下信息(用“增大、减小、不变、
>、<、=”等填空):
①t1时刻v′正 ,v′逆 ,v′正 v′逆,
Q K,平衡向 移动。
增大
不变
>
<
正反应方向
思考交流
②一段时间后,反应达到平衡状态Ⅱ, 相等,平衡状态Ⅰ的反应速率v正 平衡状态Ⅱ的v′逆。
③平衡状态Ⅱ与平衡状态Ⅰ相比,各组分的浓
度:c(SO3) ,c(O2) ,c(SO2) ;反
应物的转化率:α(O2) ,α(SO2) ;反应
的平衡常数 。
正、逆反应速率
<
增大
增大
减小
减小
增大
不变
思考交流
(2)图2表示上述反应已建立平衡状态Ⅰ,
①请画出t1时刻后只增大SO3浓度的v-t图像。
答案
②分析建立新的平衡后,各组分的浓度、反应物的转化率与平衡状态Ⅰ相比的变化情况。
答案 各组分的浓度:c(SO3)增大,c(O2)增大,c(SO2)增大;反应物的转化率:α(O2)减小,α(SO2)减小。
思考交流
(3)图3表示上述反应已建立平衡状态Ⅰ,请画出t1时刻后只减小SO2浓度的v-t图像。
答案
压强对化学平衡的影响
二
如果改变压强(容积),以下反应各物质的浓度会如何变化? 气体颜色如何变化?
交流讨论
红棕色
无色
2NO2(g) N2O4(g)
在其他条件不变的情况下,压强对化学平衡的影响规律
增大压强
Q=K
平衡不移动
Q>K
平衡逆向(气体分子总数减小)移动
Q<K
平衡正向(气体分子总数减小)移动
Δvg=0
Δvg>0
Δvg<0
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
在其他条件不变的情况下,压强对化学平衡的影响规律
减小压强
Δvg=0
Δvg>0
Δvg<0
Q=K
平衡不移动
Q<K
平衡正向(气体分子总数增大)移动
Q>K
平衡逆向(气体分子总数增大)移动
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
(1)当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
(2)对有气体参加的可逆反应,在恒温恒容条件下,压强与气体的浓度成正比,因而压强对化学平衡的影响,要看压强改变是否使浓度商发生改变。
思考交流
1.正误判断
(1)有气体参与的反应,改变压强,平衡一定发生移动
(2)增大压强可使反应2SO2(g)+O2(g) 2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小
(3)对于反应:2HI(g) H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动
×
×
×
思考交流
2.常温下,一定体积的密闭容器中,充入NO2和N2O4的混合气体,反应2NO2(g)(红棕色) N2O4(g)(无色)达到平衡。
(1)若将容器的体积缩小为原来的一半,平衡向_______方向移动,平衡后气体的颜色与原来相比_____(填“加深”“变浅”或“不变”)。
(2)从K与Q的视角论证平衡正向移动的原因:_____________________
_______________________________________________________________________________________________。
正反应
加深
思考交流
3.在一定温度下,反应mA(g)+nB(g) pC(g)+qD(g)达到平衡,完成下列填空:
(1)若m+n>p+q,缩小容器的容积,增大压强[课下研究m+n①化学平衡向 方向移动,平衡后c平(A) (填“增大”“减小”或“不变”,下同),c平(D) ,B的转化率 。
正反应
增大
增大
增大
思考交流
②在图中补全,t1时,增大压强后的v-t图像。
答案
思考交流
(2)若m+n=p+q,扩大容器的容积,
①Q K,化学平衡 移动,c平(A) ,c平(D) ,B的转化率 。
②在图中补全,t1时,减小压强后的v-t图像。
=
不
减小
减小
不变
答案
思考交流
4.在密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),达到平衡状态。
(1)保持温度、容积不变,再充入少量He。容器内压强增大平衡是否移动,阐述判断的理由。
答案 不移动。因为容器容积不变,则各物质的浓度未发生变化,Q=K,则平衡不移动。
思考交流
(2)保持温度、容器压强不变,再充入少量He。容器的容积如何变化?平衡移动方向如何?简述判断的方法。
答案 容积增大,平衡逆向移动。扩大容器的容积,相当于减小压强,平衡向气体体积增大的方向移动,该反应逆向移动。或从Q变化分析,此时Q>K。
练后反思
充入“惰性”气体对化学平衡的影响
思考交流
5.已知化学反应2A(?)+B(g) 2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是____________,C是______。
固体或液体
气体
说明逆向为气体体积减小的反应,由于B为气体,所以C为气体,A为非气体。
勒 夏特列原理
三
1.外因对化学平衡的影响
条件的改变(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小反应产物浓度
减小反应物浓度或增大反应产物浓度
压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强
减小压强
反应前后气体分子数不变 改变压强
向正反应方向移动
向逆反应方向移动
向气体分子数目减小的方向移动
向气体分子数目增大的方向移动
平衡不移动
条件的改变(其他条件不变) 化学平衡的移动
温度 升高温度
降低温度
催化剂 使用催化剂
向吸热反应方向移动
向放热反应方向移动
平衡不移动
如果改变一个条件,平衡就向着能够减弱这种改变的方向移动
2.勒·夏特列原理
(1)内容:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。
(2)适用范围
已达到平衡的反应体系
×
不可逆过程或未达到平衡的可逆过程
(3)对原理中“减弱这个改变”的理解
“减弱”不等于“消除”,更不是“扭转”
缩小体积增大压强,混合气体颜色先加深,后变浅,达到新的平衡后混合体系颜色比原平衡时颜色深。
2NO2(g)(红棕色) N2O4(g)(无色)
思考交流
1.下列事实中,不能用勒·夏特列原理解释的是____(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2 2H2O+O2的反应,使用MnO2可加快制备O2的反应速率
C.反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平衡
向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提
高,理论上应采取低温高压的措施
E.H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
BE
催化剂只能改变反应速率,对化学平衡的移动无影响。
思考交流
2.在一密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2)=1 mol·L-1,容器内压强为p,温度为T。
(1)再向容器中通入N2,使其浓度变为2 mol·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是_________________________。
(2)将容器体积缩小至平衡时的一半,并保持温度不变,再次达到平衡时压强p′的范围是__________。
(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是__________。
1 mol·L-1pT思考交流
3.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得C的浓度为0.50 mol·L-1。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90 mol·L-1。
(1)压缩容积时,平衡是否发生移动?移动的方向如何?
答案 发生移动,平衡逆向移动
(2)C的体积分数_____(填“增大”“减小”或“不变”)。
(3)x+y z(填“>”“<”或“=”)。
减小
<
第4课时 反应条件对化学平衡的影响(二)
第2章 第2节
1.通过实验探究掌握浓度、压强对化学平衡的影响规律(重点)。
2.能从浓度商与平衡常数的视角定量解释浓度、压强对化学平衡的影响(难点)。
学习目标
浓度对化学平衡的影响
一
一定温度下,平衡状态
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Q减小
Q<K
平衡正向移动
Q减小
Q<K
平衡正向移动
Q增大
Q>K
平衡逆向移动
Q增大
Q>K
平衡逆向移动
温度一定时,反应aA+bB cC+dD的平衡常数是一个定值。
1.浓度对化学平衡的影响
2.实验探究浓度对化学平衡的影响
实验原理 Fe3++3SCN- Fe(SCN)3(红色)
步骤1 向盛有5 mL 0.01 mol·L-1 FeCl3溶液的试管中加入5 mL 0.01 mol·L-1 KSCN溶液,将上述溶液平均分装在两支试管中
现象
步骤2 向其中一支试管滴加1 mol· L-1 FeCl3溶液4滴,振荡 向另一支试管中滴加1 mol·
L-1 KSCN溶液4滴,振荡
现象
溶液显红色
溶液红色加深
溶液红色加深
实验原理 Fe3++3SCN- Fe(SCN)3(红色)
步骤3 向上述两支试管中各加入少量铁粉,振荡
现象
实验结论
两试管中溶液的红色均变浅
对Fe3++3SCN- Fe(SCN)3的化学平衡,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均增大,即化学平衡均向正反应方向移动;加入铁粉,Fe+2Fe3+=== 3Fe2+,Fe3+浓度减小,平衡逆向移动
3.在其他条件不变的情况下,浓度对化学平衡的影响规律
c(反应物)增大或c(反应产物)减小
c(反应物)减小或c(反应产物)增大
平衡正向移动
Q减小
K不变
Q<K
平衡逆向移动
Q>K
Q增大
K不变
为了提高产率,生产过程中常常将反应产物及时从体系中移走,使反应所建立的化学平衡不断地正向移动。
4.工业生产中的应用
在化工生产中,常常通过增加某一价廉、易得的反应物的浓度来提高另一昂贵、稀缺的反应物的转化率,从而降低生产成本。
2NH3
N2 +3H2
催化剂
高温、高压
思考:对于工业合成氨的反应,为了降低成本、提高产率可以采取哪些措施?
①适当提高N2的比例
②及时将NH3从反应混合物中分离出去
(1)增加固体或纯液体的量平衡不移动。
(2)只要是增大浓度,新平衡状态下的反应速率一定大于原平衡状态;减小浓度,新平衡状态下的速率一定小于原平衡状态。
(3)反应物有两种或两种以上,增加一种物质的浓度,该物质的平衡转化率降低, 而其他物质的转化率提高。
(4)只有改变实际参加反应的离子浓度对平衡才有影响,如:
增加KCl固体的量平衡不移动。
FeCl3+3KSCN Fe(SCN)3+3KCl
Fe3++3SCN- Fe(SCN)3
思考交流
1.正误判断
(1)合成氨反应中,增加N2的浓度,可使平衡正向移动,提高H2的转化率,降低成本
(2)C(s)+H2O(g) CO(g)+H2(g)在某温度下达到平衡后,增加一部分C(s),v正增大,平衡正向移动
(3)恒容密闭容器中充入He,可使N2(g)+3H2(g) 2NH3(g)平衡向正反应方向移动
(4)化学平衡向正反应方向移动,v逆一定比v正小
√
×
×
√
思考交流
2.观察表中数据,总结反应物的初始浓度与转化率变化规律。
对于1 200 ℃时的反应H2(g)+CO2(g) H2O(g)+CO(g),
初始浓度/(mol·L-1) 平衡转化率/%
c始(H2) c始(CO2) α(H2) α(CO2)
A 0.010 0 0.010 0 60 60
B 0.012 0 0.010 0 54 65
C 0.008 0 0.010 0 66 53
结论:______________________________________________________
_________________。
增大一种反应物的浓度,可提高另一种反应物的转化率,而自身的转化率降低
思考交流
3.从速率变化的视角,理解浓度改变与平衡移动方向。以一定温度下,可逆反应2SO2(g)+O2(g) 2SO3(g)为例:
(1)图1为上述反应建立平衡状态Ⅰ后,t1时刻只
增大O2浓度的v-t图像。
由图像获得如下信息(用“增大、减小、不变、
>、<、=”等填空):
①t1时刻v′正 ,v′逆 ,v′正 v′逆,
Q K,平衡向 移动。
增大
不变
>
<
正反应方向
思考交流
②一段时间后,反应达到平衡状态Ⅱ, 相等,平衡状态Ⅰ的反应速率v正 平衡状态Ⅱ的v′逆。
③平衡状态Ⅱ与平衡状态Ⅰ相比,各组分的浓
度:c(SO3) ,c(O2) ,c(SO2) ;反
应物的转化率:α(O2) ,α(SO2) ;反应
的平衡常数 。
正、逆反应速率
<
增大
增大
减小
减小
增大
不变
思考交流
(2)图2表示上述反应已建立平衡状态Ⅰ,
①请画出t1时刻后只增大SO3浓度的v-t图像。
答案
②分析建立新的平衡后,各组分的浓度、反应物的转化率与平衡状态Ⅰ相比的变化情况。
答案 各组分的浓度:c(SO3)增大,c(O2)增大,c(SO2)增大;反应物的转化率:α(O2)减小,α(SO2)减小。
思考交流
(3)图3表示上述反应已建立平衡状态Ⅰ,请画出t1时刻后只减小SO2浓度的v-t图像。
答案
压强对化学平衡的影响
二
如果改变压强(容积),以下反应各物质的浓度会如何变化? 气体颜色如何变化?
交流讨论
红棕色
无色
2NO2(g) N2O4(g)
在其他条件不变的情况下,压强对化学平衡的影响规律
增大压强
Q=K
平衡不移动
Q>K
平衡逆向(气体分子总数减小)移动
Q<K
平衡正向(气体分子总数减小)移动
Δvg=0
Δvg>0
Δvg<0
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
在其他条件不变的情况下,压强对化学平衡的影响规律
减小压强
Δvg=0
Δvg>0
Δvg<0
Q=K
平衡不移动
Q<K
平衡正向(气体分子总数增大)移动
Q>K
平衡逆向(气体分子总数增大)移动
Δvg=(化学方程式中气态反应产物化学式前系数之和)-(化学方程式中气态反应物化学式前系数之和)。
(1)当平衡混合物中都是固态或液态物质时,改变压强后化学平衡一般不发生移动。
(2)对有气体参加的可逆反应,在恒温恒容条件下,压强与气体的浓度成正比,因而压强对化学平衡的影响,要看压强改变是否使浓度商发生改变。
思考交流
1.正误判断
(1)有气体参与的反应,改变压强,平衡一定发生移动
(2)增大压强可使反应2SO2(g)+O2(g) 2SO3(g)平衡正向移动,原因是增大压强,v正增大,v逆减小
(3)对于反应:2HI(g) H2(g)+I2(g),其他条件不变时,增大压强,体系的颜色加深,平衡正向移动
×
×
×
思考交流
2.常温下,一定体积的密闭容器中,充入NO2和N2O4的混合气体,反应2NO2(g)(红棕色) N2O4(g)(无色)达到平衡。
(1)若将容器的体积缩小为原来的一半,平衡向_______方向移动,平衡后气体的颜色与原来相比_____(填“加深”“变浅”或“不变”)。
(2)从K与Q的视角论证平衡正向移动的原因:_____________________
_______________________________________________________________________________________________。
正反应
加深
思考交流
3.在一定温度下,反应mA(g)+nB(g) pC(g)+qD(g)达到平衡,完成下列填空:
(1)若m+n>p+q,缩小容器的容积,增大压强[课下研究m+n
正反应
增大
增大
增大
思考交流
②在图中补全,t1时,增大压强后的v-t图像。
答案
思考交流
(2)若m+n=p+q,扩大容器的容积,
①Q K,化学平衡 移动,c平(A) ,c平(D) ,B的转化率 。
②在图中补全,t1时,减小压强后的v-t图像。
=
不
减小
减小
不变
答案
思考交流
4.在密闭容器中发生反应N2(g)+3H2(g) 2NH3(g),达到平衡状态。
(1)保持温度、容积不变,再充入少量He。容器内压强增大平衡是否移动,阐述判断的理由。
答案 不移动。因为容器容积不变,则各物质的浓度未发生变化,Q=K,则平衡不移动。
思考交流
(2)保持温度、容器压强不变,再充入少量He。容器的容积如何变化?平衡移动方向如何?简述判断的方法。
答案 容积增大,平衡逆向移动。扩大容器的容积,相当于减小压强,平衡向气体体积增大的方向移动,该反应逆向移动。或从Q变化分析,此时Q>K。
练后反思
充入“惰性”气体对化学平衡的影响
思考交流
5.已知化学反应2A(?)+B(g) 2C(?)达到平衡,当增大压强时,平衡向逆反应方向移动,则下列物质的状态可能是A是____________,C是______。
固体或液体
气体
说明逆向为气体体积减小的反应,由于B为气体,所以C为气体,A为非气体。
勒 夏特列原理
三
1.外因对化学平衡的影响
条件的改变(其他条件不变) 化学平衡的移动
浓度 增大反应物浓度或减小反应产物浓度
减小反应物浓度或增大反应产物浓度
压强(对有气体参加的反应) 反应前后气体分子数改变 增大压强
减小压强
反应前后气体分子数不变 改变压强
向正反应方向移动
向逆反应方向移动
向气体分子数目减小的方向移动
向气体分子数目增大的方向移动
平衡不移动
条件的改变(其他条件不变) 化学平衡的移动
温度 升高温度
降低温度
催化剂 使用催化剂
向吸热反应方向移动
向放热反应方向移动
平衡不移动
如果改变一个条件,平衡就向着能够减弱这种改变的方向移动
2.勒·夏特列原理
(1)内容:如果改变平衡体系的一个条件(如温度、浓度或压强),平衡将向减弱这个改变的方向移动。
(2)适用范围
已达到平衡的反应体系
×
不可逆过程或未达到平衡的可逆过程
(3)对原理中“减弱这个改变”的理解
“减弱”不等于“消除”,更不是“扭转”
缩小体积增大压强,混合气体颜色先加深,后变浅,达到新的平衡后混合体系颜色比原平衡时颜色深。
2NO2(g)(红棕色) N2O4(g)(无色)
思考交流
1.下列事实中,不能用勒·夏特列原理解释的是____(填字母)。
A.溴水中存在如下平衡:Br2+H2O HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2 2H2O+O2的反应,使用MnO2可加快制备O2的反应速率
C.反应:CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0,升高温度,平衡
向逆反应方向移动
D.合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,为使氨的产率提
高,理论上应采取低温高压的措施
E.H2(g)+I2(g) 2HI(g),缩小体积加压颜色加深
BE
催化剂只能改变反应速率,对化学平衡的移动无影响。
思考交流
2.在一密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,在某一时刻达到平衡,测得c(N2)=1 mol·L-1,容器内压强为p,温度为T。
(1)再向容器中通入N2,使其浓度变为2 mol·L-1,并保持容积不变,再次达到平衡时c(N2)的范围是_________________________。
(2)将容器体积缩小至平衡时的一半,并保持温度不变,再次达到平衡时压强p′的范围是__________。
(3)迅速升温至T1,并保持容积不变,且不与外界进行热交换,再次达到平衡时,温度T′的范围是__________。
1 mol·L-1
3.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g) zC(g),平衡时测得C的浓度为0.50 mol·L-1。保持温度不变,将容器的容积压缩到原来的一半,再达到平衡时,测得C的浓度变为0.90 mol·L-1。
(1)压缩容积时,平衡是否发生移动?移动的方向如何?
答案 发生移动,平衡逆向移动
(2)C的体积分数_____(填“增大”“减小”或“不变”)。
(3)x+y z(填“>”“<”或“=”)。
减小
<
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
