专题4第二单元硫及其化合物的相互转化(含解析)同步练习2023——2024学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 专题4第二单元硫及其化合物的相互转化(含解析)同步练习2023——2024学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 775.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-09 00:00:00 | ||
图片预览




文档简介
专题4第二单元硫及其化合物的相互转化同步练习
姓名 班级
一、选择题
1.硫及其化合物的转化具有重要应用。下列说法不正确的是
A.实验室检验既具有氧化性也具有还原性:
B.工业制硫酸过程中的物质转化:
C.用脱除天然气中的:
D.实验室制备少量的原理:
2.钛铁矿与过氧化钠熔融后得到钛酸钠(),反应的化学方程式为:,下列有关说法正确的是
A.化合物中阴阳离子的个数比为1:1
B.该反应中的还原产物只有
C.若有1mol被氧化,则被还原的为2mol
D.每生成18.6g氧化钠,转移电子的物质的量是3.6mol
3.下列反应的离子方程式正确的是
A.的溶液中通入3.36L(标准状况):
B.和HI的反应:
C.向莫尔盐[]溶液中加入过量氢氧化钠溶液:
D.向明矾[]溶液中逐滴加入溶液至恰好沉淀完全:
4.能正确表示下列变化的离子方程式是
A.大理石与醋酸反应:
B.用氢氧化钠溶液吸收少量二氧化硫气体:
C.向碘化钾与碘酸钾的混合溶液中加入硫酸:
D.向溶液中加过量的溶液:
5.建设美丽乡村,守护中华家园,衣食住行皆化学。下列说法正确的是
A.粉刷墙壁使用的生石灰主要成分是Ca(OH)2
B.整修乡村公路大量使用的水泥属于新型无机非金属材料
C.合理使用添加剂有助于身体健康,维生素C因难与氧气反应而做抗氧化剂
D.公园增设健身器材表面涂一层防锈漆有利于延长使用时间
6.陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔,LiCoO2等杂质)制备碳酸钴的工艺流程如图:
下列有关描述错误的是
A.“滤液①”主要成分是NaAlO2
B.“操作①”、“操作②”的分离方法不同
C.“酸溶”反应中H2O2可以换成O2
D.“沉钴”时Na2CO3的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生Co(OH)2杂质
7.下列常见金属的冶炼原理不合理的是
A.还原法炼铝: B.加热法炼汞:
C.热还原法炼铁: D.火法炼铜:
8.已知为一种常见酸的浓溶液,能使蔗糖粉末变黑。与反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为单质铁,则足量A与X在室温下即可完全反应
C.若A为单质碳,则将C通入少量澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为加热、催化剂
9.设NA表示阿伏加德罗常数,下列说法正确的是
A.将0.1mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目为0.1NA
B.1L 0.1mol/L NaHSO4溶液中含有0.1NA个HSO
C.常温常压下,23g NO2和N2O4的混合气体一定含有NA个氧原子
D.0.1mol Na2O2固体与足量的H2O充分反应,转移0.2NA个电子
10.下列离子方程式错误的是
A.工业上用二氧化氮溶于水生产硝酸:
B.为测定空气中含量,将其通入到酸性溶液中:
C.海带提碘实验过程中,向含的溶液中滴加、稀硫酸:
D.研究温度对化学反应速率影响时,向溶液中滴加稀硫酸:
11.BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。已知“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS;“沉淀”步骤中生成的沉淀化学式为BaTiO(C2O4)2。
下列说法中错误的是
A.“焙烧”步骤中碳粉的主要作用是做还原剂
B.“浸取”步骤中的滤渣为CaS:“酸化”步骤中的酸可用盐酸或稀硫酸
C.“沉淀”步骤中发生反应的化学方程式为
D.“热分解”过程中产生的CO和CO2的物质的量之比为1:1
12.下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气:
B.过量铁粉加入稀硝酸中
C.NaOH溶液与少量H2C2O4溶液反应:
D.CuSO4溶液与过量浓氨水反应的离子方程式:
13.下列叙述对应的离子方程式正确的是
A.向饱和NaOH溶液通入过量CO2析出白色晶体:
B.向NaHSO3溶液中滴入酸化的Ba(NO3)2溶液产生白色沉淀:
C.碘化亚铁溶液中滴加少量稀硝酸:
D.IBr与NaOH溶液反应:
14.实验室中利用洁净的铜片和浓硫酸进行如图实验,其中所得“固体”中含有和白色物质,下列说法错误的是
A.与的物质的量之和可能为 B.为还原产物,为氧化产物
C.浓硫酸既表现酸性又表现氧化性 D.白色物质为
15.从矿物学资料查得,一定条件下自然界存在如下反应:,下列说法正确的是
(提示:化学反应中,元素化合价升高说明原子失去电子被氧化,元素化合价降低说明原子得到电子被还原;原子之间得失电子叫做电子的转移)
A.CuSO4在反应中会氧化FeS2
B.Cu2S既是氧化产物又是还原产物
C.每5个FeS2发生反应,有10个电子发生转移
D.FeS2在反应中只得电子
二、实验题
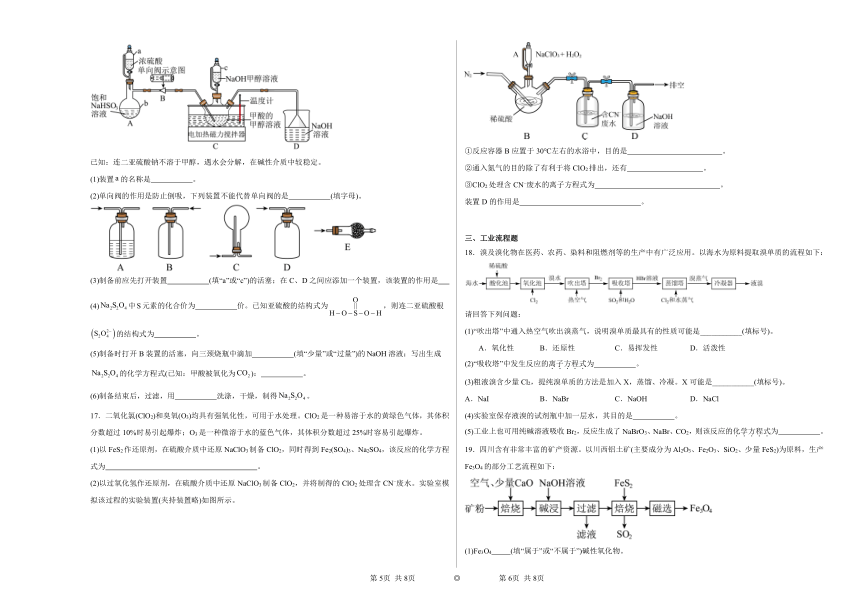
16.连二亚硫酸钠是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取。
已知:连二亚硫酸钠不溶于甲醇,遇水会分解,在碱性介质中较稳定。
(1)装置的名称是 。
(2)单向阀的作用是防止倒吸,下列装置不能代替单向阀的是 (填字母)。
(3)制备前应先打开装置 (填“a”或“c”)的活塞;在C、D之间应添加一个装置,该装置的作用是
(4)中元素的化合价为 价。已知亚硫酸的结构式为,则连二亚硫酸根的结构式为 。
(5)制备时打开B装置的活塞,向三颈烧瓶中滴加 (填“少量”或“过量”)的溶液;写出生成的化学方程式(已知:甲酸被氧化为): 。
(6)制备结束后,过滤,用 洗涤,干燥,制得。
17.二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为 。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN 废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
①反应容器B应置于30℃左右的水浴中,目的是 。
②通入氮气的目的除了有利于将ClO2排出,还有 。
③ClO2处理含CN 废水的离子方程式为 。
装置D的作用是 。
三、工业流程题
18.溴及溴化物在医药、农药、染料和阻燃剂等的生产中有广泛应用。以海水为原料提取溴单质的流程如下:
请回答下列问题:
(1)“吹出塔”中通入热空气吹出溴蒸气,说明溴单质最具有的性质可能是___________(填标号)。
A.氧化性 B.还原性 C.易挥发性 D.活泼性
(2)“吸收塔”中发生反应的离子方程式为 。
(3)粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝。X可能是___________(填标号)。
A.NaI B.NaBr C.NaOH D.NaCl
(4)实验室保存液溴的试剂瓶中加一层水,其目的是 。
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为 。
19.四川含有非常丰富的矿产资源。以川西铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:
(1)Fe3O4 (填“属于”或“不属于”)碱性氧化物。
(2)已知上述流程中两次焙烧均会产生SO2,滤渣中含大量的Fe2O3。
①矿粉焙烧过程中还原剂和氧化剂物质的量之比为 ,过程加入少量CaO的目的是 ,用NaOH溶液吸收SO2离子方程式为
②“过滤”得到的滤液中含有的阴离子有OH-、 。
③Fe2O3与FeS2混合后焙烧(缺氧条件下)反应的化学方程式为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.使酸性高锰酸钾溶液褪色体现还原性,和Na2S反应生成S体现其氧化性,故A正确;
B.工业制硫酸过程中的物质转化为:FeS2和O2反应生成SO2,SO2发生催化氧化反应生成SO3,SO3和H2O反应生成H2SO4,故B错误;
C.具有氧化性,具有还原性,二者发生反应可以用于脱除天然气中的,故C正确;
D.Cu和浓硫酸在加热的条件下发生反应生成SO2,可以制备少量,方程式为:,故D正确;
故选B。
2.C
【详解】A.Na2O2中阳离子为Na+、阴离子为,所以Na2O2晶体中阴阳离子个数之比为1:2,A错误;
B.该反应中,FeTiO3中铁、 Ti元素的化合价升高,被氧化,Na2O2中氧元素的化合价降低被还原,若3molNa2O2参加反应,则由Na2O2生成的-2价氧原子为6mol,所以除了Na2O是还原产物外,Na2FeO4和Na2TiO4也是还原产物,B错误;
C.Fe的化合价从+2价升高到+6价,Na2O2中O元素的化合价从-1价降低到-2价。由化学计量数可知,有1molFe2+被氧化,则Fe2+失去的电子为4mol,所以被Fe2+还原的Na2O2为2mol,C正确;
D.n(Na2O)==18.6g÷62g/mol=0.3mol, 每生成1mol Na2O转移6 mol电子,则生成0.3 mol Na2O转移1.8 mol电子,D错误;
故选C。
3.A
【详解】A.Fe2+的还原性强于Br-,因此Cl2先和Fe2+发生反应,的(为0.15mol)溶液中通入3.36L(标准状况,为0.15mol),则亚铁离子完全反应,与亚铁离子反应的氯气为0.075mol、则剩余的0.075mol氯气消耗0.15mol溴离子,即消耗Fe2+、Br-、Cl2的物质的量分别为0.15:0.15:0.15,正确的离子反应方程式为,故A正确;
B.Fe3+具有强氧化性,I-具有强还原性,两者发生氧化还原反应生成碘单质和亚铁离子,即,B错误;
C.向莫尔盐[]溶液中加入过量氢氧化钠溶液,铵根离子完全转化为一水合氨,亚铁离子完全转化为氢氧化亚铁沉淀,反应为:,C错误;
D.明矾[]溶液中逐滴加入溶液至恰好沉淀完全,则氢氧根离子使得铝离子恰好转化为偏铝酸根离子:,D错误;
故选A。
4.B
【详解】A.醋酸为弱酸不能拆、碳酸钙不溶于水不能拆,反应为,A错误;
B.氢氧化钠溶液吸收少量二氧化硫气体生成亚硫酸钠和水:,B正确;
C.向碘化御与碘酸钾的混合溶液中加入硫酸发生归中反应生成碘单质,根据电子守恒可知反应为:,C错误;
D.向溶液中加过量的溶液,碳酸氢根离子也会和氢氧根离子生成水和碳酸根离子:,D错误;
故选B。
5.D
【详解】A.生石灰的主要成分是氧化钙(CaO),A错误;
B.水泥属于硅酸盐材料,属于传统无机非金属材料,B错误;
C.维生素C易与氧气反应,具有还原性,C错误;
D.防锈漆有利于保护器材,防止器材生锈,D正确;
故选D。
6.B
【分析】经过第一步碱浸操作,废料中的铝箔溶解转化为NaAlO2(滤液①)而被除去,钴渣①主要含Co3O4和LiCoO2,后续萃取的是Co2+,说明经过酸溶之后,Co元素转化为Co2+,即在酸溶步骤中Co元素被还原,故H2O2此时作还原剂,经过操作①得到滤液②,说明操作①为过滤操作,所得滤液②中主要含CoSO4和Li2SO4,经过萃取操作(操作②)实现两者分离,有机相中为CoR2,向有机相中加入硫酸,进行反萃取,实现Co元素从有机相转移到水相,最后经过沉钴操作获得CoCO3,据此分析解题。
【详解】A.由分析知,滤液①”主要成分是NaAlO2,A正确;
B.“操作①”为过滤,“操作②”为萃取、分液,二者的分离方法不同,B错误;
C.由分析知,“酸溶”反应中H2O2作还原剂,不可以换成O2,C正确;
D.“沉钴”时Na2CO3的滴速过快或浓度太大溶液碱性增强会产生Co(OH)2杂质,将导致产品不纯,D正确;
故答案为:B。
7.A
【分析】对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来;在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来;活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属。
【详解】A.Al的还原性大于氢气,氢气不能与氧化铝反应制Al,故A错误;
B.Hg为不活泼金属,通常直接加热其化合物冶炼Hg,故B正确;
C.一氧化碳还原氧化铁生成铁和二氧化碳,能炼铁,故C正确;
D.Cu为不活泼金属,与氧气高温条件下反应可制得Cu,故D正确;
故选A。
8.D
【分析】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,X为浓硫酸。
【详解】A.浓硫酸使蔗糖变黑主要体现了浓硫酸的脱水性,A错误;
B.若A为铁,铁室温下与浓硫酸钝化,不可完全反应,B错误;
C.浓硫酸与碳单质发生氧化还原反应生成二氧化硫和二氧化碳、水,SO2与O2在催化剂、加热条件下反应制备SO3,三氧化硫和水生成硫酸,则B为SO2;C为二氧化碳,将CO2通入少量澄清石灰水中,二氧化碳过量,生成碳酸氢钙,不一定观察到白色沉淀产生,C错误;
D.由C分析可知,工业上,二氧化硫转化为三氧化硫的反应条件为加热、催化剂,D正确;
故选D。
9.C
【详解】A.将0.1mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目小于0.1NA,A错误;
B.在水溶液中 ,NaHSO4溶液中不存在硫酸氢根离子,B错误;
C.常温常压下,23g NO2和N2O4的混合气体一定含有氧原子的物质的量为:,氧原子的个数为NA个,C正确;
D.根据 ,所以0.1mol Na2O2固体与足量的H2O充分反应,生成0.05mol氧气,转移NA=0.1NA个电子,D错误;
故选C。
10.D
【详解】A.工业上用二氧化氮溶于水生产硝酸,二氧化氮和水反应生成硝酸和一氧化氮:,故A正确;
B.为测定空气中SO2含量,将其通入到酸性KMnO4溶液中,,二氧化硫具有还原性,被高锰酸钾氧化为硫酸,高锰酸钾被还原为硫酸锰,反应的离子方程式:,故B正确;
C.海带提碘实验过程中,向含I-的溶液中滴加H2O2、稀硫酸,酸性溶液中过氧化氢氧化碘离子生成碘单质,反应的离子方程式为:2I-+H2O2+2H+=I2+2H2O,故C正确;
D.向Na2S2O3溶液中滴加稀硫酸反应生成硫单质、二氧化硫和水,反应的离子方程式为:,故D错误;
故选:D。
11.B
【分析】由流程和题中信息可知,BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、易溶于水的BaS和微溶于水的CaS;烧渣经水浸取后过滤,滤渣中碳粉和CaS,滤液中有BaS和BaCl2;滤液经酸化后浓缩结晶得到BaCl2晶体;BaCl2晶体溶于水后,加入TiCl4和(NH4)2C2O4将钡离子充分沉淀得到BaTiO(C2O4)2;BaTiO(C2O4)2经热分解得到BaTiO3。
【详解】A.“焙烧”步骤中BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、易溶于水的BaS和微溶于水的CaS,C的化合价从0价到+2价,即碳粉的主要作用是做还原剂,故A正确;
B.“浸取”步骤中的滤渣为CaS和碳粉;“酸化”步骤中的酸可用盐酸,稀硫酸会加入杂质离子不可用,故B错误;
C.“沉淀”步骤为BaCl2晶体溶于水后,加入TiCl4和(NH4)2C2O4将钡离子充分沉淀得到BaTiO(C2O4)2,对应的化学方程式为:,故C正确;
D.BaTiO(C2O4)2经热分解得到BaTiO3,对应的化学方程式为: ,CO和CO2的物质的量之比为1:1,故D正确;
故选B。
12.C
【详解】A.氯气先氧化碘离子,然后氧化亚铁离子,FeI2和Cl2以1:1反应时,氯气只能氧化碘离子,离子方程式为2I-+Cl2═I2+2Cl-,故A错误;
B.过量铁粉加入稀硝酸中应生成Fe2+,正确离子反应为:3Fe+8H++2=3Fe2++2NO↑+4H2O,故B错误;
C.NaOH和少量H2C2O4反应生成Na2C2O4和H2O,离子方程式为,故C正确;
D.CuSO4溶液和过量浓氨水反应生成铜氨络合物,离子方程式为Cu2++4NH3 H2O=[Cu(NH3)4]2++4H2O,故D错误;
故选:C。
13.D
【详解】A.向饱和NaOH溶液通入过量析出白色晶体即产生沉淀,故离子方程式为:,故A错误;
B.硝酸具有强氧化性,能够将NaHSO3氧化为硫酸钠,硫酸钠与硝酸钡反应生成难溶于酸的硫酸钡,向NaHSO3溶液中滴入酸化的Ba(NO3)2溶液产生白色沉淀的离子方程式为:,故B错误;
C.碘离子的还原性比亚铁离子强,碘化亚铁中滴入少量稀硝酸,先与碘离子反应,正确离子方程式为:2+6I-+8H+=3I2+2NO↑+4H2O,故C错误;
D.IBr中I为+1价,Br为 1价,则IBr与NaOH溶液反应:IBr+2OH-=Br-+IO- +H2O,故D正确;
故选D。
14.A
【分析】由图知,铜与足量浓硫酸反应生成Cu2S和白色物质X,无气体生成,生成Cu2S时铜元素从0价升高到+1价、硫元素从+6价降低到-2价,则按得失电子数守恒、必定存在其他产物(所含元素化合价升高)、按元素质量守恒只能为CuSO4,则白色物质X为CuSO4,配平得到该反应方程式为:5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O,据此回答。
【详解】A.由5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O知,3molCu生成0.6molCu2S,0.6molCu2S发生反应3Cu2S+16H++4NO=6Cu2++3S↓+4NO↑+8H2O得到0.8mol NO与0.6mol S,NO与S物质的量之和为1.4mol,A错误;
B.Cu2S和白色物质CuSO4加稀硫酸和稀硝酸时溶解,存在反应:3Cu2S+16H++4 NO=6Cu2++3S↓+4NO↑+8H2O,Y为S单质,则NO为还原产物、Y为氧化产物,B正确;
C.由5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O可知,硫元素从+6价降低到-2价时表现氧化性,同时生成硫酸铜表现酸性,C正确;
D.由分析可知,白色物质X为CuSO4,D正确;
故选:A。
15.A
【详解】A.14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,的S元素的化合价由-1价升高为+6价,CuSO4作氧化剂、的FeS2作还原剂,的FeS2作氧化剂,所以CuSO4在反应中会氧化FeS2,A正确;
B.生成Cu2S消耗的FeS2、CuSO4都作氧化剂,氧化剂对应的产物是还原产物,所以Cu2S是还原产物,B错误;
C.每5个FeS2发生反应,转移电子的个数为×5×2×[(+6)-(-1)]=21,C错误;
D.该反应中的FeS2失电子,的FeS2得电子,D错误;
故答案为:A。
16.(1)恒压滴液漏斗
(2)A、E
(3) a 防止水蒸气进入C装置
(4) +3
(5) 过量
(6)甲醇
【分析】利用A装置制备,在C装置中甲酸、和反应生成连二亚硫酸钠,反应的化学方程式为,D装置中碱液吸收处理尾气。
【详解】(1)装置a为恒压滴液漏斗,其侧管将上下气体连通,因而能保持恒压;
(2)具有缓冲作用的装置能防倒吸,BCD装置能防倒吸,AE装置不能防倒吸,因此不能代替单向阀的是AE;
(3)连二亚硫酸钠具有较强的还原性,在空气中极易被氧化,因此制备前应先打开恒压滴液漏斗a的活塞,利用反应产生的将装置中的空气排尽;连二亚硫酸钠遇水会分解,因此需在A、B和C、D之间都添加一个装有浓硫酸的洗气装置,目的是防止水蒸气进入C装置;
(4)2分子脱去2个形成1个键得到,则的结构式为;为价,则中元素的化合价为+3价;
(5)已知:甲酸被氧化为,碱性条件下二氧化碳转化为碳酸根离子;由于制备的连二亚硫酸钠在碱性介质中较稳定,因此需要向三颈烧瓶中滴加过量的溶液;甲酸、和反应生成连二亚硫酸钠,根据质量守恒可知,还会生成碳酸钠和水,反应的化学方程式为;
(6)连二亚硫酸钠不溶于甲醇,因此制备结束后,过滤,用甲醇洗涤,干燥,可制得。
17.(1)2FeS2+30NaClO3+14H2SO4=30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O
(2) 提高化学反应速率,同时防止H2O2受热分解(或答:高于30℃会导(3)致H2O2分解,低于30℃会导致反应速率较低) 稀释ClO2,防止其发生爆炸 2CN +2ClO2=2CO2+N2+2Cl 吸收ClO2等气体,防止污染大气
【分析】以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN 废水,氮气很稳定,通入氮气从溶液中赶出ClO2,氮气稀释了ClO2气体,防止ClO2浓度过高发生爆炸,ClO2通入C中处理含CN 废水,装置D吸收尾气中的ClO2等污染大气的气体,以此解答。
【详解】(1)FeS2中+2价铁元素被氧化为Fe3,-1价硫元素被氧化为SO,NaClO3中+5价氯元素被还原为+4价ClO2,根据化合价升降守恒和元素守恒配平,其化学方程式为2FeS2+30NaClO3+14H2SO4=30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O。
(2)①反应容器B应置于30℃左右的水浴中,目的是提高化学反应速率,同时防止H2O2受热分解(或答:高于30℃会导(3)致H2O2分解,低于30℃会导致反应速率较低);
②氮气很稳定,通入氮气从溶液中赶出ClO2,氮气稀释了ClO2气体,防止ClO2浓度过高发生爆炸;
③ClO2具有较强氧化性,被还原为Cl-,CN-具有较强还原性,+2价碳元素被氧化为CO2,-3价氮元素被氧化为N2,由此写离子方程式为:2CN +2ClO2=2CO2+N2+2Cl ;装置D吸收尾气中的ClO2等污染大气的气体。
18.(1)C
(2)SO2 + 2H2O + Br2=4H+ + SO+ 2Br-
(3)B
(4)液封避免或减少溴的挥发
(5)3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑
【分析】海水进入酸化池利用稀硫酸酸化,然后进入氧化池,利用氯气把溴离子氧化为单质溴,生成的溴水进入吹出塔,利用热空气把溴蒸汽吹入到吸收塔中,利用二氧化硫把单质溴还原为溴离子,进入蒸馏塔,在利用氯气氧化,利用水蒸气吹出溴蒸汽,利用冷凝器冷凝得到液溴,据此解答;
【详解】(1)利用气体的易挥发性可以通过空气吹出发将气体从溶液中带出;“吹出塔”中通入热空气吹出溴蒸气,说明溴单质具有易挥发性,故答案为:C;
(2)“吸收塔”中SO2和Br2反应生成H2SO4和HBr,其反应的离子方程式为SO2 + 2H2O + Br2=4H+ + SO+ 2Br-,故答案为:SO2 + 2H2O + Br2=4H+ + SO+ 2Br-;
(3)由于NaBr与Cl2反应生成Br2,所以粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝,X可能是NaBr,故答案为:B;
(4)实验室保存液溴的试剂瓶中加一层水,其目的是防止液溴挥发,故答案为:防止液溴挥发;
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,其反应的化学方程式为3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑,故答案为:3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑。
19.(1)不属于
(2) 4:11 固硫,防止污染环境(或与SO2反应使其转化成CaSO3,最终转化成CaSO4,防止污染) SO2+2OH-=SO+H2O SiO、AlO FeS2+16Fe2O311Fe3O4+2SO2↑
【分析】铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2)通入氧气进行焙烧,FeS2被氧化成Fe2O3和SO2,SO2与少量CaO反应使其转化成CaSO3,最终转化成CaSO4,加入氢氧化钠溶液碱浸,SiO2转化为SiO、Al2O3转化为AlO,过滤后,滤渣中的Fe2O3与FeS2混合后焙烧(缺氧条件下)反应得到Fe3O4,据此分析解答。
【详解】(1)Fe3O4与酸反应生成两种盐,因此Fe3O4不属于碱性氧化物;
(2)①矿粉焙烧过程中,发生的氧化还原反应为4FeS2+11O22Fe2O3+8SO2,FeS2失去电子作还原剂,O2得到电子作氧化剂,所以还原剂和氧化剂物质的量之比为4:11;CaO能与SO2反应使其转化成CaSO3,最终转化成CaSO4,从而达到固硫的目的,防止污染环境;利用NaOH溶液吸收SO2的离子方程式为SO2+2OH-=SO+H2O;
②铝、硅氧化物均可以和碱反应进入溶液,因此滤液中含有的阴离子有OH-、SiO、AlO;
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,化学方程式为FeS2+16Fe2O311Fe3O4+2SO2↑。
答案第1页,共2页
答案第1页,共2页
姓名 班级
一、选择题
1.硫及其化合物的转化具有重要应用。下列说法不正确的是
A.实验室检验既具有氧化性也具有还原性:
B.工业制硫酸过程中的物质转化:
C.用脱除天然气中的:
D.实验室制备少量的原理:
2.钛铁矿与过氧化钠熔融后得到钛酸钠(),反应的化学方程式为:,下列有关说法正确的是
A.化合物中阴阳离子的个数比为1:1
B.该反应中的还原产物只有
C.若有1mol被氧化,则被还原的为2mol
D.每生成18.6g氧化钠,转移电子的物质的量是3.6mol
3.下列反应的离子方程式正确的是
A.的溶液中通入3.36L(标准状况):
B.和HI的反应:
C.向莫尔盐[]溶液中加入过量氢氧化钠溶液:
D.向明矾[]溶液中逐滴加入溶液至恰好沉淀完全:
4.能正确表示下列变化的离子方程式是
A.大理石与醋酸反应:
B.用氢氧化钠溶液吸收少量二氧化硫气体:
C.向碘化钾与碘酸钾的混合溶液中加入硫酸:
D.向溶液中加过量的溶液:
5.建设美丽乡村,守护中华家园,衣食住行皆化学。下列说法正确的是
A.粉刷墙壁使用的生石灰主要成分是Ca(OH)2
B.整修乡村公路大量使用的水泥属于新型无机非金属材料
C.合理使用添加剂有助于身体健康,维生素C因难与氧气反应而做抗氧化剂
D.公园增设健身器材表面涂一层防锈漆有利于延长使用时间
6.陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔,LiCoO2等杂质)制备碳酸钴的工艺流程如图:
下列有关描述错误的是
A.“滤液①”主要成分是NaAlO2
B.“操作①”、“操作②”的分离方法不同
C.“酸溶”反应中H2O2可以换成O2
D.“沉钴”时Na2CO3的滴速过快或浓度太大将导致产品不纯,其原因是溶液碱性增强会产生Co(OH)2杂质
7.下列常见金属的冶炼原理不合理的是
A.还原法炼铝: B.加热法炼汞:
C.热还原法炼铁: D.火法炼铜:
8.已知为一种常见酸的浓溶液,能使蔗糖粉末变黑。与反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为单质铁,则足量A与X在室温下即可完全反应
C.若A为单质碳,则将C通入少量澄清石灰水中,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为加热、催化剂
9.设NA表示阿伏加德罗常数,下列说法正确的是
A.将0.1mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目为0.1NA
B.1L 0.1mol/L NaHSO4溶液中含有0.1NA个HSO
C.常温常压下,23g NO2和N2O4的混合气体一定含有NA个氧原子
D.0.1mol Na2O2固体与足量的H2O充分反应,转移0.2NA个电子
10.下列离子方程式错误的是
A.工业上用二氧化氮溶于水生产硝酸:
B.为测定空气中含量,将其通入到酸性溶液中:
C.海带提碘实验过程中,向含的溶液中滴加、稀硫酸:
D.研究温度对化学反应速率影响时,向溶液中滴加稀硫酸:
11.BaTiO3是一种压电材料。以BaSO4为原料,采用下列路线可制备粉状BaTiO3。已知“焙烧”后固体产物有BaCl2、易溶于水的BaS和微溶于水的CaS;“沉淀”步骤中生成的沉淀化学式为BaTiO(C2O4)2。
下列说法中错误的是
A.“焙烧”步骤中碳粉的主要作用是做还原剂
B.“浸取”步骤中的滤渣为CaS:“酸化”步骤中的酸可用盐酸或稀硫酸
C.“沉淀”步骤中发生反应的化学方程式为
D.“热分解”过程中产生的CO和CO2的物质的量之比为1:1
12.下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气:
B.过量铁粉加入稀硝酸中
C.NaOH溶液与少量H2C2O4溶液反应:
D.CuSO4溶液与过量浓氨水反应的离子方程式:
13.下列叙述对应的离子方程式正确的是
A.向饱和NaOH溶液通入过量CO2析出白色晶体:
B.向NaHSO3溶液中滴入酸化的Ba(NO3)2溶液产生白色沉淀:
C.碘化亚铁溶液中滴加少量稀硝酸:
D.IBr与NaOH溶液反应:
14.实验室中利用洁净的铜片和浓硫酸进行如图实验,其中所得“固体”中含有和白色物质,下列说法错误的是
A.与的物质的量之和可能为 B.为还原产物,为氧化产物
C.浓硫酸既表现酸性又表现氧化性 D.白色物质为
15.从矿物学资料查得,一定条件下自然界存在如下反应:,下列说法正确的是
(提示:化学反应中,元素化合价升高说明原子失去电子被氧化,元素化合价降低说明原子得到电子被还原;原子之间得失电子叫做电子的转移)
A.CuSO4在反应中会氧化FeS2
B.Cu2S既是氧化产物又是还原产物
C.每5个FeS2发生反应,有10个电子发生转移
D.FeS2在反应中只得电子
二、实验题
16.连二亚硫酸钠是一种漂白剂,由于它对衣物的损伤和氧化剂相比要小得多,可用于各种纤维的纺织品而不至于造成伤害,所以也叫做保险粉。某化学小组用如图所示装置制取。
已知:连二亚硫酸钠不溶于甲醇,遇水会分解,在碱性介质中较稳定。
(1)装置的名称是 。
(2)单向阀的作用是防止倒吸,下列装置不能代替单向阀的是 (填字母)。
(3)制备前应先打开装置 (填“a”或“c”)的活塞;在C、D之间应添加一个装置,该装置的作用是
(4)中元素的化合价为 价。已知亚硫酸的结构式为,则连二亚硫酸根的结构式为 。
(5)制备时打开B装置的活塞,向三颈烧瓶中滴加 (填“少量”或“过量”)的溶液;写出生成的化学方程式(已知:甲酸被氧化为): 。
(6)制备结束后,过滤,用 洗涤,干燥,制得。
17.二氧化氯(ClO2)和臭氧(O3)均具有强氧化性,可用于水处理。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸;O3是一种微溶于水的蓝色气体,其体积分数超过25%时容易引起爆炸。
(1)以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为 。
(2)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN 废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
①反应容器B应置于30℃左右的水浴中,目的是 。
②通入氮气的目的除了有利于将ClO2排出,还有 。
③ClO2处理含CN 废水的离子方程式为 。
装置D的作用是 。
三、工业流程题
18.溴及溴化物在医药、农药、染料和阻燃剂等的生产中有广泛应用。以海水为原料提取溴单质的流程如下:
请回答下列问题:
(1)“吹出塔”中通入热空气吹出溴蒸气,说明溴单质最具有的性质可能是___________(填标号)。
A.氧化性 B.还原性 C.易挥发性 D.活泼性
(2)“吸收塔”中发生反应的离子方程式为 。
(3)粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝。X可能是___________(填标号)。
A.NaI B.NaBr C.NaOH D.NaCl
(4)实验室保存液溴的试剂瓶中加一层水,其目的是 。
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式为 。
19.四川含有非常丰富的矿产资源。以川西铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2)为原料,生产Fe3O4的部分工艺流程如下:
(1)Fe3O4 (填“属于”或“不属于”)碱性氧化物。
(2)已知上述流程中两次焙烧均会产生SO2,滤渣中含大量的Fe2O3。
①矿粉焙烧过程中还原剂和氧化剂物质的量之比为 ,过程加入少量CaO的目的是 ,用NaOH溶液吸收SO2离子方程式为
②“过滤”得到的滤液中含有的阴离子有OH-、 。
③Fe2O3与FeS2混合后焙烧(缺氧条件下)反应的化学方程式为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.使酸性高锰酸钾溶液褪色体现还原性,和Na2S反应生成S体现其氧化性,故A正确;
B.工业制硫酸过程中的物质转化为:FeS2和O2反应生成SO2,SO2发生催化氧化反应生成SO3,SO3和H2O反应生成H2SO4,故B错误;
C.具有氧化性,具有还原性,二者发生反应可以用于脱除天然气中的,故C正确;
D.Cu和浓硫酸在加热的条件下发生反应生成SO2,可以制备少量,方程式为:,故D正确;
故选B。
2.C
【详解】A.Na2O2中阳离子为Na+、阴离子为,所以Na2O2晶体中阴阳离子个数之比为1:2,A错误;
B.该反应中,FeTiO3中铁、 Ti元素的化合价升高,被氧化,Na2O2中氧元素的化合价降低被还原,若3molNa2O2参加反应,则由Na2O2生成的-2价氧原子为6mol,所以除了Na2O是还原产物外,Na2FeO4和Na2TiO4也是还原产物,B错误;
C.Fe的化合价从+2价升高到+6价,Na2O2中O元素的化合价从-1价降低到-2价。由化学计量数可知,有1molFe2+被氧化,则Fe2+失去的电子为4mol,所以被Fe2+还原的Na2O2为2mol,C正确;
D.n(Na2O)==18.6g÷62g/mol=0.3mol, 每生成1mol Na2O转移6 mol电子,则生成0.3 mol Na2O转移1.8 mol电子,D错误;
故选C。
3.A
【详解】A.Fe2+的还原性强于Br-,因此Cl2先和Fe2+发生反应,的(为0.15mol)溶液中通入3.36L(标准状况,为0.15mol),则亚铁离子完全反应,与亚铁离子反应的氯气为0.075mol、则剩余的0.075mol氯气消耗0.15mol溴离子,即消耗Fe2+、Br-、Cl2的物质的量分别为0.15:0.15:0.15,正确的离子反应方程式为,故A正确;
B.Fe3+具有强氧化性,I-具有强还原性,两者发生氧化还原反应生成碘单质和亚铁离子,即,B错误;
C.向莫尔盐[]溶液中加入过量氢氧化钠溶液,铵根离子完全转化为一水合氨,亚铁离子完全转化为氢氧化亚铁沉淀,反应为:,C错误;
D.明矾[]溶液中逐滴加入溶液至恰好沉淀完全,则氢氧根离子使得铝离子恰好转化为偏铝酸根离子:,D错误;
故选A。
4.B
【详解】A.醋酸为弱酸不能拆、碳酸钙不溶于水不能拆,反应为,A错误;
B.氢氧化钠溶液吸收少量二氧化硫气体生成亚硫酸钠和水:,B正确;
C.向碘化御与碘酸钾的混合溶液中加入硫酸发生归中反应生成碘单质,根据电子守恒可知反应为:,C错误;
D.向溶液中加过量的溶液,碳酸氢根离子也会和氢氧根离子生成水和碳酸根离子:,D错误;
故选B。
5.D
【详解】A.生石灰的主要成分是氧化钙(CaO),A错误;
B.水泥属于硅酸盐材料,属于传统无机非金属材料,B错误;
C.维生素C易与氧气反应,具有还原性,C错误;
D.防锈漆有利于保护器材,防止器材生锈,D正确;
故选D。
6.B
【分析】经过第一步碱浸操作,废料中的铝箔溶解转化为NaAlO2(滤液①)而被除去,钴渣①主要含Co3O4和LiCoO2,后续萃取的是Co2+,说明经过酸溶之后,Co元素转化为Co2+,即在酸溶步骤中Co元素被还原,故H2O2此时作还原剂,经过操作①得到滤液②,说明操作①为过滤操作,所得滤液②中主要含CoSO4和Li2SO4,经过萃取操作(操作②)实现两者分离,有机相中为CoR2,向有机相中加入硫酸,进行反萃取,实现Co元素从有机相转移到水相,最后经过沉钴操作获得CoCO3,据此分析解题。
【详解】A.由分析知,滤液①”主要成分是NaAlO2,A正确;
B.“操作①”为过滤,“操作②”为萃取、分液,二者的分离方法不同,B错误;
C.由分析知,“酸溶”反应中H2O2作还原剂,不可以换成O2,C正确;
D.“沉钴”时Na2CO3的滴速过快或浓度太大溶液碱性增强会产生Co(OH)2杂质,将导致产品不纯,D正确;
故答案为:B。
7.A
【分析】对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来;在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来;活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属。
【详解】A.Al的还原性大于氢气,氢气不能与氧化铝反应制Al,故A错误;
B.Hg为不活泼金属,通常直接加热其化合物冶炼Hg,故B正确;
C.一氧化碳还原氧化铁生成铁和二氧化碳,能炼铁,故C正确;
D.Cu为不活泼金属,与氧气高温条件下反应可制得Cu,故D正确;
故选A。
8.D
【分析】X为一种常见酸的浓溶液,能使蔗糖粉末变黑,X为浓硫酸。
【详解】A.浓硫酸使蔗糖变黑主要体现了浓硫酸的脱水性,A错误;
B.若A为铁,铁室温下与浓硫酸钝化,不可完全反应,B错误;
C.浓硫酸与碳单质发生氧化还原反应生成二氧化硫和二氧化碳、水,SO2与O2在催化剂、加热条件下反应制备SO3,三氧化硫和水生成硫酸,则B为SO2;C为二氧化碳,将CO2通入少量澄清石灰水中,二氧化碳过量,生成碳酸氢钙,不一定观察到白色沉淀产生,C错误;
D.由C分析可知,工业上,二氧化硫转化为三氧化硫的反应条件为加热、催化剂,D正确;
故选D。
9.C
【详解】A.将0.1mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目小于0.1NA,A错误;
B.在水溶液中 ,NaHSO4溶液中不存在硫酸氢根离子,B错误;
C.常温常压下,23g NO2和N2O4的混合气体一定含有氧原子的物质的量为:,氧原子的个数为NA个,C正确;
D.根据 ,所以0.1mol Na2O2固体与足量的H2O充分反应,生成0.05mol氧气,转移NA=0.1NA个电子,D错误;
故选C。
10.D
【详解】A.工业上用二氧化氮溶于水生产硝酸,二氧化氮和水反应生成硝酸和一氧化氮:,故A正确;
B.为测定空气中SO2含量,将其通入到酸性KMnO4溶液中,,二氧化硫具有还原性,被高锰酸钾氧化为硫酸,高锰酸钾被还原为硫酸锰,反应的离子方程式:,故B正确;
C.海带提碘实验过程中,向含I-的溶液中滴加H2O2、稀硫酸,酸性溶液中过氧化氢氧化碘离子生成碘单质,反应的离子方程式为:2I-+H2O2+2H+=I2+2H2O,故C正确;
D.向Na2S2O3溶液中滴加稀硫酸反应生成硫单质、二氧化硫和水,反应的离子方程式为:,故D错误;
故选:D。
11.B
【分析】由流程和题中信息可知,BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、易溶于水的BaS和微溶于水的CaS;烧渣经水浸取后过滤,滤渣中碳粉和CaS,滤液中有BaS和BaCl2;滤液经酸化后浓缩结晶得到BaCl2晶体;BaCl2晶体溶于水后,加入TiCl4和(NH4)2C2O4将钡离子充分沉淀得到BaTiO(C2O4)2;BaTiO(C2O4)2经热分解得到BaTiO3。
【详解】A.“焙烧”步骤中BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、易溶于水的BaS和微溶于水的CaS,C的化合价从0价到+2价,即碳粉的主要作用是做还原剂,故A正确;
B.“浸取”步骤中的滤渣为CaS和碳粉;“酸化”步骤中的酸可用盐酸,稀硫酸会加入杂质离子不可用,故B错误;
C.“沉淀”步骤为BaCl2晶体溶于水后,加入TiCl4和(NH4)2C2O4将钡离子充分沉淀得到BaTiO(C2O4)2,对应的化学方程式为:,故C正确;
D.BaTiO(C2O4)2经热分解得到BaTiO3,对应的化学方程式为: ,CO和CO2的物质的量之比为1:1,故D正确;
故选B。
12.C
【详解】A.氯气先氧化碘离子,然后氧化亚铁离子,FeI2和Cl2以1:1反应时,氯气只能氧化碘离子,离子方程式为2I-+Cl2═I2+2Cl-,故A错误;
B.过量铁粉加入稀硝酸中应生成Fe2+,正确离子反应为:3Fe+8H++2=3Fe2++2NO↑+4H2O,故B错误;
C.NaOH和少量H2C2O4反应生成Na2C2O4和H2O,离子方程式为,故C正确;
D.CuSO4溶液和过量浓氨水反应生成铜氨络合物,离子方程式为Cu2++4NH3 H2O=[Cu(NH3)4]2++4H2O,故D错误;
故选:C。
13.D
【详解】A.向饱和NaOH溶液通入过量析出白色晶体即产生沉淀,故离子方程式为:,故A错误;
B.硝酸具有强氧化性,能够将NaHSO3氧化为硫酸钠,硫酸钠与硝酸钡反应生成难溶于酸的硫酸钡,向NaHSO3溶液中滴入酸化的Ba(NO3)2溶液产生白色沉淀的离子方程式为:,故B错误;
C.碘离子的还原性比亚铁离子强,碘化亚铁中滴入少量稀硝酸,先与碘离子反应,正确离子方程式为:2+6I-+8H+=3I2+2NO↑+4H2O,故C错误;
D.IBr中I为+1价,Br为 1价,则IBr与NaOH溶液反应:IBr+2OH-=Br-+IO- +H2O,故D正确;
故选D。
14.A
【分析】由图知,铜与足量浓硫酸反应生成Cu2S和白色物质X,无气体生成,生成Cu2S时铜元素从0价升高到+1价、硫元素从+6价降低到-2价,则按得失电子数守恒、必定存在其他产物(所含元素化合价升高)、按元素质量守恒只能为CuSO4,则白色物质X为CuSO4,配平得到该反应方程式为:5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O,据此回答。
【详解】A.由5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O知,3molCu生成0.6molCu2S,0.6molCu2S发生反应3Cu2S+16H++4NO=6Cu2++3S↓+4NO↑+8H2O得到0.8mol NO与0.6mol S,NO与S物质的量之和为1.4mol,A错误;
B.Cu2S和白色物质CuSO4加稀硫酸和稀硝酸时溶解,存在反应:3Cu2S+16H++4 NO=6Cu2++3S↓+4NO↑+8H2O,Y为S单质,则NO为还原产物、Y为氧化产物,B正确;
C.由5Cu+4H2SO4(浓)=3CuSO4+Cu2S+4H2O可知,硫元素从+6价降低到-2价时表现氧化性,同时生成硫酸铜表现酸性,C正确;
D.由分析可知,白色物质X为CuSO4,D正确;
故选:A。
15.A
【详解】A.14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,的S元素的化合价由-1价升高为+6价,CuSO4作氧化剂、的FeS2作还原剂,的FeS2作氧化剂,所以CuSO4在反应中会氧化FeS2,A正确;
B.生成Cu2S消耗的FeS2、CuSO4都作氧化剂,氧化剂对应的产物是还原产物,所以Cu2S是还原产物,B错误;
C.每5个FeS2发生反应,转移电子的个数为×5×2×[(+6)-(-1)]=21,C错误;
D.该反应中的FeS2失电子,的FeS2得电子,D错误;
故答案为:A。
16.(1)恒压滴液漏斗
(2)A、E
(3) a 防止水蒸气进入C装置
(4) +3
(5) 过量
(6)甲醇
【分析】利用A装置制备,在C装置中甲酸、和反应生成连二亚硫酸钠,反应的化学方程式为,D装置中碱液吸收处理尾气。
【详解】(1)装置a为恒压滴液漏斗,其侧管将上下气体连通,因而能保持恒压;
(2)具有缓冲作用的装置能防倒吸,BCD装置能防倒吸,AE装置不能防倒吸,因此不能代替单向阀的是AE;
(3)连二亚硫酸钠具有较强的还原性,在空气中极易被氧化,因此制备前应先打开恒压滴液漏斗a的活塞,利用反应产生的将装置中的空气排尽;连二亚硫酸钠遇水会分解,因此需在A、B和C、D之间都添加一个装有浓硫酸的洗气装置,目的是防止水蒸气进入C装置;
(4)2分子脱去2个形成1个键得到,则的结构式为;为价,则中元素的化合价为+3价;
(5)已知:甲酸被氧化为,碱性条件下二氧化碳转化为碳酸根离子;由于制备的连二亚硫酸钠在碱性介质中较稳定,因此需要向三颈烧瓶中滴加过量的溶液;甲酸、和反应生成连二亚硫酸钠,根据质量守恒可知,还会生成碳酸钠和水,反应的化学方程式为;
(6)连二亚硫酸钠不溶于甲醇,因此制备结束后,过滤,用甲醇洗涤,干燥,可制得。
17.(1)2FeS2+30NaClO3+14H2SO4=30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O
(2) 提高化学反应速率,同时防止H2O2受热分解(或答:高于30℃会导(3)致H2O2分解,低于30℃会导致反应速率较低) 稀释ClO2,防止其发生爆炸 2CN +2ClO2=2CO2+N2+2Cl 吸收ClO2等气体,防止污染大气
【分析】以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN 废水,氮气很稳定,通入氮气从溶液中赶出ClO2,氮气稀释了ClO2气体,防止ClO2浓度过高发生爆炸,ClO2通入C中处理含CN 废水,装置D吸收尾气中的ClO2等污染大气的气体,以此解答。
【详解】(1)FeS2中+2价铁元素被氧化为Fe3,-1价硫元素被氧化为SO,NaClO3中+5价氯元素被还原为+4价ClO2,根据化合价升降守恒和元素守恒配平,其化学方程式为2FeS2+30NaClO3+14H2SO4=30ClO2↑+Fe2(SO4)3+15Na2SO4+14H2O。
(2)①反应容器B应置于30℃左右的水浴中,目的是提高化学反应速率,同时防止H2O2受热分解(或答:高于30℃会导(3)致H2O2分解,低于30℃会导致反应速率较低);
②氮气很稳定,通入氮气从溶液中赶出ClO2,氮气稀释了ClO2气体,防止ClO2浓度过高发生爆炸;
③ClO2具有较强氧化性,被还原为Cl-,CN-具有较强还原性,+2价碳元素被氧化为CO2,-3价氮元素被氧化为N2,由此写离子方程式为:2CN +2ClO2=2CO2+N2+2Cl ;装置D吸收尾气中的ClO2等污染大气的气体。
18.(1)C
(2)SO2 + 2H2O + Br2=4H+ + SO+ 2Br-
(3)B
(4)液封避免或减少溴的挥发
(5)3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑
【分析】海水进入酸化池利用稀硫酸酸化,然后进入氧化池,利用氯气把溴离子氧化为单质溴,生成的溴水进入吹出塔,利用热空气把溴蒸汽吹入到吸收塔中,利用二氧化硫把单质溴还原为溴离子,进入蒸馏塔,在利用氯气氧化,利用水蒸气吹出溴蒸汽,利用冷凝器冷凝得到液溴,据此解答;
【详解】(1)利用气体的易挥发性可以通过空气吹出发将气体从溶液中带出;“吹出塔”中通入热空气吹出溴蒸气,说明溴单质具有易挥发性,故答案为:C;
(2)“吸收塔”中SO2和Br2反应生成H2SO4和HBr,其反应的离子方程式为SO2 + 2H2O + Br2=4H+ + SO+ 2Br-,故答案为:SO2 + 2H2O + Br2=4H+ + SO+ 2Br-;
(3)由于NaBr与Cl2反应生成Br2,所以粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝,X可能是NaBr,故答案为:B;
(4)实验室保存液溴的试剂瓶中加一层水,其目的是防止液溴挥发,故答案为:防止液溴挥发;
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,其反应的化学方程式为3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑,故答案为:3Br2 + 3Na2CO3=5NaBr + NaBrO3 + 3CO2↑。
19.(1)不属于
(2) 4:11 固硫,防止污染环境(或与SO2反应使其转化成CaSO3,最终转化成CaSO4,防止污染) SO2+2OH-=SO+H2O SiO、AlO FeS2+16Fe2O311Fe3O4+2SO2↑
【分析】铝土矿(主要成分为Al2O3、Fe2O3、SiO2、少量FeS2)通入氧气进行焙烧,FeS2被氧化成Fe2O3和SO2,SO2与少量CaO反应使其转化成CaSO3,最终转化成CaSO4,加入氢氧化钠溶液碱浸,SiO2转化为SiO、Al2O3转化为AlO,过滤后,滤渣中的Fe2O3与FeS2混合后焙烧(缺氧条件下)反应得到Fe3O4,据此分析解答。
【详解】(1)Fe3O4与酸反应生成两种盐,因此Fe3O4不属于碱性氧化物;
(2)①矿粉焙烧过程中,发生的氧化还原反应为4FeS2+11O22Fe2O3+8SO2,FeS2失去电子作还原剂,O2得到电子作氧化剂,所以还原剂和氧化剂物质的量之比为4:11;CaO能与SO2反应使其转化成CaSO3,最终转化成CaSO4,从而达到固硫的目的,防止污染环境;利用NaOH溶液吸收SO2的离子方程式为SO2+2OH-=SO+H2O;
②铝、硅氧化物均可以和碱反应进入溶液,因此滤液中含有的阴离子有OH-、SiO、AlO;
③Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,化学方程式为FeS2+16Fe2O311Fe3O4+2SO2↑。
答案第1页,共2页
答案第1页,共2页
