化学人教版(2019)必修第一册2.1.2钠的化合物及其 焰色实验 课件(共55张ppt+5个视频)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2钠的化合物及其 焰色实验 课件(共55张ppt+5个视频) |
|
|
| 格式 | pptx | ||
| 文件大小 | 140.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-10 00:00:00 | ||
图片预览






文档简介
(共55张PPT)
第一节 钠及其化合物
第二课时 钠的化合物及其
焰色实验
第二章 海水中的重要元素
——钠和氯
情境引入
氧化钠
过氧化钠
Na2O
Na2O2
物质
生成条件
颜色状态
化合价
Na2O
Na2O2
4Na+O2
2Na2O
Na2O2
2Na+O2
阳、阴离子个数比
2:1
2:1
白色固体
淡黄色固体
-2
-1
+1
+1
(常温)
(加热)
Δ
(一)结构与物理性质
是否为碱性氧化物
是
否
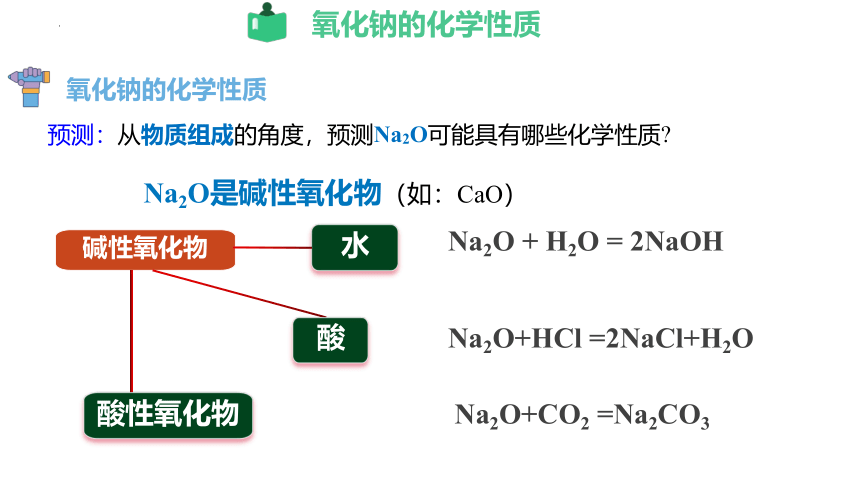
氧化钠的化学性质
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
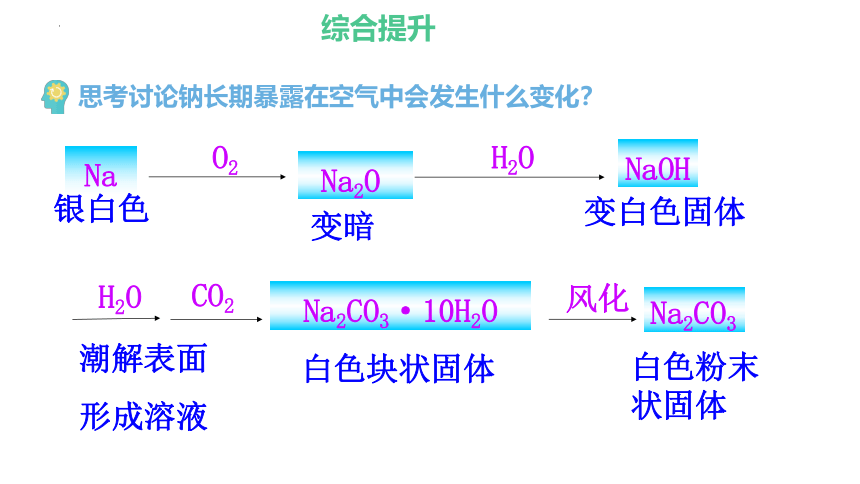
Na2CO3·10H2O
O2
H2O
Na2O
变暗
NaOH
变白色固体
Na2CO3
白色粉末状固体
CO2
Na
银白色
风化
H2O
潮解表面
形成溶液
白色块状固体
思考讨论钠长期暴露在空气中会发生什么变化?
综合提升
氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成什么物质呢?
【实验2-3】
实验目的:探究Na2O2与水的反应
把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞溶液,有什么现象发生?
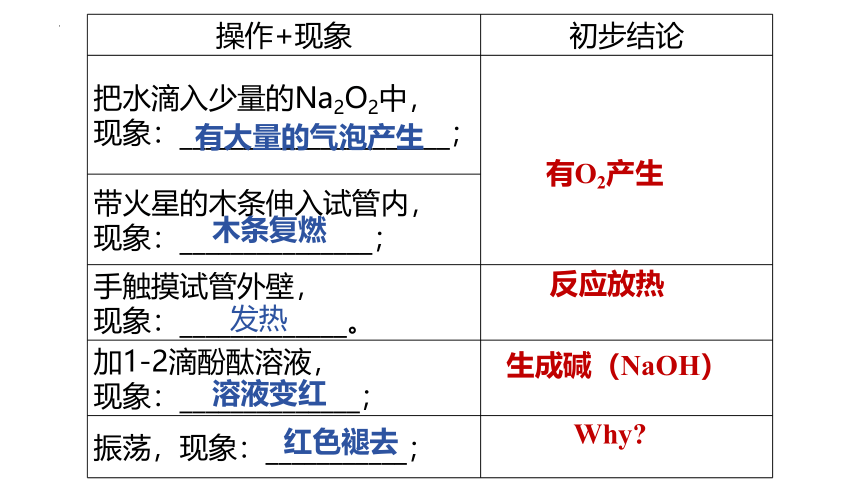
操作+现象 初步结论
把水滴入少量的Na2O2中, 现象:_____________________;
带火星的木条伸入试管内, 现象:_______________;
手触摸试管外壁, 现象:_____________。
加1-2滴酚酞溶液, 现象:______________;
振荡,现象:___________;
有大量的气泡产生
木条复燃
有O2产生
发热
反应放热
溶液变红
生成碱(NaOH)
红色褪去
Why
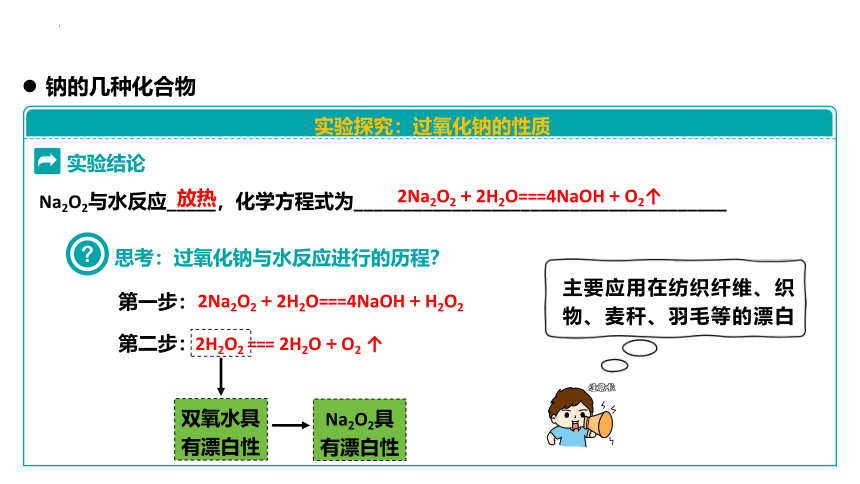
实验结论
Na2O2与水反应_____,化学方程式为______________________________________
放热
2Na2O2+2H2O===4NaOH+O2↑
钠的几种化合物
实验探究:过氧化钠的性质
2Na2O2+2H2O===4NaOH+H2O2
2H2O2 === 2H2O+O2 ↑
思考:过氧化钠与水反应进行的历程?
第一步:
第二步:
双氧水具
有漂白性
Na2O2具
有漂白性
主要应用在纺织纤维、织物、麦秆、羽毛等的漂白
【思考】氧化钠、过氧化钠是否属于碱性氧化物?
氧化钠属于碱性氧化物、过氧化钠不属于碱性氧化物
原因:过氧化钠与水反应,除了生成碱外,还生成氧气。
探究二:观看过氧化钠与二氧化碳的反应视频,写出相应的化学方程式
钠的几种化合物
实验探究:过氧化钠的性质
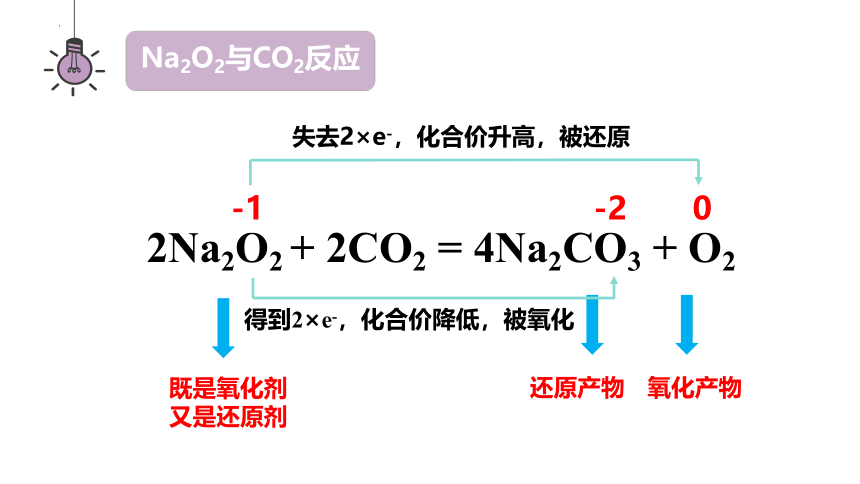
2Na2O2 + 2CO2 = 4Na2CO3 + O2
-1 -2 0
失去2×e-,化合价升高,被还原
得到2×e-,化合价降低,被氧化
既是氧化剂又是还原剂
还原产物
氧化产物
Na2O2与CO2反应
Na2O2的用途
用作供氧剂
用作漂白剂
用于杀菌、消毒
可在呼吸面具或潜水艇中作为氧气的来源
可用于漂白纺织类物品、麦杆、羽毛等
可用于对厨具、废水等杀菌、消毒
化学式 Na2O Na2O2
阴:阳离子
与H2O反应
与CO2反应
与盐酸反应
特性
主要用途
转化
1:2
1:2
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl==2NaCl+H2O
2Na2O2+4HCl==4NaCl+2H2O+O2↑
碱性氧化物
强氧化性、漂白性
供氧剂、漂白剂
思考2:将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
2Na2O2+2CO2 = 2Na2CO3+O2 Δm(固体)
2×78 2×44 2×106 32 56
44g 28g
结论:Na2O2与CO2的反应,固体增重,实为CO的质量
思考1:将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
2Na2O2+2H2O = 4NaOH+O2↑ Δm(固体)
2×78 2×18 4×40 4
18 g 2g
结论:Na2O2与H2O的反应,固体增重,实为H2的质量
探究过氧化钠与水、二氧化碳反应的定量关系
【例1】常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中消耗的二氧化碳的质量是_____g,生成的碳酸钠的质量是_____g。
【例2】 21.2 g H2在一定条件下与氧气充分反应后产生的水蒸气全部通入足量Na2O2中,固体质量增加( )
A.21.2 g B.14 g C.6.78 g D.不能确定
44
106
A
钠的化合物除了氧化钠和过氧化钠,还有碳酸钠和碳酸氢钠。他们分别有什么性质呢?
碳酸钠
碳酸氢钠
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
(1)Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
①观察外观;加1mL 水;触摸试管底部
②加10mL水
③加2滴酚酞溶液
结论
细小白色晶体;加水部分溶解;吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
[探究]
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
1、碳酸钠和碳酸氢钠的性质
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
Na2CO3 + xH2O ====== Na2CO3·xH2O
碳酸钠和碳酸氢钠的热稳定性
【实验2-5】如图,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
碳酸钠和碳酸氢钠的热稳定性
实验现象 实验现象 实验结论
Na2CO3很稳定,受热不分解
澄清石灰水不变浑浊
澄清石灰水变浑浊
NaHCO3不稳定,受热易分解
热稳定性:Na2CO3 > NaHCO3
2NaHCO3 Na2CO3 + H2O + CO2↑
碳酸钠和碳酸氢钠的热稳定性
【套管实验】
Na2CO3
NaHCO3
【现象】
两试管中均有气泡产生,A中澄清石灰水变浑浊,B中澄清石灰水不变浑浊。
Na2CO3 和NaHCO3与盐酸反应
实验操作:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。
Na2CO3 和NaHCO3与盐酸反应
Na2CO3 和NaHCO3与盐酸反应
实验操作 现象 结论与解释
两个气球均膨胀;NaHCO3与盐酸混合气球________________。
等质量的NaHCO3和Na2CO3分别与足量盐酸反应,NaHCO3反应更 _________,产生的气体________。
膨胀得更快更大
剧烈
更多
Na2CO3 +2HCl = 2NaCl+H2O+ CO2↑
NaHCO3 +HCl = NaCl+H2O+ CO2↑
反应方程式
化学性质
Na2CO3
少量盐酸:
过量盐酸:
CO32- + H+ = HCO3-
Na2CO3 + HCl=== NaHCO3 + NaCl
Na2CO3 + 2HCl=== 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
现象:过一小段时间才产生气泡,速率较慢。
等质量的Na2CO3 NaHCO3与足量盐酸反应,NaHCO3产生CO2更多。
化学性质
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
三
与盐酸反应
现象:立即产生气泡,速率较快。
思考:为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢;NaHCO3碱性较弱,反应速率快。
温馨提示:胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与氢氧化钠溶液
NaHCO3 + NaOH = Na2CO3 + H2O
不反应
碳酸氢钠与氢氧化钠溶液
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与澄清石灰水
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
碳酸氢钠与澄清石灰水
2NaHCO3 + Ca(OH)2 = CaCO3 + Na2CO3 + 2H2O
澄清石灰水少量
澄清石灰水过量
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
碳酸钠、碳酸氢钠与盐的反应
碳酸钠与可溶性钙盐/钡盐
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
碳酸氢钠与可溶性钙盐/钡盐
不反应
化学性质
三
向澄清石灰水持续通入二氧化碳,发现澄清石灰水先变浑浊后又变清,你知道为什么吗?
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3 + CO2 + H2O = 2NaHCO3↓
思考:
与CO2反应
Na2CO3
NaHCO3
不反应
(4)碳酸钠与碳酸氢钠的相互转化
①Na2CO3与CO2和水反应:
②NaHCO3与碱反应生成碳酸钠和水
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+ CO2+H2O= 2NaHCO3
2NaHCO3 = Na2CO3+H2O+CO2↑
③NaHCO3受热分解
问题:如何鉴别碳酸钠和碳酸氢钠?
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
【小结】碳酸钠和碳酸氢钠的性质比较
物质 Na2CO3 NaHCO3
俗名
外观
溶解度
溶液碱性强弱
与HCl反应
与NaOH反应
与CO2反应
热稳定性
与CaCl2反应
纯碱、苏打
小苏打
白色粉末
白色细小晶体
碳酸钠的溶解度大于碳酸氢钠
碳酸钠溶液的碱性强于碳酸氢钠溶液
Na2CO3+2HCl=NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
不反应
不反应
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
不反应
加热不分解
Na2CO3+CaCl2=CaCO3↓+ 2NaCl
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
Na2CO3 和NaHCO3的用途
纺织
造纸
制皂
制玻璃
Na2CO3
制胃药
烘焙糕点
NaHCO3
Na2CO3 和NaHCO3的用途
科学史话
我国化学工程专家侯德榜于1943年创立侯氏制碱法。原料是食盐水、氨气和二氧化碳,产品为纯碱和氯化铵。此方法提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍采用。变换气制碱的联碱工艺,是我国独创,具有显著的节能效果。
中国的脊梁——侯德榜
NaCl+NH3+CO2+H2O ══ NH4Cl+NaHCO3 ↓
2NaHCO3 ══ Na2CO3 + H2O + CO2 ↑
△
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
思考
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
焰色试验
注意:钠元素的焰色试验是黄色
钾元素的焰色试验呈蓝色
(透过蓝色的钴玻璃观察)。
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
焰色试验
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 ____色 __色 ___色(透过蓝色钴玻璃) 紫色 ____色 洋红色 ____色 __色
紫红
黄
紫
砖红
黄绿
绿
几种金属的焰色
焰色试验
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
应用
焰色试验
注意:焰色反应用来鉴别物质,这种鉴别方法属于物理变化,不属于化学变化
检验金属元素的存在
利用焰色试验制节日烟花
焰色试验的注意要点
1.焰色试验是物理变化而不是化学变化。
2.焰色试验是金属元素的性质,不是物质的性质。
3.并不是所有的金属元素都能发生焰色反应,如Fe。
4.在中学化学实验中要求掌握钠、钾的焰色反应,对于K+的火焰颜色必须透过蓝色钴玻璃进行观察,以防止Na+对其造成干扰。
4.应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
思考:1.在洗涤时能否把盐酸改为硝酸或硫酸?
2.所有的金属元素都能发生颜色反应吗?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
1. 膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③
C.①④ D.③④
B
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3D.热稳定性:NaHCO3C
4. 下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
C
5.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
6.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
第3课时 钠盐、焰色试验
Thanks
谢谢观看
第一节 钠及其化合物
第二课时 钠的化合物及其
焰色实验
第二章 海水中的重要元素
——钠和氯
情境引入
氧化钠
过氧化钠
Na2O
Na2O2
物质
生成条件
颜色状态
化合价
Na2O
Na2O2
4Na+O2
2Na2O
Na2O2
2Na+O2
阳、阴离子个数比
2:1
2:1
白色固体
淡黄色固体
-2
-1
+1
+1
(常温)
(加热)
Δ
(一)结构与物理性质
是否为碱性氧化物
是
否
氧化钠的化学性质
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
Na2CO3·10H2O
O2
H2O
Na2O
变暗
NaOH
变白色固体
Na2CO3
白色粉末状固体
CO2
Na
银白色
风化
H2O
潮解表面
形成溶液
白色块状固体
思考讨论钠长期暴露在空气中会发生什么变化?
综合提升
氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成什么物质呢?
【实验2-3】
实验目的:探究Na2O2与水的反应
把水滴入盛有少量Na2O2固体的试管中,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞溶液,有什么现象发生?
操作+现象 初步结论
把水滴入少量的Na2O2中, 现象:_____________________;
带火星的木条伸入试管内, 现象:_______________;
手触摸试管外壁, 现象:_____________。
加1-2滴酚酞溶液, 现象:______________;
振荡,现象:___________;
有大量的气泡产生
木条复燃
有O2产生
发热
反应放热
溶液变红
生成碱(NaOH)
红色褪去
Why
实验结论
Na2O2与水反应_____,化学方程式为______________________________________
放热
2Na2O2+2H2O===4NaOH+O2↑
钠的几种化合物
实验探究:过氧化钠的性质
2Na2O2+2H2O===4NaOH+H2O2
2H2O2 === 2H2O+O2 ↑
思考:过氧化钠与水反应进行的历程?
第一步:
第二步:
双氧水具
有漂白性
Na2O2具
有漂白性
主要应用在纺织纤维、织物、麦秆、羽毛等的漂白
【思考】氧化钠、过氧化钠是否属于碱性氧化物?
氧化钠属于碱性氧化物、过氧化钠不属于碱性氧化物
原因:过氧化钠与水反应,除了生成碱外,还生成氧气。
探究二:观看过氧化钠与二氧化碳的反应视频,写出相应的化学方程式
钠的几种化合物
实验探究:过氧化钠的性质
2Na2O2 + 2CO2 = 4Na2CO3 + O2
-1 -2 0
失去2×e-,化合价升高,被还原
得到2×e-,化合价降低,被氧化
既是氧化剂又是还原剂
还原产物
氧化产物
Na2O2与CO2反应
Na2O2的用途
用作供氧剂
用作漂白剂
用于杀菌、消毒
可在呼吸面具或潜水艇中作为氧气的来源
可用于漂白纺织类物品、麦杆、羽毛等
可用于对厨具、废水等杀菌、消毒
化学式 Na2O Na2O2
阴:阳离子
与H2O反应
与CO2反应
与盐酸反应
特性
主要用途
转化
1:2
1:2
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl==2NaCl+H2O
2Na2O2+4HCl==4NaCl+2H2O+O2↑
碱性氧化物
强氧化性、漂白性
供氧剂、漂白剂
思考2:将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
2Na2O2+2CO2 = 2Na2CO3+O2 Δm(固体)
2×78 2×44 2×106 32 56
44g 28g
结论:Na2O2与CO2的反应,固体增重,实为CO的质量
思考1:将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
2Na2O2+2H2O = 4NaOH+O2↑ Δm(固体)
2×78 2×18 4×40 4
18 g 2g
结论:Na2O2与H2O的反应,固体增重,实为H2的质量
探究过氧化钠与水、二氧化碳反应的定量关系
【例1】常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中消耗的二氧化碳的质量是_____g,生成的碳酸钠的质量是_____g。
【例2】 21.2 g H2在一定条件下与氧气充分反应后产生的水蒸气全部通入足量Na2O2中,固体质量增加( )
A.21.2 g B.14 g C.6.78 g D.不能确定
44
106
A
钠的化合物除了氧化钠和过氧化钠,还有碳酸钠和碳酸氢钠。他们分别有什么性质呢?
碳酸钠
碳酸氢钠
探究碳酸钠和碳酸氢钠的溶解性
在两只试管中分别加入少量碳酸钠和碳酸氢钠固体(各约1g),完成实验,观察实验现象。
实验2-4
(1)Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
①观察外观;加1mL 水;触摸试管底部
②加10mL水
③加2滴酚酞溶液
结论
细小白色晶体;加水部分溶解;吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
[探究]
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
1、碳酸钠和碳酸氢钠的性质
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
Na2CO3 + xH2O ====== Na2CO3·xH2O
碳酸钠和碳酸氢钠的热稳定性
【实验2-5】如图,分别加热Na2CO3和NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
碳酸钠和碳酸氢钠的热稳定性
实验现象 实验现象 实验结论
Na2CO3很稳定,受热不分解
澄清石灰水不变浑浊
澄清石灰水变浑浊
NaHCO3不稳定,受热易分解
热稳定性:Na2CO3 > NaHCO3
2NaHCO3 Na2CO3 + H2O + CO2↑
碳酸钠和碳酸氢钠的热稳定性
【套管实验】
Na2CO3
NaHCO3
【现象】
两试管中均有气泡产生,A中澄清石灰水变浑浊,B中澄清石灰水不变浑浊。
Na2CO3 和NaHCO3与盐酸反应
实验操作:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的Na2CO3、NaHCO3粉末的小气球分别套在两支试管的管口。将气球内的Na2CO3和NaHCO3同时倒入试管中。
Na2CO3 和NaHCO3与盐酸反应
Na2CO3 和NaHCO3与盐酸反应
实验操作 现象 结论与解释
两个气球均膨胀;NaHCO3与盐酸混合气球________________。
等质量的NaHCO3和Na2CO3分别与足量盐酸反应,NaHCO3反应更 _________,产生的气体________。
膨胀得更快更大
剧烈
更多
Na2CO3 +2HCl = 2NaCl+H2O+ CO2↑
NaHCO3 +HCl = NaCl+H2O+ CO2↑
反应方程式
化学性质
Na2CO3
少量盐酸:
过量盐酸:
CO32- + H+ = HCO3-
Na2CO3 + HCl=== NaHCO3 + NaCl
Na2CO3 + 2HCl=== 2NaCl+H2O +CO2↑
CO32- + 2H+ = H2O + CO2↑
三
与盐酸反应
【实验拓展】
在两支试管中分别加入等质量NaHCO3和Na2CO3,滴加等体积的稀盐酸,观察现象。
现象:过一小段时间才产生气泡,速率较慢。
等质量的Na2CO3 NaHCO3与足量盐酸反应,NaHCO3产生CO2更多。
化学性质
NaHCO3 +HCl===NaCl+H2O+CO2↑
NaHCO3
HCO3- + H+ = H2O + CO2↑
三
与盐酸反应
现象:立即产生气泡,速率较快。
思考:为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢;NaHCO3碱性较弱,反应速率快。
温馨提示:胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与氢氧化钠溶液
NaHCO3 + NaOH = Na2CO3 + H2O
不反应
碳酸氢钠与氢氧化钠溶液
碳酸钠、碳酸氢钠与碱的反应
碳酸钠与澄清石灰水
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
碳酸氢钠与澄清石灰水
2NaHCO3 + Ca(OH)2 = CaCO3 + Na2CO3 + 2H2O
澄清石灰水少量
澄清石灰水过量
NaHCO3 + Ca(OH)2 = CaCO3 + NaOH + H2O
碳酸钠、碳酸氢钠与盐的反应
碳酸钠与可溶性钙盐/钡盐
Na2CO3 + CaCl2 = CaCO3 + 2NaCl
碳酸氢钠与可溶性钙盐/钡盐
不反应
化学性质
三
向澄清石灰水持续通入二氧化碳,发现澄清石灰水先变浑浊后又变清,你知道为什么吗?
【类比】若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
现象:溶液变浑浊或有晶体析出
Na2CO3 + CO2 + H2O = 2NaHCO3↓
思考:
与CO2反应
Na2CO3
NaHCO3
不反应
(4)碳酸钠与碳酸氢钠的相互转化
①Na2CO3与CO2和水反应:
②NaHCO3与碱反应生成碳酸钠和水
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+ CO2+H2O= 2NaHCO3
2NaHCO3 = Na2CO3+H2O+CO2↑
③NaHCO3受热分解
问题:如何鉴别碳酸钠和碳酸氢钠?
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
【小结】碳酸钠和碳酸氢钠的性质比较
物质 Na2CO3 NaHCO3
俗名
外观
溶解度
溶液碱性强弱
与HCl反应
与NaOH反应
与CO2反应
热稳定性
与CaCl2反应
纯碱、苏打
小苏打
白色粉末
白色细小晶体
碳酸钠的溶解度大于碳酸氢钠
碳酸钠溶液的碱性强于碳酸氢钠溶液
Na2CO3+2HCl=NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
不反应
不反应
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+CO2+H2O=2NaHCO3
不反应
加热不分解
Na2CO3+CaCl2=CaCO3↓+ 2NaCl
2NaHCO3 = Na2CO3 + H2O + CO2↑
△
Na2CO3 和NaHCO3的用途
纺织
造纸
制皂
制玻璃
Na2CO3
制胃药
烘焙糕点
NaHCO3
Na2CO3 和NaHCO3的用途
科学史话
我国化学工程专家侯德榜于1943年创立侯氏制碱法。原料是食盐水、氨气和二氧化碳,产品为纯碱和氯化铵。此方法提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足,曾在全球享有盛誉,得到普遍采用。变换气制碱的联碱工艺,是我国独创,具有显著的节能效果。
中国的脊梁——侯德榜
NaCl+NH3+CO2+H2O ══ NH4Cl+NaHCO3 ↓
2NaHCO3 ══ Na2CO3 + H2O + CO2 ↑
△
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
思考
1.定义:很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
焰色试验
注意:钠元素的焰色试验是黄色
钾元素的焰色试验呈蓝色
(透过蓝色的钴玻璃观察)。
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
焰色试验
金属元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 ____色 __色 ___色(透过蓝色钴玻璃) 紫色 ____色 洋红色 ____色 __色
紫红
黄
紫
砖红
黄绿
绿
几种金属的焰色
焰色试验
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
应用
焰色试验
注意:焰色反应用来鉴别物质,这种鉴别方法属于物理变化,不属于化学变化
检验金属元素的存在
利用焰色试验制节日烟花
焰色试验的注意要点
1.焰色试验是物理变化而不是化学变化。
2.焰色试验是金属元素的性质,不是物质的性质。
3.并不是所有的金属元素都能发生焰色反应,如Fe。
4.在中学化学实验中要求掌握钠、钾的焰色反应,对于K+的火焰颜色必须透过蓝色钴玻璃进行观察,以防止Na+对其造成干扰。
4.应用:
1.鉴别一些金属元素;
2.用相应的金属化合物制作烟火。
思考:1.在洗涤时能否把盐酸改为硝酸或硫酸?
2.所有的金属元素都能发生颜色反应吗?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
1. 膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,使面坯起发,形成致密多孔组织,从而使制品具有膨松、柔软或酥脆的一类物质。为使以面粉为原料的面包松软可口,通常用碳酸氢钠作膨松剂,因为它①热稳定性差 ②增加甜味 ③产生二氧化碳 ④提供钠离子。其中合理的是( )
A.②③ B.①③
C.①④ D.③④
B
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.下列有关Na2CO3与NaHCO3的性质比较中不正确的是( )
A.相同溶质质量分数两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同溶质质量分数的稀硫酸反应放出气泡的速率:NaHCO3
4. 下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象的是( )
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
C
5.下列实验方法能达到实验目的的是( )
A.加热可除去NaHCO3固体中少量的Na2CO3
B.用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液
C.用NaOH溶液鉴别BaCl2溶液和MgCl2溶液
D.用闻气味的方法鉴别CO2和CO
C
6.如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
A.a先通入CO2,然后b通入NH3,c中放碱石灰
B.a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C.b先通入NH3,然后a通入CO2,c中放碱石灰
D.b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
B
第3课时 钠盐、焰色试验
Thanks
谢谢观看
