化学人教版(2019)必修第一册2.1.1钠及其性质应用 课件(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.1钠及其性质应用 课件(共36张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 64.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-10 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
第二章 海水中的重要元素---钠和氯
第一节 钠及其化合物
第1课时 活泼金属-钠
3
2
本节重点
本节难点
钠与水的反应
钠的原子结构
钠与非金属单质的反应
1
食盐与我们的生活密切相关,每个人天天都要吃一定量的盐,不吃盐就没有劲儿。据统计,正常每个人一天要消耗10-20克食盐,一年要消耗5-10公斤食盐。
躲在食盐里的金属
山西省运城盐湖里铲收原盐
海水中的钠元素以游离态还是化合态形式存在?
化合态形式存在
为什么海水中没有游离态的钠?你能解释吗?
猜测:钠是一种非常活泼的金属。
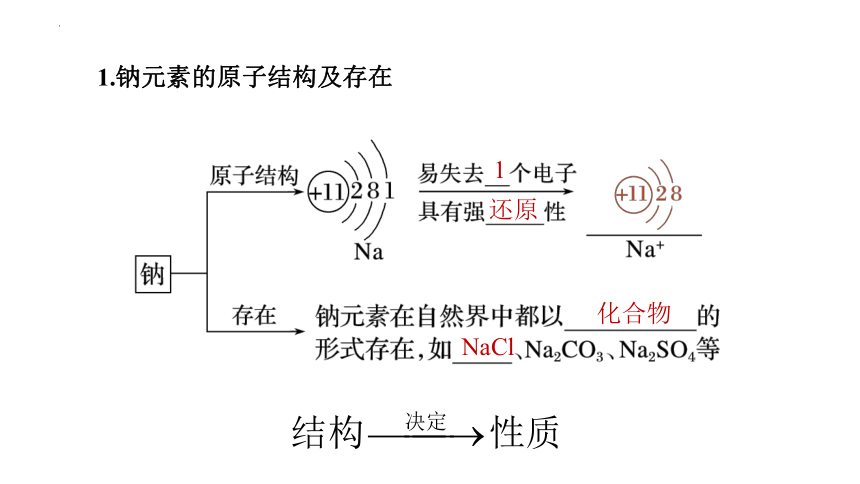
1.钠元素的原子结构及存在
1
还原
化合物
NaCl
钠常常保存在石蜡油或煤油中
探究一:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
活泼的金属单质——钠
实验探究:金属钠的性质
切割钠
实验现象
新切开的钠具有_______的金属光泽
银白
活泼的金属单质——钠
实验探究:金属钠的性质
实验结论:金属钠的物理性质
活泼的金属单质——钠
实验探究:金属钠的性质
颜色 状态 硬度
银白色 固体 小
实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气
结论:常温下,金属钠与氧气反应
4Na+O2===2Na2O
(白色)
实验现象
活泼的金属单质——钠
实验探究:金属钠的性质
在空气中很快________
变暗
如果加热,钠又会发生什么变化呢
把小块金属钠放在坩埚里加热,有什么现象?
钠受热先____________________,接着_____起来,火焰呈________, 最后生成_________固体。
2Na +O2 = Na2O2 (淡黄色)
△
实验现象
【实验3-2】
熔成银白色小球
燃烧
黄色
淡黄色
钠与氧气反应小结:
①常温下,空气中氧化
4Na+O2 =2Na2O (白色)
②钠在空气中燃烧
2Na+O2=Na2O2 (淡黄色)
△
注意:反应物相同,反应条件不同,产物不同!
2Na2O + O2 = 2Na2O2
△
产物的稳定性:Na2O < Na2O2
Na2O与Na2O2的比较
名称
颜色及 状态
氧元素 化合价
氧化钠
过氧化钠
白色固体
淡黄色固体
+1 -2
Na2O
+1 -1
Na2O2
Na2O
Na2O2
这两个反应是否属于氧化还原反应?若是,请用单双线桥表示,并指出氧化剂、还原剂、氧化产物、还原产物以及反应中转移的电子数目。
①生成Na2O:
②生成Na2O2:
则相同质量的两块钠,分别发生上述反应,转移的电子数:①=②。
0
0
+1 -2
失去4× e- ,化合价升高,被氧化
得到2× 2e- ,化合价降低,被还原
0
0
+1 -1
失去2× e- ,化合价升高,被氧化
得到2× e- ,化合价降低,被还原
归纳总结
活泼的金属单质——钠
实验探究:金属钠的性质
——钠与其他非金属单质化合生成的化合物中钠只显____价
+1
2Na+Cl2==== 2NaCl (白色)
加热
Na与Cl2在点燃条件下的反应
2Na+S====Na2S
Na与S在研磨条件下的反应
Na
(银白色)
Na2O
(表面变暗)
NaOH
(白色固体)
潮解
(表面变溶液)
Na2CO3·10H2O
(白色粉末)
Na2CO3
(白色粉末)
O2
H2O
Na长时间暴露在空气中,最后生成什么?
H2O
风化
CO2
2015年8月12日晚,天津滨海新区发生剧烈爆炸,消防员在短短几分钟就赶到起火点,迅速用水灭火,灭火过程中发生了更大二次和三次爆炸这一次事故造成死亡173人 据了解,在这个仓库内有易燃物品,主要是金属钠,约500吨。
新闻播报
【预测】
铜金属不与水反应,常温下可用铝或铁制容器盛水,说明铁或铝常温下不与水反应,那么钠能否与水反应呢?若能反应,请从物质组成及氧化还原反应的角度,预测钠与水反应的生成物?
1.理论预测
(1)从物质组成的角度来看,钠含有Na元素,水含有 元素。
(2)从氧化还原的角度来看,钠具有 性,水具有 性,二者发生氧化还原反应生成 和 。
H、O
还原
氧化
NaOH
H2
一 、钠的化学性质
2.实验探究
实验:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。观察现象。注意观察:钠在水中的位置,钠的形状变化、水溶液中颜色的变化
证据(现象) 推理
钠浮在水面上
钠密度比水小
钠立刻熔成一个小球
反应放热,钠熔点低
钠在水面上四处游动
反应剧烈,有气体生成
产生气体
发出“嘶嘶”响声
反应后溶液变红
有碱性物质生成
钠与水反应的生成物是氢氧化钠和氢气
2Na+2H2O == 2NaOH+H2↑
离子方程式:
2Na + 2H2O == 2Na+ + 2OH- + H2↑
得出结论
1.钠为什么要保存在石蜡油或煤油中?
2.钠着火了应该如何扑灭?
用干燥的沙土扑灭
因为钠不与石蜡油或煤油反应且密度比石蜡油或煤油大,能隔绝空气,防止钠被氧化
思考与交流
钠与水和煤油的混合液反应实验探究
思考:预测钠投入煤油和水的混合物中的现象。
钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠在界面与煤油中上下跳动,并与水反应产生气泡
1钠与盐酸、钠与水反应更剧烈?
2.写出钠与盐酸反应的化学方程式
2Na+2H2O = 2NaOH+H2↑
2Na+2HCl = 2NaCl+H2↑
结论:钠与酸溶液反应,实质上是钠跟H+反应;而酸中的H+浓度比水中H+浓度大,故先跟酸反应后跟水反应
钠与盐酸反应实验探究
4、 与盐溶液的反应
在烧杯中加入约20mL的CuSO4溶液,将切好的钠投入到其中,盖上表面皿,观察现象。
【实验】
4、 与盐溶液的反应
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
注意:一般活泼金属K、Ca、Na与盐溶液的反应,先考虑与水的反应,再考虑与水反应的产物(碱)能否和该盐溶液反应。
(1)与硫酸铜溶液的反应
2Na+2H2O+Cu2+══2Na++Cu(OH)2↓+H2↑
2Na+2H2O+CuSO4 ===Cu(OH)2↓+Na2SO4+H2↑
“先酸再水后盐”
4、 与盐溶液的反应
2Na + CuSO4 (熔融) = Na2SO4 + Cu
(2)熔融硫酸铜的反应
尝试书写Na与熔融TiCl4反应的方程式
4Na+TiCl4(熔融)= 4NaCl+Ti
工业制钛
利用钠的强还原性
注意:钠只有与某些熔融盐作用时才能置换出相应的金属。
钠在自然界都是以化合态存在,如NaCl、Na2CO3、Na2SO4等。
2NaCl(熔融) ==== 2Na + Cl2↑
通电
钠的制备
冶炼钛
高压钠灯
原子反应堆热交换剂
钠的用途
4Na+TiCl4==== Ti +4NaCl
钠在高温下发黄光,实质是钠原子的核外电子在电子层间做电子跃迁,当内层电子往外层跃迁时,它就以光能的形式释放能量。整个过程都是物理变化。
熔点低,沸点高,热力学性质好,传热快。76%K与24%钠的合金在-12.6℃凝固,比钾和钠的熔点(63.5℃和97.9℃)都低。
强还原性
高温
将一小块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )
① 钠投入水中,先沉入水底,后浮出水面 ② 钠立即与水反应,并有气体产生
③ 反应后溶液变红色 ④ 钠熔化成光亮的小球
⑤ 小球在水面上迅速游动 ⑥ 有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
C
随堂检测
2.将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有沉淀产生的是________(填序号)。
①MgSO4溶液 ②NaHCO3溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤FeCl3溶液
随堂演练
1
2
3
4
①④⑤
第一节
钠及其化合物
第1课时
原子结构
钠的物理性质
钠的化学性质
熔点低、密度小于水、导电导热
与氧气反应(条件不同,产物不同)
与水反应
与酸碱盐反应的实质
THANKS
谢谢聆听
第二章 海水中的重要元素---钠和氯
第一节 钠及其化合物
第1课时 活泼金属-钠
3
2
本节重点
本节难点
钠与水的反应
钠的原子结构
钠与非金属单质的反应
1
食盐与我们的生活密切相关,每个人天天都要吃一定量的盐,不吃盐就没有劲儿。据统计,正常每个人一天要消耗10-20克食盐,一年要消耗5-10公斤食盐。
躲在食盐里的金属
山西省运城盐湖里铲收原盐
海水中的钠元素以游离态还是化合态形式存在?
化合态形式存在
为什么海水中没有游离态的钠?你能解释吗?
猜测:钠是一种非常活泼的金属。
1.钠元素的原子结构及存在
1
还原
化合物
NaCl
钠常常保存在石蜡油或煤油中
探究一:用镊子取一小块钠,用滤纸吸干表面的煤油后,用刀切去一端的外皮,观察钠的光泽和颜色,并注意新切开的钠的表面所发生的变化。
活泼的金属单质——钠
实验探究:金属钠的性质
切割钠
实验现象
新切开的钠具有_______的金属光泽
银白
活泼的金属单质——钠
实验探究:金属钠的性质
实验结论:金属钠的物理性质
活泼的金属单质——钠
实验探究:金属钠的性质
颜色 状态 硬度
银白色 固体 小
实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气
结论:常温下,金属钠与氧气反应
4Na+O2===2Na2O
(白色)
实验现象
活泼的金属单质——钠
实验探究:金属钠的性质
在空气中很快________
变暗
如果加热,钠又会发生什么变化呢
把小块金属钠放在坩埚里加热,有什么现象?
钠受热先____________________,接着_____起来,火焰呈________, 最后生成_________固体。
2Na +O2 = Na2O2 (淡黄色)
△
实验现象
【实验3-2】
熔成银白色小球
燃烧
黄色
淡黄色
钠与氧气反应小结:
①常温下,空气中氧化
4Na+O2 =2Na2O (白色)
②钠在空气中燃烧
2Na+O2=Na2O2 (淡黄色)
△
注意:反应物相同,反应条件不同,产物不同!
2Na2O + O2 = 2Na2O2
△
产物的稳定性:Na2O < Na2O2
Na2O与Na2O2的比较
名称
颜色及 状态
氧元素 化合价
氧化钠
过氧化钠
白色固体
淡黄色固体
+1 -2
Na2O
+1 -1
Na2O2
Na2O
Na2O2
这两个反应是否属于氧化还原反应?若是,请用单双线桥表示,并指出氧化剂、还原剂、氧化产物、还原产物以及反应中转移的电子数目。
①生成Na2O:
②生成Na2O2:
则相同质量的两块钠,分别发生上述反应,转移的电子数:①=②。
0
0
+1 -2
失去4× e- ,化合价升高,被氧化
得到2× 2e- ,化合价降低,被还原
0
0
+1 -1
失去2× e- ,化合价升高,被氧化
得到2× e- ,化合价降低,被还原
归纳总结
活泼的金属单质——钠
实验探究:金属钠的性质
——钠与其他非金属单质化合生成的化合物中钠只显____价
+1
2Na+Cl2==== 2NaCl (白色)
加热
Na与Cl2在点燃条件下的反应
2Na+S====Na2S
Na与S在研磨条件下的反应
Na
(银白色)
Na2O
(表面变暗)
NaOH
(白色固体)
潮解
(表面变溶液)
Na2CO3·10H2O
(白色粉末)
Na2CO3
(白色粉末)
O2
H2O
Na长时间暴露在空气中,最后生成什么?
H2O
风化
CO2
2015年8月12日晚,天津滨海新区发生剧烈爆炸,消防员在短短几分钟就赶到起火点,迅速用水灭火,灭火过程中发生了更大二次和三次爆炸这一次事故造成死亡173人 据了解,在这个仓库内有易燃物品,主要是金属钠,约500吨。
新闻播报
【预测】
铜金属不与水反应,常温下可用铝或铁制容器盛水,说明铁或铝常温下不与水反应,那么钠能否与水反应呢?若能反应,请从物质组成及氧化还原反应的角度,预测钠与水反应的生成物?
1.理论预测
(1)从物质组成的角度来看,钠含有Na元素,水含有 元素。
(2)从氧化还原的角度来看,钠具有 性,水具有 性,二者发生氧化还原反应生成 和 。
H、O
还原
氧化
NaOH
H2
一 、钠的化学性质
2.实验探究
实验:在烧杯中加入一些水,滴入几滴酚酞溶液,然后把一块绿豆大的钠放入水中。观察现象。注意观察:钠在水中的位置,钠的形状变化、水溶液中颜色的变化
证据(现象) 推理
钠浮在水面上
钠密度比水小
钠立刻熔成一个小球
反应放热,钠熔点低
钠在水面上四处游动
反应剧烈,有气体生成
产生气体
发出“嘶嘶”响声
反应后溶液变红
有碱性物质生成
钠与水反应的生成物是氢氧化钠和氢气
2Na+2H2O == 2NaOH+H2↑
离子方程式:
2Na + 2H2O == 2Na+ + 2OH- + H2↑
得出结论
1.钠为什么要保存在石蜡油或煤油中?
2.钠着火了应该如何扑灭?
用干燥的沙土扑灭
因为钠不与石蜡油或煤油反应且密度比石蜡油或煤油大,能隔绝空气,防止钠被氧化
思考与交流
钠与水和煤油的混合液反应实验探究
思考:预测钠投入煤油和水的混合物中的现象。
钠的密度介于水和煤油之间,所以钠在煤油和水的界面处,钠与水反应有气泡产生,固体上下跳动,至钠消失。
钠在界面与煤油中上下跳动,并与水反应产生气泡
1钠与盐酸、钠与水反应更剧烈?
2.写出钠与盐酸反应的化学方程式
2Na+2H2O = 2NaOH+H2↑
2Na+2HCl = 2NaCl+H2↑
结论:钠与酸溶液反应,实质上是钠跟H+反应;而酸中的H+浓度比水中H+浓度大,故先跟酸反应后跟水反应
钠与盐酸反应实验探究
4、 与盐溶液的反应
在烧杯中加入约20mL的CuSO4溶液,将切好的钠投入到其中,盖上表面皿,观察现象。
【实验】
4、 与盐溶液的反应
2Na + 2H2O = 2NaOH + H2↑
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
注意:一般活泼金属K、Ca、Na与盐溶液的反应,先考虑与水的反应,再考虑与水反应的产物(碱)能否和该盐溶液反应。
(1)与硫酸铜溶液的反应
2Na+2H2O+Cu2+══2Na++Cu(OH)2↓+H2↑
2Na+2H2O+CuSO4 ===Cu(OH)2↓+Na2SO4+H2↑
“先酸再水后盐”
4、 与盐溶液的反应
2Na + CuSO4 (熔融) = Na2SO4 + Cu
(2)熔融硫酸铜的反应
尝试书写Na与熔融TiCl4反应的方程式
4Na+TiCl4(熔融)= 4NaCl+Ti
工业制钛
利用钠的强还原性
注意:钠只有与某些熔融盐作用时才能置换出相应的金属。
钠在自然界都是以化合态存在,如NaCl、Na2CO3、Na2SO4等。
2NaCl(熔融) ==== 2Na + Cl2↑
通电
钠的制备
冶炼钛
高压钠灯
原子反应堆热交换剂
钠的用途
4Na+TiCl4==== Ti +4NaCl
钠在高温下发黄光,实质是钠原子的核外电子在电子层间做电子跃迁,当内层电子往外层跃迁时,它就以光能的形式释放能量。整个过程都是物理变化。
熔点低,沸点高,热力学性质好,传热快。76%K与24%钠的合金在-12.6℃凝固,比钾和钠的熔点(63.5℃和97.9℃)都低。
强还原性
高温
将一小块金属钠投入滴有紫色石蕊溶液的盛冷水的烧杯中,甲同学认为可以观察到下列实验现象,其中正确的有( )
① 钠投入水中,先沉入水底,后浮出水面 ② 钠立即与水反应,并有气体产生
③ 反应后溶液变红色 ④ 钠熔化成光亮的小球
⑤ 小球在水面上迅速游动 ⑥ 有“嘶嘶”的响声发出
A. ①②③④ B. ②③④⑤
C. ②④⑤⑥ D. ③④⑥
C
随堂检测
2.将金属钠放入盛有下列溶液的小烧杯中,既有气体产生,又有沉淀产生的是________(填序号)。
①MgSO4溶液 ②NaHCO3溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤FeCl3溶液
随堂演练
1
2
3
4
①④⑤
第一节
钠及其化合物
第1课时
原子结构
钠的物理性质
钠的化学性质
熔点低、密度小于水、导电导热
与氧气反应(条件不同,产物不同)
与水反应
与酸碱盐反应的实质
THANKS
谢谢聆听
