2.2.3 与气体相关的大型实验制备课件(共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2.3 与气体相关的大型实验制备课件(共24张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-10 21:51:39 | ||
图片预览



文档简介
(共24张PPT)
第3课时 与气体相关的大型实验制备
第二章 第二节 氯及其化合物
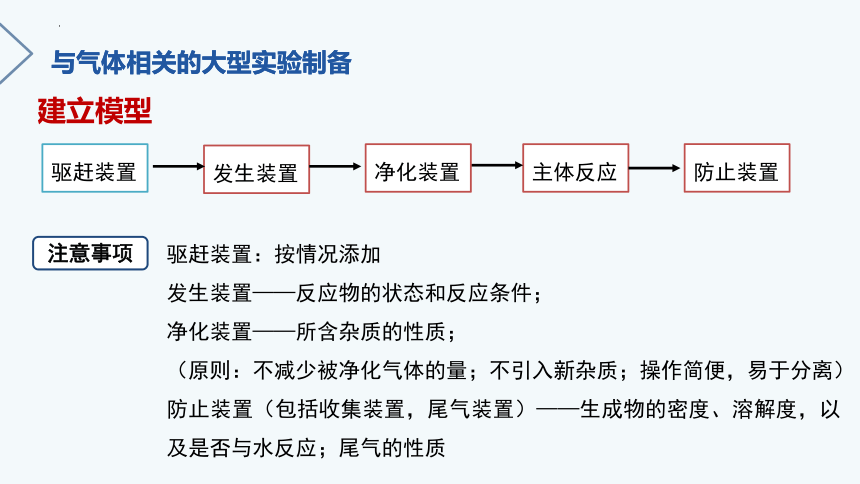
与气体相关的大型实验制备
建立模型
驱赶装置
发生装置
主体反应
防止装置
注意事项
驱赶装置:按情况添加
发生装置——反应物的状态和反应条件;
净化装置——所含杂质的性质;
(原则:不减少被净化气体的量;不引入新杂质;操作简便,易于分离)
防止装置(包括收集装置,尾气装置)——生成物的密度、溶解度,以及是否与水反应;尾气的性质
净化装置
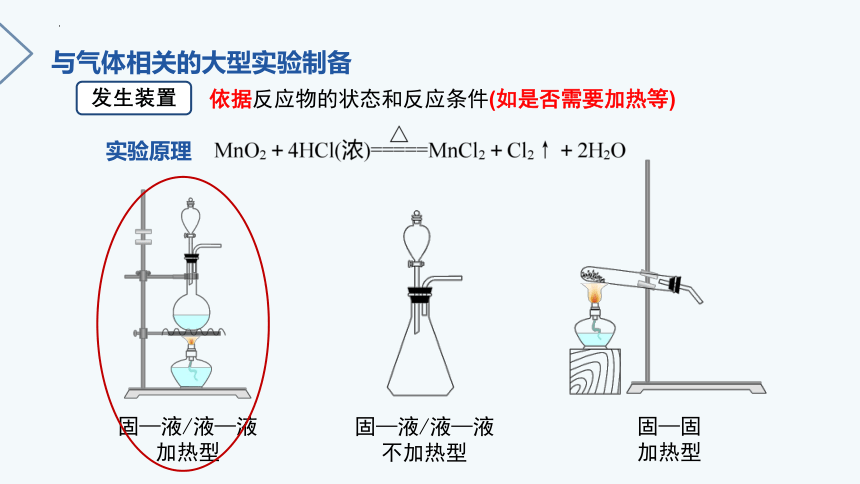
实验原理
发生装置
固—液/液—液
加热型
固—液/液—液
不加热型
固—固
加热型
依据反应物的状态和反应条件(如是否需要加热等)
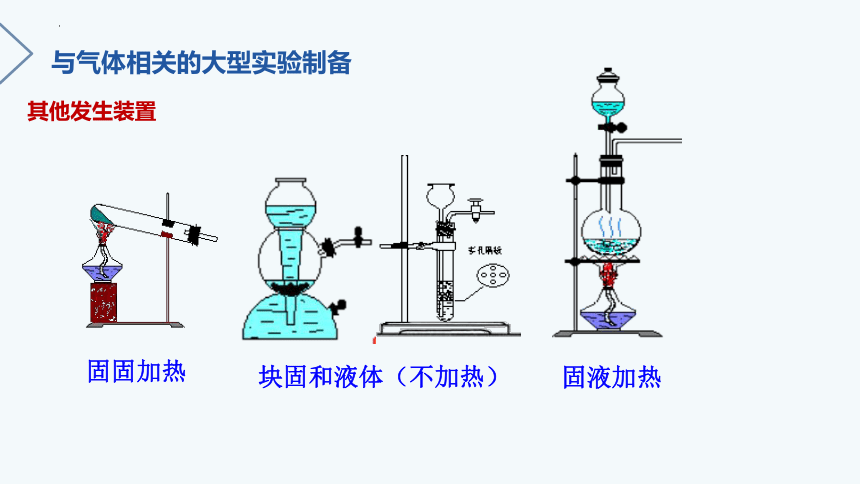
固固加热
块固和液体(不加热)
固液加热
其他发生装置
净化装置
【思考】获得的氯气中含有哪些杂质?用什么试剂除去以进行洗气?
杂质:HCl气体、H2O
除杂试剂:饱和食盐水
除杂顺序:先除HCl气体,再除去H2O(先除杂后干燥)
装置的选择及连接:
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
(因为氯气在饱和食盐水中的溶解度低,而HCl易溶于水)
浓硫酸或无水CaCl2
防止装置
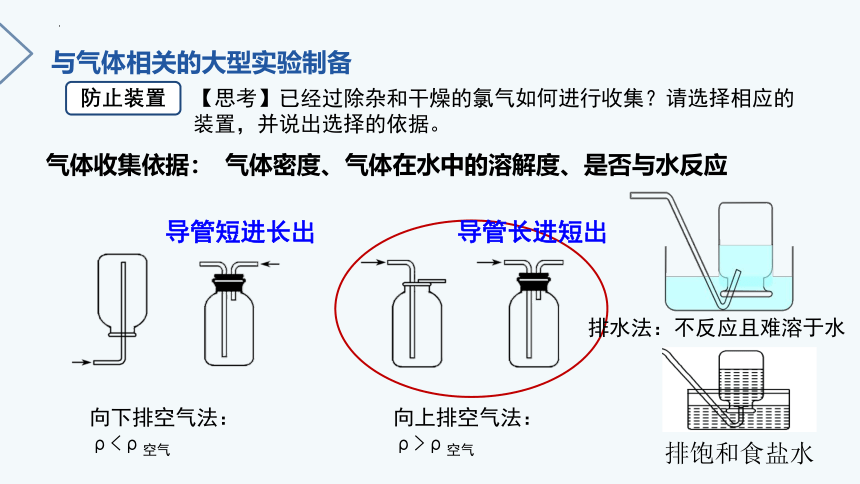
【思考】已经过除杂和干燥的氯气如何进行收集?请选择相应的 装置,并说出选择的依据。
向下排空气法:
ρ<ρ空气
向上排空气法:
ρ>ρ空气
排水法:不反应且难溶于水
气体收集依据:
气体密度、气体在水中的溶解度、是否与水反应
导管长进短出
导管短进长出
排饱和食盐水
尾气吸收
防止装置
【思考】实验室制氯气是否需要进行尾气吸收?如何吸收
根据生成物的性质选择试剂(方法)将气体转化为无害物质
Cl2 + 2OH- == Cl- + ClO- + H2O
NaOH溶液
尾气吸收
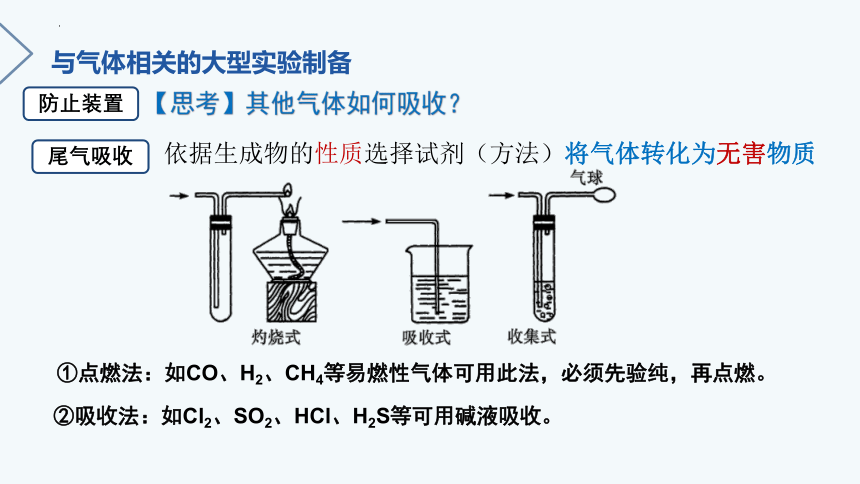
①点燃法:如CO、H2、CH4等易燃性气体可用此法,必须先验纯,再点燃。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
防止装置
【思考】其他气体如何吸收?
依据生成物的性质选择试剂(方法)将气体转化为无害物质
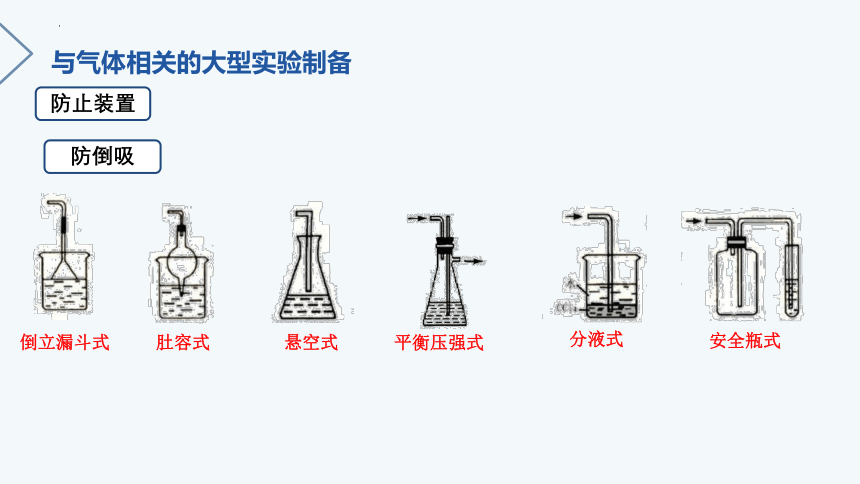
防倒吸
防止装置
分液式
安全瓶式
平衡压强式
倒立漏斗式
肚容式
悬空式
仪器组装顺序:自下而上、从左到右
收集装置:
尾气处理装置:
发生装置:
固、液加热
向上排气法(或排饱和食盐水法)
碱液(NaOH)吸收
净化装置:
洗气瓶:饱和食盐水(HCL)、浓硫酸(H2O)
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
多余氯气能否直接排放到空气中?应如何处理?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
为什么?
氯气的检验:
Ⅰ.观察法(黄绿色);Ⅱ.湿润的淀粉 KI试纸,其原理是Cl2+2KI===
2KCl+I2,置换出的I2遇淀粉变蓝色;Ⅲ.湿润的蓝色石蕊试纸
(先变红后褪色)
深度思考
【问题2】实验室制取氯气时,需要加热,加热温度是否越高越好?
【问题1】一定量的浓盐酸与足量的二氧化锰反应,盐酸是否能完全参与反应?为什么?
不能,因为随着反应的进行,浓盐酸逐渐变为稀盐酸,不再与二氧化锰反应。
否,为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,以减少HCl的挥发。
深度思考
【问题3】能不能用碱石灰作为干燥剂除去水蒸气?
【问题4】尾气吸收时能不能选择澄清石灰水?
不能,因为澄清石灰水中Ca(OH)2的量少,吸收不完全。
不能,因为Cl2属于酸性气体,能与碱发生反应,不能选用碱性干燥剂
深度思考
【问题5】如何验证氯气已收集满?
【方法1】将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。
【方法2】将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
实验室制备氯气可能会出现的问题:
1、随着反应的进行,烧瓶内生成的气体越来越多,压强增大,使分液漏斗内的压强小于烧瓶内的压强,从而使浓盐酸不能顺利滴下。
2、Cl2有毒,排空气法容易产生泄露,最好用排液法。
3、尾气吸收的时候,如果气流过快,容易吸收不完全。
资料卡片
思考: 如何进行改进?
恒压漏斗
排饱和食盐水法
采用多孔球泡
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
知识运用
1、某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是________。
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
√
A.Ⅰ图中:如果MnO2过量,盐酸就可全部消耗
B.Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液呈酸性,结果有Cl2生成
2、某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
D
3.某化学小组用图示装置制取氯气,下列说法不正确的是( )
A.该装置图中至少存在两处明显错误
B.为了防止氯气污染空气,必须进行尾气处理
C.在集气瓶的导管口处放一片湿润的淀粉碘化钾
试纸,可以证明是否有氯气逸出
D.该实验中收集氯气的方法不正确
D
设计气体制备装置的基本思路
明确气体制备的原理,写出相应的化学方程式
根据药品状态、反应条件,选择合适的反应装置
分析气体是否含有杂质,根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质,选择收集装置,分析是否需要尾气处理装置
第一步
第二步
第三步
第四步
专家提醒:“84消毒液”与“洁厕灵”混用会有危险!
氯气中毒的症状
吸入氯气后对上呼吸粘膜的强烈刺激,可引起呼吸道烧伤、急性肺水肿等,严重者可危及生命。
氯气中毒后的应急措施
立即将患者转移到空气新鲜处
用清水反复冲洗皮肤、眼睛
中毒严重的应迅速送医院救治
第3课时 与气体相关的大型实验制备
第二章 第二节 氯及其化合物
与气体相关的大型实验制备
建立模型
驱赶装置
发生装置
主体反应
防止装置
注意事项
驱赶装置:按情况添加
发生装置——反应物的状态和反应条件;
净化装置——所含杂质的性质;
(原则:不减少被净化气体的量;不引入新杂质;操作简便,易于分离)
防止装置(包括收集装置,尾气装置)——生成物的密度、溶解度,以及是否与水反应;尾气的性质
净化装置
实验原理
发生装置
固—液/液—液
加热型
固—液/液—液
不加热型
固—固
加热型
依据反应物的状态和反应条件(如是否需要加热等)
固固加热
块固和液体(不加热)
固液加热
其他发生装置
净化装置
【思考】获得的氯气中含有哪些杂质?用什么试剂除去以进行洗气?
杂质:HCl气体、H2O
除杂试剂:饱和食盐水
除杂顺序:先除HCl气体,再除去H2O(先除杂后干燥)
装置的选择及连接:
装置Ⅰ(洗气瓶):盛液体除杂试剂,气流方向是长管进,短管出。
装置Ⅱ(干燥管):盛固体除杂试剂,气流方向是粗口进,细口出。
(因为氯气在饱和食盐水中的溶解度低,而HCl易溶于水)
浓硫酸或无水CaCl2
防止装置
【思考】已经过除杂和干燥的氯气如何进行收集?请选择相应的 装置,并说出选择的依据。
向下排空气法:
ρ<ρ空气
向上排空气法:
ρ>ρ空气
排水法:不反应且难溶于水
气体收集依据:
气体密度、气体在水中的溶解度、是否与水反应
导管长进短出
导管短进长出
排饱和食盐水
尾气吸收
防止装置
【思考】实验室制氯气是否需要进行尾气吸收?如何吸收
根据生成物的性质选择试剂(方法)将气体转化为无害物质
Cl2 + 2OH- == Cl- + ClO- + H2O
NaOH溶液
尾气吸收
①点燃法:如CO、H2、CH4等易燃性气体可用此法,必须先验纯,再点燃。
②吸收法:如Cl2、SO2、HCl、H2S等可用碱液吸收。
防止装置
【思考】其他气体如何吸收?
依据生成物的性质选择试剂(方法)将气体转化为无害物质
防倒吸
防止装置
分液式
安全瓶式
平衡压强式
倒立漏斗式
肚容式
悬空式
仪器组装顺序:自下而上、从左到右
收集装置:
尾气处理装置:
发生装置:
固、液加热
向上排气法(或排饱和食盐水法)
碱液(NaOH)吸收
净化装置:
洗气瓶:饱和食盐水(HCL)、浓硫酸(H2O)
能否用澄清石灰水代替NaOH?为什么?
如何检验氯气已收集满?
多余氯气能否直接排放到空气中?应如何处理?
MnO2
浓HCl
饱和食盐水(除HCl)
浓硫酸
(除H2O)
注意导气管的进出方式(长进短出)
为什么?
氯气的检验:
Ⅰ.观察法(黄绿色);Ⅱ.湿润的淀粉 KI试纸,其原理是Cl2+2KI===
2KCl+I2,置换出的I2遇淀粉变蓝色;Ⅲ.湿润的蓝色石蕊试纸
(先变红后褪色)
深度思考
【问题2】实验室制取氯气时,需要加热,加热温度是否越高越好?
【问题1】一定量的浓盐酸与足量的二氧化锰反应,盐酸是否能完全参与反应?为什么?
不能,因为随着反应的进行,浓盐酸逐渐变为稀盐酸,不再与二氧化锰反应。
否,为了减少制得的Cl2中HCl的含量,所以加热温度不宜过高,以减少HCl的挥发。
深度思考
【问题3】能不能用碱石灰作为干燥剂除去水蒸气?
【问题4】尾气吸收时能不能选择澄清石灰水?
不能,因为澄清石灰水中Ca(OH)2的量少,吸收不完全。
不能,因为Cl2属于酸性气体,能与碱发生反应,不能选用碱性干燥剂
深度思考
【问题5】如何验证氯气已收集满?
【方法1】将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。
【方法2】将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
实验室制备氯气可能会出现的问题:
1、随着反应的进行,烧瓶内生成的气体越来越多,压强增大,使分液漏斗内的压强小于烧瓶内的压强,从而使浓盐酸不能顺利滴下。
2、Cl2有毒,排空气法容易产生泄露,最好用排液法。
3、尾气吸收的时候,如果气流过快,容易吸收不完全。
资料卡片
思考: 如何进行改进?
恒压漏斗
排饱和食盐水法
采用多孔球泡
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
知识运用
1、某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是________。
A.①中可用分液漏斗代替长颈漏斗
B.①中缺少加热装置
C.②中盛放的NaOH溶液可以净化氯气
D.④中盛放的NaOH溶液可以吸收尾气
√
A.Ⅰ图中:如果MnO2过量,盐酸就可全部消耗
B.Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水,经足够长的时间光照,量筒内最后剩余气体为HCl和氧气
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中至溶液呈酸性,结果有Cl2生成
2、某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )
D
3.某化学小组用图示装置制取氯气,下列说法不正确的是( )
A.该装置图中至少存在两处明显错误
B.为了防止氯气污染空气,必须进行尾气处理
C.在集气瓶的导管口处放一片湿润的淀粉碘化钾
试纸,可以证明是否有氯气逸出
D.该实验中收集氯气的方法不正确
D
设计气体制备装置的基本思路
明确气体制备的原理,写出相应的化学方程式
根据药品状态、反应条件,选择合适的反应装置
分析气体是否含有杂质,根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质,选择收集装置,分析是否需要尾气处理装置
第一步
第二步
第三步
第四步
专家提醒:“84消毒液”与“洁厕灵”混用会有危险!
氯气中毒的症状
吸入氯气后对上呼吸粘膜的强烈刺激,可引起呼吸道烧伤、急性肺水肿等,严重者可危及生命。
氯气中毒后的应急措施
立即将患者转移到空气新鲜处
用清水反复冲洗皮肤、眼睛
中毒严重的应迅速送医院救治
