4.2.1电解原理(共46张PPT)2023-2024学年高二化学课件(人教版2019选择性必修1)
文档属性
| 名称 | 4.2.1电解原理(共46张PPT)2023-2024学年高二化学课件(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 45.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-10 21:57:02 | ||
图片预览









文档简介
(共46张PPT)
第1课时 电 解 原 理
第二节 电解池
回顾:电解水的实验
原电池是将化学能转化为电能的装置
反过来,假如我们把电流通入水或者水溶液中会不会发生变化?
电解水的装置
问题:电解池的构成要素有哪些呢
①直流电源;
②两个电极
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
③电解质溶液
通电
2 H2O ====2 H2 ↑+ O2↑
④ 形成闭合的回路
:阴极、阳极
阳极
阴极
电解水装置示意图
[比原电池多的部分]
(传导电流)
——电解池
水
e-
e-
e-
e-
e-
e-
水在通电前后,离子和电子的运动情况
+
-
H+
OH-
缺电子的一极
富集负电荷的一极
H2↑
O2↑
—————
+++++
H2O H++OH-
一起来想一想
H+
OH-
2H++2e- =H2 ↑
4OH- -4e- =O2+2H2O
还原反应
氧化反应
通电
2 H2O ====2 H2 ↑+ O2↑
1.电解:
使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程叫做电解。
C
C
一、电解原理
⑴电流是发生氧化—还原反应的根源、动力。
⑵电解质溶液导电的实质:
明确:
(3)阴离子失去电子,阳离子得到电子的过程叫放电
电解质溶液发生了氧化还原反应。
2.将电能转变为化学能的装置叫电解池或电解槽
电解池
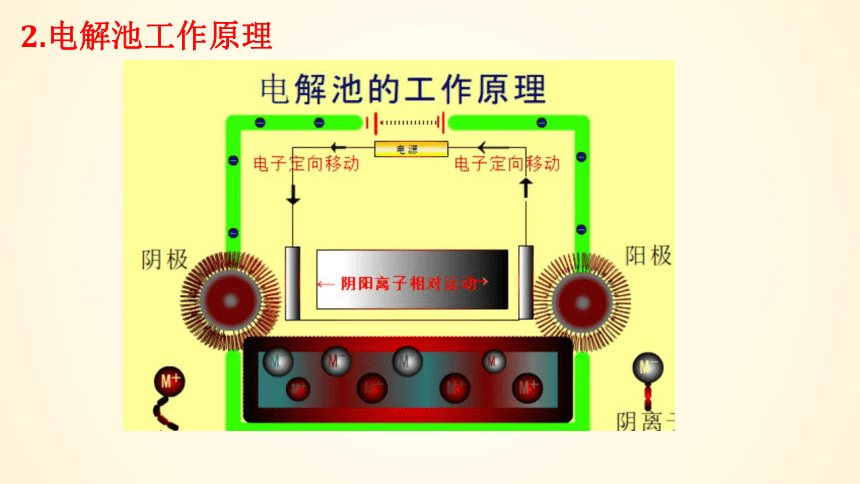
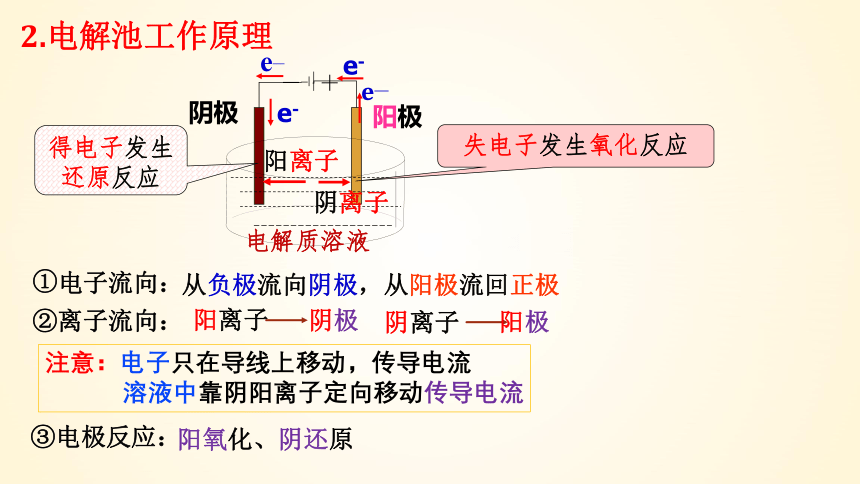
2.电解池工作原理
-
+
阴极
阳极
电解质溶液
2.电解池工作原理
①
阳氧化、阴还原
②离子流向:
③电极反应:
从负极流向阴极,从阳极流回正极
电子流向:
阳离子
阴离子
阳离子
阴极
阴离子
阳极
注意:电子只在导线上移动,传导电流
溶液中靠阴阳离子定向移动传导电流
e-
e-
e—
e—
得电子发生还原反应
失电子发生氧化反应
思考与交流:
纯水的导电性很微弱,为什么?
为了增强水的导电能力,我们可以加入什么物质呢?
纯水中H+、OH—浓度太小。
NaCl
NaOH
Na2SO4
HCl
H2SO4
CuCl2
CuSO4
……
HNO3
这些物质都可以增强水溶液的导电能力,
但是,它们会不会影响电解水的反应,改变反应的实质呢?
电解质
实验探究
课本P101[实验4-2]向CuCl2溶液中通入直流电
思考分析
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
3.猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
通电前,溶液中存在哪些离子?运动情况如何?
2. 通电后,阴、阳离子移动方向如何?
阳离子:Cu2+ 、H+ 阴离子:Cl- 、OH-
无规则的自由运动
Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动
H2O H+ + OH-
CuCl2= Cu2++2Cl-
电解氯化铜溶液
实验:
电解氯化铜溶液
1.实验现象记录:
阳极:
阴极:
产生氯气
产生红色的铜单质
2.实验结论:
在外加电流的作用下,CuCl2(aq)发生了化学变化,产生铜和氯气。
3.实验结论的解释:
阴极:
2Cl--2e-= Cl2↑(氧化反应)
Cu2+ +2e-= Cu (还原反应)
电极反应:
阳极:
CuCl2 Cu + Cl2↑
电解
溶液的变化情况:
总反应式:
CuCl2溶液浓度 。
降低
疑问:此时,H+、OH-为什么不放电?
4.探寻原理
①离子移动
通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;
通电后:Cu2+ H+移向阴极,
Cl- OH-移向阳极;
②电极反应:
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
Ⅰ通电前
- +
阴极
阳极
Ⅱ通电后
阳极:
阴极:
4.探寻原理
:电极产物反思
为什么不是O2呢?
为什么不是H2呢?
失电子能力:
Cl- OH-
得电子能力:
Cu2+ H+
放电
能力
放电顺序不同
>
>
Cl-
OH-
Cu2+
H+
电解时的离子放电顺序:
金属越不活泼的对应阳离子氧化性越强,越容易得电子。
Ag+ Hg2+ Cu2+ H+ Pb2+ Sn2+ Fe2+ Zn2+ Al 3+ Mg 2+ Na+ Ca 2+ K+
Fe3+
水溶液只考虑此部分
电镀时可放电
只在熔融状态下放电
> > > > > > > > > > > >
电极本身不参加反应,氧化性强的阳离子 “争”先得电子
阴极: 电子,发生 反应
得
还原
S2- I- Br- Cl- OH- 最高价含氧酸根离子 F-
阳极: 电子,发生 反应
活性金属>
(除Pt、Au)
(如NO3-、SO42-)
水溶液只考虑此部分
> > > > > >
(1)若为活性电极(除Au、Pt外的金属),电极失电子
失
氧化
(2)若为惰性电极,还原性强的阴离子 “争”先失电子
[石墨(C)、金(Au)、铂(Pt)]
电解时的离子放电顺序:
[例]以石墨碳棒为电极,请写出电解NaCl溶液时,
在阴、阳两极上发生的电极反应式及总的化学方程式。
阳极
阴极
温馨提示:
1、溶液中存在哪些微粒?
2、阳极区有哪些离子?
阴极区又有哪些离子?
3、哪个离子先放电?
OH-在哪一极?
2Cl--2e-=Cl2↑
2H++2e-=H2↑
(2H2O+2e- =H2↑+2OH-)
(Cl-、OH-):
(Na+、H+):
1. 阴、阳极的半反应关键抓“离子”,先不管它来自什么物质
阴极
2.总反应式中要考虑放电的离子来自于什么物质,往往写物质。
电解
2NaCl+2H2O === Cl2↑+H2↑+2NaOH
温馨提示:
总离子反应:
2Cl-+2H2O === Cl2 +H2 +2OH-
电解
总反应方程式:
(包括水的电离,并分 成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳氧化,阴还原完成电极反应式
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质必须保持分子形式)
分析电解反应的一般思路
归纳总结:
电解CuCl2溶液能得到金属铜,
为什么电解NaCl 溶液得不到金属钠?
?
动动脑
电解熔融的氯化钠
要怎么样才能得到金属钠呢?
∵ 水溶液中,放电能力:H+ > Na+
电解
Pt
Pt
熔融的氯化钠
电解熔融的氯化钠,电极反应式及总方程式
阳极:
阴极:
可见,电解是最强有力的氧化还原的手段,电解法是冶炼金属的一种重要方法。
?
想一想
?
阳极
阴极
2Cl--2e- = Cl2↑
2Na+ + 2e- = 2Na
2NaCl(熔融) ===2Na + Cl2 ↑
电解
1799年,意大利物理学家伏打发明了电池,
此后,许多科学家对电产生了浓厚的兴趣……
1800年,英国尼科尔逊和卡里斯尔成功电解水,使人们认识到可以将电用于化学研究.
1807年,戴维用电解KOH制得了金属钾
1807年,戴维电解苏打制得了金属钠
1808年,戴维制得了金属钙、镁、钡、锶……
戴维
当时化学家戴维就在想,既然水能通电发生分解,那么盐溶液、固体化合物呢?他开始研究各种物质的电解作用。经过无数次的实验,终于在1807年,他通过电解的方法发现钾、钠两种元素。
想一想,探一探
一、对比原电池与电解池的构造有什么异同?
C
C
1.电解池一定有外加电源,而原电池没有。
2.电解池中,阴、阳极只取决于电源的连接方式,与电极材料的活性无关。
关键:
二、Cu+H2SO4(稀)=CuSO4+H2↑不能自发反应。请思考:
能否借助今天学习的电解知识,设计实验使该反应发生?
H2SO4(稀)
Cu
C或Pt
想一想,探一探
1、分析下图,哪个是原电池,哪个是电解池。
原电池
原电池
原电池
电解池
电解池
2.指出下列装置的名称、电极名称,并表示出电子移动方向。
e-
e-
e-
e-
e-
-
+
阳
阴
原电池
电解池
e-
Ⅰ Ⅱ
试写出各极的电极反应式?
原电池与电解池的工作原理
3. 符合电解原理的是( )
①电解是把化学能转变为电能
②电解质溶液导电是化学变化,金属导电是物理变化
③不能自发进行的氧化还原反应,通过电解原理可以实现
④原电池的负极与电解池的阳极发生的都是氧化反应
A ①②③④ B ②③ C ③④ D ②③④
×
√
√
D
√
4.用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合溶液,最初一段时间,阴极和阳极上分别析出的物质分别是( )
A. H2 Cl2 B. Cu Cl2 C. H2 O2 D. Cu O2
B
阳离子:
阴离子:
> >
> >
Cu2+、H+、Na+
Cl—、OH—、SO42—、NO3—
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
锌铜原电池
负极
正极
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
锌铜原电池
负极
正极
×
灯泡亮
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
A
a
b
用饱和Na2SO4、酚酞溶液浸湿的滤纸
锌铜原电池
负极
正极
外接电源的电解池
阴
阳
Cu2+ +2e-=Cu
√
×
不变
b点为阳极:
4OH--4e-=2H2O +O2↑
OH-放电,阳极区显酸性,酚酞不变色。
a点为阴极:
4H+ +4e-=2H2 ↑
H+放电,阴极区显碱性,酚酞变红色。
滤纸上相当是发生电解 的反应
水
×
×
2H2O-4e-=O2↑+4H+
4H2O+4e- =2H2↑+4OH-
二、电解规律(用惰性电极电解时)
⑴电解水型
阳极:
阴极:
总反应:
电解后溶液中溶质的质量分数 ,若要恢复
原来的浓度,只需加入一定量的 即可。
实质:电解 。
例如:电解H2SO4溶液
增大
水
类似的
4OH--4e-=2H2O +O2↑
4H+ +4e-=2H2 ↑
2H2O== O2↑ +2H2↑
电解
水
分析:电解H2SO4、NaOH、Na2SO4等溶液的实质
(HNO3、H3PO4 、CH3COOH等)
含氧酸
H2SO4
活泼金属的含氧酸
强碱溶液NaOH
[KOH、Ba(OH)2、Ca(OH)2等]
Na2SO4
NaNO3
K2CO3
……
2H2O-4e-=O2↑+4H+
⑵电解电解质型
电解后溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量的 (通入一定量的 )
阳极:
阴极:
总反应:
例如:电解盐酸
实质:
电解 .
减小
溶质
(氢氟酸除外)
2Cl-- 2e-=Cl2↑
2H+ +2e-= H2 ↑
2HCl== Cl2↑ + H2↑
电解
电解质本身
注意不是加盐酸
分析:电解HCl、CuCl2等溶液的实质
类似的
无氧酸溶液HCl
不活泼金属的无氧酸盐溶液
CuCl2
HBr HI
CuBr2 CuI2
HCl气体
⑶放O2生酸型
阳极 :
阴极:
总反应:
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量( )
A. Cu B. CuO C. Cu(OH)2 D. CuCO3 E. Cu(OH)2CO3
电解CuSO4溶液
减小
BD
电解质复原的原则:
想一想,H+应该在哪一极生成?
阳极
4OH--4e-=2H2O +O2↑
2Cu2+ +4e-=2Cu
2CuSO4+2H2O == 2Cu+O2↑+2H2SO4
电解
分析:电解CuSO4溶液、AgNO3溶液等的电解实质。
实质:
电解 .
电解质和水
①“出去”什么,加什么;
②“出去”多少,加多少。
2H2O-4e-=O2↑+4H+
阳极 :
阴极:
总化学反应:
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量( )
A. Ag B. Ag2O C. AgOH
电解AgNO3溶液
结论:电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解。
减小
B
4OH--4e-=2H2O +O2↑
4Ag+ +4e-=4Ag
4AgNO3 +2H2O == 4Ag+O2↑+4HNO3
电解
总离子反应:
4Ag+ +2H2O === 4Ag+O2 +4H+
电解
2H2O-4e-=O2↑+4H+
⑶放O2生酸型
分析:电解CuSO4溶液、AgNO3溶液等的电解实质。
⑷放H2生碱型
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需通入一定量的 。
阳极 (C):
阴极 (C):
总反应:
2Cl-- 2e-=Cl2↑
2H+ +2e-= H2 ↑
2NaCl+2H2O==2NaOH+ H2↑ + Cl2↑
电解
分析:电解NaCl、KI等溶液的电解实质
电解NaCl溶液
实质:
电解 .
电解质和水
减小
HCl
注意不是加盐酸
2H2O+2e- =H2↑+2OH-
电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需通入一定量的 。
阳极 (C):
阴极 (C):
总反应:
2I-- 2e-=I2
2H+ +2e-= H2 ↑
2KI+2H2O==2KOH+ l2 + H2↑
电解
电解KI溶液
减小
Hl
类似的:
KBr
MgCl2
AlCl3
等活泼金属的无氧酸盐溶液
2H2O+2e- =H2↑+2OH-
⑷放H2生碱型
分析:电解NaCl、KI等溶液的电解实质
完成下表 (用惰性电极电解下列溶液)
类型 实例 电解对象 电解质浓度 pH 电解质溶液复原需加入的物质
H2SO4
NaOH
Na2SO4
HCl
CuCl2
CuSO4
NaCl
H2O
H2O
H2O
增大
增大
增大
减小
增大
不变
H2O
H2O
H2O
HCl
CuCl2
电解质和水
电解质和水
减小
减小
生成新电解质---酸
生成新电解质---碱
增大
减小
增大
HCl
CuCl2
CuO
HCl
电解水型
电解电解质型
放O2
生酸型
放H2
生碱型
CuCO3
电解产物小结:
S2- I- Br- Cl- OH-(水) 最高价含氧酸根离子 F-
活性金属>
(除Pt、Au)
Ag+ Hg2+ Cu2+ H+ Pb2+ Sn2+ Fe2+ Zn2+ Al 3+ Mg 2+ Na+ Ca 2+
Fe3+
水溶液只考虑此部分
电镀时可放电
只在熔融状态下放电
(如NO3-、SO42-)
水溶液只考虑此部分
阳极:
阴极:
Ag
Hg
Fe2+
Cu
H2
金属离子
S
I2
Br2
Cl2
O2
①产生O2、Cl2的一极一定为 极
②产生H2的一极一定为 极
阳
阴
③滴入石蕊试剂显红色的一极是 极
④滴入酚酞试剂显红色的一极是 极
⑤有损耗的一极一定为 极
⑥电极增重的一极一定是 极
阳
阴
阴
阳
常见阴、阳极的判断方法:
①产生O2、Cl2的一极一定为 极
②产生H2的一极一定为 极
阳
阴
1.用惰性电极电解下列溶液一段时间,再加入一定量的另一纯净物(方括号内),能使溶液恢复原来的成分和浓度的是 ( )
CuSO4 [Cu(OH)2] B. NaOH [NaOH]
C. CuCl2 [CuCl2] D. NaCl [NaCl]
C
2. 从H+、Cu2+ 、 Na+ 、 SO42- 、 OH- 、 Cl-六种离子中恰当地组成电解质,并将其溶于水后按下列要求进行电解。
(1)以碳棒为电极,使电解质质量减小,水量不变,应采用的电解质 。
(2)以碳棒为电极,使电解质质量不变,水量减小,应采用的电解质 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量均减小,应采用的电解质 。
HCl 、 CuCl2
NaOH 、 H2SO4、Na2SO4
NaCl 、CuSO4
A B C D
甲 KOH H2SO4 Na2SO4 CuSO4
乙 CuSO4 AgNO3 HCl HNO3
甲
乙
D
3.用铂电极电解下表中各组物质的水溶液,电解一段时间以后,甲、乙两池中溶液的pH值均减小,而在①和④两极,电极产物的物质的量之比为1︰2的是( )
阳极
阴极
阳极
阴极
4. 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.4mol/L
A
[小结]
解答有关电解问题步骤
1.首先观察是否有外接电源
2.分析电解质水溶液的组成,找全离子分两组.
3.观察阳极是否为金属, 金属作阳极失电子
4.根据阴阳两极放电顺序写出两极反应式.
5.合并两极反应写出电解反应式.
第1课时 电 解 原 理
第二节 电解池
回顾:电解水的实验
原电池是将化学能转化为电能的装置
反过来,假如我们把电流通入水或者水溶液中会不会发生变化?
电解水的装置
问题:电解池的构成要素有哪些呢
①直流电源;
②两个电极
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
③电解质溶液
通电
2 H2O ====2 H2 ↑+ O2↑
④ 形成闭合的回路
:阴极、阳极
阳极
阴极
电解水装置示意图
[比原电池多的部分]
(传导电流)
——电解池
水
e-
e-
e-
e-
e-
e-
水在通电前后,离子和电子的运动情况
+
-
H+
OH-
缺电子的一极
富集负电荷的一极
H2↑
O2↑
—————
+++++
H2O H++OH-
一起来想一想
H+
OH-
2H++2e- =H2 ↑
4OH- -4e- =O2+2H2O
还原反应
氧化反应
通电
2 H2O ====2 H2 ↑+ O2↑
1.电解:
使电流通过电解质溶液而在阴、阳两极引起
氧化还原反应的过程叫做电解。
C
C
一、电解原理
⑴电流是发生氧化—还原反应的根源、动力。
⑵电解质溶液导电的实质:
明确:
(3)阴离子失去电子,阳离子得到电子的过程叫放电
电解质溶液发生了氧化还原反应。
2.将电能转变为化学能的装置叫电解池或电解槽
电解池
2.电解池工作原理
-
+
阴极
阳极
电解质溶液
2.电解池工作原理
①
阳氧化、阴还原
②离子流向:
③电极反应:
从负极流向阴极,从阳极流回正极
电子流向:
阳离子
阴离子
阳离子
阴极
阴离子
阳极
注意:电子只在导线上移动,传导电流
溶液中靠阴阳离子定向移动传导电流
e-
e-
e—
e—
得电子发生还原反应
失电子发生氧化反应
思考与交流:
纯水的导电性很微弱,为什么?
为了增强水的导电能力,我们可以加入什么物质呢?
纯水中H+、OH—浓度太小。
NaCl
NaOH
Na2SO4
HCl
H2SO4
CuCl2
CuSO4
……
HNO3
这些物质都可以增强水溶液的导电能力,
但是,它们会不会影响电解水的反应,改变反应的实质呢?
电解质
实验探究
课本P101[实验4-2]向CuCl2溶液中通入直流电
思考分析
Cl-→Cl2↑ OH-→O2↑
阴极区:
Cu2+→Cu H+→H2↑
阳极区:
3.猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
通电前,溶液中存在哪些离子?运动情况如何?
2. 通电后,阴、阳离子移动方向如何?
阳离子:Cu2+ 、H+ 阴离子:Cl- 、OH-
无规则的自由运动
Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动
H2O H+ + OH-
CuCl2= Cu2++2Cl-
电解氯化铜溶液
实验:
电解氯化铜溶液
1.实验现象记录:
阳极:
阴极:
产生氯气
产生红色的铜单质
2.实验结论:
在外加电流的作用下,CuCl2(aq)发生了化学变化,产生铜和氯气。
3.实验结论的解释:
阴极:
2Cl--2e-= Cl2↑(氧化反应)
Cu2+ +2e-= Cu (还原反应)
电极反应:
阳极:
CuCl2 Cu + Cl2↑
电解
溶液的变化情况:
总反应式:
CuCl2溶液浓度 。
降低
疑问:此时,H+、OH-为什么不放电?
4.探寻原理
①离子移动
通电前:CuCl2 = Cu2+ + 2Cl-,
Cu2+、Cl-为自由移动的离子;
通电后:Cu2+ H+移向阴极,
Cl- OH-移向阳极;
②电极反应:
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu(还原反应)
总反应式:CuCl2 Cu + Cl2↑
电解
Ⅰ通电前
- +
阴极
阳极
Ⅱ通电后
阳极:
阴极:
4.探寻原理
:电极产物反思
为什么不是O2呢?
为什么不是H2呢?
失电子能力:
Cl- OH-
得电子能力:
Cu2+ H+
放电
能力
放电顺序不同
>
>
Cl-
OH-
Cu2+
H+
电解时的离子放电顺序:
金属越不活泼的对应阳离子氧化性越强,越容易得电子。
Ag+ Hg2+ Cu2+ H+ Pb2+ Sn2+ Fe2+ Zn2+ Al 3+ Mg 2+ Na+ Ca 2+ K+
Fe3+
水溶液只考虑此部分
电镀时可放电
只在熔融状态下放电
> > > > > > > > > > > >
电极本身不参加反应,氧化性强的阳离子 “争”先得电子
阴极: 电子,发生 反应
得
还原
S2- I- Br- Cl- OH- 最高价含氧酸根离子 F-
阳极: 电子,发生 反应
活性金属>
(除Pt、Au)
(如NO3-、SO42-)
水溶液只考虑此部分
> > > > > >
(1)若为活性电极(除Au、Pt外的金属),电极失电子
失
氧化
(2)若为惰性电极,还原性强的阴离子 “争”先失电子
[石墨(C)、金(Au)、铂(Pt)]
电解时的离子放电顺序:
[例]以石墨碳棒为电极,请写出电解NaCl溶液时,
在阴、阳两极上发生的电极反应式及总的化学方程式。
阳极
阴极
温馨提示:
1、溶液中存在哪些微粒?
2、阳极区有哪些离子?
阴极区又有哪些离子?
3、哪个离子先放电?
OH-在哪一极?
2Cl--2e-=Cl2↑
2H++2e-=H2↑
(2H2O+2e- =H2↑+2OH-)
(Cl-、OH-):
(Na+、H+):
1. 阴、阳极的半反应关键抓“离子”,先不管它来自什么物质
阴极
2.总反应式中要考虑放电的离子来自于什么物质,往往写物质。
电解
2NaCl+2H2O === Cl2↑+H2↑+2NaOH
温馨提示:
总离子反应:
2Cl-+2H2O === Cl2 +H2 +2OH-
电解
总反应方程式:
(包括水的电离,并分 成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳氧化,阴还原完成电极反应式
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质必须保持分子形式)
分析电解反应的一般思路
归纳总结:
电解CuCl2溶液能得到金属铜,
为什么电解NaCl 溶液得不到金属钠?
?
动动脑
电解熔融的氯化钠
要怎么样才能得到金属钠呢?
∵ 水溶液中,放电能力:H+ > Na+
电解
Pt
Pt
熔融的氯化钠
电解熔融的氯化钠,电极反应式及总方程式
阳极:
阴极:
可见,电解是最强有力的氧化还原的手段,电解法是冶炼金属的一种重要方法。
?
想一想
?
阳极
阴极
2Cl--2e- = Cl2↑
2Na+ + 2e- = 2Na
2NaCl(熔融) ===2Na + Cl2 ↑
电解
1799年,意大利物理学家伏打发明了电池,
此后,许多科学家对电产生了浓厚的兴趣……
1800年,英国尼科尔逊和卡里斯尔成功电解水,使人们认识到可以将电用于化学研究.
1807年,戴维用电解KOH制得了金属钾
1807年,戴维电解苏打制得了金属钠
1808年,戴维制得了金属钙、镁、钡、锶……
戴维
当时化学家戴维就在想,既然水能通电发生分解,那么盐溶液、固体化合物呢?他开始研究各种物质的电解作用。经过无数次的实验,终于在1807年,他通过电解的方法发现钾、钠两种元素。
想一想,探一探
一、对比原电池与电解池的构造有什么异同?
C
C
1.电解池一定有外加电源,而原电池没有。
2.电解池中,阴、阳极只取决于电源的连接方式,与电极材料的活性无关。
关键:
二、Cu+H2SO4(稀)=CuSO4+H2↑不能自发反应。请思考:
能否借助今天学习的电解知识,设计实验使该反应发生?
H2SO4(稀)
Cu
C或Pt
想一想,探一探
1、分析下图,哪个是原电池,哪个是电解池。
原电池
原电池
原电池
电解池
电解池
2.指出下列装置的名称、电极名称,并表示出电子移动方向。
e-
e-
e-
e-
e-
-
+
阳
阴
原电池
电解池
e-
Ⅰ Ⅱ
试写出各极的电极反应式?
原电池与电解池的工作原理
3. 符合电解原理的是( )
①电解是把化学能转变为电能
②电解质溶液导电是化学变化,金属导电是物理变化
③不能自发进行的氧化还原反应,通过电解原理可以实现
④原电池的负极与电解池的阳极发生的都是氧化反应
A ①②③④ B ②③ C ③④ D ②③④
×
√
√
D
√
4.用惰性电极电解稀H2SO4、Cu(NO3)2、NaCl的混合溶液,最初一段时间,阴极和阳极上分别析出的物质分别是( )
A. H2 Cl2 B. Cu Cl2 C. H2 O2 D. Cu O2
B
阳离子:
阴离子:
> >
> >
Cu2+、H+、Na+
Cl—、OH—、SO42—、NO3—
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
锌铜原电池
负极
正极
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
锌铜原电池
负极
正极
×
灯泡亮
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c()增大
D.片刻后可观察到滤纸b点变红色
5.将右图所示实验装置的K闭合,下列判断正确的是( )
A
a
b
用饱和Na2SO4、酚酞溶液浸湿的滤纸
锌铜原电池
负极
正极
外接电源的电解池
阴
阳
Cu2+ +2e-=Cu
√
×
不变
b点为阳极:
4OH--4e-=2H2O +O2↑
OH-放电,阳极区显酸性,酚酞不变色。
a点为阴极:
4H+ +4e-=2H2 ↑
H+放电,阴极区显碱性,酚酞变红色。
滤纸上相当是发生电解 的反应
水
×
×
2H2O-4e-=O2↑+4H+
4H2O+4e- =2H2↑+4OH-
二、电解规律(用惰性电极电解时)
⑴电解水型
阳极:
阴极:
总反应:
电解后溶液中溶质的质量分数 ,若要恢复
原来的浓度,只需加入一定量的 即可。
实质:电解 。
例如:电解H2SO4溶液
增大
水
类似的
4OH--4e-=2H2O +O2↑
4H+ +4e-=2H2 ↑
2H2O== O2↑ +2H2↑
电解
水
分析:电解H2SO4、NaOH、Na2SO4等溶液的实质
(HNO3、H3PO4 、CH3COOH等)
含氧酸
H2SO4
活泼金属的含氧酸
强碱溶液NaOH
[KOH、Ba(OH)2、Ca(OH)2等]
Na2SO4
NaNO3
K2CO3
……
2H2O-4e-=O2↑+4H+
⑵电解电解质型
电解后溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量的 (通入一定量的 )
阳极:
阴极:
总反应:
例如:电解盐酸
实质:
电解 .
减小
溶质
(氢氟酸除外)
2Cl-- 2e-=Cl2↑
2H+ +2e-= H2 ↑
2HCl== Cl2↑ + H2↑
电解
电解质本身
注意不是加盐酸
分析:电解HCl、CuCl2等溶液的实质
类似的
无氧酸溶液HCl
不活泼金属的无氧酸盐溶液
CuCl2
HBr HI
CuBr2 CuI2
HCl气体
⑶放O2生酸型
阳极 :
阴极:
总反应:
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量( )
A. Cu B. CuO C. Cu(OH)2 D. CuCO3 E. Cu(OH)2CO3
电解CuSO4溶液
减小
BD
电解质复原的原则:
想一想,H+应该在哪一极生成?
阳极
4OH--4e-=2H2O +O2↑
2Cu2+ +4e-=2Cu
2CuSO4+2H2O == 2Cu+O2↑+2H2SO4
电解
分析:电解CuSO4溶液、AgNO3溶液等的电解实质。
实质:
电解 .
电解质和水
①“出去”什么,加什么;
②“出去”多少,加多少。
2H2O-4e-=O2↑+4H+
阳极 :
阴极:
总化学反应:
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量( )
A. Ag B. Ag2O C. AgOH
电解AgNO3溶液
结论:电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解。
减小
B
4OH--4e-=2H2O +O2↑
4Ag+ +4e-=4Ag
4AgNO3 +2H2O == 4Ag+O2↑+4HNO3
电解
总离子反应:
4Ag+ +2H2O === 4Ag+O2 +4H+
电解
2H2O-4e-=O2↑+4H+
⑶放O2生酸型
分析:电解CuSO4溶液、AgNO3溶液等的电解实质。
⑷放H2生碱型
电解后原溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需通入一定量的 。
阳极 (C):
阴极 (C):
总反应:
2Cl-- 2e-=Cl2↑
2H+ +2e-= H2 ↑
2NaCl+2H2O==2NaOH+ H2↑ + Cl2↑
电解
分析:电解NaCl、KI等溶液的电解实质
电解NaCl溶液
实质:
电解 .
电解质和水
减小
HCl
注意不是加盐酸
2H2O+2e- =H2↑+2OH-
电解后原溶液中溶质的质量分数 ,若要恢
复原来的组成和浓度,需通入一定量的 。
阳极 (C):
阴极 (C):
总反应:
2I-- 2e-=I2
2H+ +2e-= H2 ↑
2KI+2H2O==2KOH+ l2 + H2↑
电解
电解KI溶液
减小
Hl
类似的:
KBr
MgCl2
AlCl3
等活泼金属的无氧酸盐溶液
2H2O+2e- =H2↑+2OH-
⑷放H2生碱型
分析:电解NaCl、KI等溶液的电解实质
完成下表 (用惰性电极电解下列溶液)
类型 实例 电解对象 电解质浓度 pH 电解质溶液复原需加入的物质
H2SO4
NaOH
Na2SO4
HCl
CuCl2
CuSO4
NaCl
H2O
H2O
H2O
增大
增大
增大
减小
增大
不变
H2O
H2O
H2O
HCl
CuCl2
电解质和水
电解质和水
减小
减小
生成新电解质---酸
生成新电解质---碱
增大
减小
增大
HCl
CuCl2
CuO
HCl
电解水型
电解电解质型
放O2
生酸型
放H2
生碱型
CuCO3
电解产物小结:
S2- I- Br- Cl- OH-(水) 最高价含氧酸根离子 F-
活性金属>
(除Pt、Au)
Ag+ Hg2+ Cu2+ H+ Pb2+ Sn2+ Fe2+ Zn2+ Al 3+ Mg 2+ Na+ Ca 2+
Fe3+
水溶液只考虑此部分
电镀时可放电
只在熔融状态下放电
(如NO3-、SO42-)
水溶液只考虑此部分
阳极:
阴极:
Ag
Hg
Fe2+
Cu
H2
金属离子
S
I2
Br2
Cl2
O2
①产生O2、Cl2的一极一定为 极
②产生H2的一极一定为 极
阳
阴
③滴入石蕊试剂显红色的一极是 极
④滴入酚酞试剂显红色的一极是 极
⑤有损耗的一极一定为 极
⑥电极增重的一极一定是 极
阳
阴
阴
阳
常见阴、阳极的判断方法:
①产生O2、Cl2的一极一定为 极
②产生H2的一极一定为 极
阳
阴
1.用惰性电极电解下列溶液一段时间,再加入一定量的另一纯净物(方括号内),能使溶液恢复原来的成分和浓度的是 ( )
CuSO4 [Cu(OH)2] B. NaOH [NaOH]
C. CuCl2 [CuCl2] D. NaCl [NaCl]
C
2. 从H+、Cu2+ 、 Na+ 、 SO42- 、 OH- 、 Cl-六种离子中恰当地组成电解质,并将其溶于水后按下列要求进行电解。
(1)以碳棒为电极,使电解质质量减小,水量不变,应采用的电解质 。
(2)以碳棒为电极,使电解质质量不变,水量减小,应采用的电解质 。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量均减小,应采用的电解质 。
HCl 、 CuCl2
NaOH 、 H2SO4、Na2SO4
NaCl 、CuSO4
A B C D
甲 KOH H2SO4 Na2SO4 CuSO4
乙 CuSO4 AgNO3 HCl HNO3
甲
乙
D
3.用铂电极电解下表中各组物质的水溶液,电解一段时间以后,甲、乙两池中溶液的pH值均减小,而在①和④两极,电极产物的物质的量之比为1︰2的是( )
阳极
阴极
阳极
阴极
4. 用石墨电极电解100mL H2SO4与CuSO4的混合液,通电一段时间后,两极均收集到2.24L(标况)气体,则原混合液中Cu2+的物质的量浓度为( )
A.1mol/L B.2mol/L C.3mol/L D.4mol/L
A
[小结]
解答有关电解问题步骤
1.首先观察是否有外接电源
2.分析电解质水溶液的组成,找全离子分两组.
3.观察阳极是否为金属, 金属作阳极失电子
4.根据阴阳两极放电顺序写出两极反应式.
5.合并两极反应写出电解反应式.
