2024沪教版九年级化学下学期单元测试卷--期末测评卷(含答案)
文档属性
| 名称 | 2024沪教版九年级化学下学期单元测试卷--期末测评卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 00:00:00 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024沪教版九年级化学下学期单元测试卷
期末测评卷
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Ca—40 Cu—64 Zn—65 Ag—108
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.下列物质的用途中,既利用了其物理性质,又利用了其化学性质的是( )
A.用二氧化碳灭火 B.用铁锅炒菜做饭
C.用煤作燃料 D.用石墨作干电池的电极
2.下列措施有利于生态文明建设的是 ( )
①研发易降解塑料 ②限制生产含磷的洗衣粉
③田间焚烧秸秆 ④应用高效洁净的能源
⑤加快化石燃料的开发与使用
A.①③⑤ B.①②④ C.②③⑤ D.②④⑤
3.下列事实用分子观点解释正确的是 ( )
A.油菜花旁香味浓郁证明分子在不断运动
B.蔗糖是白色固体说明分子用肉眼可看见
C.干冰升华说明分子可以再分
D.水结冰体积膨胀是因为分子体积变大了
4.下列有关燃烧和灭火的说法正确的是 ( )
A.油锅着火后向锅中放入菜叶的目的是降低油的着火点
B.家用煤加工成蜂窝煤是为了增大煤与氧气的接触面积
C.高层建筑物起火立即乘电梯撤离
D.不慎碰倒了酒精灯,酒精在桌面上燃烧,用水来灭火
5.地瑞那韦(化学式为C27H37N3O7S)对新冠肺炎病毒有一定的抑制作用,下列有关说法正确的是 ( )
A.地瑞那韦由75个原子构成
B.地瑞那韦属于有机物
C.地瑞那韦中质量分数最大的元素是氢
D.地瑞那韦中氮、氧元素的质量比是3∶7
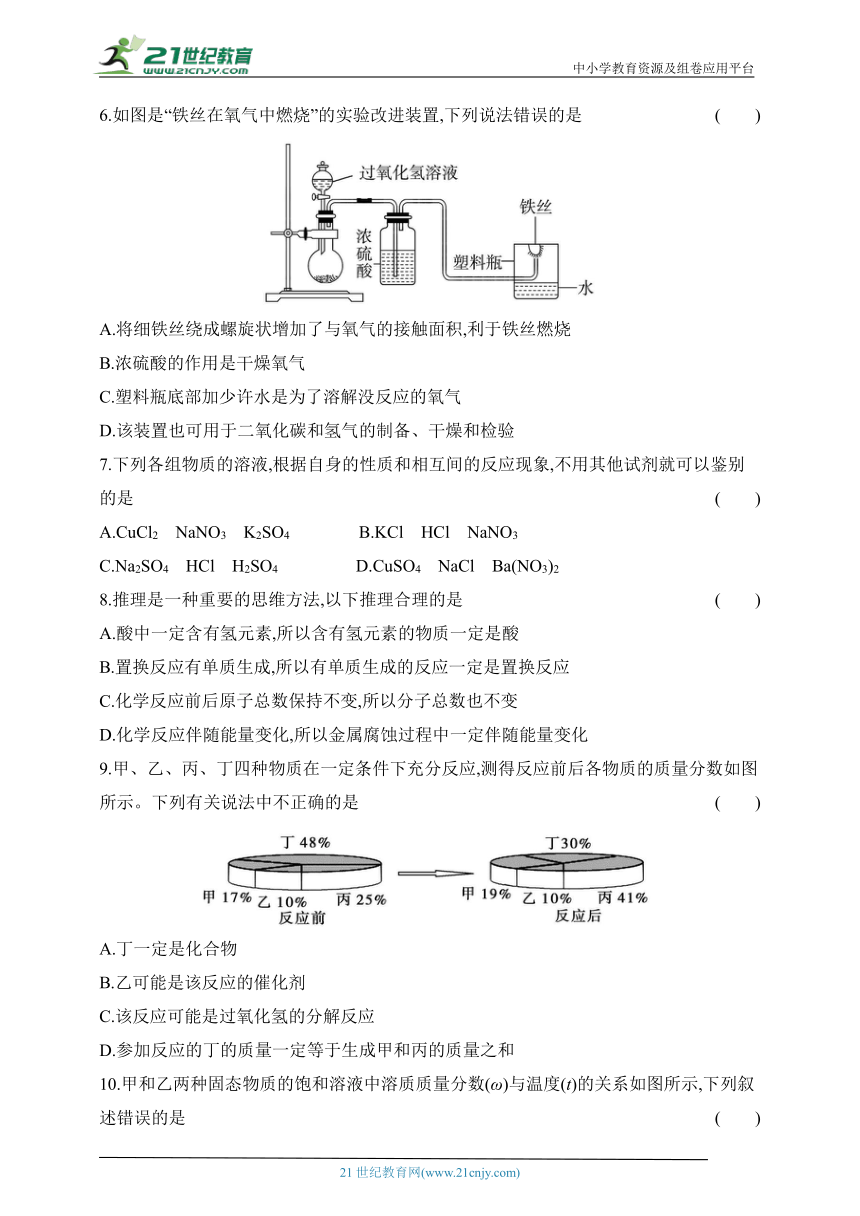
6.如图是“铁丝在氧气中燃烧”的实验改进装置,下列说法错误的是 ( )
A.将细铁丝绕成螺旋状增加了与氧气的接触面积,利于铁丝燃烧
B.浓硫酸的作用是干燥氧气
C.塑料瓶底部加少许水是为了溶解没反应的氧气
D.该装置也可用于二氧化碳和氢气的制备、干燥和检验
7.下列各组物质的溶液,根据自身的性质和相互间的反应现象,不用其他试剂就可以鉴别的是 ( )
A.CuCl2 NaNO3 K2SO4 B.KCl HCl NaNO3
C.Na2SO4 HCl H2SO4 D.CuSO4 NaCl Ba(NO3)2
8.推理是一种重要的思维方法,以下推理合理的是 ( )
A.酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B.置换反应有单质生成,所以有单质生成的反应一定是置换反应
C.化学反应前后原子总数保持不变,所以分子总数也不变
D.化学反应伴随能量变化,所以金属腐蚀过程中一定伴随能量变化
9.甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列有关说法中不正确的是 ( )
A.丁一定是化合物
B.乙可能是该反应的催化剂
C.该反应可能是过氧化氢的分解反应
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
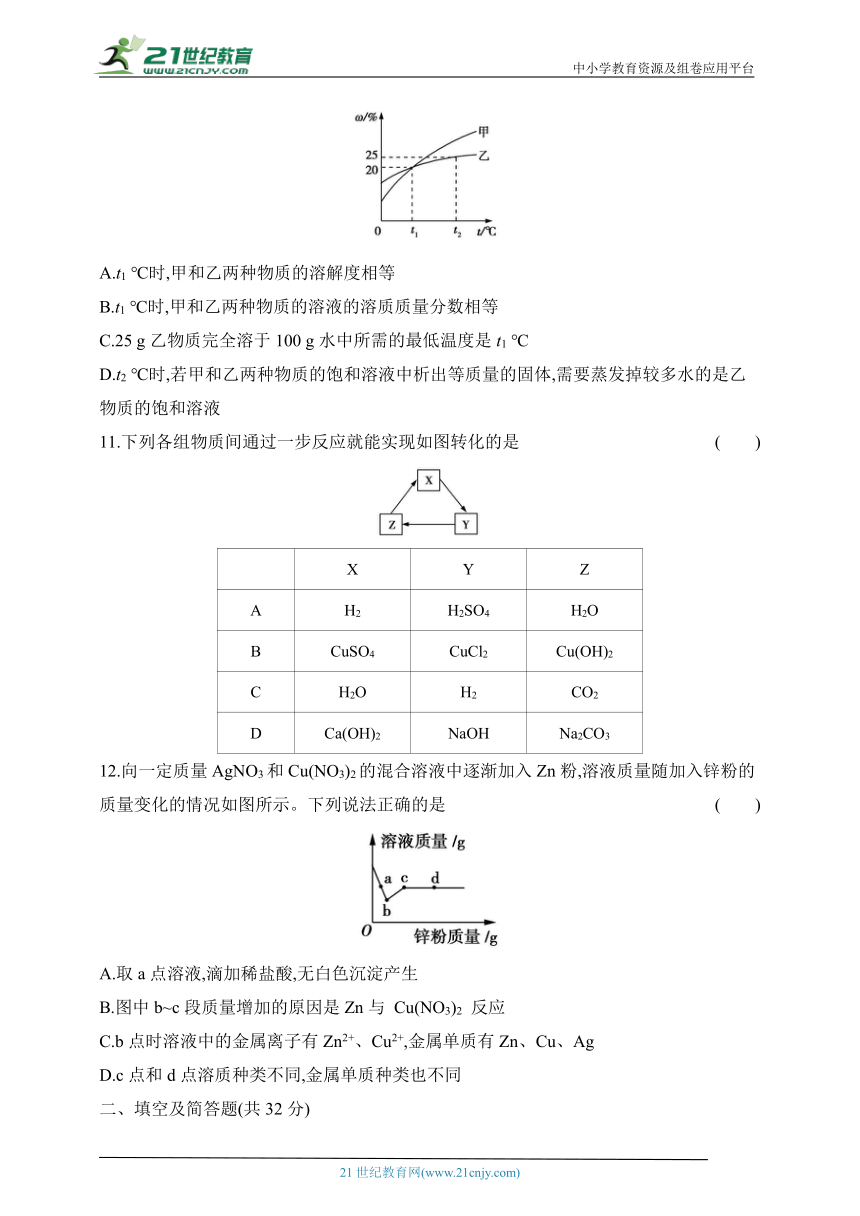
10.甲和乙两种固态物质的饱和溶液中溶质质量分数(ω)与温度(t)的关系如图所示,下列叙述错误的是 ( )
A.t1 ℃时,甲和乙两种物质的溶解度相等
B.t1 ℃时,甲和乙两种物质的溶液的溶质质量分数相等
C.25 g乙物质完全溶于100 g水中所需的最低温度是t1 ℃
D.t2 ℃时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液
11.下列各组物质间通过一步反应就能实现如图转化的是 ( )
X Y Z
A H2 H2SO4 H2O
B CuSO4 CuCl2 Cu(OH)2
C H2O H2 CO2
D Ca(OH)2 NaOH Na2CO3
12.向一定质量AgNO3和Cu(NO3)2的混合溶液中逐渐加入Zn粉,溶液质量随加入锌粉的质量变化的情况如图所示。下列说法正确的是 ( )
A.取a点溶液,滴加稀盐酸,无白色沉淀产生
B.图中b~c段质量增加的原因是Zn与 Cu(NO3)2 反应
C.b点时溶液中的金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag
D.c点和d点溶质种类不同,金属单质种类也不同
二、填空及简答题(共32分)
13.(6分)能源、材料、环境、食品等与人们的生产生活密切相关。请从化学的视角分析下列有关问题并填写空格:
(1)化石燃料包括煤、石油和 。
(2)铝合金可用于制造飞机的外壳, 铝合金属于 (填“合成材料”“金属材料” 或“复合材料”)。
(3)塑料给我们的生活带来便利的同时, 却对环境造成了不利影响,人们把塑料给环境带来的污染称为 。
(4)为了合理膳食,营养均衡,生活中把榨好的蔬菜汁放到面粉中,做成口味独特、营养丰富的蔬菜馒头,这种馒头提供的主要营养物质是 和 。
(5)化肥对提高农作物产量具有重要作用。尿素[CO(NH2)2]属于 (填“氮肥”“钾肥”或“磷肥”)。
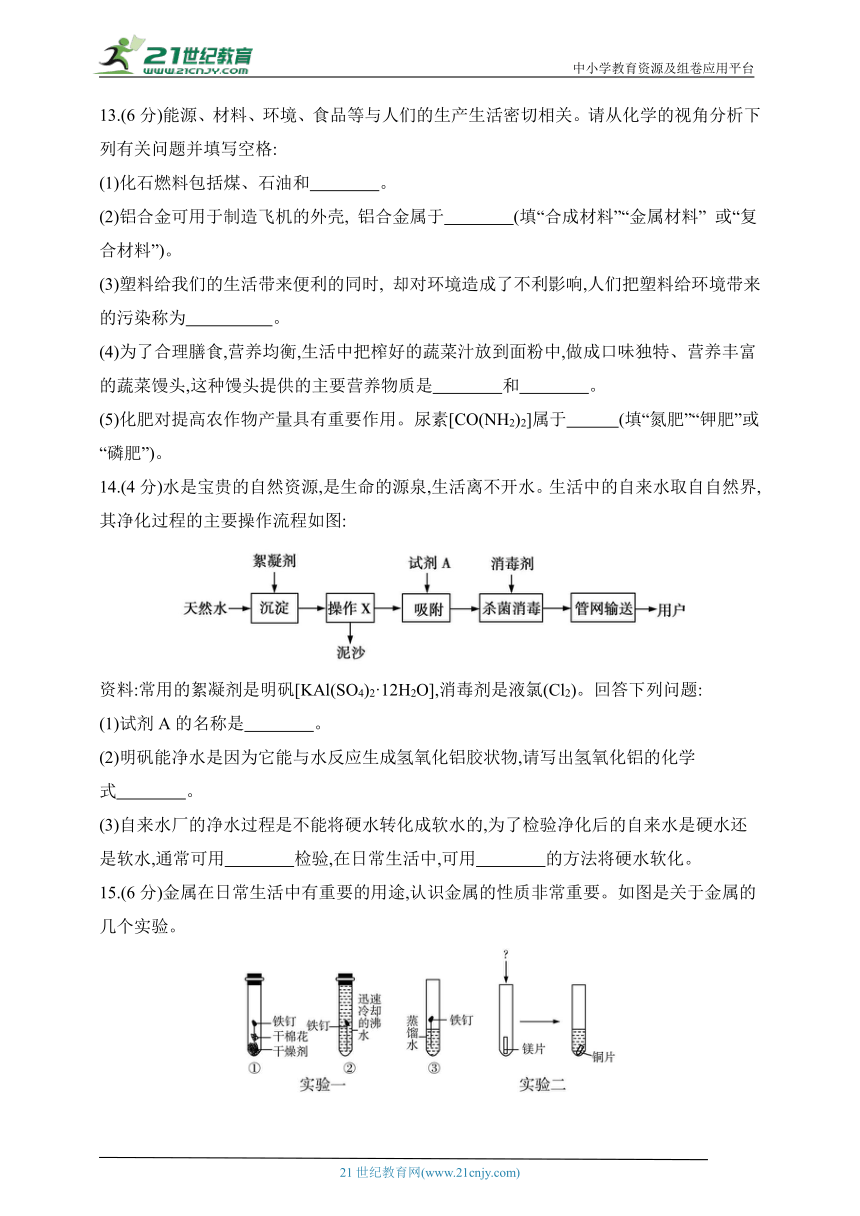
14.(4分)水是宝贵的自然资源,是生命的源泉,生活离不开水。生活中的自来水取自自然界,其净化过程的主要操作流程如图:
资料:常用的絮凝剂是明矾[KAl(SO4)2·12H2O],消毒剂是液氯(Cl2)。回答下列问题:
(1)试剂A的名称是 。
(2)明矾能净水是因为它能与水反应生成氢氧化铝胶状物,请写出氢氧化铝的化学式 。
(3)自来水厂的净水过程是不能将硬水转化成软水的,为了检验净化后的自来水是硬水还是软水,通常可用 检验,在日常生活中,可用 的方法将硬水软化。
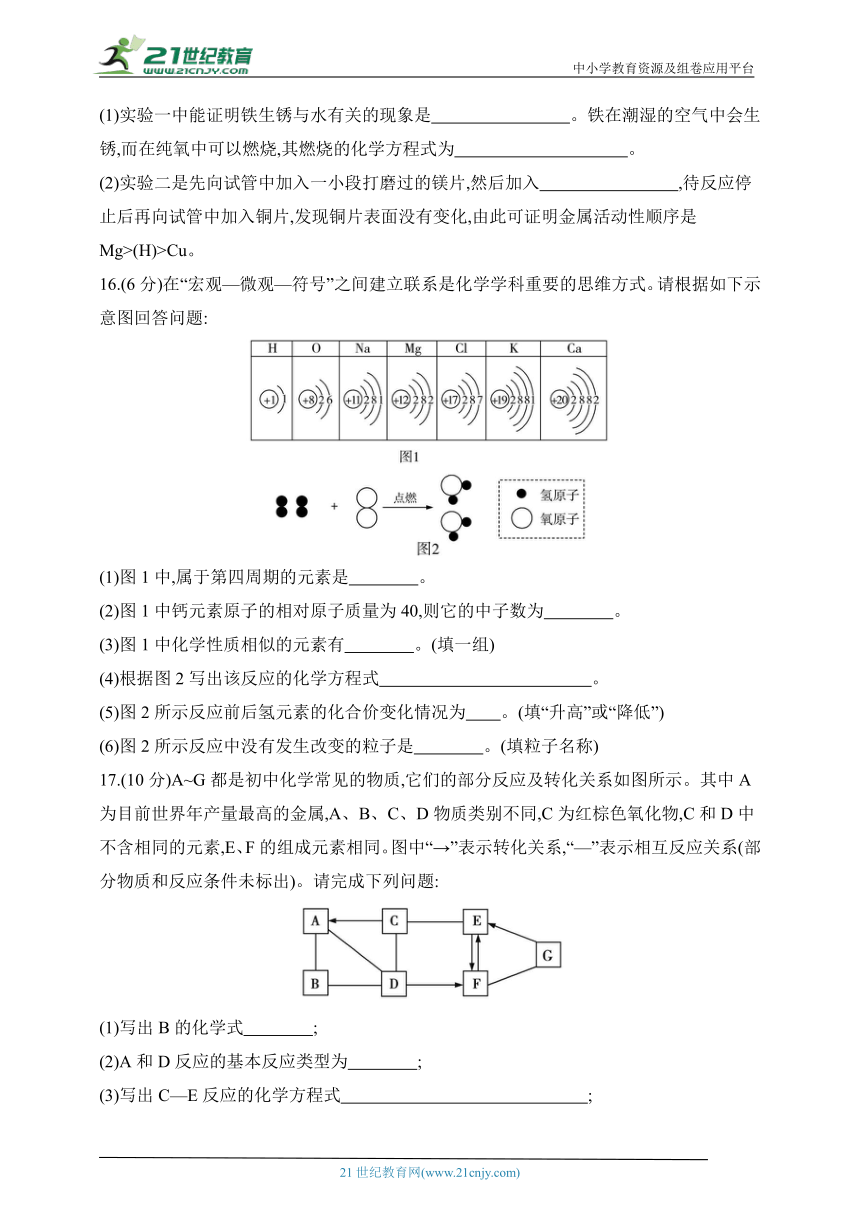
15.(6分)金属在日常生活中有重要的用途,认识金属的性质非常重要。如图是关于金属的几个实验。
(1)实验一中能证明铁生锈与水有关的现象是 。铁在潮湿的空气中会生锈,而在纯氧中可以燃烧,其燃烧的化学方程式为 。
(2)实验二是先向试管中加入一小段打磨过的镁片,然后加入 ,待反应停止后再向试管中加入铜片,发现铜片表面没有变化,由此可证明金属活动性顺序是Mg>(H)>Cu。
16.(6分)在“宏观—微观—符号”之间建立联系是化学学科重要的思维方式。请根据如下示意图回答问题:
(1)图1中,属于第四周期的元素是 。
(2)图1中钙元素原子的相对原子质量为40,则它的中子数为 。
(3)图1中化学性质相似的元素有 。(填一组)
(4)根据图2写出该反应的化学方程式 。
(5)图2所示反应前后氢元素的化合价变化情况为 。(填“升高”或“降低”)
(6)图2所示反应中没有发生改变的粒子是 。(填粒子名称)
17.(10分)A~G都是初中化学常见的物质,它们的部分反应及转化关系如图所示。其中A为目前世界年产量最高的金属,A、B、C、D物质类别不同,C为红棕色氧化物,C和D中不含相同的元素,E、F的组成元素相同。图中“→”表示转化关系,“—”表示相互反应关系(部分物质和反应条件未标出)。请完成下列问题:
(1)写出B的化学式 ;
(2)A和D反应的基本反应类型为 ;
(3)写出C—E反应的化学方程式 ;
(4)写出E→F反应的化学方程式 ,该反应伴随的能量变化是 (填“放热”或“吸热”)。
三、实验与探究题(共23分)
18.(9分)化学是一门以实验为基础的科学,请结合图示回答问题:
(1)实验室制取CO2的化学方程式为 ,如图甲,实验室制取CO2时一般选择的发生与收集装置是 (填序号),验满的方法是 。 不选择E装置作为收集装置的原因是 。
(2)小彭同学设计了图乙所示装置验证二氧化碳的性质,当通入二氧化碳一段时间
后,F中的现象是 ;G中的现象是 ;H中观察到蜡烛由低到高依次熄灭,说明 。
19.(14分)学习复分解反应发生的条件时,小红同学做了下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气体 有白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为 。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而说明试管①中也发生了反应,这种试剂是 。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即 Mg2+和 Cl-同时存在于溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示,S对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]
沉淀A的化学式是 。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂 改成 。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中观察到的现象是 。
[实验反思]小明反思步骤Ⅲ时想起,加NaOH溶液采用了滴加的方式,但没有立即观察到明显现象,你认为其中的原因是
。
四、计算题(共9分)
20.(9分)石灰石的主要成分是CaCO3,某校化学兴趣小组同学通过实验测定某石灰石中碳酸钙的质量分数。取一定量的石灰石样品研碎和100 g稀盐酸(足量)放入烧杯中,在反应过程中对烧杯及其中的剩余物进行称量(假设反应匀速进行,杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25 g),记录数据如下表:
反应时间/s 0 30 60 90 120 150
烧杯和药品质量/g 一定量 137.8 135.6 m 134.5 134.5
不考虑实验过程中的质量损失,请根据实验数据计算:
(1)反应时间30~60 s生成二氧化碳的质量为 g,表中的 m= 。
(2)该石灰石中碳酸钙的质量分数。(写出计算过程,计算结果精确至0.1%)
(3)假设石灰石和稀盐酸恰好完全反应,则反应后所得溶液的溶质质量分数为 (计算结果精确至0.1%)。
参考答案
1 2 3 4 5 6 7 8 9 10 11 12
A B A B B C D D C B B B
1.A 用二氧化碳灭火,是利用二氧化碳不能燃烧,也不支持燃烧,密度比空气大的性质,既利用了二氧化碳的物理性质,又利用了二氧化碳的化学性质。
2.B ①研发易降解的塑料能减少白色污染,符合题意;②含磷洗衣粉会污染水体,应限制生产,符合题意;③田间焚烧秸秆会污染环境,不符合题意;④应用高效洁净的能源可以减少大气污染物的排放,符合题意;⑤大量使用化石燃料会排放大量废气、烟尘,污染环境,不符合题意。
3.A 油菜花旁香味浓郁是由于分子在不断运动,A正确;蔗糖是白色固体与分子大小无关,分子用肉眼看不到,B错误;干冰升华的过程中分子之间间隔增大,分子本身的大小不变,C错误;水结冰体积膨胀是由于分子之间的间隔增大,分子本身的体积不变,D错误。
4.B 油锅着火后向锅中放入菜叶可以降低油的温度,油的着火点不能降低,A错误;为了使煤充分燃烧,节约能源,可将家用煤加工成蜂窝煤以增大煤与氧气的接触面积,B正确;出现火灾时,火有可能把电线烧断,导致电梯不能正常运转,坐电梯逃生有可能被困,C错误;不慎碰倒了酒精灯,酒精在桌面上燃烧,应该用湿抹布或沙子扑灭,而不能用水来灭火,D错误。
5.B 地瑞那韦属于宏观物质,地瑞那韦分子为微观物质,应说一个地瑞那韦分子由75个原子构成,不能说地瑞那韦由75个原子构成,A项错;地瑞那韦中含有碳元素,属于有机物,B项对;地瑞那韦中碳、氢、氮、氧、硫元素的质量之比为(27×12)∶(37×1)∶(3×14)∶(7×16)∶32=324∶37∶42∶112∶32,地瑞那韦中质量分数最大的元素是碳,C项错;地瑞那韦中氮、氧元素的质量比为42∶112=3∶8,D项错。
6.C 细铁丝绕成螺旋状增加了与氧气的接触面积,利于铁丝燃烧,A正确;浓硫酸具有吸水性,可用于干燥氧气,B正确;塑料瓶底部加少许水是为了吸收溅落熔化物的热量,防止灼烧破瓶底,不是为了溶解没反应的氧气,C错误;如果将分液漏斗中的过氧化氢溶液换为稀盐酸(或稀硫酸),将烧瓶中的固体改为石灰石(或锌粒),铁丝换成燃着的木条,可用于二氧化碳(或氢气)的制备、干燥和检验,D正确。故选C。
7.D CuSO4溶液呈蓝色,可通过观察颜色鉴别出来,各取少量另外两种溶液,分别滴入硫酸铜溶液,生成白色沉淀的是Ba(NO3)2溶液,无明显现象的是NaCl溶液。
8.D 酸中一定含有氢元素,但含有氢元素的物质不一定是酸,例如NaOH,故A不正确;置换反应有单质生成,但有单质生成的反应不一定是置换反应,例如电解水,故B不正确;化学反应前后原子总数保持不变,但分子总数不一定不变,例如CO燃烧生成CO2,故C不正确;化学反应伴随能量变化,金属的腐蚀是化学变化,所以该过程中一定伴随能量变化,故D正确。故选D。
9.C 由示意图可知,丁是反应物,甲、丙是生成物,三者的质量比是9∶1∶8。过氧化氢分解的反应中过氧化氢、氧气和水的质量比是17∶8∶9。
10.B 通过分析溶质的质量分数与温度的关系曲线可知,t1 ℃时,甲和乙两种固态物质的饱和溶液中溶质质量分数相等,所以甲和乙两种物质的溶解度相等,A说法正确;t1 ℃时,甲和乙两种物质的溶液的状态不能确定,可能是饱和溶液,也可能是不饱和溶液,所以溶质质量分数不能确定,B说法错误;25 g乙物质完全溶于100 g水中,若形成的是饱和溶液,其溶质质量分数为×100%=20%,所以25 g乙物质完全溶于100 g水中所需的最低温度是t1 ℃,C说法正确;设析出质量为a的固体,需要蒸发水的质量为x,该温度下固体的溶解度为S,则=,x=,a相等,则S越小,x越大,所以t2 ℃时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液,D说法正确。
11.B 将四个选项中的X、Y、Z物质分别填入框图中,分析如下列图示:
由以上各图可知,只有B项各物质间可以实现一步转化。
12.B 将题图中信息补充如下图:
a点硝酸银有剩余,加入稀盐酸,有白色沉淀生成,A项错误;b~c段溶液质量增加是因为Zn与Cu(NO3)2反应,每65份质量的Zn反应生成64份质量的Cu,B项正确;b点时AgNO3刚好完全反应,溶液中有生成的Zn2+和未开始反应的Cu2+,金属单质中没有Zn、Cu,C项错误;c点时Cu(NO3)2刚好完全反应,d点Zn过量,c点和d点溶质种类相同,金属单质不同,D项错误。
13.(每空1分)(1)天然气 (2)金属材料 (3)白色污染 (4)糖类 维生素 (5)氮肥
14.(每空1分)(1)活性炭 (2)Al(OH)3 (3)肥皂水 煮沸
15.(每空2分)(1)试管①中铁钉不生锈,试管③中铁钉生锈 3Fe+2O2Fe3O4 (2)足量的稀盐酸(或稀硫酸)
【解题思路】(2)由该实验可以得到结论金属活动性顺序是Mg>(H)>Cu,说明Mg可以与酸反应,Cu不能与酸反应,也不与Mg的盐溶液反应,则可以加入足量稀盐酸或稀硫酸,Mg与酸反应得到Mg的盐溶液,再加入铜片,铜片表面没有变化,说明Cu既没有与酸反应,也没有与Mg的盐溶液反应。
16.(每空1分)(1)K、Ca (2)20 (3)Na和K(或Mg和Ca) (4)2H2+O22H2O (5)升高 (6)氢原子、氧原子
17.(每空2分)(1)AgNO3 (2)置换反应 (3)3CO+Fe2O3 2Fe+3CO2
(4)2CO+O2 2CO2 放热(此小题答案不唯一,合理即可)
【解题思路】(1)A为目前世界年产量最高的金属,则A是铁。A、B、C、D物质类别不同,C为红棕色氧化物,C可转化成铁,则C是氧化铁。D与铁、氧化铁均能反应,且C和D中不含相同的元素,则D是盐酸。B与盐酸、铁均能反应,则B是硝酸银。盐酸能转化成F,E能与氧化铁反应,且E、F的组成元素相同,则F是二氧化碳,E是一氧化碳。G能转化成一氧化碳,且能与二氧化碳反应,则G是碳。(2)A和D的反应是铁和盐酸反应生成氯化亚铁和氢气,基本反应类型为置换反应。(3)C—E的反应是一氧化碳和氧化铁在高温条件下生成铁和二氧化碳。(4)E→F的反应可以是一氧化碳和氧气在点燃的条件下生成二氧化碳,该反应放热。
18.(除标注外,每空1分)(1)CaCO3+2HClCaCl2+H2O+CO2↑(2分) AD 把燃着的木条放在集气瓶口,若木条熄灭则已集满 CO2能溶于水,能和水反应
(2)紫色石蕊试液变红色 澄清石灰水变浑浊 二氧化碳的密度比空气大,不燃烧,也不支持燃烧(2分)
19.(每空2分)(1)H2SO4+Na2CO3 Na2SO4+H2O+CO2↑ (2)酚酞溶液 (3)[设计方案]BaSO4 BaCl2溶液 Ba(NO3)2溶液 均有白色沉淀产生 [实验反思]氢氧化钠先与溶液中的酸反应了
【解题思路】(2)无明显现象的酸碱中和反应,可借助指示剂颜色的变化来判断反应是否发生,向氢氧化钠溶液中滴加无色酚酞溶液,溶液变红,随着稀硫酸的加入,溶液碱性逐渐减弱,最后变为中性或酸性,溶液由红色变为无色。(3)[设计方案]将题图中的信息补充如下图:
沉淀A是硫酸钡;加入氯化钡溶液会引入Cl-,对原溶液中氯离子的检验产生干扰,应将氯化钡溶液改为硝酸钡溶液;步骤Ⅱ氯离子能与银离子结合成氯化银白色沉淀,步骤Ⅲ镁离子能与氢氧根离子结合成氢氧化镁白色沉淀。[实验反思]经过步骤Ⅰ后所得溶液中有新酸生成,加入的氢氧化钠溶液先与酸发生中和反应,当酸被完全中和后,氢氧化钠溶液再与氯化镁发生反应产生氢氧化镁白色沉淀。
20.(1)2.2(1分) 134.5(1分)
(2)解:通过分析表中的数据可知,石灰石样品完全反应生成二氧化碳的质量为(137.8 g-135.6 g)×2+(135.6 g-134.5 g)=5.5 g (1分)
石灰石样品的质量为134.5 g+5.5 g-100 g-25 g=15.0 g (1分)
设完全反应时消耗碳酸钙的质量为x。
CaCO3+2HCl CaCl2+H2O+CO2↑ (2分)
100 44
x 5.5 g
=
x=12.5 g (1分)
碳酸钙的质量分数为×100%≈83.3% (1分)
答:该石灰石中碳酸钙的质量分数约为83.3%。
(3)13.0%(1分)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024沪教版九年级化学下学期单元测试卷
期末测评卷
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 S—32 Cl—35.5 Ca—40 Cu—64 Zn—65 Ag—108
一、选择题(每小题3分,共36分,每小题只有一个选项符合题意)
1.下列物质的用途中,既利用了其物理性质,又利用了其化学性质的是( )
A.用二氧化碳灭火 B.用铁锅炒菜做饭
C.用煤作燃料 D.用石墨作干电池的电极
2.下列措施有利于生态文明建设的是 ( )
①研发易降解塑料 ②限制生产含磷的洗衣粉
③田间焚烧秸秆 ④应用高效洁净的能源
⑤加快化石燃料的开发与使用
A.①③⑤ B.①②④ C.②③⑤ D.②④⑤
3.下列事实用分子观点解释正确的是 ( )
A.油菜花旁香味浓郁证明分子在不断运动
B.蔗糖是白色固体说明分子用肉眼可看见
C.干冰升华说明分子可以再分
D.水结冰体积膨胀是因为分子体积变大了
4.下列有关燃烧和灭火的说法正确的是 ( )
A.油锅着火后向锅中放入菜叶的目的是降低油的着火点
B.家用煤加工成蜂窝煤是为了增大煤与氧气的接触面积
C.高层建筑物起火立即乘电梯撤离
D.不慎碰倒了酒精灯,酒精在桌面上燃烧,用水来灭火
5.地瑞那韦(化学式为C27H37N3O7S)对新冠肺炎病毒有一定的抑制作用,下列有关说法正确的是 ( )
A.地瑞那韦由75个原子构成
B.地瑞那韦属于有机物
C.地瑞那韦中质量分数最大的元素是氢
D.地瑞那韦中氮、氧元素的质量比是3∶7
6.如图是“铁丝在氧气中燃烧”的实验改进装置,下列说法错误的是 ( )
A.将细铁丝绕成螺旋状增加了与氧气的接触面积,利于铁丝燃烧
B.浓硫酸的作用是干燥氧气
C.塑料瓶底部加少许水是为了溶解没反应的氧气
D.该装置也可用于二氧化碳和氢气的制备、干燥和检验
7.下列各组物质的溶液,根据自身的性质和相互间的反应现象,不用其他试剂就可以鉴别的是 ( )
A.CuCl2 NaNO3 K2SO4 B.KCl HCl NaNO3
C.Na2SO4 HCl H2SO4 D.CuSO4 NaCl Ba(NO3)2
8.推理是一种重要的思维方法,以下推理合理的是 ( )
A.酸中一定含有氢元素,所以含有氢元素的物质一定是酸
B.置换反应有单质生成,所以有单质生成的反应一定是置换反应
C.化学反应前后原子总数保持不变,所以分子总数也不变
D.化学反应伴随能量变化,所以金属腐蚀过程中一定伴随能量变化
9.甲、乙、丙、丁四种物质在一定条件下充分反应,测得反应前后各物质的质量分数如图所示。下列有关说法中不正确的是 ( )
A.丁一定是化合物
B.乙可能是该反应的催化剂
C.该反应可能是过氧化氢的分解反应
D.参加反应的丁的质量一定等于生成甲和丙的质量之和
10.甲和乙两种固态物质的饱和溶液中溶质质量分数(ω)与温度(t)的关系如图所示,下列叙述错误的是 ( )
A.t1 ℃时,甲和乙两种物质的溶解度相等
B.t1 ℃时,甲和乙两种物质的溶液的溶质质量分数相等
C.25 g乙物质完全溶于100 g水中所需的最低温度是t1 ℃
D.t2 ℃时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液
11.下列各组物质间通过一步反应就能实现如图转化的是 ( )
X Y Z
A H2 H2SO4 H2O
B CuSO4 CuCl2 Cu(OH)2
C H2O H2 CO2
D Ca(OH)2 NaOH Na2CO3
12.向一定质量AgNO3和Cu(NO3)2的混合溶液中逐渐加入Zn粉,溶液质量随加入锌粉的质量变化的情况如图所示。下列说法正确的是 ( )
A.取a点溶液,滴加稀盐酸,无白色沉淀产生
B.图中b~c段质量增加的原因是Zn与 Cu(NO3)2 反应
C.b点时溶液中的金属离子有Zn2+、Cu2+,金属单质有Zn、Cu、Ag
D.c点和d点溶质种类不同,金属单质种类也不同
二、填空及简答题(共32分)
13.(6分)能源、材料、环境、食品等与人们的生产生活密切相关。请从化学的视角分析下列有关问题并填写空格:
(1)化石燃料包括煤、石油和 。
(2)铝合金可用于制造飞机的外壳, 铝合金属于 (填“合成材料”“金属材料” 或“复合材料”)。
(3)塑料给我们的生活带来便利的同时, 却对环境造成了不利影响,人们把塑料给环境带来的污染称为 。
(4)为了合理膳食,营养均衡,生活中把榨好的蔬菜汁放到面粉中,做成口味独特、营养丰富的蔬菜馒头,这种馒头提供的主要营养物质是 和 。
(5)化肥对提高农作物产量具有重要作用。尿素[CO(NH2)2]属于 (填“氮肥”“钾肥”或“磷肥”)。
14.(4分)水是宝贵的自然资源,是生命的源泉,生活离不开水。生活中的自来水取自自然界,其净化过程的主要操作流程如图:
资料:常用的絮凝剂是明矾[KAl(SO4)2·12H2O],消毒剂是液氯(Cl2)。回答下列问题:
(1)试剂A的名称是 。
(2)明矾能净水是因为它能与水反应生成氢氧化铝胶状物,请写出氢氧化铝的化学式 。
(3)自来水厂的净水过程是不能将硬水转化成软水的,为了检验净化后的自来水是硬水还是软水,通常可用 检验,在日常生活中,可用 的方法将硬水软化。
15.(6分)金属在日常生活中有重要的用途,认识金属的性质非常重要。如图是关于金属的几个实验。
(1)实验一中能证明铁生锈与水有关的现象是 。铁在潮湿的空气中会生锈,而在纯氧中可以燃烧,其燃烧的化学方程式为 。
(2)实验二是先向试管中加入一小段打磨过的镁片,然后加入 ,待反应停止后再向试管中加入铜片,发现铜片表面没有变化,由此可证明金属活动性顺序是Mg>(H)>Cu。
16.(6分)在“宏观—微观—符号”之间建立联系是化学学科重要的思维方式。请根据如下示意图回答问题:
(1)图1中,属于第四周期的元素是 。
(2)图1中钙元素原子的相对原子质量为40,则它的中子数为 。
(3)图1中化学性质相似的元素有 。(填一组)
(4)根据图2写出该反应的化学方程式 。
(5)图2所示反应前后氢元素的化合价变化情况为 。(填“升高”或“降低”)
(6)图2所示反应中没有发生改变的粒子是 。(填粒子名称)
17.(10分)A~G都是初中化学常见的物质,它们的部分反应及转化关系如图所示。其中A为目前世界年产量最高的金属,A、B、C、D物质类别不同,C为红棕色氧化物,C和D中不含相同的元素,E、F的组成元素相同。图中“→”表示转化关系,“—”表示相互反应关系(部分物质和反应条件未标出)。请完成下列问题:
(1)写出B的化学式 ;
(2)A和D反应的基本反应类型为 ;
(3)写出C—E反应的化学方程式 ;
(4)写出E→F反应的化学方程式 ,该反应伴随的能量变化是 (填“放热”或“吸热”)。
三、实验与探究题(共23分)
18.(9分)化学是一门以实验为基础的科学,请结合图示回答问题:
(1)实验室制取CO2的化学方程式为 ,如图甲,实验室制取CO2时一般选择的发生与收集装置是 (填序号),验满的方法是 。 不选择E装置作为收集装置的原因是 。
(2)小彭同学设计了图乙所示装置验证二氧化碳的性质,当通入二氧化碳一段时间
后,F中的现象是 ;G中的现象是 ;H中观察到蜡烛由低到高依次熄灭,说明 。
19.(14分)学习复分解反应发生的条件时,小红同学做了下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气体 有白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。试管③中反应的化学方程式为 。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而说明试管①中也发生了反应,这种试剂是 。
(3)为了验证试管②中是否发生复分解反应,小明同学进行了如下探究。
[提出猜想]猜想1:试管②中没有发生复分解反应,溶液中有MgCl2,即 Mg2+和 Cl-同时存在于溶液中。
猜想2:试管②中发生了复分解反应,溶液中无MgCl2。
老师提示,S对Cl-的检验有干扰,需要先除去,小明根据老师的提示和自己的猜想提出了以下实验方案。
[设计方案]
沉淀A的化学式是 。老师评价该方案时指出:设计思路正确,但试剂选择有误,你认为应该将所选的试剂 改成 。
小明按照修改后的方案进行了实验,最后得出的结论是猜想1正确,则步骤Ⅱ、步骤Ⅲ中观察到的现象是 。
[实验反思]小明反思步骤Ⅲ时想起,加NaOH溶液采用了滴加的方式,但没有立即观察到明显现象,你认为其中的原因是
。
四、计算题(共9分)
20.(9分)石灰石的主要成分是CaCO3,某校化学兴趣小组同学通过实验测定某石灰石中碳酸钙的质量分数。取一定量的石灰石样品研碎和100 g稀盐酸(足量)放入烧杯中,在反应过程中对烧杯及其中的剩余物进行称量(假设反应匀速进行,杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25 g),记录数据如下表:
反应时间/s 0 30 60 90 120 150
烧杯和药品质量/g 一定量 137.8 135.6 m 134.5 134.5
不考虑实验过程中的质量损失,请根据实验数据计算:
(1)反应时间30~60 s生成二氧化碳的质量为 g,表中的 m= 。
(2)该石灰石中碳酸钙的质量分数。(写出计算过程,计算结果精确至0.1%)
(3)假设石灰石和稀盐酸恰好完全反应,则反应后所得溶液的溶质质量分数为 (计算结果精确至0.1%)。
参考答案
1 2 3 4 5 6 7 8 9 10 11 12
A B A B B C D D C B B B
1.A 用二氧化碳灭火,是利用二氧化碳不能燃烧,也不支持燃烧,密度比空气大的性质,既利用了二氧化碳的物理性质,又利用了二氧化碳的化学性质。
2.B ①研发易降解的塑料能减少白色污染,符合题意;②含磷洗衣粉会污染水体,应限制生产,符合题意;③田间焚烧秸秆会污染环境,不符合题意;④应用高效洁净的能源可以减少大气污染物的排放,符合题意;⑤大量使用化石燃料会排放大量废气、烟尘,污染环境,不符合题意。
3.A 油菜花旁香味浓郁是由于分子在不断运动,A正确;蔗糖是白色固体与分子大小无关,分子用肉眼看不到,B错误;干冰升华的过程中分子之间间隔增大,分子本身的大小不变,C错误;水结冰体积膨胀是由于分子之间的间隔增大,分子本身的体积不变,D错误。
4.B 油锅着火后向锅中放入菜叶可以降低油的温度,油的着火点不能降低,A错误;为了使煤充分燃烧,节约能源,可将家用煤加工成蜂窝煤以增大煤与氧气的接触面积,B正确;出现火灾时,火有可能把电线烧断,导致电梯不能正常运转,坐电梯逃生有可能被困,C错误;不慎碰倒了酒精灯,酒精在桌面上燃烧,应该用湿抹布或沙子扑灭,而不能用水来灭火,D错误。
5.B 地瑞那韦属于宏观物质,地瑞那韦分子为微观物质,应说一个地瑞那韦分子由75个原子构成,不能说地瑞那韦由75个原子构成,A项错;地瑞那韦中含有碳元素,属于有机物,B项对;地瑞那韦中碳、氢、氮、氧、硫元素的质量之比为(27×12)∶(37×1)∶(3×14)∶(7×16)∶32=324∶37∶42∶112∶32,地瑞那韦中质量分数最大的元素是碳,C项错;地瑞那韦中氮、氧元素的质量比为42∶112=3∶8,D项错。
6.C 细铁丝绕成螺旋状增加了与氧气的接触面积,利于铁丝燃烧,A正确;浓硫酸具有吸水性,可用于干燥氧气,B正确;塑料瓶底部加少许水是为了吸收溅落熔化物的热量,防止灼烧破瓶底,不是为了溶解没反应的氧气,C错误;如果将分液漏斗中的过氧化氢溶液换为稀盐酸(或稀硫酸),将烧瓶中的固体改为石灰石(或锌粒),铁丝换成燃着的木条,可用于二氧化碳(或氢气)的制备、干燥和检验,D正确。故选C。
7.D CuSO4溶液呈蓝色,可通过观察颜色鉴别出来,各取少量另外两种溶液,分别滴入硫酸铜溶液,生成白色沉淀的是Ba(NO3)2溶液,无明显现象的是NaCl溶液。
8.D 酸中一定含有氢元素,但含有氢元素的物质不一定是酸,例如NaOH,故A不正确;置换反应有单质生成,但有单质生成的反应不一定是置换反应,例如电解水,故B不正确;化学反应前后原子总数保持不变,但分子总数不一定不变,例如CO燃烧生成CO2,故C不正确;化学反应伴随能量变化,金属的腐蚀是化学变化,所以该过程中一定伴随能量变化,故D正确。故选D。
9.C 由示意图可知,丁是反应物,甲、丙是生成物,三者的质量比是9∶1∶8。过氧化氢分解的反应中过氧化氢、氧气和水的质量比是17∶8∶9。
10.B 通过分析溶质的质量分数与温度的关系曲线可知,t1 ℃时,甲和乙两种固态物质的饱和溶液中溶质质量分数相等,所以甲和乙两种物质的溶解度相等,A说法正确;t1 ℃时,甲和乙两种物质的溶液的状态不能确定,可能是饱和溶液,也可能是不饱和溶液,所以溶质质量分数不能确定,B说法错误;25 g乙物质完全溶于100 g水中,若形成的是饱和溶液,其溶质质量分数为×100%=20%,所以25 g乙物质完全溶于100 g水中所需的最低温度是t1 ℃,C说法正确;设析出质量为a的固体,需要蒸发水的质量为x,该温度下固体的溶解度为S,则=,x=,a相等,则S越小,x越大,所以t2 ℃时,若甲和乙两种物质的饱和溶液中析出等质量的固体,需要蒸发掉较多水的是乙物质的饱和溶液,D说法正确。
11.B 将四个选项中的X、Y、Z物质分别填入框图中,分析如下列图示:
由以上各图可知,只有B项各物质间可以实现一步转化。
12.B 将题图中信息补充如下图:
a点硝酸银有剩余,加入稀盐酸,有白色沉淀生成,A项错误;b~c段溶液质量增加是因为Zn与Cu(NO3)2反应,每65份质量的Zn反应生成64份质量的Cu,B项正确;b点时AgNO3刚好完全反应,溶液中有生成的Zn2+和未开始反应的Cu2+,金属单质中没有Zn、Cu,C项错误;c点时Cu(NO3)2刚好完全反应,d点Zn过量,c点和d点溶质种类相同,金属单质不同,D项错误。
13.(每空1分)(1)天然气 (2)金属材料 (3)白色污染 (4)糖类 维生素 (5)氮肥
14.(每空1分)(1)活性炭 (2)Al(OH)3 (3)肥皂水 煮沸
15.(每空2分)(1)试管①中铁钉不生锈,试管③中铁钉生锈 3Fe+2O2Fe3O4 (2)足量的稀盐酸(或稀硫酸)
【解题思路】(2)由该实验可以得到结论金属活动性顺序是Mg>(H)>Cu,说明Mg可以与酸反应,Cu不能与酸反应,也不与Mg的盐溶液反应,则可以加入足量稀盐酸或稀硫酸,Mg与酸反应得到Mg的盐溶液,再加入铜片,铜片表面没有变化,说明Cu既没有与酸反应,也没有与Mg的盐溶液反应。
16.(每空1分)(1)K、Ca (2)20 (3)Na和K(或Mg和Ca) (4)2H2+O22H2O (5)升高 (6)氢原子、氧原子
17.(每空2分)(1)AgNO3 (2)置换反应 (3)3CO+Fe2O3 2Fe+3CO2
(4)2CO+O2 2CO2 放热(此小题答案不唯一,合理即可)
【解题思路】(1)A为目前世界年产量最高的金属,则A是铁。A、B、C、D物质类别不同,C为红棕色氧化物,C可转化成铁,则C是氧化铁。D与铁、氧化铁均能反应,且C和D中不含相同的元素,则D是盐酸。B与盐酸、铁均能反应,则B是硝酸银。盐酸能转化成F,E能与氧化铁反应,且E、F的组成元素相同,则F是二氧化碳,E是一氧化碳。G能转化成一氧化碳,且能与二氧化碳反应,则G是碳。(2)A和D的反应是铁和盐酸反应生成氯化亚铁和氢气,基本反应类型为置换反应。(3)C—E的反应是一氧化碳和氧化铁在高温条件下生成铁和二氧化碳。(4)E→F的反应可以是一氧化碳和氧气在点燃的条件下生成二氧化碳,该反应放热。
18.(除标注外,每空1分)(1)CaCO3+2HClCaCl2+H2O+CO2↑(2分) AD 把燃着的木条放在集气瓶口,若木条熄灭则已集满 CO2能溶于水,能和水反应
(2)紫色石蕊试液变红色 澄清石灰水变浑浊 二氧化碳的密度比空气大,不燃烧,也不支持燃烧(2分)
19.(每空2分)(1)H2SO4+Na2CO3 Na2SO4+H2O+CO2↑ (2)酚酞溶液 (3)[设计方案]BaSO4 BaCl2溶液 Ba(NO3)2溶液 均有白色沉淀产生 [实验反思]氢氧化钠先与溶液中的酸反应了
【解题思路】(2)无明显现象的酸碱中和反应,可借助指示剂颜色的变化来判断反应是否发生,向氢氧化钠溶液中滴加无色酚酞溶液,溶液变红,随着稀硫酸的加入,溶液碱性逐渐减弱,最后变为中性或酸性,溶液由红色变为无色。(3)[设计方案]将题图中的信息补充如下图:
沉淀A是硫酸钡;加入氯化钡溶液会引入Cl-,对原溶液中氯离子的检验产生干扰,应将氯化钡溶液改为硝酸钡溶液;步骤Ⅱ氯离子能与银离子结合成氯化银白色沉淀,步骤Ⅲ镁离子能与氢氧根离子结合成氢氧化镁白色沉淀。[实验反思]经过步骤Ⅰ后所得溶液中有新酸生成,加入的氢氧化钠溶液先与酸发生中和反应,当酸被完全中和后,氢氧化钠溶液再与氯化镁发生反应产生氢氧化镁白色沉淀。
20.(1)2.2(1分) 134.5(1分)
(2)解:通过分析表中的数据可知,石灰石样品完全反应生成二氧化碳的质量为(137.8 g-135.6 g)×2+(135.6 g-134.5 g)=5.5 g (1分)
石灰石样品的质量为134.5 g+5.5 g-100 g-25 g=15.0 g (1分)
设完全反应时消耗碳酸钙的质量为x。
CaCO3+2HCl CaCl2+H2O+CO2↑ (2分)
100 44
x 5.5 g
=
x=12.5 g (1分)
碳酸钙的质量分数为×100%≈83.3% (1分)
答:该石灰石中碳酸钙的质量分数约为83.3%。
(3)13.0%(1分)
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
