2024人教版九年级化学下学期单元测试卷--第九单元 溶液测评卷(含答案)
文档属性
| 名称 | 2024人教版九年级化学下学期单元测试卷--第九单元 溶液测评卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024人教版九年级化学下学期单元测试卷
第九单元 溶 液
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 O—16 Cl—35.5
一、选择题(每小题2分,共30分,每小题只有一个选项符合题意)
1.将厨房中的下列物质放入足量水中,充分搅拌,不能形成溶液的是 ( )
A.植物油 B.味精 C.白糖 D.食盐
2.下列有关溶液的说法错误的是 ( )
A.溶液是均一、稳定的混合物
B.溶液中的溶质可以是固体、液体或气体
C.海水晒盐过程中析出食盐后的母液是该温度下食盐的不饱和溶液
D.在一定温度下,改变溶剂的量不会影响某固体物质的溶解度
3.20 ℃时,氯化钠的溶解度为36 g。该温度下,关于100 g氯化钠饱和溶液的说法不正确的是 ( )
A.溶质是氯化钠
B.溶液中含有36 g氯化钠
C.加水能使其变为不饱和溶液
D.取出20 g溶液,溶质质量分数与原溶液的相同
4.如图,瓶中盛有硝酸钾的饱和溶液,瓶底有未溶解的硝酸钾固体,木块漂浮在硝酸钾饱和溶液中。当向试管中加入一定量的硝酸铵固体时,能观察到的现象是 ( )
A.木块上浮
B.硝酸钾饱和溶液温度上升
C.U形管的左侧液面下降
D.瓶底的硝酸钾固体增多
5.比较食盐和蔗糖在水中的溶解性,必须控制的条件是 ( )
A.温度均相同
B.均用玻璃棒搅拌
C.水的质量相同
D.食盐和蔗糖颗粒大小均相同
6.夏季,鱼虾养殖池内常设置一些水泵,把水喷向空中,从化学角度分析,喷水的目的是 ( )
A.降低养殖池内水的温度
B.增大水与空气的接触面积,便于氧气溶解
C.增加观赏性
D.便于太阳照射,杀灭水中的病菌
7.下列清洗方法中,利用乳化原理的是 ( )
A.用汽油洗去衣服上的油污
B.用水洗去盘子上的水果渣
C.用洗洁精洗去餐具上的油污
D.用醋清洗水壶中的水垢
8.一杯20 ℃的硝酸钾溶液,能证明它是饱和溶液的方法是 ( )
A.蒸发掉10 g水有晶体析出
B.温度降低到10 ℃,有硝酸钾晶体析出
C.在该温度下加入少量硝酸钾晶体,晶体不减少
D.以上三种方法均可以
9.向50 g稀硫酸中加入16%的硫酸溶液150 g,混合后溶液中溶质质量分数为20%,则原稀硫酸中溶质的质量分数为 ( )
A.2% B.8% C.24% D.32%
10.配制100 g质量分数为5%的氯化钠溶液,小雪的实验操作与目的分析均正确的一组是( )
选项 实验操作 目的分析
A 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
B 称取氯化钠时,在两边托盘上各放一张相同的称量纸 整洁美观
C 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
D 溶解氯化钠时,用玻璃棒搅拌 增大氯化钠的溶解度
11.现有一接近饱和的某固体的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
12.将KNO3饱和溶液的温度由40 ℃降至10 ℃,其溶解度之差为43 g,则43 g表示 ( )
A.温度每降低30 ℃,析出KNO3的质量
B.每100 g溶剂中析出KNO3的质量
C.每100 g溶液中析出KNO3的质量
D.温度降低后该溶液中析出KNO3的质量
13.化学知识中有很多的“相等”。请你判断下列说法中不正确的是 ( )
A.50 g水和50 g酒精混合,所得溶液的质量等于100 g
B.50 mL的水和50 mL的酒精混合,所得溶液的体积等于100 mL
C.溶液稀释前后,溶质的质量相等
D.60 ℃时某熟石灰的饱和溶液的质量,与降温到20 ℃时所得溶液的质量相等
14.下表列出了部分温度下Ca(OH)2和KNO3的溶解度。下列说法正确的是 ( )
温度/℃ 10 30 50 60
溶解 度/g Ca(OH)2 0.18 0.15 0.12 0.11
KNO3 20.9 45.8 85.5 110
A.将50 ℃的Ca(OH)2饱和溶液降温到10 ℃有晶体析出
B.30 ℃时KNO3的饱和溶液中溶质的质量分数为45.8%
C.50 ℃时不可能配制溶质质量分数相等的Ca(OH)2、KNO3溶液
D.当KNO3溶液中混有少量Ca(OH)2时,可采用降温结晶的方法提纯
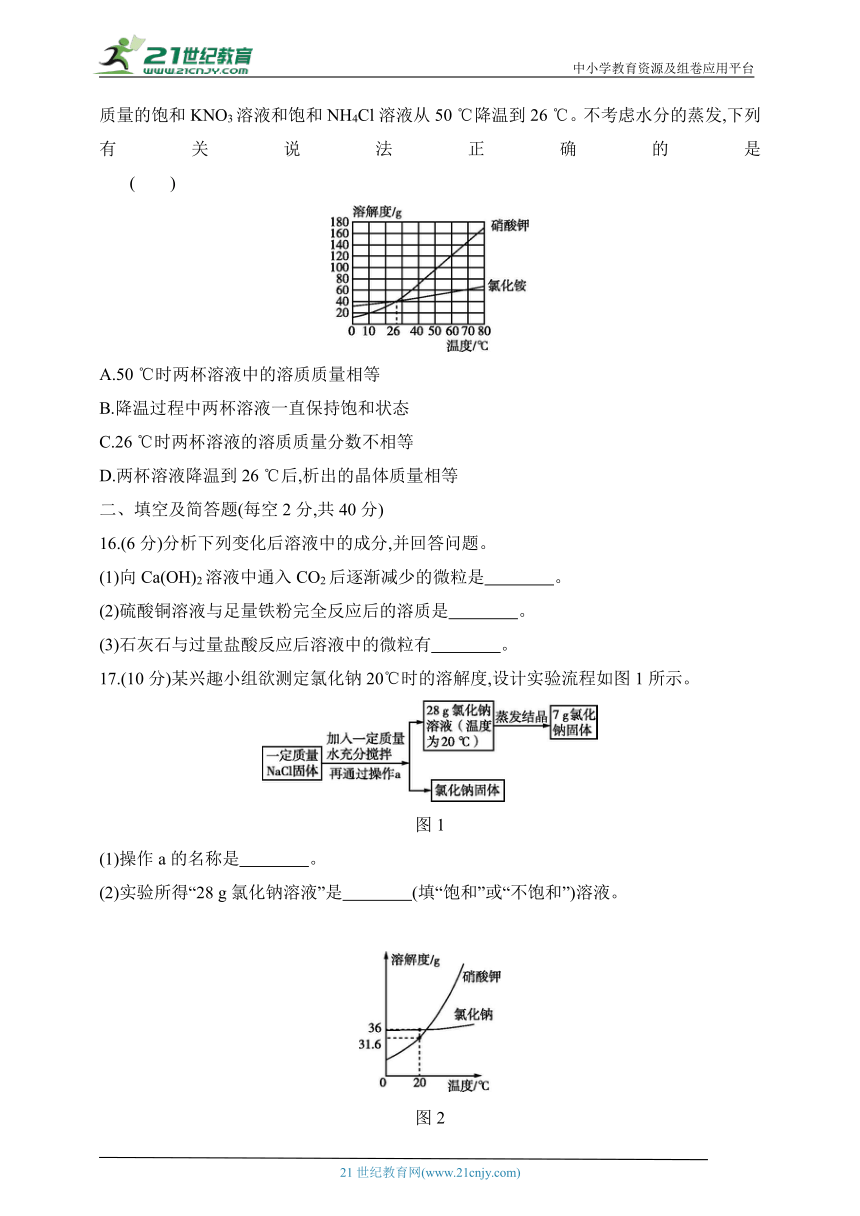
15.KNO3、NH4Cl可用于配制无土栽培营养液,二者的溶解度曲线如图所示。将两杯相同质量的饱和KNO3溶液和饱和NH4Cl溶液从50 ℃降温到26 ℃。不考虑水分的蒸发,下列有关说法正确的是 ( )
A.50 ℃时两杯溶液中的溶质质量相等
B.降温过程中两杯溶液一直保持饱和状态
C.26 ℃时两杯溶液的溶质质量分数不相等
D.两杯溶液降温到26 ℃后,析出的晶体质量相等
二、填空及简答题(每空2分,共40分)
16.(6分)分析下列变化后溶液中的成分,并回答问题。
(1)向Ca(OH)2溶液中通入CO2后逐渐减少的微粒是 。
(2)硫酸铜溶液与足量铁粉完全反应后的溶质是 。
(3)石灰石与过量盐酸反应后溶液中的微粒有 。
17.(10分)某兴趣小组欲测定氯化钠20℃时的溶解度,设计实验流程如图1所示。
图1
(1)操作a的名称是 。
(2)实验所得“28 g氯化钠溶液”是 (填“饱和”或“不饱和”)溶液。
图2
(3)经计算,本次实验测得20 ℃时氯化钠溶解度约33.3 g,与实际值(如图2)相比偏小,可能的原因是 (填序号)。
A.蒸发至水分蒸干时才停止加热,造成部分晶体溅出
B.蒸发后所得固体仍有水分,没有充分干燥就称量
(4)某位同学按上述实验流程测定硝酸钾20 ℃时的溶解度。在蒸发硝酸钾饱和溶液一部分水后,发现蒸发皿内溶液下方仍没有晶体析出,请结合硝酸钾的溶解度曲线(见图2)解释原因: 。
(5)20 ℃时将20 g硝酸钾投入50 g水中充分搅拌,所得溶液质量是 g。
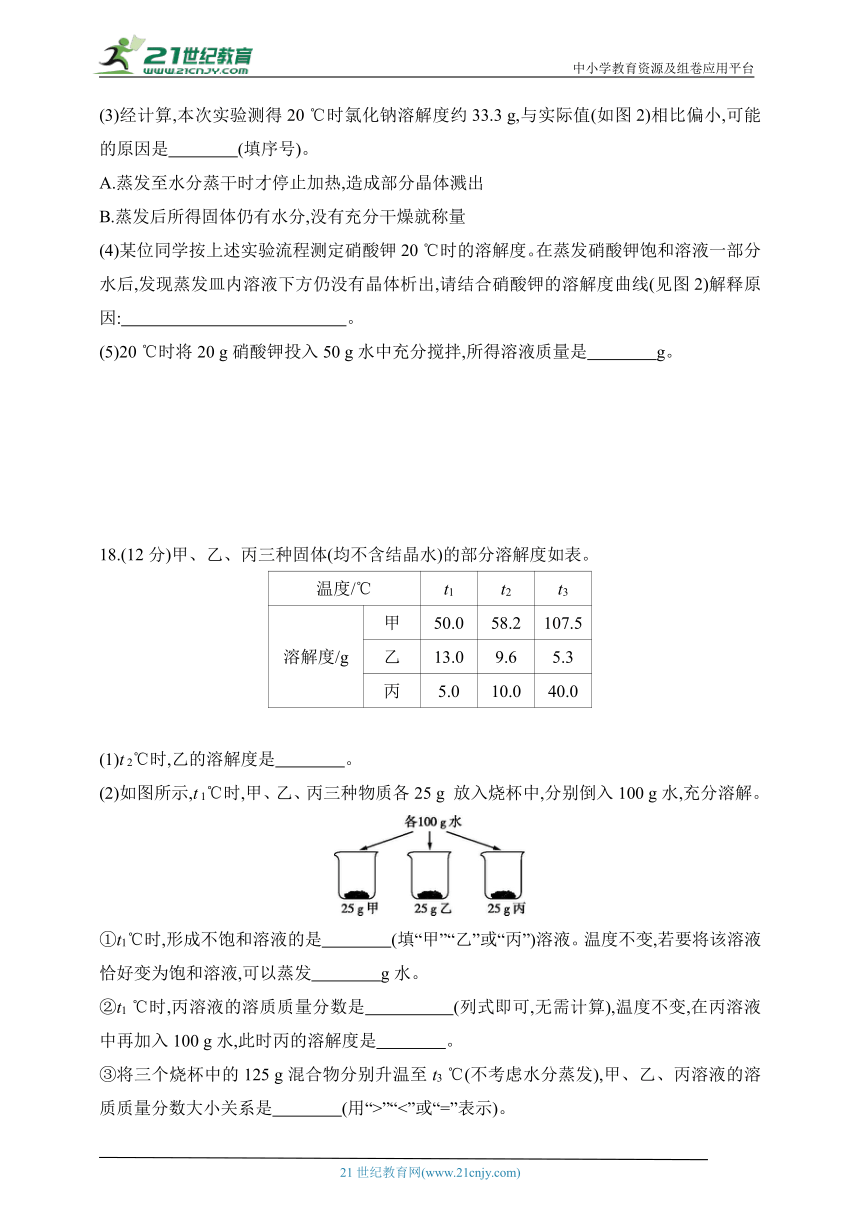
18.(12分)甲、乙、丙三种固体(均不含结晶水)的部分溶解度如表。
温度/℃ t1 t2 t3
溶解度/g 甲 50.0 58.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t 2℃时,乙的溶解度是 。
(2)如图所示,t 1℃时,甲、乙、丙三种物质各25 g 放入烧杯中,分别倒入100 g水,充分溶解。
①t1℃时,形成不饱和溶液的是 (填“甲”“乙”或“丙”)溶液。温度不变,若要将该溶液恰好变为饱和溶液,可以蒸发 g水。
②t1 ℃时,丙溶液的溶质质量分数是 (列式即可,无需计算),温度不变,在丙溶液中再加入100 g水,此时丙的溶解度是 。
③将三个烧杯中的125 g混合物分别升温至t3 ℃(不考虑水分蒸发),甲、乙、丙溶液的溶质质量分数大小关系是 (用“>”“<”或“=”表示)。
19.(12分)如图1是甲、乙两种物质的溶解度曲线,请回答问题:
图1
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而减小的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。 (答一条)
(4)t2 ℃时,分别将甲、乙两种物质的饱和溶液降温到t1 ℃,甲溶液的溶质质量分数 (填“>”“=”或“<”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行如图2实验:
图2
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因可能是 。
三、实验与探究题(每空2分,共20分)
20.(10分)现要配制60 g溶质质量分数为5%的氯化钠溶液,试完成下列填空。
【实验过程】
(1)计算:需要氯化钠的质量为3 g,需要水的体积为 mL。(水的密度为1 g/mL)
(2)称取氯化钠:在已调节平衡的天平两端的托盘上分别放上质量相等的称量纸,移动游码至刻度如 (填“甲”或“乙”)图所示。
(3)量取水:向量筒内加水,当水接近所需刻度时改用 继续加水至所需刻度。
(4)溶解:溶解时,用玻璃棒搅拌的目的是 。
(5)转移:将配得溶液移入指定容器,贴上标签。
【实验反思】
(6)上述实验中会导致所配溶液的溶质质量分数偏小的是 。(填序号)
A.氯化钠不纯
B.用量筒量水时俯视读数
C.配制溶液的烧杯事先用少量蒸馏水润洗
D.转移已配好的溶液时,有少量液体溅出
21.(10分)为了探究影响固体溶解性的因素,某同学设计了如下三组实验:
实验组别 第一组 第二组 第三组
实验温度/℃ 20 20 20 20 80 20
溶剂 水 酒精 水 水 水 水
溶剂质量/g 20 20 10 10 10 10
固体种类 A A A B A B
加入固体质量/g 10 10 10 10 10 10
溶解固体质量/g 6.2 0 m 3.6 10 3.6
(1)第一组的实验目的是 ;该组中所得到的溶液是 (填“饱和”或“不饱和”)溶液。
(2)第二组中m的数值为 。
(3)能得出结论“20 ℃时固体A的溶解性弱于固体B的溶解性”的是 (填“第一组”“第二组”或“第三组”)实验。
(4)由上述实验可知,影响固体溶解性的因素是 (填序号)。
A.温度 B.加入溶剂种类 C.加入溶剂质量
D.加入固体种类 E.加入固体质量
四、计算题(共10分)
22.(2分)为防控新型冠状病毒肺炎疫情,某地防疫部门使用二氯异氰尿酸钠(化学式为C3Cl2N3O3Na)杀菌消毒。请计算(直接写出结果即可):
(1)二氯异氰尿酸钠中氯元素和氧元素的质量比为 。
(2)现配制溶质的质量分数为0.1%的二氯异氰尿酸钠溶液5 000 g,需要二氯异氰尿酸钠固体的质量是 g。
23.(8分)实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
(1)某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水 g。
(2)在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是 。
(3)为测定该瓶溶液的溶质质量分数,他们取35 g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
反应时间/min 0 1 2 3 4 5 6
锥形瓶+瓶内物质的总 质量/g 340.00 338.78 335.64 335.28 335.20 335.20 335.20
请计算:
①反应生成氧气的总质量为 g。
②该瓶过氧化氢溶液的溶质质量分数。(写出计算过程,结果保留到0.1%)
第九单元 溶 液
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
A C B D A B C C D A A B B D B
1.A 植物油难溶于水,不能和水形成均一、稳定的混合物,即不能形成溶液。
2.C 溶液是均一、稳定的混合物,A正确;氢氧化钠溶液中的溶质是氢氧化钠固体,白酒中的溶质酒精是液体,稀盐酸中的溶质是氯化氢气体,故溶液中的溶质可以是固体、液体或气体,B正确;海水晒盐过程中析出食盐后的母液是该温度下食盐的饱和溶液,C错误;溶解度和温度、溶质性质及溶剂性质有关,在一定温度下,改变溶剂的量不会影响某固体物质的溶解度,D正确。
3.B 20℃时,氯化钠的溶解度为36 g,则该温度下,100 g水中最多溶解36 g氯化钠达到饱和状态,故136 g溶液中含有36 g氯化钠,B不正确。
4.D 硝酸铵固体溶于水会吸热,当向试管中加入一定量的硝酸铵固体时,试管中液体温度降低,硝酸钾溶液的温度也会降低,硝酸钾的溶解度减小,硝酸钾的饱和溶液中有溶质析出,硝酸钾溶液的密度降低,木块下沉,瓶内压强降低,U形管左侧液面上升。综上分析,D项正确。
5.A 影响固体物质溶解性的因素包括内部因素和外部因素。其中,内部因素是溶质、溶剂本身的性质;外部因素是温度。要比较食盐和蔗糖在水中的溶解性,需要控制在相同的温度。
6.B 夏季,气温较高,氧气在水中的溶解度降低,鱼虾养殖池内设置水泵把水喷向空中,增大水与空气的接触面积,便于氧气溶于水。故选B。
7.C 用汽油洗去衣服上的油污,利用的是汽油可溶解油污,A错误;用水洗去盘子上的水果渣利用的是水将盘子上的水果渣冲走,B错误;用洗洁精洗去餐具上的油污,利用的是乳化原理,C正确;用醋清洗水壶中的水垢,利用的是水垢中的成分能与醋酸反应,D错误。
8.C
9.D 解:设原稀硫酸中溶质的质量分数为x。
x=32%
10.A 量取水时,视线与量筒内凹液面的最低处保持水平,是为了准确读数,A正确;称取氯化钠时,在两边托盘上各放一张相同的称量纸,是为了防止腐蚀托盘,B错误;称取氯化钠时,剩余的氯化钠不能放回原瓶,以防止污染试剂,也不可随意丢弃,更不能带出实验室,应放入指定的容器内,C错误;溶解氯化钠时,用玻璃棒搅拌,可以加快氯化钠的溶解速率,但是不能增大氯化钠的溶解度,D错误。
11.A 蒸发溶剂和增加溶质,一定能使接近饱和的溶液成为饱和溶液;降低温度和加热升温,不一定能使之成为饱和溶液,如氢氧化钙的溶解度随温度降低而增大,硝酸钾的溶解度随温度升高而增大,若降温或升高温度后,溶质的溶解度增大,溶液仍不饱和。
12.B 将KNO3饱和溶液的温度由40 ℃降至10 ℃,其溶解度之差为43 g,即降温后每100 g溶剂中会析出43 g硝酸钾。
13.B 水和酒精混合,两种物质的质量可以相加,总质量为两种物质质量之和;水和酒精的分子之间都有间隔,混合后总体积小于混合前两种液体的体积之和;溶液加水稀释前后,溶质质量不变;熟石灰的溶解度随温度降低而增大,所以降温使熟石灰的饱和溶液变为不饱和溶液,即溶液的质量没有改变。故选B。
14.D Ca(OH)2的溶解度随温度的升高而减小,故将50 ℃的Ca(OH)2饱和溶液降温到10 ℃,会变为不饱和溶液,A错误;30 ℃时KNO3的饱和溶液中溶质的质量分数为,B错误;50 ℃时,分别将0.12 g两种物质溶解在100 g水中就可以配制成溶质质量分数相等的硝酸钾、氢氧化钙溶液,C错误;硝酸钾的溶解度随温度的升高而增大,Ca(OH)2的溶解度随温度的升高而减小,当KNO3溶液中混有少量Ca(OH)2时,可采用降温结晶的方法提纯,D正确。
15.B 50℃时硝酸钾的溶解度大于氯化铵的溶解度,因此50 ℃时两杯相同质量的饱和溶液中,硝酸钾质量大于氯化铵质量,A错误;两种物质的溶解度都是随着温度降低而减小,降温过程中析出固体,两杯溶液一直保持饱和状态,B正确;26 ℃时两种物质溶解度相等,两杯溶液的溶质质量分数相等,C错误;两杯溶液降温到26 ℃后,析出的晶体质量不相等,因为该温度范围内硝酸钾溶解度差大于氯化铵,所以硝酸钾溶液中析出的晶体质量大于氯化铵溶液中析出的晶体质量,D错误。
16.(1)Ca2+、OH- (2)FeSO4 (3)Ca2+、Cl-、H+、H2O
17.(1)过滤 (2)饱和 (3)A
(4)温度升高,KNO3的溶解度增大,溶液由饱和变为不饱和 (5)65.8
【解题思路】(1)经操作a后得到了固体与溶液,故操作a的名称是过滤。(2)因过滤后得到氯化钠固体,故所得“28 g氯化钠溶液”是饱和溶液。(3)若蒸发至水分蒸干时才停止加热,造成部分晶体溅出,则最终得到的氯化钠固体质量偏小,会导致实际测得的溶解度偏小;若蒸发后所得固体仍有水分,没有充分干燥就称量,则最终得到的氯化钠固体质量偏大,会导致实际测得的溶解度偏大。(4)由题图2可知,KNO3的溶解度随温度的升高而增大,故在蒸发硝酸钾饱和溶液一部分水后,发现蒸发皿内溶液下方仍没有晶体析出,是因为温度升高,KNO3的溶解度增大,溶液由饱和变为不饱和。(5)20 ℃时KNO3的溶解度为31.6 g,20 ℃时将20 g硝酸钾投入50 g水中充分搅拌,最多只能溶解15.8 g硝酸钾,故所得溶液质量是50 g+15.8 g=65.8 g。
18.(1)9.6 g (2)①甲 50 ② 5.0 g ③甲=丙>乙
【解题思路】(2)①t1 ℃时,甲、乙、丙三种物质的溶解度分别为 50.0 g、13.0 g、5.0 g,t1 ℃时,甲、乙、丙三种物质各25 g在 100 g 水中充分溶解,形成不饱和溶液的是甲溶液。设在该温度下,恰好溶解25 g甲物质需要水的质量为x,则,x=50 g,100 g-50 g=50 g,故需要蒸发掉50 g水。②t1 ℃时,丙溶液是饱和溶液,溶液中的溶质质量分数是,温度不变,再加入100 g水后丙的溶解度也不变,仍为 5.0 g。③t3 ℃时,甲、乙、丙的溶解度分别为 107.5 g、5.3 g、40.0 g,将三个烧杯中的125 g混合物分别升温至t3 ℃(不考虑水分蒸发),甲、丙完全溶解,乙溶解了 5.3 g,即甲、乙、丙溶液的溶质质量分数大小关系是甲=丙>乙。
19.(1)t1 (2)乙 (3)降低温度(合理均可) (4)> (5)①B ②甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大
【解题思路】(3)甲的溶解度随温度的升高而增大较快,要使甲物质从其饱和溶液中结晶析出有两种方法:一是降低温度;二是恒温蒸发溶剂。(4)t2 ℃时,分别将甲、乙两种物质的饱和溶液降温到t1 ℃,甲物质的溶液中会有晶体析出,形成t1 ℃的饱和溶液,乙会形成t1 ℃时的不饱和溶液,而t1 ℃时甲、乙的溶解度相同,所以甲溶液的溶质质量分数大于乙溶液的溶质质量分数。(5)①t1 ℃ 时甲的溶解度是65 g,所以该温度下50 g水中最多溶解32.5 g甲,因此B为不饱和溶液;C中加入甲共50 g,溶解32.5 g,为饱和溶液;升温至t2 ℃,该温度下甲的溶解度是90 g,则50 g水中最多溶解45 g甲,故D依然是饱和溶液。
20.(1)57 (2)甲 (3)胶头滴管 (4)加速固体溶解 (6)AC
【解题思路】(2)游码的左侧与所需刻度对齐,甲图正确。(6)氯化钠不纯导致溶质质量偏小,配制溶液的烧杯事先用少量蒸馏水润洗导致溶剂质量偏大,都会使溶质质量分数偏小。
21.(1)探究固体A在水和酒精中的溶解情况 饱和 (2)3.1 (3)第二组 (4)ABD
【解题思路】(1)第一组实验的可变量中除溶剂的种类不同(溶剂是水和酒精),其他量都相同,该组的实验目的是探究固体A在水和酒精中的溶解情况;由题表中数据可知,加入水中的固体A有剩余,加入酒精中的固体A没有溶解,该组得到的是A的水溶液,是饱和溶液。(2)由第一组数据可知,20 ℃时20 g 水中最多溶解A 6.2 g,则 20 ℃ 时10 g水中最多溶解A 3.1 g,即第二组中m的数值是3.1。(3)由第二组数据可知,20 ℃时10 g水中最多溶解A 3.1 g,20 ℃时10 g水中最多溶解B 3.6 g,说明20 ℃时固体A的溶解性弱于固体B的溶解性。(4)由第二组和第三组数据可知,温度和加入固体种类影响固体物质的溶解性;由第一组数据可知,加入溶剂种类影响固体物质的溶解性。
22.(1)71∶48(1分) (2)5(1分)
【解题思路】(2)溶液质量为5 000 g,溶质的质量分数为0.1%,需要二氯异氰尿酸钠固体的质量为:5 000 g×0.1%=5 g。
23.(1)1 000(1分) (2)过氧化氢溶液常温下即可分解产生氧气(1分) (3)①4.80(1分)
②解:设该瓶过氧化氢溶液中溶质的质量为y,
2H2O2 2H2O+ O2↑ (2分)
68 32
y 4.80 g
(1分)
y=10.2 g (1分)
该瓶过氧化氢溶液的溶质质量分数为:29.1% (1分)
答:该瓶过氧化氢溶液的溶质质量分数约29.1%。
【解题思路】(1)设需要加水的质量为x,500 g×30%=(500 g+x)×10%,x=1 000 g。
(3)①物质的总质量不再随时间改变表明反应已经完全。根据质量守恒定律,生成氧气的质量为:340.00 g -335.20 g=4.80 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版九年级化学下学期单元测试卷
第九单元 溶 液
时间:45分钟 满分:100分
可能用到的相对原子质量:H—1 O—16 Cl—35.5
一、选择题(每小题2分,共30分,每小题只有一个选项符合题意)
1.将厨房中的下列物质放入足量水中,充分搅拌,不能形成溶液的是 ( )
A.植物油 B.味精 C.白糖 D.食盐
2.下列有关溶液的说法错误的是 ( )
A.溶液是均一、稳定的混合物
B.溶液中的溶质可以是固体、液体或气体
C.海水晒盐过程中析出食盐后的母液是该温度下食盐的不饱和溶液
D.在一定温度下,改变溶剂的量不会影响某固体物质的溶解度
3.20 ℃时,氯化钠的溶解度为36 g。该温度下,关于100 g氯化钠饱和溶液的说法不正确的是 ( )
A.溶质是氯化钠
B.溶液中含有36 g氯化钠
C.加水能使其变为不饱和溶液
D.取出20 g溶液,溶质质量分数与原溶液的相同
4.如图,瓶中盛有硝酸钾的饱和溶液,瓶底有未溶解的硝酸钾固体,木块漂浮在硝酸钾饱和溶液中。当向试管中加入一定量的硝酸铵固体时,能观察到的现象是 ( )
A.木块上浮
B.硝酸钾饱和溶液温度上升
C.U形管的左侧液面下降
D.瓶底的硝酸钾固体增多
5.比较食盐和蔗糖在水中的溶解性,必须控制的条件是 ( )
A.温度均相同
B.均用玻璃棒搅拌
C.水的质量相同
D.食盐和蔗糖颗粒大小均相同
6.夏季,鱼虾养殖池内常设置一些水泵,把水喷向空中,从化学角度分析,喷水的目的是 ( )
A.降低养殖池内水的温度
B.增大水与空气的接触面积,便于氧气溶解
C.增加观赏性
D.便于太阳照射,杀灭水中的病菌
7.下列清洗方法中,利用乳化原理的是 ( )
A.用汽油洗去衣服上的油污
B.用水洗去盘子上的水果渣
C.用洗洁精洗去餐具上的油污
D.用醋清洗水壶中的水垢
8.一杯20 ℃的硝酸钾溶液,能证明它是饱和溶液的方法是 ( )
A.蒸发掉10 g水有晶体析出
B.温度降低到10 ℃,有硝酸钾晶体析出
C.在该温度下加入少量硝酸钾晶体,晶体不减少
D.以上三种方法均可以
9.向50 g稀硫酸中加入16%的硫酸溶液150 g,混合后溶液中溶质质量分数为20%,则原稀硫酸中溶质的质量分数为 ( )
A.2% B.8% C.24% D.32%
10.配制100 g质量分数为5%的氯化钠溶液,小雪的实验操作与目的分析均正确的一组是( )
选项 实验操作 目的分析
A 量取水时,视线与量筒内凹液面的最低处保持水平 准确读数
B 称取氯化钠时,在两边托盘上各放一张相同的称量纸 整洁美观
C 称取氯化钠时,将剩余的氯化钠放回原瓶 节约药品
D 溶解氯化钠时,用玻璃棒搅拌 增大氯化钠的溶解度
11.现有一接近饱和的某固体的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
12.将KNO3饱和溶液的温度由40 ℃降至10 ℃,其溶解度之差为43 g,则43 g表示 ( )
A.温度每降低30 ℃,析出KNO3的质量
B.每100 g溶剂中析出KNO3的质量
C.每100 g溶液中析出KNO3的质量
D.温度降低后该溶液中析出KNO3的质量
13.化学知识中有很多的“相等”。请你判断下列说法中不正确的是 ( )
A.50 g水和50 g酒精混合,所得溶液的质量等于100 g
B.50 mL的水和50 mL的酒精混合,所得溶液的体积等于100 mL
C.溶液稀释前后,溶质的质量相等
D.60 ℃时某熟石灰的饱和溶液的质量,与降温到20 ℃时所得溶液的质量相等
14.下表列出了部分温度下Ca(OH)2和KNO3的溶解度。下列说法正确的是 ( )
温度/℃ 10 30 50 60
溶解 度/g Ca(OH)2 0.18 0.15 0.12 0.11
KNO3 20.9 45.8 85.5 110
A.将50 ℃的Ca(OH)2饱和溶液降温到10 ℃有晶体析出
B.30 ℃时KNO3的饱和溶液中溶质的质量分数为45.8%
C.50 ℃时不可能配制溶质质量分数相等的Ca(OH)2、KNO3溶液
D.当KNO3溶液中混有少量Ca(OH)2时,可采用降温结晶的方法提纯
15.KNO3、NH4Cl可用于配制无土栽培营养液,二者的溶解度曲线如图所示。将两杯相同质量的饱和KNO3溶液和饱和NH4Cl溶液从50 ℃降温到26 ℃。不考虑水分的蒸发,下列有关说法正确的是 ( )
A.50 ℃时两杯溶液中的溶质质量相等
B.降温过程中两杯溶液一直保持饱和状态
C.26 ℃时两杯溶液的溶质质量分数不相等
D.两杯溶液降温到26 ℃后,析出的晶体质量相等
二、填空及简答题(每空2分,共40分)
16.(6分)分析下列变化后溶液中的成分,并回答问题。
(1)向Ca(OH)2溶液中通入CO2后逐渐减少的微粒是 。
(2)硫酸铜溶液与足量铁粉完全反应后的溶质是 。
(3)石灰石与过量盐酸反应后溶液中的微粒有 。
17.(10分)某兴趣小组欲测定氯化钠20℃时的溶解度,设计实验流程如图1所示。
图1
(1)操作a的名称是 。
(2)实验所得“28 g氯化钠溶液”是 (填“饱和”或“不饱和”)溶液。
图2
(3)经计算,本次实验测得20 ℃时氯化钠溶解度约33.3 g,与实际值(如图2)相比偏小,可能的原因是 (填序号)。
A.蒸发至水分蒸干时才停止加热,造成部分晶体溅出
B.蒸发后所得固体仍有水分,没有充分干燥就称量
(4)某位同学按上述实验流程测定硝酸钾20 ℃时的溶解度。在蒸发硝酸钾饱和溶液一部分水后,发现蒸发皿内溶液下方仍没有晶体析出,请结合硝酸钾的溶解度曲线(见图2)解释原因: 。
(5)20 ℃时将20 g硝酸钾投入50 g水中充分搅拌,所得溶液质量是 g。
18.(12分)甲、乙、丙三种固体(均不含结晶水)的部分溶解度如表。
温度/℃ t1 t2 t3
溶解度/g 甲 50.0 58.2 107.5
乙 13.0 9.6 5.3
丙 5.0 10.0 40.0
(1)t 2℃时,乙的溶解度是 。
(2)如图所示,t 1℃时,甲、乙、丙三种物质各25 g 放入烧杯中,分别倒入100 g水,充分溶解。
①t1℃时,形成不饱和溶液的是 (填“甲”“乙”或“丙”)溶液。温度不变,若要将该溶液恰好变为饱和溶液,可以蒸发 g水。
②t1 ℃时,丙溶液的溶质质量分数是 (列式即可,无需计算),温度不变,在丙溶液中再加入100 g水,此时丙的溶解度是 。
③将三个烧杯中的125 g混合物分别升温至t3 ℃(不考虑水分蒸发),甲、乙、丙溶液的溶质质量分数大小关系是 (用“>”“<”或“=”表示)。
19.(12分)如图1是甲、乙两种物质的溶解度曲线,请回答问题:
图1
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而减小的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。 (答一条)
(4)t2 ℃时,分别将甲、乙两种物质的饱和溶液降温到t1 ℃,甲溶液的溶质质量分数 (填“>”“=”或“<”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行如图2实验:
图2
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因可能是 。
三、实验与探究题(每空2分,共20分)
20.(10分)现要配制60 g溶质质量分数为5%的氯化钠溶液,试完成下列填空。
【实验过程】
(1)计算:需要氯化钠的质量为3 g,需要水的体积为 mL。(水的密度为1 g/mL)
(2)称取氯化钠:在已调节平衡的天平两端的托盘上分别放上质量相等的称量纸,移动游码至刻度如 (填“甲”或“乙”)图所示。
(3)量取水:向量筒内加水,当水接近所需刻度时改用 继续加水至所需刻度。
(4)溶解:溶解时,用玻璃棒搅拌的目的是 。
(5)转移:将配得溶液移入指定容器,贴上标签。
【实验反思】
(6)上述实验中会导致所配溶液的溶质质量分数偏小的是 。(填序号)
A.氯化钠不纯
B.用量筒量水时俯视读数
C.配制溶液的烧杯事先用少量蒸馏水润洗
D.转移已配好的溶液时,有少量液体溅出
21.(10分)为了探究影响固体溶解性的因素,某同学设计了如下三组实验:
实验组别 第一组 第二组 第三组
实验温度/℃ 20 20 20 20 80 20
溶剂 水 酒精 水 水 水 水
溶剂质量/g 20 20 10 10 10 10
固体种类 A A A B A B
加入固体质量/g 10 10 10 10 10 10
溶解固体质量/g 6.2 0 m 3.6 10 3.6
(1)第一组的实验目的是 ;该组中所得到的溶液是 (填“饱和”或“不饱和”)溶液。
(2)第二组中m的数值为 。
(3)能得出结论“20 ℃时固体A的溶解性弱于固体B的溶解性”的是 (填“第一组”“第二组”或“第三组”)实验。
(4)由上述实验可知,影响固体溶解性的因素是 (填序号)。
A.温度 B.加入溶剂种类 C.加入溶剂质量
D.加入固体种类 E.加入固体质量
四、计算题(共10分)
22.(2分)为防控新型冠状病毒肺炎疫情,某地防疫部门使用二氯异氰尿酸钠(化学式为C3Cl2N3O3Na)杀菌消毒。请计算(直接写出结果即可):
(1)二氯异氰尿酸钠中氯元素和氧元素的质量比为 。
(2)现配制溶质的质量分数为0.1%的二氯异氰尿酸钠溶液5 000 g,需要二氯异氰尿酸钠固体的质量是 g。
23.(8分)实验室常用溶质质量分数为10%的过氧化氢溶液制取氧气。
(1)某兴趣小组打算用如图所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水 g。
(2)在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%,依据是 。
(3)为测定该瓶溶液的溶质质量分数,他们取35 g该溶液放入锥形瓶中并加入一定量的二氧化锰。不同时间电子秤的读数如下表所示(不考虑H2O逸出):
反应时间/min 0 1 2 3 4 5 6
锥形瓶+瓶内物质的总 质量/g 340.00 338.78 335.64 335.28 335.20 335.20 335.20
请计算:
①反应生成氧气的总质量为 g。
②该瓶过氧化氢溶液的溶质质量分数。(写出计算过程,结果保留到0.1%)
第九单元 溶 液
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
A C B D A B C C D A A B B D B
1.A 植物油难溶于水,不能和水形成均一、稳定的混合物,即不能形成溶液。
2.C 溶液是均一、稳定的混合物,A正确;氢氧化钠溶液中的溶质是氢氧化钠固体,白酒中的溶质酒精是液体,稀盐酸中的溶质是氯化氢气体,故溶液中的溶质可以是固体、液体或气体,B正确;海水晒盐过程中析出食盐后的母液是该温度下食盐的饱和溶液,C错误;溶解度和温度、溶质性质及溶剂性质有关,在一定温度下,改变溶剂的量不会影响某固体物质的溶解度,D正确。
3.B 20℃时,氯化钠的溶解度为36 g,则该温度下,100 g水中最多溶解36 g氯化钠达到饱和状态,故136 g溶液中含有36 g氯化钠,B不正确。
4.D 硝酸铵固体溶于水会吸热,当向试管中加入一定量的硝酸铵固体时,试管中液体温度降低,硝酸钾溶液的温度也会降低,硝酸钾的溶解度减小,硝酸钾的饱和溶液中有溶质析出,硝酸钾溶液的密度降低,木块下沉,瓶内压强降低,U形管左侧液面上升。综上分析,D项正确。
5.A 影响固体物质溶解性的因素包括内部因素和外部因素。其中,内部因素是溶质、溶剂本身的性质;外部因素是温度。要比较食盐和蔗糖在水中的溶解性,需要控制在相同的温度。
6.B 夏季,气温较高,氧气在水中的溶解度降低,鱼虾养殖池内设置水泵把水喷向空中,增大水与空气的接触面积,便于氧气溶于水。故选B。
7.C 用汽油洗去衣服上的油污,利用的是汽油可溶解油污,A错误;用水洗去盘子上的水果渣利用的是水将盘子上的水果渣冲走,B错误;用洗洁精洗去餐具上的油污,利用的是乳化原理,C正确;用醋清洗水壶中的水垢,利用的是水垢中的成分能与醋酸反应,D错误。
8.C
9.D 解:设原稀硫酸中溶质的质量分数为x。
x=32%
10.A 量取水时,视线与量筒内凹液面的最低处保持水平,是为了准确读数,A正确;称取氯化钠时,在两边托盘上各放一张相同的称量纸,是为了防止腐蚀托盘,B错误;称取氯化钠时,剩余的氯化钠不能放回原瓶,以防止污染试剂,也不可随意丢弃,更不能带出实验室,应放入指定的容器内,C错误;溶解氯化钠时,用玻璃棒搅拌,可以加快氯化钠的溶解速率,但是不能增大氯化钠的溶解度,D错误。
11.A 蒸发溶剂和增加溶质,一定能使接近饱和的溶液成为饱和溶液;降低温度和加热升温,不一定能使之成为饱和溶液,如氢氧化钙的溶解度随温度降低而增大,硝酸钾的溶解度随温度升高而增大,若降温或升高温度后,溶质的溶解度增大,溶液仍不饱和。
12.B 将KNO3饱和溶液的温度由40 ℃降至10 ℃,其溶解度之差为43 g,即降温后每100 g溶剂中会析出43 g硝酸钾。
13.B 水和酒精混合,两种物质的质量可以相加,总质量为两种物质质量之和;水和酒精的分子之间都有间隔,混合后总体积小于混合前两种液体的体积之和;溶液加水稀释前后,溶质质量不变;熟石灰的溶解度随温度降低而增大,所以降温使熟石灰的饱和溶液变为不饱和溶液,即溶液的质量没有改变。故选B。
14.D Ca(OH)2的溶解度随温度的升高而减小,故将50 ℃的Ca(OH)2饱和溶液降温到10 ℃,会变为不饱和溶液,A错误;30 ℃时KNO3的饱和溶液中溶质的质量分数为,B错误;50 ℃时,分别将0.12 g两种物质溶解在100 g水中就可以配制成溶质质量分数相等的硝酸钾、氢氧化钙溶液,C错误;硝酸钾的溶解度随温度的升高而增大,Ca(OH)2的溶解度随温度的升高而减小,当KNO3溶液中混有少量Ca(OH)2时,可采用降温结晶的方法提纯,D正确。
15.B 50℃时硝酸钾的溶解度大于氯化铵的溶解度,因此50 ℃时两杯相同质量的饱和溶液中,硝酸钾质量大于氯化铵质量,A错误;两种物质的溶解度都是随着温度降低而减小,降温过程中析出固体,两杯溶液一直保持饱和状态,B正确;26 ℃时两种物质溶解度相等,两杯溶液的溶质质量分数相等,C错误;两杯溶液降温到26 ℃后,析出的晶体质量不相等,因为该温度范围内硝酸钾溶解度差大于氯化铵,所以硝酸钾溶液中析出的晶体质量大于氯化铵溶液中析出的晶体质量,D错误。
16.(1)Ca2+、OH- (2)FeSO4 (3)Ca2+、Cl-、H+、H2O
17.(1)过滤 (2)饱和 (3)A
(4)温度升高,KNO3的溶解度增大,溶液由饱和变为不饱和 (5)65.8
【解题思路】(1)经操作a后得到了固体与溶液,故操作a的名称是过滤。(2)因过滤后得到氯化钠固体,故所得“28 g氯化钠溶液”是饱和溶液。(3)若蒸发至水分蒸干时才停止加热,造成部分晶体溅出,则最终得到的氯化钠固体质量偏小,会导致实际测得的溶解度偏小;若蒸发后所得固体仍有水分,没有充分干燥就称量,则最终得到的氯化钠固体质量偏大,会导致实际测得的溶解度偏大。(4)由题图2可知,KNO3的溶解度随温度的升高而增大,故在蒸发硝酸钾饱和溶液一部分水后,发现蒸发皿内溶液下方仍没有晶体析出,是因为温度升高,KNO3的溶解度增大,溶液由饱和变为不饱和。(5)20 ℃时KNO3的溶解度为31.6 g,20 ℃时将20 g硝酸钾投入50 g水中充分搅拌,最多只能溶解15.8 g硝酸钾,故所得溶液质量是50 g+15.8 g=65.8 g。
18.(1)9.6 g (2)①甲 50 ② 5.0 g ③甲=丙>乙
【解题思路】(2)①t1 ℃时,甲、乙、丙三种物质的溶解度分别为 50.0 g、13.0 g、5.0 g,t1 ℃时,甲、乙、丙三种物质各25 g在 100 g 水中充分溶解,形成不饱和溶液的是甲溶液。设在该温度下,恰好溶解25 g甲物质需要水的质量为x,则,x=50 g,100 g-50 g=50 g,故需要蒸发掉50 g水。②t1 ℃时,丙溶液是饱和溶液,溶液中的溶质质量分数是,温度不变,再加入100 g水后丙的溶解度也不变,仍为 5.0 g。③t3 ℃时,甲、乙、丙的溶解度分别为 107.5 g、5.3 g、40.0 g,将三个烧杯中的125 g混合物分别升温至t3 ℃(不考虑水分蒸发),甲、丙完全溶解,乙溶解了 5.3 g,即甲、乙、丙溶液的溶质质量分数大小关系是甲=丙>乙。
19.(1)t1 (2)乙 (3)降低温度(合理均可) (4)> (5)①B ②甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大
【解题思路】(3)甲的溶解度随温度的升高而增大较快,要使甲物质从其饱和溶液中结晶析出有两种方法:一是降低温度;二是恒温蒸发溶剂。(4)t2 ℃时,分别将甲、乙两种物质的饱和溶液降温到t1 ℃,甲物质的溶液中会有晶体析出,形成t1 ℃的饱和溶液,乙会形成t1 ℃时的不饱和溶液,而t1 ℃时甲、乙的溶解度相同,所以甲溶液的溶质质量分数大于乙溶液的溶质质量分数。(5)①t1 ℃ 时甲的溶解度是65 g,所以该温度下50 g水中最多溶解32.5 g甲,因此B为不饱和溶液;C中加入甲共50 g,溶解32.5 g,为饱和溶液;升温至t2 ℃,该温度下甲的溶解度是90 g,则50 g水中最多溶解45 g甲,故D依然是饱和溶液。
20.(1)57 (2)甲 (3)胶头滴管 (4)加速固体溶解 (6)AC
【解题思路】(2)游码的左侧与所需刻度对齐,甲图正确。(6)氯化钠不纯导致溶质质量偏小,配制溶液的烧杯事先用少量蒸馏水润洗导致溶剂质量偏大,都会使溶质质量分数偏小。
21.(1)探究固体A在水和酒精中的溶解情况 饱和 (2)3.1 (3)第二组 (4)ABD
【解题思路】(1)第一组实验的可变量中除溶剂的种类不同(溶剂是水和酒精),其他量都相同,该组的实验目的是探究固体A在水和酒精中的溶解情况;由题表中数据可知,加入水中的固体A有剩余,加入酒精中的固体A没有溶解,该组得到的是A的水溶液,是饱和溶液。(2)由第一组数据可知,20 ℃时20 g 水中最多溶解A 6.2 g,则 20 ℃ 时10 g水中最多溶解A 3.1 g,即第二组中m的数值是3.1。(3)由第二组数据可知,20 ℃时10 g水中最多溶解A 3.1 g,20 ℃时10 g水中最多溶解B 3.6 g,说明20 ℃时固体A的溶解性弱于固体B的溶解性。(4)由第二组和第三组数据可知,温度和加入固体种类影响固体物质的溶解性;由第一组数据可知,加入溶剂种类影响固体物质的溶解性。
22.(1)71∶48(1分) (2)5(1分)
【解题思路】(2)溶液质量为5 000 g,溶质的质量分数为0.1%,需要二氯异氰尿酸钠固体的质量为:5 000 g×0.1%=5 g。
23.(1)1 000(1分) (2)过氧化氢溶液常温下即可分解产生氧气(1分) (3)①4.80(1分)
②解:设该瓶过氧化氢溶液中溶质的质量为y,
2H2O2 2H2O+ O2↑ (2分)
68 32
y 4.80 g
(1分)
y=10.2 g (1分)
该瓶过氧化氢溶液的溶质质量分数为:29.1% (1分)
答:该瓶过氧化氢溶液的溶质质量分数约29.1%。
【解题思路】(1)设需要加水的质量为x,500 g×30%=(500 g+x)×10%,x=1 000 g。
(3)①物质的总质量不再随时间改变表明反应已经完全。根据质量守恒定律,生成氧气的质量为:340.00 g -335.20 g=4.80 g。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
