2.1.2影响化学反应速率的因素 课件(共20张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1.2影响化学反应速率的因素 课件(共20张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 435.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 00:00:00 | ||
图片预览





文档简介
(共20张PPT)
第一节 化学反应速率
第2课时 影响化学反应速率的因素
人教版选择性必修1
学习目标
1.通过实验探究学习运用控制变量的方法研究化学反应速率
2.了解反应条件对化学反应速率影响的一般规律。
3.能运用规律解释生产、生活和科学实验中的实际问题
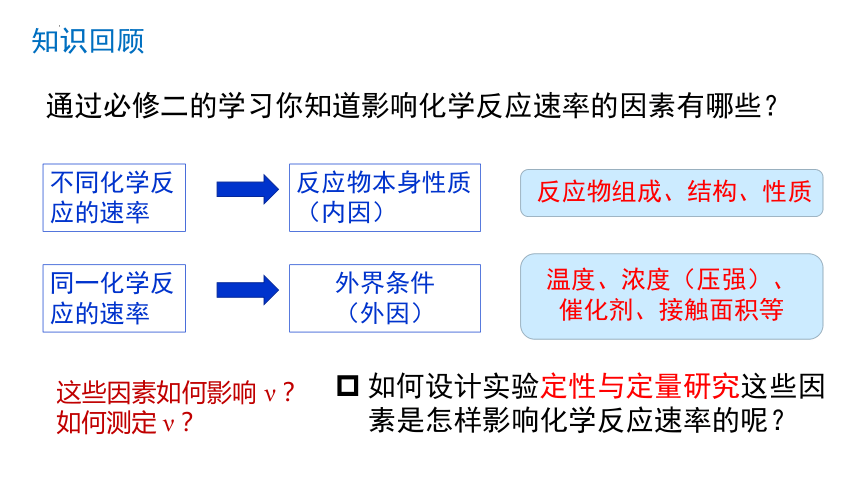
通过必修二的学习你知道影响化学反应速率的因素有哪些?
不同化学反应的速率
反应物本身性质(内因)
同一化学反应的速率
外界条件
(外因)
温度、浓度(压强)、催化剂、接触面积等
反应物组成、结构、性质
如何设计实验定性与定量研究这些因素是怎样影响化学反应速率的呢?
知识回顾
这些因素如何影响 ν ?
如何测定 ν ?
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。
定性研究:
定量研究:
选择合适实验装置准确测量时间、气体体积、压强、pH等的变化。
选择实验现象明显的化学反应。通过观察冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
控制变量法
一、 定性研究影响化学反应速率的因素
【提出问题】
浓度、温度、催化剂等因素如何影响化学反应速率?如何测定化学反应速率?
【实验探究】
选择实验用品,设计实验探究影响化学反应速率的因素。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
控制变量法
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
【实验原理】
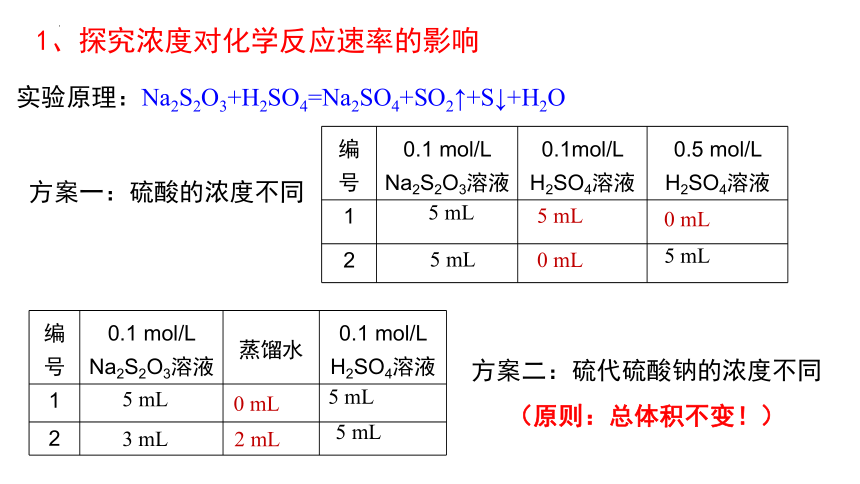
1、探究浓度对化学反应速率的影响
方案一:硫酸的浓度不同
实验原理:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
编号 0.1 mol/L Na2S2O3溶液 0.1mol/L H2SO4溶液 0.5 mol/L H2SO4溶液
1
2
5 mL
5 mL
5 mL
5 mL
0 mL
0 mL
方案二:硫代硫酸钠的浓度不同
(原则:总体积不变!)
编号 0.1 mol/L Na2S2O3溶液 蒸馏水 0.1 mol/L H2SO4溶液
1
2
5 mL
3 mL
5 mL
5 mL
0 mL
2 mL
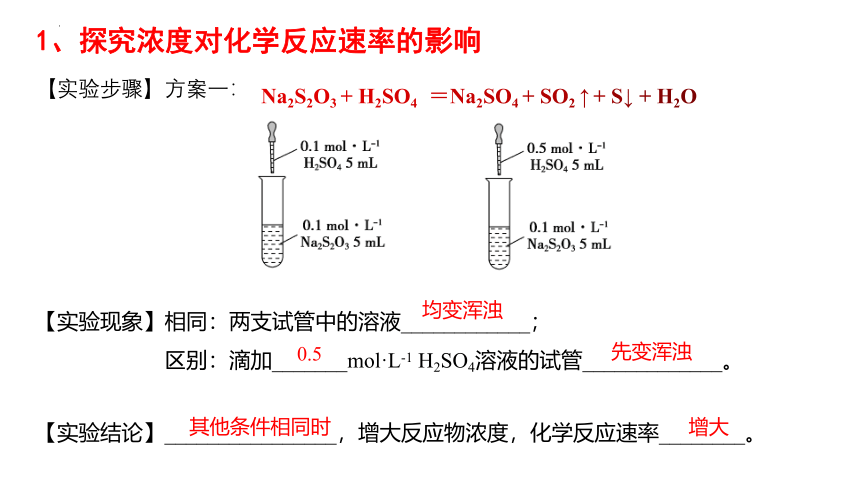
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:滴加_______mol·L-1 H2SO4溶液的试管_____________。
【实验结论】________________,增大反应物浓度,化学反应速率________。
均变浑浊
0.5
先变浑浊
其他条件相同时
增大
1、探究浓度对化学反应速率的影响
Na2S2O3 + H2SO4 =Na2SO4 + SO2 ↑ + S↓ + H2O
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:烧杯中装_______的试管_____________。
【实验结论】________________,升高温度,化学反应速率________。
均变浑浊
热水
先变浑浊
其他条件相同时
增大
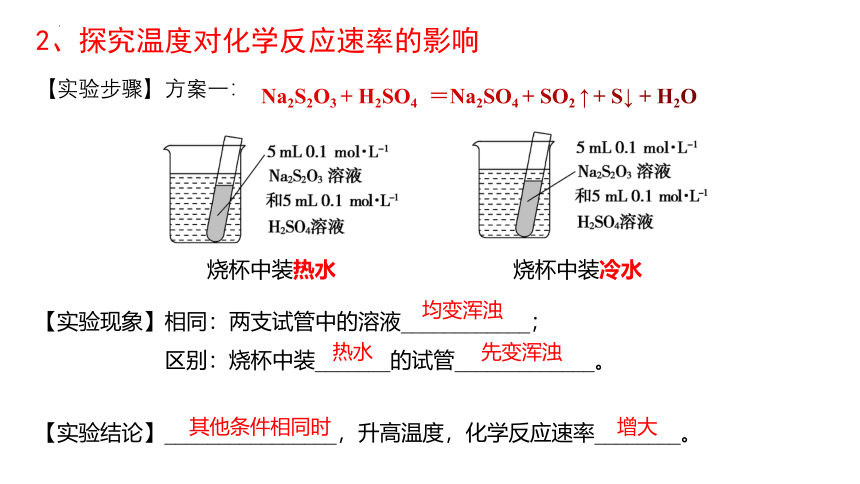
2、探究温度对化学反应速率的影响
Na2S2O3 + H2SO4 =Na2SO4 + SO2 ↑ + S↓ + H2O
烧杯中装热水 烧杯中装冷水
★注意事项:
(1)无论吸热反应、还是放热反应,升高温度,速率都加快。
(2)反应若是可逆反应,升高温度,正、逆反应速率都加快。
2、探究温度对化学反应速率的影响
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:烧杯中滴加_______的试管_____________。
【实验结论】________________,催化剂可以_________化学反应速率
均有气泡产生
FeCl3
产生气泡速率更快
其他条件相同时
改变
3、探究催化剂对化学反应速率的影响
2H2O2 = 2H2O + O2↑
4、拓展:压强对化学反应速率的影响
注意事项:
(1)压强对反应速率的影响,仅针对有气体参与的反应。
(2)压强对反应速率的影响,本质是引起浓度的变化:
①恒温时,压缩体积 → 压强增大 → 气体浓度增大 → 反应速率增大;
②恒温恒容时,充入气体反应物 → 压强增大 → 气体反应物浓度增大 → 反应速率增大;
充入惰性气体 → 总压强增大 → 气体浓度不变 → 反应速率不变。
③恒温恒压时,充入惰性气体 → 压强不变 → 体积增大 → 气体浓度减小 → 反应速率减小。
内因 (决定) 反应物的性质 反应物的化学性质越活泼,化学反应速率越快
外因 温度 温度越高,化学反应速率越快
浓度 增大反应物的浓度,可以加快化学反应速率
催化剂 催化剂可以改变化学反应速率
压强 有气体参加的反应,增大压强(减小容器容积),反应速率加快
其他 ①增大固体反应物的表面积(即粉碎成小颗粒),反应速率加快
②形成原电池,通常能加快反应速率
③超声波、电磁波、光照等也能影响反应速率
归纳总结——影响化学反应速率的因素
2.定量研究影响化学反应速率的因素
【实验操作】(1)按下图所示安装装置,在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
加入试剂 反应时间 反应速率
40 mL 1 mol·L-1硫酸 ________ ________
40 mL 4 mol·L-1硫酸 ________ ________
长
短
慢
快
【实验结论】4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌
反应的速率_______。
快
实验拓展探究(大本练习第19页)
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?_____________________
____________________________________________________________
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________ 。
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
忽视加入稀硫酸排出气体的体积
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?__________________________________________________
____________________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
课堂小结
影响化学反应速率的因素
定性研究影响化学反应速率的因素
定量研究影响化学反应速率的因素
浓度、
温度、
催化剂
控制变量法
b.固定时间,测体积?
a.固定体积,测时间?
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
深度思考
溶液中的Cl- 起催化作用
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果___________________。
深度思考
MnO2>Fe3+>Cu2+
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
5
10
(2)设计实验方案①和②的目的是:______________________________
__________。
探究Na2S2O3的浓度对化学反应速
率的影响
(3)设计实验方案②和④的目的是:______________________________。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究温度对化学反应速率的影响
(4)各实验方案中均需加入一定体积的水的原因:__________________
______________。
各实验方案中混合液
的体积均相等
第一节 化学反应速率
第2课时 影响化学反应速率的因素
人教版选择性必修1
学习目标
1.通过实验探究学习运用控制变量的方法研究化学反应速率
2.了解反应条件对化学反应速率影响的一般规律。
3.能运用规律解释生产、生活和科学实验中的实际问题
通过必修二的学习你知道影响化学反应速率的因素有哪些?
不同化学反应的速率
反应物本身性质(内因)
同一化学反应的速率
外界条件
(外因)
温度、浓度(压强)、催化剂、接触面积等
反应物组成、结构、性质
如何设计实验定性与定量研究这些因素是怎样影响化学反应速率的呢?
知识回顾
这些因素如何影响 ν ?
如何测定 ν ?
科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。这种变量控制的方法是科学探究中常用的方法。
定性研究:
定量研究:
选择合适实验装置准确测量时间、气体体积、压强、pH等的变化。
选择实验现象明显的化学反应。通过观察冒气泡快慢;颜色变化;固体量减少;浑浊程度;温度变化等。
控制变量法
一、 定性研究影响化学反应速率的因素
【提出问题】
浓度、温度、催化剂等因素如何影响化学反应速率?如何测定化学反应速率?
【实验探究】
选择实验用品,设计实验探究影响化学反应速率的因素。
【实验用品】
烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表。
0.1 mol/L Na2S2O3溶液、 0.1 mol/L H2SO4溶液、 0.5 mol/L H2SO4溶液、5% H2O2溶液、1 mol/L FeCl3溶液、蒸馏水、热水。
控制变量法
Na2S2O3+H2SO4 = Na2SO4+SO2 +S +H2O
【实验原理】
1、探究浓度对化学反应速率的影响
方案一:硫酸的浓度不同
实验原理:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
编号 0.1 mol/L Na2S2O3溶液 0.1mol/L H2SO4溶液 0.5 mol/L H2SO4溶液
1
2
5 mL
5 mL
5 mL
5 mL
0 mL
0 mL
方案二:硫代硫酸钠的浓度不同
(原则:总体积不变!)
编号 0.1 mol/L Na2S2O3溶液 蒸馏水 0.1 mol/L H2SO4溶液
1
2
5 mL
3 mL
5 mL
5 mL
0 mL
2 mL
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:滴加_______mol·L-1 H2SO4溶液的试管_____________。
【实验结论】________________,增大反应物浓度,化学反应速率________。
均变浑浊
0.5
先变浑浊
其他条件相同时
增大
1、探究浓度对化学反应速率的影响
Na2S2O3 + H2SO4 =Na2SO4 + SO2 ↑ + S↓ + H2O
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:烧杯中装_______的试管_____________。
【实验结论】________________,升高温度,化学反应速率________。
均变浑浊
热水
先变浑浊
其他条件相同时
增大
2、探究温度对化学反应速率的影响
Na2S2O3 + H2SO4 =Na2SO4 + SO2 ↑ + S↓ + H2O
烧杯中装热水 烧杯中装冷水
★注意事项:
(1)无论吸热反应、还是放热反应,升高温度,速率都加快。
(2)反应若是可逆反应,升高温度,正、逆反应速率都加快。
2、探究温度对化学反应速率的影响
【实验步骤】方案一:
【实验现象】相同:两支试管中的溶液____________;
区别:烧杯中滴加_______的试管_____________。
【实验结论】________________,催化剂可以_________化学反应速率
均有气泡产生
FeCl3
产生气泡速率更快
其他条件相同时
改变
3、探究催化剂对化学反应速率的影响
2H2O2 = 2H2O + O2↑
4、拓展:压强对化学反应速率的影响
注意事项:
(1)压强对反应速率的影响,仅针对有气体参与的反应。
(2)压强对反应速率的影响,本质是引起浓度的变化:
①恒温时,压缩体积 → 压强增大 → 气体浓度增大 → 反应速率增大;
②恒温恒容时,充入气体反应物 → 压强增大 → 气体反应物浓度增大 → 反应速率增大;
充入惰性气体 → 总压强增大 → 气体浓度不变 → 反应速率不变。
③恒温恒压时,充入惰性气体 → 压强不变 → 体积增大 → 气体浓度减小 → 反应速率减小。
内因 (决定) 反应物的性质 反应物的化学性质越活泼,化学反应速率越快
外因 温度 温度越高,化学反应速率越快
浓度 增大反应物的浓度,可以加快化学反应速率
催化剂 催化剂可以改变化学反应速率
压强 有气体参加的反应,增大压强(减小容器容积),反应速率加快
其他 ①增大固体反应物的表面积(即粉碎成小颗粒),反应速率加快
②形成原电池,通常能加快反应速率
③超声波、电磁波、光照等也能影响反应速率
归纳总结——影响化学反应速率的因素
2.定量研究影响化学反应速率的因素
【实验操作】(1)按下图所示安装装置,在锥形瓶内放入2g锌粒,通过分液漏斗加入40 mL 1 mol/L的稀硫酸,测量收集10 mL H2所用的时间。
(2)用4 mol/L的稀硫酸代替1 mol/L的稀硫酸重复上述实验。
加入试剂 反应时间 反应速率
40 mL 1 mol·L-1硫酸 ________ ________
40 mL 4 mol·L-1硫酸 ________ ________
长
短
慢
快
【实验结论】4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌
反应的速率_______。
快
实验拓展探究(大本练习第19页)
在用上述实验测定锌与硫酸反应的速率时:
(1)为确保测定的准确性,应注意哪些事项?_____________________
____________________________________________________________
(2)用上述装置测定化学反应速率时,操作、药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是______________________ 。
锌的颗粒(即比表面积)大小基本相同;稀硫酸要迅速加入;装置气密性良好,且计时要迅速准确
忽视加入稀硫酸排出气体的体积
(3)除了测定氢气的体积外,你还能设计哪些方案测定锌与稀硫酸反应的速率?__________________________________________________
____________________________________________________________
在恒容反应装置中,测定一段时间内压强的变化;测定一段时间内H+的浓度变化;测定一段时间内锌粒的质量变化等。
课堂小结
影响化学反应速率的因素
定性研究影响化学反应速率的因素
定量研究影响化学反应速率的因素
浓度、
温度、
催化剂
控制变量法
b.固定时间,测体积?
a.固定体积,测时间?
1.(1)亚氯酸盐(如NaClO2)可用作漂白剂,在常温,不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O,分解时刚加入硫酸反应缓慢,随后突然反应释放出大量ClO2,这是因为________________________。
深度思考
溶液中的Cl- 起催化作用
(2)H2O2分解制O2的实验中,在10% H2O2溶液中未加催化剂,试管口带火星的木条没有明显变化。加入MnO2粉末,溶液中迅速产生大量气泡,木条立刻复燃;若加入1 mL 0.1 mol·L-1 FeCl3溶液,溶液中产生气泡比较快,木条复燃;若加入1 mL 0.1 mol·L-1 CuCl2溶液,溶液中产生气泡比较慢,一段时间后木条复燃。由此可知催化剂的催化效果___________________。
深度思考
MnO2>Fe3+>Cu2+
2.控制变量法是化学实验的常用方法之一。某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
回答下列问题:
(1)V1=____,V2=____。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
5
10
(2)设计实验方案①和②的目的是:______________________________
__________。
探究Na2S2O3的浓度对化学反应速
率的影响
(3)设计实验方案②和④的目的是:______________________________。
深度思考
实验 方案 反应温 度/℃ Na2S2O3溶液 稀H2SO4 H2O
V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
① 25 5 0.1 10 0.1 5
② 25 V1 0.2 5 0.2 10
③ 35 5 0.1 10 0.1 5
④ 35 5 0.2 5 0.2 V2
探究温度对化学反应速率的影响
(4)各实验方案中均需加入一定体积的水的原因:__________________
______________。
各实验方案中混合液
的体积均相等
