苏教版(2019) 高中化学必修第二册 6.1.1化学反应速率同步练习(含解析)
文档属性
| 名称 | 苏教版(2019) 高中化学必修第二册 6.1.1化学反应速率同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 757.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
6.1.1化学反应速率同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在一定温度下,将和C(各0.16mol)充入10L恒容密闭容器中,发生反应,一段时间后反应达到了平衡,反应过程中测得的数据如下表,下列说法正确的有几项
t/s 2 4 7 9
n(C)/mol 0.12 0.10 0.09 0.09
①反应前2s的平均反应速率
②反应进行至4s末时,的转化率为37.5%
③其他反应条件不变,加入一定量的C(s),反应速率一定加快
④反应达到平衡时,的物质的量浓度为
A.1 B.2 C.3 D.4
2.工业上,常用O2氧化HCl转化成Cl2,提高效益,减少污染。反应为:4HCl(g)+O2(g)2Cl2(g) +2H2O(g)。一定条件下,测得数据如下:
t/ min 0 2.0 4.0 6.0 8.0 10.0 12. 0
c(Cl2)/10-3mol L-1 0 1.8 3.8 5.7 7.2 7.7 7.7
下列说法错误的是
A.条件不变时,14 min时v正(Cl2)=v逆(H2O)
B.2.0~4.0 min内的平均反应速率大于6.0~8.0 min内的
C.0~6.0 min内HCl的平均反应速率为1.9 mol·L-1·min-1
D.加入高效催化剂,达到平衡所用时间小于10.0 min
3.某温度下,密闭容器中A与B反应生成C和D,其反应速率分别用v(A)、v(B)、v(C)、v(D)表示,已知v(A)、v(B)、v(C)、v(D)之间有以下关系5v(A)=4v(B),v(A)=v(C),6v(B)=5v(D),则此反应可表示为( )
A.5A+6B=C+5D B.4A+5B=4C+6D
C.4A+4B=5C+6D D.4A+6B=4C+5D
4.反应,经2min B的浓度减少。对此反应速率的正确表示是
A.在第2min末时的反应速率,用反应物B来表示是
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.用A表示的反应速率是
D.在这2min内用B和C表示的反应速率的值都是相同的
5.一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态。下列说法正确的是
A.该反应的化学方程式为: 2X3Y + Z
B.10s时Y的平均速率为0.12 mol·L-1·min-1
C.X的转化率为66.7%
D.增大压强,该反应速率一定加快
6.已知反应X(s)+3Y(g) Z(g)+2W(g)在四种不同情况下的反应速率,其中反应最快的为
A.v(X)=1.0mol/(L·s) B.v(Y)=0.6mol/(L·s)
C.v(Z)=5.0mol/(L·min) D.v(W)=0.5mol/(L·s)
7.对于反应3A(g)+B(g) 4C(g)+2D(g),测得4种条件下的反应速率分别为①v(A)=0.9mol·L-1·s-1、②v(B)=24mol·L-1·min-1③v(C)=1.6mol·L-1·s-1④v(D)=1.8mol·L-1·min-1,则上述4种条件下的反应速率大小关系正确的是
A.②>④>③>① B.②>①>④>③ C.②=③>①>④ D.②=③>④=①
8.对于反应,下列表示的反应速率最快的是
A. B.
C. D.
9.已知反应在不同条件下的化学反应速率如下,其中反应速率最快的是
A. B.
C. D.
10.已知某反应的各物质浓度数据如下
A B C
起始浓度 1.0 3.0 0
2s末浓度 0.6 1.8 0.8
据此可推算出上述化学方程式中A、B、C三种物质的化学计量数之比是
A.1:3:2 B.3:1:2 C.2:1:3 D.9:3:4
二、填空题
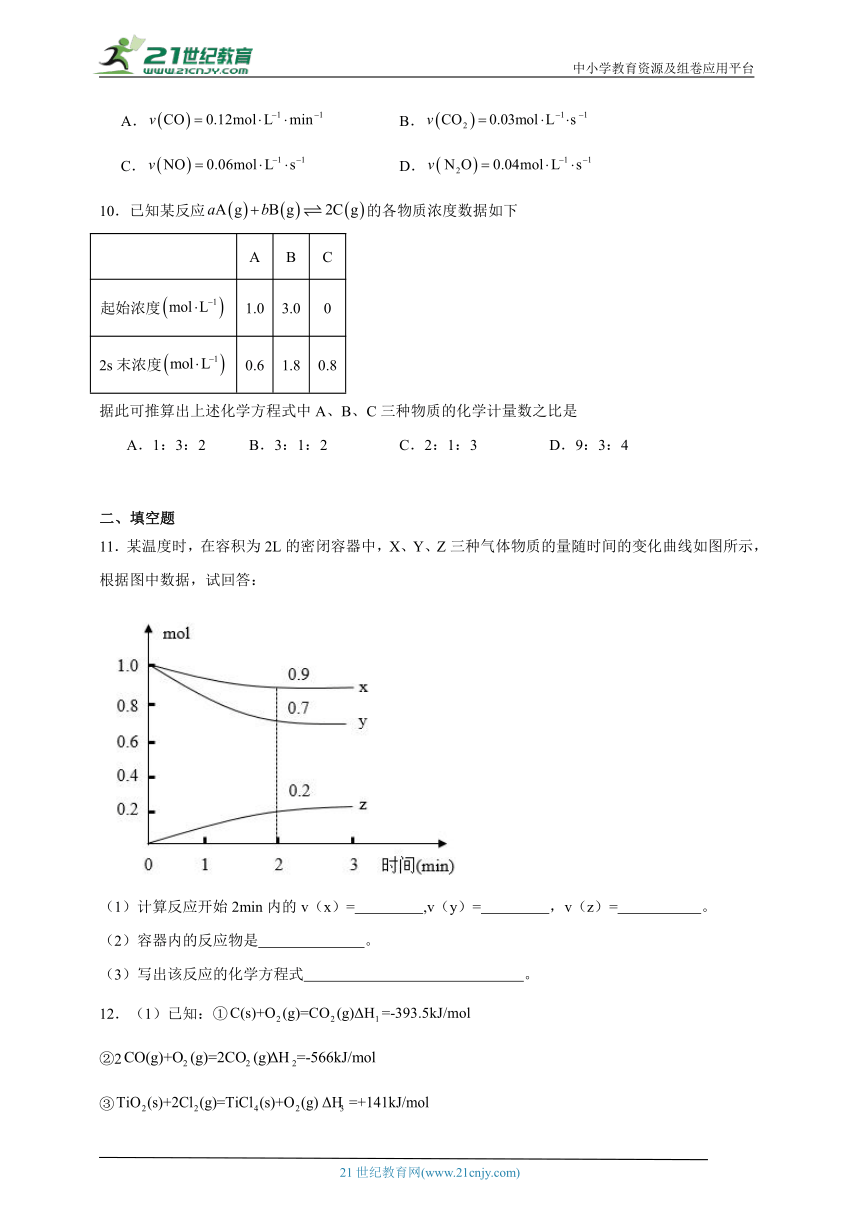
11.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的v(x)= ,v(y)= ,v(z)= 。
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
12.(1)已知:①
②2
③
则的△H= 。
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: 2,已知该反应在2404℃,平衡常数. 请回答:
①某温度下,向2L的密闭容器中充入和各1mol,5分钟后的物质的量为0.5,则的反应速率为
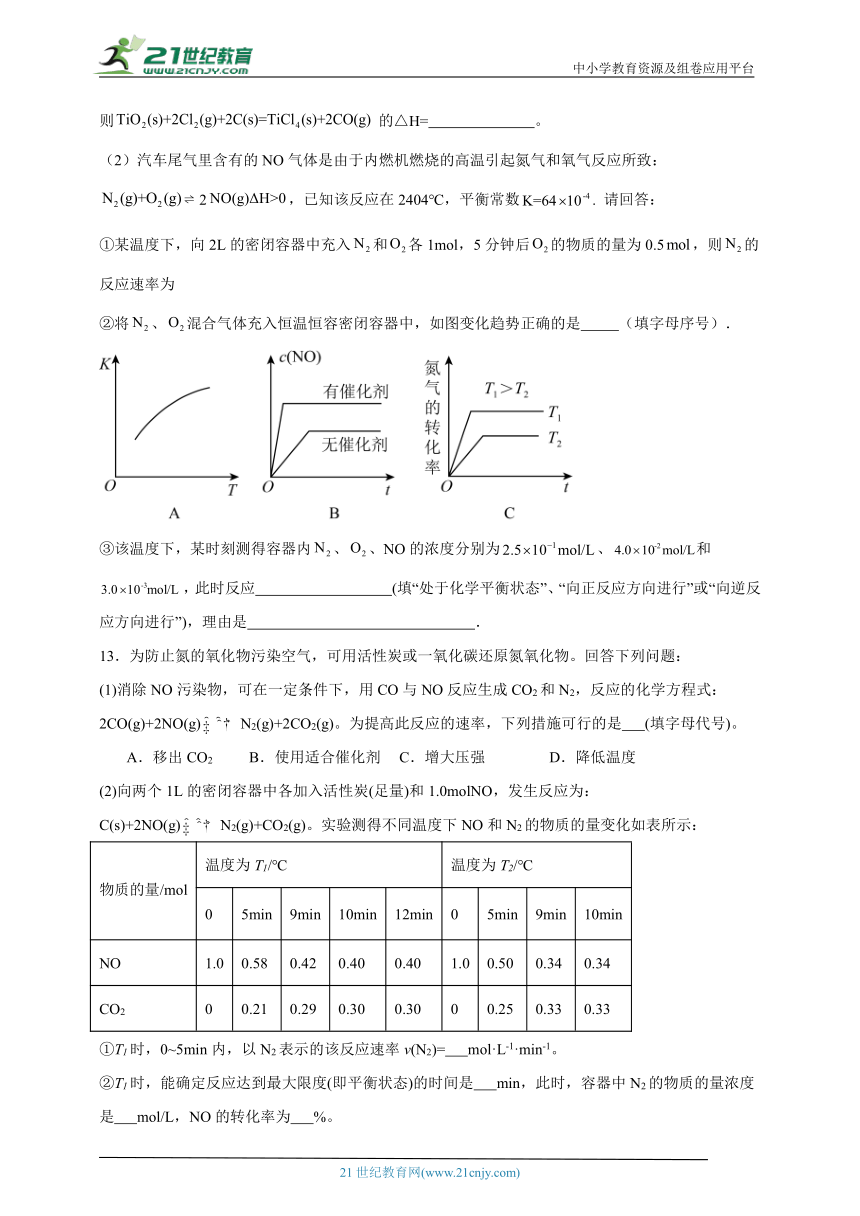
②将、混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是 (填字母序号).
③该温度下,某时刻测得容器内、、NO的浓度分别为、和,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
13.为防止氮的氧化物污染空气,可用活性炭或一氧化碳还原氮氧化物。回答下列问题:
(1)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,反应的化学方程式:2CO(g)+2NO(g)N2(g)+2CO2(g)。为提高此反应的速率,下列措施可行的是 (填字母代号)。
A.移出CO2 B.使用适合催化剂 C.增大压强 D.降低温度
(2)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g)N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:
物质的量/mol 温度为T1/℃ 温度为T2/℃
0 5min 9min 10min 12min 0 5min 9min 10min
NO 1.0 0.58 0.42 0.40 0.40 1.0 0.50 0.34 0.34
CO2 0 0.21 0.29 0.30 0.30 0 0.25 0.33 0.33
①T1时,0~5min内,以N2表示的该反应速率v(N2)= mol·L-1·min-1。
②T1时,能确定反应达到最大限度(即平衡状态)的时间是 min,此时,容器中N2的物质的量浓度是 mol/L,NO的转化率为 %。
③容器中的温度关系为T1 T2(填“>”“<”或“=”)。
14.(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min 5 10 15 20 25 30
c(NH3)/(mol·L-1) 0.08 0.14 0.18 0.20 0.20 0.20
①前20min的平均速率ν(H2)为 ,该温度下此反应化学平衡平衡常数为 。
②能提高反应中N2的平衡转化率的是 。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ 700 800 830 1 000 1 200
K 1.67 1.11 1.00 0.60 0.38
该反应的化学方程式是 ;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应 达到平衡状态(填是或否)。
15.二氧化碳的排放越来越受到能源和环境领域的关注,其综合利用是目前研究的重要课题之一。一定温度下,在2L密闭容器中充入3molCO2和6molH2,发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测定H2的转化率[α(H2)]随时间的变化如图所示:
0~20min内,用CH3OH的浓度变化表示的平均反应速率:v(CH3OH)= mol L-1 min-1。
16.硝基苯甲酸乙酯在OH — 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
t/s 0 120 180 240 330 530 600 700 800
α% 0 33 42 49 59 73 74 75 75
(1)列式计算该反应在120~180s与330~530s区间的平均反应速率 , ;比较两者大小可得出的结论是 。
(2)列式计算该温度下反应的平衡常数 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,可以采取的措施有 (要求写出两条)。
(4)硝基苯甲酸乙酯有 种,其中苯环上的一氯代物最少的结构简式为 。
17.I.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图1所示。根据图中数据,填写下列空白。
(1)该反应的化学方程式为 。
(2)反应开始至2min,气体Z的平均反应速率v(Z)= 。
II.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5min后测得c(D)=1mol·L-1,c(A)∶c(B)=3:5,C的反应速率是0.3mol·L-1·min-1。
(3)A在5min末的浓度是 。
(4)ν(B)= 。
(5)x= 。
(6)5min末A的转化率为 。
18.(1)1molH2(g)和1molCl2(g)在一定条件下反应生成2molHCl(g),放出184.5kJ的热量,已知断裂1molH2(g)中的H-H和1molCl2(g)中的Cl-Cl分别需要吸收436.4kJ和242.7kJ的能量,则1molHCl分子中的化学键形成时释放 kJ的能量。
(2)标准状况下,2.24L甲烷完全燃烧生成液态水和二氧化碳气体时可以放出89.1kJ的热量。请写出甲烷完全燃烧的热化学方程式 。
(3)把1molX气体和0.5molY气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),2min未生成0.2molW,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
①前2min内,用X表示的平均反应速率 。
②2min末时Y的转化率 。
③化学方程式中Z的化学计量数n= 。
19.一定温度下,向1.0 L密闭容器中加入0.60 mol X(g),发生反应X(g)Y(s)+2Z(g) ΔH>0,测得反应物X浓度与反应时间的数据如下表:
反应时间t/min 0 1 2 3 4 6 8
c(X)/mol·L-1 0.60 0.42 0.30 0.21 0.15 a 0.037 5
(1)3 min时用Z表示的平均反应速率v(Z)= 。(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。
由此规律推出反应在6 min时反应物的浓度a为 mol·L-1。
20.某反应在体积为5L的恒容密闭容器中进行,各相关物质的物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
(1)结合图像信息,判断该反应可能是 (填选项序号)。
①;②;③
(2)试计算:
①反应从开始至2分钟时,以B的浓度变化表示的该反应的平均反应速率 ;
②反应达到限度后A物质的转化率 。
三、实验题
21.溶液和溶液可发生反应:。利用下列装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积的溶液、溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集所用时间t,重复多次取平均值。
回答下列问题:
(1)仪器A的名称为 。该实验过程中,最适合在水槽中收集气体的仪器是 (填字母)。
(2)若需控制体系温度为,采取的合理加热方式为 。
(3)探究反应速率与的关系,测得相关实验数据如下表所示。
实验编号
溶液 溶液 醋酸 水
1 4.0 4.0 4.0 8.0 334
2 6.0 6.0 150
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 0.0 38
① mL, mL。
②该实验所得结论为 。
(4)在上述实验1-4中,甲同学用数字传感器测得溶液中,甲同学认为作催化剂,增加实验5,用盐酸替代醋酸,若,且反应前后不变,则 mL。
实验编号
溶液/ 溶液/ 盐酸 水
5 12.0 4.0
22.近期,我国科学家在实验室中成功用二氧化碳合成了淀粉,反应速率大小是评价该研究成果的重要依据。为探究影响反应速率的因素,某同学在实验室中寻找合适试剂进行实验。
(1)为比较和对分解的催化效果,设计了以下实验:
若该实验中反应速率①>②,能否说明对分解的催化效果一定比好,给出你的判断并简要说明理由 。
(2)丙酮的碘代反应的速率方程为 (其中v为反应速率,k为速率常数,为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7/k。改变反应物浓度时,反应的瞬时速率如表所示:
0.25 0.050 1.4
0.50 0.050 2.8
1.00 0.050 5.6
0.50 0.10 2.8
①该反应的速率常数k的数值为 。
②在过量的存在时,反应掉87.5%的所需的时间是 min。
23.纳米铁粉可用作隐形材料。一种制备纳米铁粉工艺的实验步骤如下:
①在磁力搅拌作用下,向温度约为80℃的饱和FeSO4溶液中不断加入饱和H2C2O4溶液至不再产生黄色沉淀(FeC2O4·2H2O)为止;
②过滤,用煮沸过的蒸馏水将黄色沉淀洗涤干净;
③干燥固体后,在700℃ 并隔绝空气的条件下将固体焙烧至完全变黑。
(1)步骤①中搅拌的目的是 ,每生成0.1 mol FeC2O4·2H2O,生成H2SO4的物质的量为 mol。
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是
(3)步骤③中生成纳米铁的化学方程式为 。
(4)在两支三口烧瓶中盛有相同体积、用硫酸酸化的水样,将其中一支烧瓶中的溶液控制在无氧的条件下,然后分别向烧瓶中加入相同量(足量)的纳米铁粉,测得NO的脱除率与时间的关系如图所示:
①已知在有氧条件下,起始时水样中c(NO)=1.8 × 10-3mol·L-1,则0~4 h内,v(NO)= mol·L-1·h-1。
②由图可知,3 h前,无氧条件下NO的脱除率明显比有氧条件下的高,其原因是 。
参考答案:
1.C
2.C
3.B
4.B
5.A
6.D
7.C
8.A
9.D
10.A
11. 0.025mol/(L·min) 0.075mol/(L·min) 0.05mol//(L·min) X、Y 3X+Y 2Z
12. -80kJ/mol 0.05mol/(L min) AC 向正反应方向进行 (3×10-3)2/(2.5×10-1)(4×10-2)=9×10-4<K=64×10-4,则反应应向正反应方向进行;
13.(1)BC
(2) 0.042 10 0.30 60 <
14. 0.015 mol·L-1· min-1 0.10 (mol·L-1)-2 BC B CO(g)+H2O(g) CO2(g)+H2(g) 否
15.0.04
16. v=0.05mol/L×(42%-33.0%)/(180-120)s=7.5×10-5mol·L-1·s-1 v=0.05mol/L×(73%-59%)/(530-330)s=3.5×10-5mol·L-1·s-1 随着反应进行,反应物浓度降低,反应速率减慢 K=(0.050mol/L×75%)2/[0.050mol/L×(1-75%)]2=9.0 升高温度,增大OH-的浓度,移去产物 3
17.(1)3X+Y 2Z
(2)0.05 mol·L-1·min-1
(3)1.5 mol·L-1
(4)0.1mol·L-1·min-1
(5)3
(6)50%
18. 431.8 CH4(g)+ 2O2(g)=CO2(g) +2H2O(l) △H= - 891kJ/mol v(X)=0.075 mol/(L min) 20﹪ 4
19. 0.26 mol·L-1·min-1 每间隔2 min,X的浓度减少为原来的一半 0.075
20.(1)②
(2) 0.1mol/(L·min) 40%
21.(1) 锥形瓶 a
(2)水浴加热
(3) 4.0 8.0 其他条件不变的情况下,溶液浓度越高,则反应速率越快
(4)3.0
22.(1)否,两催化剂的阴离子不同
(2) 5.6×10-3min-1 375
23. 使反应物充分接触,加快反应速率 0.1 除去水体中溶解的氧气 FeC2O4 2H2OFe+2CO2↑+2H2O 3.6×10-4(或0.00036) 有氧时在纳米铁粉表面生成了铁的氧化物,阻碍了 NO的还原反应的进行
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
6.1.1化学反应速率同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.在一定温度下,将和C(各0.16mol)充入10L恒容密闭容器中,发生反应,一段时间后反应达到了平衡,反应过程中测得的数据如下表,下列说法正确的有几项
t/s 2 4 7 9
n(C)/mol 0.12 0.10 0.09 0.09
①反应前2s的平均反应速率
②反应进行至4s末时,的转化率为37.5%
③其他反应条件不变,加入一定量的C(s),反应速率一定加快
④反应达到平衡时,的物质的量浓度为
A.1 B.2 C.3 D.4
2.工业上,常用O2氧化HCl转化成Cl2,提高效益,减少污染。反应为:4HCl(g)+O2(g)2Cl2(g) +2H2O(g)。一定条件下,测得数据如下:
t/ min 0 2.0 4.0 6.0 8.0 10.0 12. 0
c(Cl2)/10-3mol L-1 0 1.8 3.8 5.7 7.2 7.7 7.7
下列说法错误的是
A.条件不变时,14 min时v正(Cl2)=v逆(H2O)
B.2.0~4.0 min内的平均反应速率大于6.0~8.0 min内的
C.0~6.0 min内HCl的平均反应速率为1.9 mol·L-1·min-1
D.加入高效催化剂,达到平衡所用时间小于10.0 min
3.某温度下,密闭容器中A与B反应生成C和D,其反应速率分别用v(A)、v(B)、v(C)、v(D)表示,已知v(A)、v(B)、v(C)、v(D)之间有以下关系5v(A)=4v(B),v(A)=v(C),6v(B)=5v(D),则此反应可表示为( )
A.5A+6B=C+5D B.4A+5B=4C+6D
C.4A+4B=5C+6D D.4A+6B=4C+5D
4.反应,经2min B的浓度减少。对此反应速率的正确表示是
A.在第2min末时的反应速率,用反应物B来表示是
B.分别用B、C、D表示反应的速率,其比值是3:2:1
C.用A表示的反应速率是
D.在这2min内用B和C表示的反应速率的值都是相同的
5.一定温度下,在0.5L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,10s时达到化学平衡状态。下列说法正确的是
A.该反应的化学方程式为: 2X3Y + Z
B.10s时Y的平均速率为0.12 mol·L-1·min-1
C.X的转化率为66.7%
D.增大压强,该反应速率一定加快
6.已知反应X(s)+3Y(g) Z(g)+2W(g)在四种不同情况下的反应速率,其中反应最快的为
A.v(X)=1.0mol/(L·s) B.v(Y)=0.6mol/(L·s)
C.v(Z)=5.0mol/(L·min) D.v(W)=0.5mol/(L·s)
7.对于反应3A(g)+B(g) 4C(g)+2D(g),测得4种条件下的反应速率分别为①v(A)=0.9mol·L-1·s-1、②v(B)=24mol·L-1·min-1③v(C)=1.6mol·L-1·s-1④v(D)=1.8mol·L-1·min-1,则上述4种条件下的反应速率大小关系正确的是
A.②>④>③>① B.②>①>④>③ C.②=③>①>④ D.②=③>④=①
8.对于反应,下列表示的反应速率最快的是
A. B.
C. D.
9.已知反应在不同条件下的化学反应速率如下,其中反应速率最快的是
A. B.
C. D.
10.已知某反应的各物质浓度数据如下
A B C
起始浓度 1.0 3.0 0
2s末浓度 0.6 1.8 0.8
据此可推算出上述化学方程式中A、B、C三种物质的化学计量数之比是
A.1:3:2 B.3:1:2 C.2:1:3 D.9:3:4
二、填空题
11.某温度时,在容积为2L的密闭容器中,X、Y、Z三种气体物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
(1)计算反应开始2min内的v(x)= ,v(y)= ,v(z)= 。
(2)容器内的反应物是 。
(3)写出该反应的化学方程式 。
12.(1)已知:①
②2
③
则的△H= 。
(2)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: 2,已知该反应在2404℃,平衡常数. 请回答:
①某温度下,向2L的密闭容器中充入和各1mol,5分钟后的物质的量为0.5,则的反应速率为
②将、混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是 (填字母序号).
③该温度下,某时刻测得容器内、、NO的浓度分别为、和,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 .
13.为防止氮的氧化物污染空气,可用活性炭或一氧化碳还原氮氧化物。回答下列问题:
(1)消除NO污染物,可在一定条件下,用CO与NO反应生成CO2和N2,反应的化学方程式:2CO(g)+2NO(g)N2(g)+2CO2(g)。为提高此反应的速率,下列措施可行的是 (填字母代号)。
A.移出CO2 B.使用适合催化剂 C.增大压强 D.降低温度
(2)向两个1L的密闭容器中各加入活性炭(足量)和1.0molNO,发生反应为:C(s)+2NO(g)N2(g)+CO2(g)。实验测得不同温度下NO和N2的物质的量变化如表所示:
物质的量/mol 温度为T1/℃ 温度为T2/℃
0 5min 9min 10min 12min 0 5min 9min 10min
NO 1.0 0.58 0.42 0.40 0.40 1.0 0.50 0.34 0.34
CO2 0 0.21 0.29 0.30 0.30 0 0.25 0.33 0.33
①T1时,0~5min内,以N2表示的该反应速率v(N2)= mol·L-1·min-1。
②T1时,能确定反应达到最大限度(即平衡状态)的时间是 min,此时,容器中N2的物质的量浓度是 mol/L,NO的转化率为 %。
③容器中的温度关系为T1 T2(填“>”“<”或“=”)。
14.(1)恒温下,向一个2L的恒容密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示。
时间/min 5 10 15 20 25 30
c(NH3)/(mol·L-1) 0.08 0.14 0.18 0.20 0.20 0.20
①前20min的平均速率ν(H2)为 ,该温度下此反应化学平衡平衡常数为 。
②能提高反应中N2的平衡转化率的是 。
A.增加N2的浓度 B.增加H2的量 C.移出部分NH3
D.提高反应温度 E.加入合适的催化剂
(2)工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的恒容密闭容器中达到平衡后。改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是 。
A、充入氦气增大压强 B、增大反应物的浓度 C、使用催化剂 D、降低温度
(3)已知某化学反应的平衡常数表达式为K=[CO2]·[H2]/[CO]·[H2O],在不同的温度下该反应的平衡常数如下表:
t℃ 700 800 830 1 000 1 200
K 1.67 1.11 1.00 0.60 0.38
该反应的化学方程式是 ;若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol,该反应 达到平衡状态(填是或否)。
15.二氧化碳的排放越来越受到能源和环境领域的关注,其综合利用是目前研究的重要课题之一。一定温度下,在2L密闭容器中充入3molCO2和6molH2,发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测定H2的转化率[α(H2)]随时间的变化如图所示:
0~20min内,用CH3OH的浓度变化表示的平均反应速率:v(CH3OH)= mol L-1 min-1。
16.硝基苯甲酸乙酯在OH — 存在下发生水解反应:O2NC6H4COOC2H5+OH- O2NC6H4COO-+C2H5OH
两种反应物的初始浓度均为0.050mol/L ,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如表所示,回答下列问题:
t/s 0 120 180 240 330 530 600 700 800
α% 0 33 42 49 59 73 74 75 75
(1)列式计算该反应在120~180s与330~530s区间的平均反应速率 , ;比较两者大小可得出的结论是 。
(2)列式计算该温度下反应的平衡常数 。
(3)为提高O2NC6H4COOC2H5的平衡转化率,可以采取的措施有 (要求写出两条)。
(4)硝基苯甲酸乙酯有 种,其中苯环上的一氯代物最少的结构简式为 。
17.I.某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图1所示。根据图中数据,填写下列空白。
(1)该反应的化学方程式为 。
(2)反应开始至2min,气体Z的平均反应速率v(Z)= 。
II.将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5min后测得c(D)=1mol·L-1,c(A)∶c(B)=3:5,C的反应速率是0.3mol·L-1·min-1。
(3)A在5min末的浓度是 。
(4)ν(B)= 。
(5)x= 。
(6)5min末A的转化率为 。
18.(1)1molH2(g)和1molCl2(g)在一定条件下反应生成2molHCl(g),放出184.5kJ的热量,已知断裂1molH2(g)中的H-H和1molCl2(g)中的Cl-Cl分别需要吸收436.4kJ和242.7kJ的能量,则1molHCl分子中的化学键形成时释放 kJ的能量。
(2)标准状况下,2.24L甲烷完全燃烧生成液态水和二氧化碳气体时可以放出89.1kJ的热量。请写出甲烷完全燃烧的热化学方程式 。
(3)把1molX气体和0.5molY气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)=nZ(g)+2W(g),2min未生成0.2molW,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
①前2min内,用X表示的平均反应速率 。
②2min末时Y的转化率 。
③化学方程式中Z的化学计量数n= 。
19.一定温度下,向1.0 L密闭容器中加入0.60 mol X(g),发生反应X(g)Y(s)+2Z(g) ΔH>0,测得反应物X浓度与反应时间的数据如下表:
反应时间t/min 0 1 2 3 4 6 8
c(X)/mol·L-1 0.60 0.42 0.30 0.21 0.15 a 0.037 5
(1)3 min时用Z表示的平均反应速率v(Z)= 。(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。
由此规律推出反应在6 min时反应物的浓度a为 mol·L-1。
20.某反应在体积为5L的恒容密闭容器中进行,各相关物质的物质的量随时间的变化情况如图所示(已知A、B、C均为气体)。
(1)结合图像信息,判断该反应可能是 (填选项序号)。
①;②;③
(2)试计算:
①反应从开始至2分钟时,以B的浓度变化表示的该反应的平均反应速率 ;
②反应达到限度后A物质的转化率 。
三、实验题
21.溶液和溶液可发生反应:。利用下列装置(夹持仪器略去)探究影响反应速率的因素,向A中加入一定体积的溶液、溶液和水,充分搅拌;控制体系温度,通过分液漏斗往A中加入醋酸;当导管口气泡均匀稳定冒出时收集气体,用秒表测量收集所用时间t,重复多次取平均值。
回答下列问题:
(1)仪器A的名称为 。该实验过程中,最适合在水槽中收集气体的仪器是 (填字母)。
(2)若需控制体系温度为,采取的合理加热方式为 。
(3)探究反应速率与的关系,测得相关实验数据如下表所示。
实验编号
溶液 溶液 醋酸 水
1 4.0 4.0 4.0 8.0 334
2 6.0 6.0 150
3 4.0 4.0 4.0 83
4 12.0 4.0 4.0 0.0 38
① mL, mL。
②该实验所得结论为 。
(4)在上述实验1-4中,甲同学用数字传感器测得溶液中,甲同学认为作催化剂,增加实验5,用盐酸替代醋酸,若,且反应前后不变,则 mL。
实验编号
溶液/ 溶液/ 盐酸 水
5 12.0 4.0
22.近期,我国科学家在实验室中成功用二氧化碳合成了淀粉,反应速率大小是评价该研究成果的重要依据。为探究影响反应速率的因素,某同学在实验室中寻找合适试剂进行实验。
(1)为比较和对分解的催化效果,设计了以下实验:
若该实验中反应速率①>②,能否说明对分解的催化效果一定比好,给出你的判断并简要说明理由 。
(2)丙酮的碘代反应的速率方程为 (其中v为反应速率,k为速率常数,为反应物X的浓度),其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为0.7/k。改变反应物浓度时,反应的瞬时速率如表所示:
0.25 0.050 1.4
0.50 0.050 2.8
1.00 0.050 5.6
0.50 0.10 2.8
①该反应的速率常数k的数值为 。
②在过量的存在时,反应掉87.5%的所需的时间是 min。
23.纳米铁粉可用作隐形材料。一种制备纳米铁粉工艺的实验步骤如下:
①在磁力搅拌作用下,向温度约为80℃的饱和FeSO4溶液中不断加入饱和H2C2O4溶液至不再产生黄色沉淀(FeC2O4·2H2O)为止;
②过滤,用煮沸过的蒸馏水将黄色沉淀洗涤干净;
③干燥固体后,在700℃ 并隔绝空气的条件下将固体焙烧至完全变黑。
(1)步骤①中搅拌的目的是 ,每生成0.1 mol FeC2O4·2H2O,生成H2SO4的物质的量为 mol。
(2)步骤②洗涤用的蒸馏水需预先煮沸的目的是
(3)步骤③中生成纳米铁的化学方程式为 。
(4)在两支三口烧瓶中盛有相同体积、用硫酸酸化的水样,将其中一支烧瓶中的溶液控制在无氧的条件下,然后分别向烧瓶中加入相同量(足量)的纳米铁粉,测得NO的脱除率与时间的关系如图所示:
①已知在有氧条件下,起始时水样中c(NO)=1.8 × 10-3mol·L-1,则0~4 h内,v(NO)= mol·L-1·h-1。
②由图可知,3 h前,无氧条件下NO的脱除率明显比有氧条件下的高,其原因是 。
参考答案:
1.C
2.C
3.B
4.B
5.A
6.D
7.C
8.A
9.D
10.A
11. 0.025mol/(L·min) 0.075mol/(L·min) 0.05mol//(L·min) X、Y 3X+Y 2Z
12. -80kJ/mol 0.05mol/(L min) AC 向正反应方向进行 (3×10-3)2/(2.5×10-1)(4×10-2)=9×10-4<K=64×10-4,则反应应向正反应方向进行;
13.(1)BC
(2) 0.042 10 0.30 60 <
14. 0.015 mol·L-1· min-1 0.10 (mol·L-1)-2 BC B CO(g)+H2O(g) CO2(g)+H2(g) 否
15.0.04
16. v=0.05mol/L×(42%-33.0%)/(180-120)s=7.5×10-5mol·L-1·s-1 v=0.05mol/L×(73%-59%)/(530-330)s=3.5×10-5mol·L-1·s-1 随着反应进行,反应物浓度降低,反应速率减慢 K=(0.050mol/L×75%)2/[0.050mol/L×(1-75%)]2=9.0 升高温度,增大OH-的浓度,移去产物 3
17.(1)3X+Y 2Z
(2)0.05 mol·L-1·min-1
(3)1.5 mol·L-1
(4)0.1mol·L-1·min-1
(5)3
(6)50%
18. 431.8 CH4(g)+ 2O2(g)=CO2(g) +2H2O(l) △H= - 891kJ/mol v(X)=0.075 mol/(L min) 20﹪ 4
19. 0.26 mol·L-1·min-1 每间隔2 min,X的浓度减少为原来的一半 0.075
20.(1)②
(2) 0.1mol/(L·min) 40%
21.(1) 锥形瓶 a
(2)水浴加热
(3) 4.0 8.0 其他条件不变的情况下,溶液浓度越高,则反应速率越快
(4)3.0
22.(1)否,两催化剂的阴离子不同
(2) 5.6×10-3min-1 375
23. 使反应物充分接触,加快反应速率 0.1 除去水体中溶解的氧气 FeC2O4 2H2OFe+2CO2↑+2H2O 3.6×10-4(或0.00036) 有氧时在纳米铁粉表面生成了铁的氧化物,阻碍了 NO的还原反应的进行
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
