苏教版(2019) 高中化学必修第二册 6.1.3化学反应的限度同步练习(含答案)
文档属性
| 名称 | 苏教版(2019) 高中化学必修第二册 6.1.3化学反应的限度同步练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 797.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
6.1.3化学反应的限度同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.密封容器中发生可逆反应:X2+Y22Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
A.c(X2)=0.2mol/L B.c(Y2)=0.35mol/L C.c(Y2)=0.2mol/L D.c(Z)=0.4mol/L
2.对于可逆反应4NH3+5O24NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.反应达到平衡时,反应物的转化率一定小于100%
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
3.3A(g)+2B(s)2C(g)+3D(g) △H=+a kJ·mol-1。达到平衡时,下列说法一定正确的是:
A.当B(s)的质量不再发生变化时,说明该反应已达到平衡状态
B.若开始时加入3 mol A和2 mol B,则反应达到平衡时共吸收a kJ热量
C.若保持恒温、恒容不变,从反应开始到平衡的过程中,气体压强始终不变
D.当用B表示的正反应速率等于用C表示的逆反应速率时,反应已达到平衡状态
4.某温度下,在恒容密闭容器中进行反应:X(g)+Y(g)Z(g)+W(s)。下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中Y的正反应速率与逆反应速率相等时,反应达到平衡
C.升高温度,正反应速率增大,逆反应速率减小
D.达到平衡后,X的转化率可能为100%
5.向一支大试管中加入5mL0.1mol·L-1KI溶液和1mL0.1mol·L-1FeCl3溶液,用力振荡,为证明I-与Fe3+可发生可逆反应,下列实验设计不正确的是( )
A.取少量反应后的溶液于试管中,滴加淀粉溶液,观察现象
B.取少量反应后溶液于试管中,滴加0.1mol·L-1KSCN溶液,观察现象
C.取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液(该溶液与Fe2+反应能产生蓝色沉淀),检验是否有Fe2+生成
D.取少量反应后溶液于试管中,滴加AgNO3溶液,观察现象
6.已知X(g)+3Y (g)2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A.充分反应后,放出热量为a kJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C.与使用催化剂相比,△H及两次平衡时各物质的物质的量分数不会改变
D.若增大Y的浓度,平衡正向移,正反应速率增大,逆反应速率减小
7.下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.需高温条件进行的反应均为吸热反应
C.2 mol SO2 与 1 mol O2 混合反应,生成的 SO3 一定小于 2 mol
D.由分子组成的物质中一定含有共价键
8.汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是
A.只要使用合理的催化剂及载体,就可完全清除NO和CO
B.使用性能好的催化剂可使反应的反应热增大
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.该反应达到平衡时v(NO)正=v(CO)逆
9.设NA为阿伏加 德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图 ),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
10.设NA为阿伏加德罗常数的值,下列说法正确的是
A.pH=2的硫酸溶液中含有的氢离子数目为0.01NA
B.15.6 g的Na2S和Na2O2固体混合物中,阴离子数为0.2NA
C.1 mol碳正离子()中所含的电子总数为9NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
二、填空题
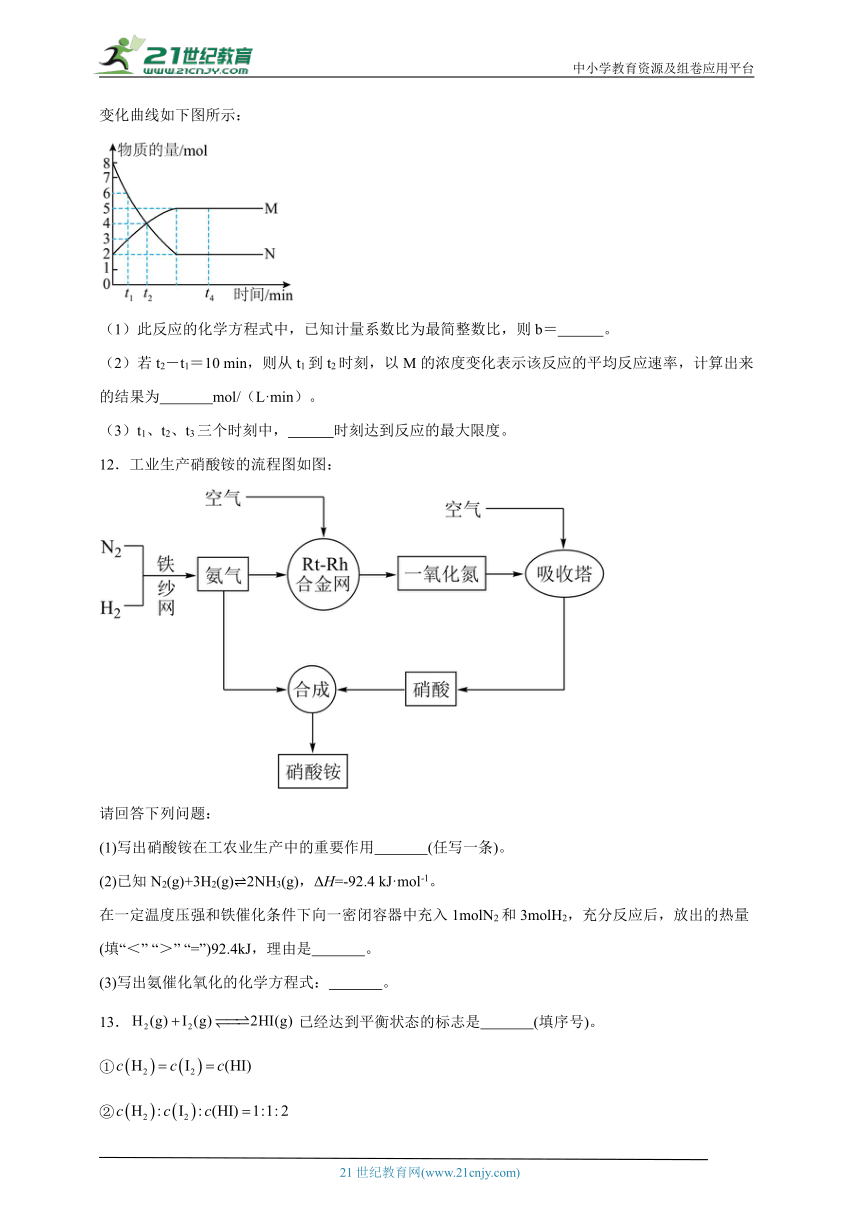
11.一定温度下,在容积为2L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:
(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b= 。
(2)若t2-t1=10 min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为 mol/(L·min)。
(3)t1、t2、t3三个时刻中, 时刻达到反应的最大限度。
12.工业生产硝酸铵的流程图如图:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用 (任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量 (填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式: 。
13.已经达到平衡状态的标志是 (填序号)。
①
②
③、、不再随时间而改变
④单位时间内生成mol的同时生成mol
⑤单位时间内生成mol的同时生成mol
⑥反应速率
⑦一个键断裂的同时有两个键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
其他条件一定,混合气体的平均相对分子质量不再变化
14.向含有2 mol的SO2的容器中通入过量氧气发生2SO2+O22SO3,充分反应后生成SO3的物质的量 (填“<”“>”或“=”,下同)2 mol, 转化率 100%。
15.反应mA+nBpC,某温度下达到平衡时,
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系为 。
(2)若c为气体,且m+n=p,在加压时,化学平衡发生移动,则平衡必定是向 方向移动。
(3)如果在体系中增大或减小B的量平衡均不移动,则B为 态。
(4)若升高温度,A的转化率降低,此反应的逆反应是 热反应。
16.(Ⅰ)在体积为2L的密闭容器中,某可逆反应(ABC均为气体),从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示。
(1)则该反应的反应物是 ,生成物是 ;
(2)该反应的化学方程式为 ;
(3)反应开始至2分钟时,用C表示反应速率 ;
(4)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。
(Ⅱ)对于反应:2SO2(g)+O2(g)2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
编 号 改变的条件 生成SO3的速率
① 升高温度
② 降低温度
③ 增大O2的浓度
④ 使用V2O5作催化剂
17.化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 100 240 464 576 620
①哪一时间段反应速率最大 min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是 。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是( )
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
①该反应的化学方程式是 。
②该反应达到平衡状态的标志是 。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为 。
三、实验题
18.某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是 ;在不改变反应物用量的前提下,改进的方法是 。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是 。
(3)控制适合的条件,将反应2Fe3++2I-2Fe2++I2,设计成如图所示的原电池。
①反应开始时,乙中石墨电极上发生 (填“氧化”或“还原”)反应,电极反应式为 。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作 (填“正”或“负”)极,该电极的电极反应式为 。
19.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡,静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为 反应。(填可逆不可逆)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色, 一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 。
20.化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。 I-+ Fe3+ I2+ Fe2+
(2)步骤ⅲ中,试剂X是 。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是 。
参考答案:
1.B
【详解】A.若c(X)=0.2mol L-1,则 c(X)=0.1mol L-1,反应消耗 c(Z)=0.2mol L-1,Z完全转化为反应物,不符合可逆反应的特征,A选项错误;
B.若c(Y2)=0.35mol L-1,则 c(Y2)=0.05mol L-1,反应消耗 c(Z)=0.1mol L-1,还存在Z物质,符合可逆反应的特征,B选项正确;
C.若c(Y2)=0.2mol L-1,则 c(Y2)=0.1mol L-1,反应消耗 c(Z)=0.2mol L-1,Z完全转化为反应物,不符合可逆反应的特征,C选项错误;
D.c(Z)=0.4mol L-1,则 c(Z)=0.2mol L-1,反应消耗 c(X)=0.1mol L-1,X完全转化为生成物,不符合可逆反应的特征,D选项错误;
答案选B。
2.B
【详解】A.反应速率之比等于方程式的系数之比,v正(NH3):v逆(H2O)=2:3,即3v正(NH3)=2v逆(H2O)时说明化学反应的正、逆反应速率是相等的,达到了化学平衡状态,故A错误;
B.可逆反应不能进行到底,即任何时候,反应物的转化率都小于100%,故B正确;
C.若增加容器体积,相当于减小压强,各物质的浓度均减小,正、逆反应速率都减小,故C错误;
D.单位时间内生成xmolNO,同时消耗xmolNH3,只表示了正反应方向,不能说明化学反应的正、逆反应速率是相等的,故D错误;
故答案为B。
3.A
【详解】A. B(s)的质量不再发生变化,则A、C、D的质量也不发生变化,因此A、C、D的浓度不再发生变化,说明该反应已达到平衡状态,故A正确;
B. 该反应为可逆反应,反应物的转化率不可能为100%,即3 mol A和2 mol B反应时,消耗的A少于3mol,则反应达到平衡时吸收的热量少于a kJ,故B错误;
C. B为固体,反应后气体的物质的量增加,若保持恒温、恒容不变,从反应开始到平衡的过程中,气体压强逐渐增大,故C错误;
D. B为固体,不能用B的浓度变化表示反应速率,故D错误;
答案选A。
【点睛】本题的易错点为D,关键是要注意B为固体,由于固体和纯液体的浓度始终不变,不能用固体和纯液体物质表示化学反应速率。
4.B
【详解】A.加入固体,不影响化学反应速率,W是固体,加入少量W,不影响化学反应速率,故A错误;
B.同一物质的正逆反应速率相等时,反应达到平衡状态,则Y的正逆反应速率相等时该反应达到平衡状态,故B正确;
C.升高温度,活化分子百分数增大,导致正、逆反应速率都增大,故C错误;
D.该反应为可逆反应,反应物不能完全转化为生成物,所以X的转化率不可能达到100%,故D错误;
故选B。
【点睛】本题的易错点为A,要注意固体和纯液体量的多少不影响化学反应速率。
5.D
【详解】A.取少量反应后的溶液,滴加淀粉溶液,溶液现蓝色,说明有碘单质生成,说明I-与Fe3+能发生反应,故A正确;
B.取少量反应后溶液于试管中,滴加0.1mol·L-1KSCN溶液,溶液显红色,说明反应后溶液中存在Fe3+,说明Fe3+虽然少量、但没有完全反应,说明反应可逆,故B正确;
C.取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液若产生蓝色沉淀则说明有Fe2+生成,说明I-与Fe3+能发生反应,故C正确;
D.由于KI过量,滴加AgNO3溶液,无论是否发生可逆反应,一定会产生黄色沉淀,故D错误;
故选D。
6.C
【详解】A项,a>0说明反应是放热反应,同时该反应为可逆反应,所以反应不会进行完全,放出热量小于a kJ,故A项错误;
B项,当反应达到平衡状态时,X与W的物质的量浓度之比不一定为1:2,故B项错误;
C项,使用催化剂能够降低反应的活化能,加快反应速率,但不能使平衡发生移动,同时反应热只跟起始和终止状态有关,和变化途径无关,所以与使用催化剂相比,△H及两次平衡时各物质的物质的量分数不会改变,故C项正确;
D项,增大Y的浓度,正反应速率和逆反应速率都增大,故D项错误。
综上所述,本题正确答案为C。
7.C
【详解】A.氢氧燃料电池放电时,化学能不可能全部转化为电能,部分转化为热能,故A错误;
B.工业上合成氨需要在高温下进行,该反应为放热反应,故B错误;
C.由于SO2 与 O2 的反应属于可逆反应,则2 mol SO2 与 1 mol O2 混合反应不能完全生成SO3,则生成的SO3的物质的量一定小于 2 mol,故C正确;
D.由分子组成的物质不一定含有共价键,如稀有气体是单原子分子,不含化学键,故D错误;
答案选C。
【点睛】反应吸热或放热,与反应条件无关,需要加热不代表反应就是吸热反应。
8.D
【详解】A、根据可逆反应的特点可知:不可能完全清除NO和CO,故A错误;
B、催化剂对化学平衡无影响,故催化剂对反应热无影响,故B错误;
C、平衡时各物质的浓度关系取决于物质的起始物质的量和转化率,故达到平衡时c(NO)与c(CO)不一定相等,故C错误;
D、平衡时,v(NO)正=v(NO)逆,NO与CO的化学计量数相等,故v(NO)正=v(CO)逆,故D正确。
9.B
【详解】A.纯水中氢离子和氢氧根离子浓度相等,所以pH=6的纯水中,氢氧根离子浓度为l×10-6mol/L,1L纯水中含有的OH-数目为l×10-6NA,故A错误;
B. 氢氧燃料电池在酸性条件下,负极的电极反应式为:H2-2e-=2H+,正极的电极反应式为:4H++O2+4e-=2H2O,当转移2mol电子时,被氧化的分子数为NA,故B正确;
C. 由雄黄的结构简式: 可知,结构中不存在S—S ,所以C错误;
D. 因为H2+I22HI为可逆反应,所以一定条件下向密闭容器中充入1molH2和2molI2(g)充分反应,生成HI分子数小于2NA,故D错误;
所以本题答案:B。
10.B
【详解】A.pH=2的硫酸溶液中c(H+)=0.01 mol/L,但溶液中只有离子浓度,没有溶液体积,因此不能计算离子数目,A错误;
B.Na2S和Na2O2的式量都是78,15.6 g的Na2S和Na2O2固体混合物中含有物质的物质的量是0.2 mol,由于这两种物质中阳离子与阴离子个数比都是2:1,则0.2 mol固体混合物中含有阴离子的物质的量是0.2 mol,阴离子数为0.2NA,B正确;
C.1个中含有8个电子,1 mol碳正离子()中所含的电子总数为8NA,C错误;
D.NO与O2反应产生NO2,2 mol NO与1 mol O2充分反应,产生2 mol NO2,NO2会有一部分发生反应产生N2O4,反应方程式为:2NO2N2O4,则反应后气体的物质的量小于2 mol,故最终产物的分子数小于2NA,D错误;
故合理选项是B。
11. 1 0.05 t3
【分析】(1)化学方程式的系数数比等于物质的量变化量之比;
(2)根据 计算以M的浓度变化表示该反应的平均反应速率;
(3)物质的量不再随时间延长而变化时达到反应的最大限度。
【详解】(1)N的物质的量变化是8-2=6mol,M的物质的量变化是5-2=3mol,化学方程式的系数数比等于物质的量变化量之比,所以a:b=6:3=2:1,所以b=1;
(2)容积为2L,t2-t1=10 min,则从t1到t2时刻,M的物质的量变化5-4=1mol,所以0.05 mol/(L·min);
(3)t3时刻M、N的物质的量不再随时间延长而变化,所以t3时刻达到反应的最大限度。
【点睛】考查化学反应速率计算、化学平衡状态判断,侧重对基础知识的巩固,注意化学方程式的系数数比等于物质的量变化量之比。
12. 可做氮肥等 < 在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ 4NH3+5O24NO+6H2O
【分析】氮气与氢气在催化剂存在时反应生成氨气,氨气在催化剂存在时氧化生成一氧化氮和水,一氧化氮、空气在吸收塔中反应生成硝酸,硝酸和氨气可以合成硝酸铵,据此分析解答。
【详解】(1)硝酸铵含有氮元素,氮元素是植物生长需要的一种元素,是一种很好的氮肥,故答案为:可做氮肥等;
(2)N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ mol-1表示在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,但是该反应为可逆反应,在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,不可能反应完全,所以放出的热量小于92.4kJ,故答案为:<;在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能反应完全,所以放出的热量小于92.4kJ;
(3)氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O24NO+6H2O,故答案为:4NH3+5O2 4NO+6H2O。
13.③④⑦⑨
【详解】①在非平衡状态下,也能有c(H2)=c(I2)=c(HI),则①不能说明该反应达到平衡状态,①不符合题意;
②在非平衡状态下,也能有c(H2):c(I2):c(HI)=1:1:2,则②不能说明该反应达到平衡状态,②不符合题意;
③各组分浓度不再改变,说明该反应达到平衡状态,③符合题意;
④单位时间内生成n mol H2,同时生成2n mol HI,说明正逆反应速率相等,即该反应达到平衡状态,④符合题意;
⑤任何时候,单位时间内生成n mol H2,同时生成n mol I2,则⑤不能说明该反应达到平衡状态,⑤不符合题意;
⑥题中并未标明反应速率代表的反应方向,则⑥不能说明该反应达到平衡状态,⑥不符合题意;
⑦一个H-H键断裂的同时有两个H-I键断裂,说明正逆反应速率相等,即该反应达到平衡状态,⑦符合题意;
⑧该反应是气体体积不变的反应;温度和体积一定时,容器内压强始终不变,故⑧不能说明该反应达到平衡状态,⑧不符合题意;
⑨温度和体积一定时,混合气体的颜色不再变化,说明c(I2)不再变化,则该反应达到平衡状态,⑨符合题意;
⑩该反应是气体体积不变的反应;温度和体积一定时,混合气体的密度始终不变,故⑩不能说明该反应达到平衡状态,⑩不符合题意;
该反应是气体总物质的量不变的反应;温度和体积一定时,混合气体的总物质的量始终不变,故 不能说明该反应达到平衡状态, 不符合题意;
综上所述,该反应达到平衡状态的标志是③④⑦⑨。
14. < <
【详解】通入过量氧气,2 mol的 SO2也不可能反应完,充分反应后生成SO3的物质的量<2 mol,反应物的转化率<100%,故答案为< <
【点睛】可逆反应的基本特点是:反应物不可能全部转化为生成物,转化率肯定小于100%。
15.(1)m+n>p
(2)逆反应
(3)液态或固态
(4)吸
【解析】(1)
减压后正反应速率小于逆反应速率,说明减小压强,平衡逆向移动,则逆反应为气体分子数增大的反应,m+n>p。
(2)
加压,平衡发生了移动,说明反应物与生成物气体的物质的量不相等,由于m+n=p,所以A、B至少有一种不是气体,即该反应的正反应是气体分子数增大的反应,则加压使得平衡向逆反应方向移动。
(3)
改变B的量,平衡不移动,则B不是气体,为液态或固态。
(4)
升高温度,A的转化率降低,说明平衡逆向移动,则逆反应是吸热反应。
16. A、B C 2A(g)+B(g) 2C(g) 0.5 mol/(L min) 化学平衡 增大 减小 增大 增大
【分析】(Ⅰ)(1)由图象中物质的量的变化趋势分析判断;
(2)根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(3)根据v==计算;
(4)根据化学平衡状态的特征分析解答;
(Ⅱ)根据影响反应速率的因素分析判断。
【详解】(Ⅰ)(1)由图象可知,A、B的物质的量减小,所以A、B是反应物,C的物质的量增加,C为生成物,故答案为A、B;C;
(2)当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A)∶△n(B)∶△n(C)=2∶1∶2,所以反应的化学方程式为:2A+B 2C,故答案为2A+B 2C;
(3)反应开始至2分钟时,v(C)==0.5 mol/(L min),故答案为0.5 mol/(L min);
(4)当反应达到平衡状态时,各物质的物质的量不再变化,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,故答案为化学平衡;
(Ⅱ)影响反应速率的因素:温度、浓度、催化剂、压强、固体的表面积等。温度越高,浓度越大,压强越大、使用催化剂均可以使反应速率加快,反之,会使反应速率减慢。
①升高温度,化学反应速率增大,②降低温度,化学反应速率减慢;③增大反应物O2的浓度,化学反应速率加快;④使用V2O5作催化剂,化学反应速率加快,故答案为增大;减小;增大;增大。
17. 2~3min 因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大 0.025mol/(L·min) CD 3X(g)+Y(g)2Z(g) CD 30%
【分析】(1)①在0~1、1~2、2~3、3~4、4~5min时间段中产生气体的体积判断,根据金属与酸的反应为放热反应分析解答;②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=计算反应速率;
(2)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(3)①根据图象判断出反应物和生成物,以及参加反应的物质的物质的量之比书写化学方程式;②根据反应到达平衡状态的特征分析判断;③根据转化率=×100%计算。
【详解】(1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为100mL、140mL、224mL、112mL、54mL,由此可知反应速率最大的时间段为2~3 min;因为该反应是放热反应,开始阶段温度对反应的速率起决定性的作用,温度越高,反应速率越大,故答案为2~3 min;因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大;
②在3~4min时间段内,n(H2)==0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)==0.025mol/(L min),故答案为0.025mol/(L min);
(2)A.加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A可行;B.加入KCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;C.加入KNO3溶液,H+浓度减小,因酸性溶液中有NO3-,具有强氧化性,与Zn反应无氢气生成,故C不可行;D.加入CuSO4溶液,Zn置换出Cu反应速度增大,且影响生成氢气的量,故D不可行;故答案为CD;
(3)①由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物。当反应进行到5min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,则△n(Y)∶△n(Z)∶△n(X)=1∶2∶3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X(g)+Y(g)2Z(g),故答案为3X(g)+Y(g)2Z(g);
②A.X、Y、Z的反应速率相等,不能说明是否变化,不能作平衡状态的标志,故A错误;B.随着反应的进行,X、Y的反应速率比始终为3∶1,不能作为平衡状态的标志,故B错误;C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等,反应达到平衡状态,故C正确;D.生成1mol Y的同时生成2mol Z,正逆反应速率相等,反应达到平衡状态,故D正确;故答案为CD;
③2min内X的转化率为×100%=30%,故答案为30%。
【点睛】本题的易错点为(2)中C,要注意硝酸根离子在酸性溶液中具有强氧化性,与活泼金属反应,一般不放出氢气。
18. 该反应中KI过量,故不能直接检验是否存在I- 取少量反应液,滴加KSCN溶液,若溶液变红,则证明还有Fe3+未完全反应 取少量反应液,滴加淀粉溶液,若溶液变蓝,则说明生成了I2 氧化 2I--2e-=I2 负 Fe2+-e-=Fe3+
【分析】(1)根据实验①中KI溶液、FeCl3溶液的浓度和体积知,KI过量,不能直接检验I-判断反应具有可逆性。要证明反应有一定的限度,应检验反应后的溶液中是否含Fe3+。
(2)检验I2用淀粉溶液。
(3)①反应开始时,乙中石墨电极上I-发生氧化反应生成I2。
②在甲中加入FeCl2固体,平衡向逆反应方向移动,甲电极上Fe2+发生氧化反应生成Fe3+。
【详解】(1)实验①中n(KI)=0.1mol/L×0.005L=0.0005mol,n(FeCl3)=0.1mol/L×0.002L=0.0002mol,该反应中KI过量,不能直接检验是否含I-判断反应的可逆性,实验①不合理。在不改变反应物用量的前提下,要证明反应有一定的限度,应检验反应后的溶液中是否含Fe3+,改进的方法是:取少量反应液,滴加KSCN溶液,若溶液变红,则证明还有Fe3+未完全反应,证明反应具有可逆性。
(2)检验I2可用淀粉溶液,方法是:取少量反应液,滴加淀粉溶液,若溶液变蓝,则说明生成了I2。
(3)①反应开始时,甲中石墨电极上Fe3+发生还原反应生成Fe2+,乙中石墨电极上I-发生氧化反应生成I2,电极反应式为2I--2e-=I2。
②在甲中加入FeCl2固体,Fe2+浓度增大,平衡向逆反应方向移动,甲中Fe2+发生氧化反应生成Fe3+,甲中的石墨作负极,该电极的电极反应式为:Fe2+-e-=Fe3+。
19. 防止氯化亚铁被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ 可逆 反应生成的Fe3+催化了H2O2的分解
【分析】(1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,浮在液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,是亚铁离子检验的特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用。
【详解】(1)FeCl2易被空气中的氧气氧化,而铁和氯化铁可反应生成氯化亚铁,则在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;
故答案为防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl2易被空气中的氧气氧化,煤油不溶于水,密度比水小,浮于液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
故答案为隔绝空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子检验的特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色,说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2Fe3++2I =I2+2Fe2+,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
故答案为Fe2+;可逆;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用,产生气泡的原因是反应生成的Fe3+催化了H2O2的分解;
故答案为反应生成的Fe3+催化了H2O2的分解。
20. 2 2 1 2 KSCN溶液 ii中下层溶液紫红色,iii中加入KSCN溶液后显红色
【分析】探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度,实际上就是证明反应后的混合溶液里既有I2生成,但Fe3+没有完全反应还有剩余。据此解答。
【详解】(1)反应中碘元素化合价从-1价升高到0价,铁元素化合价从+3价降低到+2价,则根据电子得失守恒可知反应的离子方程式为2I-+2Fe3+I2+2Fe2+;
(2)根据题干信息可知反应中碘化钾一定是过量的,要证明是可逆反应,则反应后一定有铁离子剩余,检验铁离子可以用KSCN溶液,则步骤ⅲ中,试剂X是KSCN溶液。
(3)要证明是可逆反应,则反应后一定有碘生成和铁离子剩余,步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是ⅱ中下层溶液紫红色,ⅲ中加入KSCN溶液后显红色。
【点睛】探究性实验是常考考点,但基础性较强,理解反应实质和实验原理是解题的关键,注意重视基本理论的理解与运用,夯实基础,提高分析问题解决问题的能力。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
6.1.3化学反应的限度同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.密封容器中发生可逆反应:X2+Y22Z,已知起始时X2、Y2、Z的物质的量浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。反应在一定条件下进行到某一时刻时,各物质的物质的量浓度可能是( )
A.c(X2)=0.2mol/L B.c(Y2)=0.35mol/L C.c(Y2)=0.2mol/L D.c(Z)=0.4mol/L
2.对于可逆反应4NH3+5O24NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.反应达到平衡时,反应物的转化率一定小于100%
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
3.3A(g)+2B(s)2C(g)+3D(g) △H=+a kJ·mol-1。达到平衡时,下列说法一定正确的是:
A.当B(s)的质量不再发生变化时,说明该反应已达到平衡状态
B.若开始时加入3 mol A和2 mol B,则反应达到平衡时共吸收a kJ热量
C.若保持恒温、恒容不变,从反应开始到平衡的过程中,气体压强始终不变
D.当用B表示的正反应速率等于用C表示的逆反应速率时,反应已达到平衡状态
4.某温度下,在恒容密闭容器中进行反应:X(g)+Y(g)Z(g)+W(s)。下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中Y的正反应速率与逆反应速率相等时,反应达到平衡
C.升高温度,正反应速率增大,逆反应速率减小
D.达到平衡后,X的转化率可能为100%
5.向一支大试管中加入5mL0.1mol·L-1KI溶液和1mL0.1mol·L-1FeCl3溶液,用力振荡,为证明I-与Fe3+可发生可逆反应,下列实验设计不正确的是( )
A.取少量反应后的溶液于试管中,滴加淀粉溶液,观察现象
B.取少量反应后溶液于试管中,滴加0.1mol·L-1KSCN溶液,观察现象
C.取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液(该溶液与Fe2+反应能产生蓝色沉淀),检验是否有Fe2+生成
D.取少量反应后溶液于试管中,滴加AgNO3溶液,观察现象
6.已知X(g)+3Y (g)2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A.充分反应后,放出热量为a kJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C.与使用催化剂相比,△H及两次平衡时各物质的物质的量分数不会改变
D.若增大Y的浓度,平衡正向移,正反应速率增大,逆反应速率减小
7.下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.需高温条件进行的反应均为吸热反应
C.2 mol SO2 与 1 mol O2 混合反应,生成的 SO3 一定小于 2 mol
D.由分子组成的物质中一定含有共价键
8.汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是
A.只要使用合理的催化剂及载体,就可完全清除NO和CO
B.使用性能好的催化剂可使反应的反应热增大
C.假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO)
D.该反应达到平衡时v(NO)正=v(CO)逆
9.设NA为阿伏加 德罗常数的值,下列说法正确的是
A.1LpH=6的纯水中含有OH-的数目为10-8NA
B.当氢氧酸性燃料电池中转移2mol电子时被氧化的分子数为NA
C.0.5mol雄黄(As4S4,结构如图 ),含有NA个S—S键
D.一定条件下向密闭容器中充入1molH2和2molH2(g)充分反应,生成HI分子数最多等于2NA
10.设NA为阿伏加德罗常数的值,下列说法正确的是
A.pH=2的硫酸溶液中含有的氢离子数目为0.01NA
B.15.6 g的Na2S和Na2O2固体混合物中,阴离子数为0.2NA
C.1 mol碳正离子()中所含的电子总数为9NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
二、填空题
11.一定温度下,在容积为2L的密闭容器中进行反应:aN(g)bM(g),M、N的物质的量随时间的变化曲线如下图所示:
(1)此反应的化学方程式中,已知计量系数比为最简整数比,则b= 。
(2)若t2-t1=10 min,则从t1到t2时刻,以M的浓度变化表示该反应的平均反应速率,计算出来的结果为 mol/(L·min)。
(3)t1、t2、t3三个时刻中, 时刻达到反应的最大限度。
12.工业生产硝酸铵的流程图如图:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用 (任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量 (填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式: 。
13.已经达到平衡状态的标志是 (填序号)。
①
②
③、、不再随时间而改变
④单位时间内生成mol的同时生成mol
⑤单位时间内生成mol的同时生成mol
⑥反应速率
⑦一个键断裂的同时有两个键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
其他条件一定,混合气体的平均相对分子质量不再变化
14.向含有2 mol的SO2的容器中通入过量氧气发生2SO2+O22SO3,充分反应后生成SO3的物质的量 (填“<”“>”或“=”,下同)2 mol, 转化率 100%。
15.反应mA+nBpC,某温度下达到平衡时,
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系为 。
(2)若c为气体,且m+n=p,在加压时,化学平衡发生移动,则平衡必定是向 方向移动。
(3)如果在体系中增大或减小B的量平衡均不移动,则B为 态。
(4)若升高温度,A的转化率降低,此反应的逆反应是 热反应。
16.(Ⅰ)在体积为2L的密闭容器中,某可逆反应(ABC均为气体),从0~2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示。
(1)则该反应的反应物是 ,生成物是 ;
(2)该反应的化学方程式为 ;
(3)反应开始至2分钟时,用C表示反应速率 ;
(4)2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 状态。
(Ⅱ)对于反应:2SO2(g)+O2(g)2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)。
编 号 改变的条件 生成SO3的速率
① 升高温度
② 降低温度
③ 增大O2的浓度
④ 使用V2O5作催化剂
17.化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) 1 2 3 4 5
氢气体积(mL) 100 240 464 576 620
①哪一时间段反应速率最大 min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是 。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率 (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是( )
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
①该反应的化学方程式是 。
②该反应达到平衡状态的标志是 。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为 。
三、实验题
18.某研究性小组决定用实验探究的方法证明化学反应具有一定的限度。取5mL 0.1mol/L KI溶液于试管中,滴加0.1mol/L FeCl3溶液2mL,发生如下反应:2Fe3++2I-2Fe2++I2。为证明该反应具有可逆性且具有限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。综合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验中①不合理,你认为是 ;在不改变反应物用量的前提下,改进的方法是 。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是 。
(3)控制适合的条件,将反应2Fe3++2I-2Fe2++I2,设计成如图所示的原电池。
①反应开始时,乙中石墨电极上发生 (填“氧化”或“还原”)反应,电极反应式为 。
②电流计读数为0时,反应达到平衡状态。此时在甲中加入FeCl2固体,发现电流计又发生偏转,则甲中的石墨作 (填“正”或“负”)极,该电极的电极反应式为 。
19.某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡,静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为 反应。(填可逆不可逆)。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色, 一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 。
20.化学小组实验探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度。
实验:i.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液。充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
(1)将KI和FeCl3反应的离子方程式补充完整。 I-+ Fe3+ I2+ Fe2+
(2)步骤ⅲ中,试剂X是 。
(3)步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是 。
参考答案:
1.B
【详解】A.若c(X)=0.2mol L-1,则 c(X)=0.1mol L-1,反应消耗 c(Z)=0.2mol L-1,Z完全转化为反应物,不符合可逆反应的特征,A选项错误;
B.若c(Y2)=0.35mol L-1,则 c(Y2)=0.05mol L-1,反应消耗 c(Z)=0.1mol L-1,还存在Z物质,符合可逆反应的特征,B选项正确;
C.若c(Y2)=0.2mol L-1,则 c(Y2)=0.1mol L-1,反应消耗 c(Z)=0.2mol L-1,Z完全转化为反应物,不符合可逆反应的特征,C选项错误;
D.c(Z)=0.4mol L-1,则 c(Z)=0.2mol L-1,反应消耗 c(X)=0.1mol L-1,X完全转化为生成物,不符合可逆反应的特征,D选项错误;
答案选B。
2.B
【详解】A.反应速率之比等于方程式的系数之比,v正(NH3):v逆(H2O)=2:3,即3v正(NH3)=2v逆(H2O)时说明化学反应的正、逆反应速率是相等的,达到了化学平衡状态,故A错误;
B.可逆反应不能进行到底,即任何时候,反应物的转化率都小于100%,故B正确;
C.若增加容器体积,相当于减小压强,各物质的浓度均减小,正、逆反应速率都减小,故C错误;
D.单位时间内生成xmolNO,同时消耗xmolNH3,只表示了正反应方向,不能说明化学反应的正、逆反应速率是相等的,故D错误;
故答案为B。
3.A
【详解】A. B(s)的质量不再发生变化,则A、C、D的质量也不发生变化,因此A、C、D的浓度不再发生变化,说明该反应已达到平衡状态,故A正确;
B. 该反应为可逆反应,反应物的转化率不可能为100%,即3 mol A和2 mol B反应时,消耗的A少于3mol,则反应达到平衡时吸收的热量少于a kJ,故B错误;
C. B为固体,反应后气体的物质的量增加,若保持恒温、恒容不变,从反应开始到平衡的过程中,气体压强逐渐增大,故C错误;
D. B为固体,不能用B的浓度变化表示反应速率,故D错误;
答案选A。
【点睛】本题的易错点为D,关键是要注意B为固体,由于固体和纯液体的浓度始终不变,不能用固体和纯液体物质表示化学反应速率。
4.B
【详解】A.加入固体,不影响化学反应速率,W是固体,加入少量W,不影响化学反应速率,故A错误;
B.同一物质的正逆反应速率相等时,反应达到平衡状态,则Y的正逆反应速率相等时该反应达到平衡状态,故B正确;
C.升高温度,活化分子百分数增大,导致正、逆反应速率都增大,故C错误;
D.该反应为可逆反应,反应物不能完全转化为生成物,所以X的转化率不可能达到100%,故D错误;
故选B。
【点睛】本题的易错点为A,要注意固体和纯液体量的多少不影响化学反应速率。
5.D
【详解】A.取少量反应后的溶液,滴加淀粉溶液,溶液现蓝色,说明有碘单质生成,说明I-与Fe3+能发生反应,故A正确;
B.取少量反应后溶液于试管中,滴加0.1mol·L-1KSCN溶液,溶液显红色,说明反应后溶液中存在Fe3+,说明Fe3+虽然少量、但没有完全反应,说明反应可逆,故B正确;
C.取少量反应后溶液于试管中,滴加K3[Fe(CN)6]溶液若产生蓝色沉淀则说明有Fe2+生成,说明I-与Fe3+能发生反应,故C正确;
D.由于KI过量,滴加AgNO3溶液,无论是否发生可逆反应,一定会产生黄色沉淀,故D错误;
故选D。
6.C
【详解】A项,a>0说明反应是放热反应,同时该反应为可逆反应,所以反应不会进行完全,放出热量小于a kJ,故A项错误;
B项,当反应达到平衡状态时,X与W的物质的量浓度之比不一定为1:2,故B项错误;
C项,使用催化剂能够降低反应的活化能,加快反应速率,但不能使平衡发生移动,同时反应热只跟起始和终止状态有关,和变化途径无关,所以与使用催化剂相比,△H及两次平衡时各物质的物质的量分数不会改变,故C项正确;
D项,增大Y的浓度,正反应速率和逆反应速率都增大,故D项错误。
综上所述,本题正确答案为C。
7.C
【详解】A.氢氧燃料电池放电时,化学能不可能全部转化为电能,部分转化为热能,故A错误;
B.工业上合成氨需要在高温下进行,该反应为放热反应,故B错误;
C.由于SO2 与 O2 的反应属于可逆反应,则2 mol SO2 与 1 mol O2 混合反应不能完全生成SO3,则生成的SO3的物质的量一定小于 2 mol,故C正确;
D.由分子组成的物质不一定含有共价键,如稀有气体是单原子分子,不含化学键,故D错误;
答案选C。
【点睛】反应吸热或放热,与反应条件无关,需要加热不代表反应就是吸热反应。
8.D
【详解】A、根据可逆反应的特点可知:不可能完全清除NO和CO,故A错误;
B、催化剂对化学平衡无影响,故催化剂对反应热无影响,故B错误;
C、平衡时各物质的浓度关系取决于物质的起始物质的量和转化率,故达到平衡时c(NO)与c(CO)不一定相等,故C错误;
D、平衡时,v(NO)正=v(NO)逆,NO与CO的化学计量数相等,故v(NO)正=v(CO)逆,故D正确。
9.B
【详解】A.纯水中氢离子和氢氧根离子浓度相等,所以pH=6的纯水中,氢氧根离子浓度为l×10-6mol/L,1L纯水中含有的OH-数目为l×10-6NA,故A错误;
B. 氢氧燃料电池在酸性条件下,负极的电极反应式为:H2-2e-=2H+,正极的电极反应式为:4H++O2+4e-=2H2O,当转移2mol电子时,被氧化的分子数为NA,故B正确;
C. 由雄黄的结构简式: 可知,结构中不存在S—S ,所以C错误;
D. 因为H2+I22HI为可逆反应,所以一定条件下向密闭容器中充入1molH2和2molI2(g)充分反应,生成HI分子数小于2NA,故D错误;
所以本题答案:B。
10.B
【详解】A.pH=2的硫酸溶液中c(H+)=0.01 mol/L,但溶液中只有离子浓度,没有溶液体积,因此不能计算离子数目,A错误;
B.Na2S和Na2O2的式量都是78,15.6 g的Na2S和Na2O2固体混合物中含有物质的物质的量是0.2 mol,由于这两种物质中阳离子与阴离子个数比都是2:1,则0.2 mol固体混合物中含有阴离子的物质的量是0.2 mol,阴离子数为0.2NA,B正确;
C.1个中含有8个电子,1 mol碳正离子()中所含的电子总数为8NA,C错误;
D.NO与O2反应产生NO2,2 mol NO与1 mol O2充分反应,产生2 mol NO2,NO2会有一部分发生反应产生N2O4,反应方程式为:2NO2N2O4,则反应后气体的物质的量小于2 mol,故最终产物的分子数小于2NA,D错误;
故合理选项是B。
11. 1 0.05 t3
【分析】(1)化学方程式的系数数比等于物质的量变化量之比;
(2)根据 计算以M的浓度变化表示该反应的平均反应速率;
(3)物质的量不再随时间延长而变化时达到反应的最大限度。
【详解】(1)N的物质的量变化是8-2=6mol,M的物质的量变化是5-2=3mol,化学方程式的系数数比等于物质的量变化量之比,所以a:b=6:3=2:1,所以b=1;
(2)容积为2L,t2-t1=10 min,则从t1到t2时刻,M的物质的量变化5-4=1mol,所以0.05 mol/(L·min);
(3)t3时刻M、N的物质的量不再随时间延长而变化,所以t3时刻达到反应的最大限度。
【点睛】考查化学反应速率计算、化学平衡状态判断,侧重对基础知识的巩固,注意化学方程式的系数数比等于物质的量变化量之比。
12. 可做氮肥等 < 在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,所以放出的热量小于92.4kJ 4NH3+5O24NO+6H2O
【分析】氮气与氢气在催化剂存在时反应生成氨气,氨气在催化剂存在时氧化生成一氧化氮和水,一氧化氮、空气在吸收塔中反应生成硝酸,硝酸和氨气可以合成硝酸铵,据此分析解答。
【详解】(1)硝酸铵含有氮元素,氮元素是植物生长需要的一种元素,是一种很好的氮肥,故答案为:可做氮肥等;
(2)N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ mol-1表示在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,但是该反应为可逆反应,在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,不可能反应完全,所以放出的热量小于92.4kJ,故答案为:<;在常温常压条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能反应完全,所以放出的热量小于92.4kJ;
(3)氨气催化氧化生成一氧化氮和水,反应的化学方程式为4NH3+5O24NO+6H2O,故答案为:4NH3+5O2 4NO+6H2O。
13.③④⑦⑨
【详解】①在非平衡状态下,也能有c(H2)=c(I2)=c(HI),则①不能说明该反应达到平衡状态,①不符合题意;
②在非平衡状态下,也能有c(H2):c(I2):c(HI)=1:1:2,则②不能说明该反应达到平衡状态,②不符合题意;
③各组分浓度不再改变,说明该反应达到平衡状态,③符合题意;
④单位时间内生成n mol H2,同时生成2n mol HI,说明正逆反应速率相等,即该反应达到平衡状态,④符合题意;
⑤任何时候,单位时间内生成n mol H2,同时生成n mol I2,则⑤不能说明该反应达到平衡状态,⑤不符合题意;
⑥题中并未标明反应速率代表的反应方向,则⑥不能说明该反应达到平衡状态,⑥不符合题意;
⑦一个H-H键断裂的同时有两个H-I键断裂,说明正逆反应速率相等,即该反应达到平衡状态,⑦符合题意;
⑧该反应是气体体积不变的反应;温度和体积一定时,容器内压强始终不变,故⑧不能说明该反应达到平衡状态,⑧不符合题意;
⑨温度和体积一定时,混合气体的颜色不再变化,说明c(I2)不再变化,则该反应达到平衡状态,⑨符合题意;
⑩该反应是气体体积不变的反应;温度和体积一定时,混合气体的密度始终不变,故⑩不能说明该反应达到平衡状态,⑩不符合题意;
该反应是气体总物质的量不变的反应;温度和体积一定时,混合气体的总物质的量始终不变,故 不能说明该反应达到平衡状态, 不符合题意;
综上所述,该反应达到平衡状态的标志是③④⑦⑨。
14. < <
【详解】通入过量氧气,2 mol的 SO2也不可能反应完,充分反应后生成SO3的物质的量<2 mol,反应物的转化率<100%,故答案为< <
【点睛】可逆反应的基本特点是:反应物不可能全部转化为生成物,转化率肯定小于100%。
15.(1)m+n>p
(2)逆反应
(3)液态或固态
(4)吸
【解析】(1)
减压后正反应速率小于逆反应速率,说明减小压强,平衡逆向移动,则逆反应为气体分子数增大的反应,m+n>p。
(2)
加压,平衡发生了移动,说明反应物与生成物气体的物质的量不相等,由于m+n=p,所以A、B至少有一种不是气体,即该反应的正反应是气体分子数增大的反应,则加压使得平衡向逆反应方向移动。
(3)
改变B的量,平衡不移动,则B不是气体,为液态或固态。
(4)
升高温度,A的转化率降低,说明平衡逆向移动,则逆反应是吸热反应。
16. A、B C 2A(g)+B(g) 2C(g) 0.5 mol/(L min) 化学平衡 增大 减小 增大 增大
【分析】(Ⅰ)(1)由图象中物质的量的变化趋势分析判断;
(2)根据物质的物质的量变化值等于化学计量数之比书写化学方程;
(3)根据v==计算;
(4)根据化学平衡状态的特征分析解答;
(Ⅱ)根据影响反应速率的因素分析判断。
【详解】(Ⅰ)(1)由图象可知,A、B的物质的量减小,所以A、B是反应物,C的物质的量增加,C为生成物,故答案为A、B;C;
(2)当反应到达2min时,△n(A)=2mol,△n(B)=1mol,△n(C)=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A)∶△n(B)∶△n(C)=2∶1∶2,所以反应的化学方程式为:2A+B 2C,故答案为2A+B 2C;
(3)反应开始至2分钟时,v(C)==0.5 mol/(L min),故答案为0.5 mol/(L min);
(4)当反应达到平衡状态时,各物质的物质的量不再变化,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了平衡状态,故答案为化学平衡;
(Ⅱ)影响反应速率的因素:温度、浓度、催化剂、压强、固体的表面积等。温度越高,浓度越大,压强越大、使用催化剂均可以使反应速率加快,反之,会使反应速率减慢。
①升高温度,化学反应速率增大,②降低温度,化学反应速率减慢;③增大反应物O2的浓度,化学反应速率加快;④使用V2O5作催化剂,化学反应速率加快,故答案为增大;减小;增大;增大。
17. 2~3min 因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大 0.025mol/(L·min) CD 3X(g)+Y(g)2Z(g) CD 30%
【分析】(1)①在0~1、1~2、2~3、3~4、4~5min时间段中产生气体的体积判断,根据金属与酸的反应为放热反应分析解答;②计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=计算反应速率;
(2)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量;
(3)①根据图象判断出反应物和生成物,以及参加反应的物质的物质的量之比书写化学方程式;②根据反应到达平衡状态的特征分析判断;③根据转化率=×100%计算。
【详解】(1)①在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为100mL、140mL、224mL、112mL、54mL,由此可知反应速率最大的时间段为2~3 min;因为该反应是放热反应,开始阶段温度对反应的速率起决定性的作用,温度越高,反应速率越大,故答案为2~3 min;因为反应开始阶段温度对反应的速率起决定性的作用,反应是放热反应,升高温度,反应速率增大;
②在3~4min时间段内,n(H2)==0.005mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.01mol,则υ(HCl)==0.025mol/(L min),故答案为0.025mol/(L min);
(2)A.加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A可行;B.加入KCl溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;C.加入KNO3溶液,H+浓度减小,因酸性溶液中有NO3-,具有强氧化性,与Zn反应无氢气生成,故C不可行;D.加入CuSO4溶液,Zn置换出Cu反应速度增大,且影响生成氢气的量,故D不可行;故答案为CD;
(3)①由图象可以看出,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物。当反应进行到5min时,△n(Y)=0.2mol,△n(Z)=0.4mol,△n(X)=0.6mol,则△n(Y)∶△n(Z)∶△n(X)=1∶2∶3,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:3X(g)+Y(g)2Z(g),故答案为3X(g)+Y(g)2Z(g);
②A.X、Y、Z的反应速率相等,不能说明是否变化,不能作平衡状态的标志,故A错误;B.随着反应的进行,X、Y的反应速率比始终为3∶1,不能作为平衡状态的标志,故B错误;C.体积固定,混合气体的总物质的量不确定,当容器的压强保持一定,说明正逆反应速率相等,反应达到平衡状态,故C正确;D.生成1mol Y的同时生成2mol Z,正逆反应速率相等,反应达到平衡状态,故D正确;故答案为CD;
③2min内X的转化率为×100%=30%,故答案为30%。
【点睛】本题的易错点为(2)中C,要注意硝酸根离子在酸性溶液中具有强氧化性,与活泼金属反应,一般不放出氢气。
18. 该反应中KI过量,故不能直接检验是否存在I- 取少量反应液,滴加KSCN溶液,若溶液变红,则证明还有Fe3+未完全反应 取少量反应液,滴加淀粉溶液,若溶液变蓝,则说明生成了I2 氧化 2I--2e-=I2 负 Fe2+-e-=Fe3+
【分析】(1)根据实验①中KI溶液、FeCl3溶液的浓度和体积知,KI过量,不能直接检验I-判断反应具有可逆性。要证明反应有一定的限度,应检验反应后的溶液中是否含Fe3+。
(2)检验I2用淀粉溶液。
(3)①反应开始时,乙中石墨电极上I-发生氧化反应生成I2。
②在甲中加入FeCl2固体,平衡向逆反应方向移动,甲电极上Fe2+发生氧化反应生成Fe3+。
【详解】(1)实验①中n(KI)=0.1mol/L×0.005L=0.0005mol,n(FeCl3)=0.1mol/L×0.002L=0.0002mol,该反应中KI过量,不能直接检验是否含I-判断反应的可逆性,实验①不合理。在不改变反应物用量的前提下,要证明反应有一定的限度,应检验反应后的溶液中是否含Fe3+,改进的方法是:取少量反应液,滴加KSCN溶液,若溶液变红,则证明还有Fe3+未完全反应,证明反应具有可逆性。
(2)检验I2可用淀粉溶液,方法是:取少量反应液,滴加淀粉溶液,若溶液变蓝,则说明生成了I2。
(3)①反应开始时,甲中石墨电极上Fe3+发生还原反应生成Fe2+,乙中石墨电极上I-发生氧化反应生成I2,电极反应式为2I--2e-=I2。
②在甲中加入FeCl2固体,Fe2+浓度增大,平衡向逆反应方向移动,甲中Fe2+发生氧化反应生成Fe3+,甲中的石墨作负极,该电极的电极反应式为:Fe2+-e-=Fe3+。
19. 防止氯化亚铁被氧化 2Fe2++Cl2=2Fe3++2Cl- 隔绝空气(排除氧气对实验的影响) Fe2+ 可逆 反应生成的Fe3+催化了H2O2的分解
【分析】(1)铁和氯化铁反应生成氯化亚铁,氯化亚铁溶液中加入铁粉防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁;
(3)煤油不溶于水,密度比水小,浮在液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,是亚铁离子检验的特征反应现象,第一支试管中加入1mL CCl4充分振荡、静置,CCl4层显紫色说明生成I2,碘离子被铁离子氧化为碘单质,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用。
【详解】(1)FeCl2易被空气中的氧气氧化,而铁和氯化铁可反应生成氯化亚铁,则在FeCl2溶液中需加入少量铁屑,其目的是防止氯化亚铁被氧化;
故答案为防止氯化亚铁被氧化;
(2)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为2Fe2++Cl2=2Fe3++2Cl-;
(3)FeCl2易被空气中的氧气氧化,煤油不溶于水,密度比水小,浮于液面上,可以隔绝溶液与空气接触,排除氧气对实验的影响;
故答案为隔绝空气(排除氧气对实验的影响);
(4)加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀是亚铁离子检验的特征反应现象,实验②检验的离子是Fe2+,①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色,说明生成I2,碘离子被铁离子氧化为碘单质,反应的离子方程式为:2Fe3++2I =I2+2Fe2+,③第三支试管中加入1滴KSCN溶液,溶液变红,说明溶液中含有铁离子,在I 过量的情况下,溶液中仍含有Fe3+,说明该反应为可逆反应;
故答案为Fe2+;可逆;
(5)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,说明过氧化氢氧化亚铁离子为铁离子,铁离子对过氧化氢分解起到催化剂作用,产生气泡的原因是反应生成的Fe3+催化了H2O2的分解;
故答案为反应生成的Fe3+催化了H2O2的分解。
20. 2 2 1 2 KSCN溶液 ii中下层溶液紫红色,iii中加入KSCN溶液后显红色
【分析】探究KI和FeCl3生成KCl、I2和FeCl2的反应存在一定限度,实际上就是证明反应后的混合溶液里既有I2生成,但Fe3+没有完全反应还有剩余。据此解答。
【详解】(1)反应中碘元素化合价从-1价升高到0价,铁元素化合价从+3价降低到+2价,则根据电子得失守恒可知反应的离子方程式为2I-+2Fe3+I2+2Fe2+;
(2)根据题干信息可知反应中碘化钾一定是过量的,要证明是可逆反应,则反应后一定有铁离子剩余,检验铁离子可以用KSCN溶液,则步骤ⅲ中,试剂X是KSCN溶液。
(3)要证明是可逆反应,则反应后一定有碘生成和铁离子剩余,步骤ⅱ和ⅲ的实验现象中,能说明①中反应存在一定限度的实验现象是ⅱ中下层溶液紫红色,ⅲ中加入KSCN溶液后显红色。
【点睛】探究性实验是常考考点,但基础性较强,理解反应实质和实验原理是解题的关键,注意重视基本理论的理解与运用,夯实基础,提高分析问题解决问题的能力。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
