【轻松备课】科粤版化学九年级上 第四章 4.3 质量守恒定律 教学课件
文档属性
| 名称 | 【轻松备课】科粤版化学九年级上 第四章 4.3 质量守恒定律 教学课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 16:42:41 | ||
图片预览





文档简介
(共24张PPT)
第四章 生命之源——水
4.3 质量守恒定律
第四章 生命之源——水
1.通过实验测定几个化学反应前后质量的变化以及对反应实质的分析,理解和掌握质量守恒定律的含义。
2.从化学变化实质及原子、分子的知识理解质量守恒定律。
3.增强应用实验方法来定量研究问题和分析问题的能力。
学 习 目 标
自主 探 究
1.木炭物质燃烧成为灰烬,质量如何变化?
2.小树苗长成参天大树,质量又如何变化呢?
1.参加化学反应的各物质的质量之和大于生成的各物质的质量之和。
2.参加化学反应的各物质的质量之和等于生成的各物质的质量之和。
3.参加化学反应的各物质的质量之和小于生成的各物质的质量之和。
猜想和假设
物质发生化学变化,反应物的质量同生成物的质量之间究竟存在什么关系?
提出问题
一、探究质量守恒定律
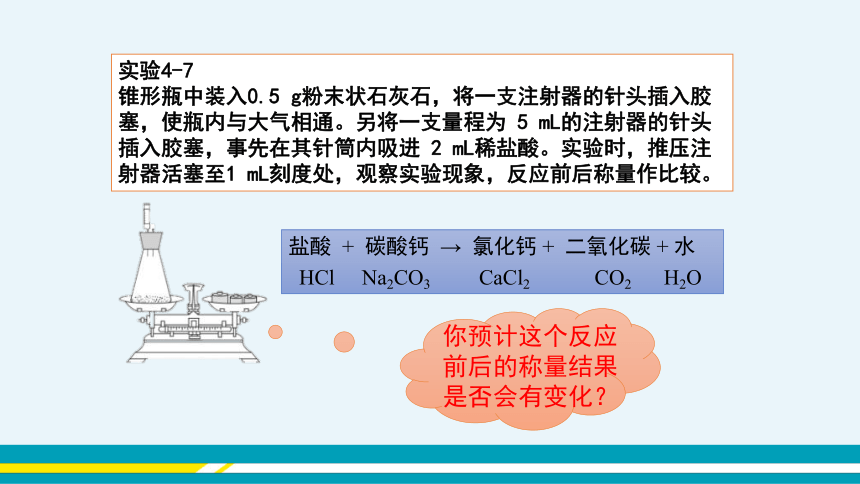
实验4-7
锥形瓶中装入0.5 g粉末状石灰石,将一支注射器的针头插入胶塞,使瓶内与大气相通。另将一支量程为 5 mL的注射器的针头插入胶塞,事先在其针筒内吸进 2 mL稀盐酸。实验时,推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl Na2CO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
0
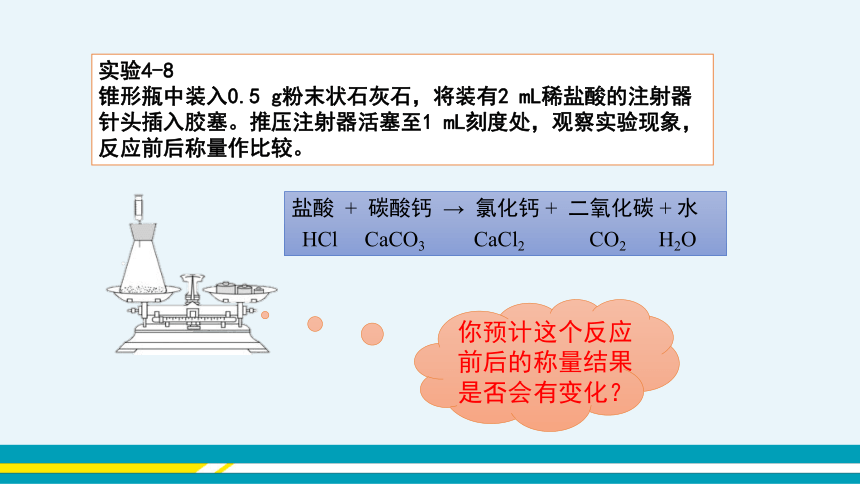
实验4-8
锥形瓶中装入0.5 g粉末状石灰石,将装有2 mL稀盐酸的注射器针头插入胶塞。推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
0
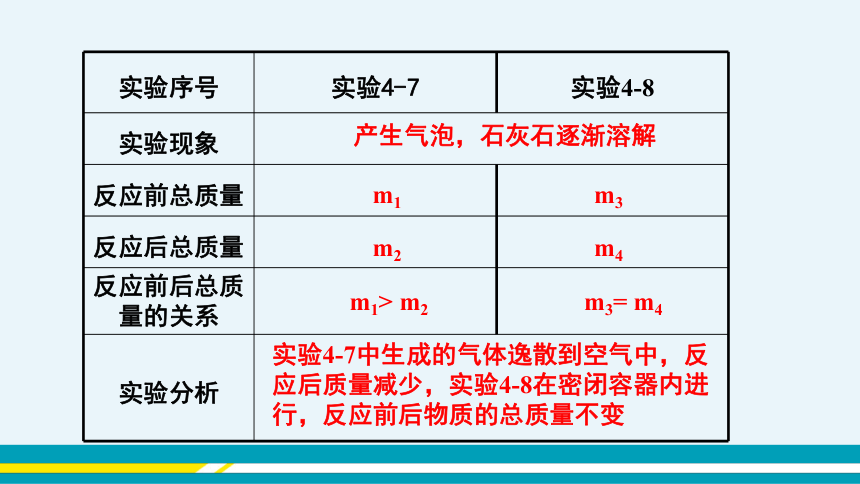
实验序号 实验4-7 实验4-8
实验现象 反应前总质量
反应后总质量
反应前后总质量的关系
实验分析 m1
m2
产生气泡,石灰石逐渐溶解
m1> m2
实验4-7中生成的气体逸散到空气中,反应后质量减少,实验4-8在密闭容器内进行,反应前后物质的总质量不变
m3
m4
m3= m4
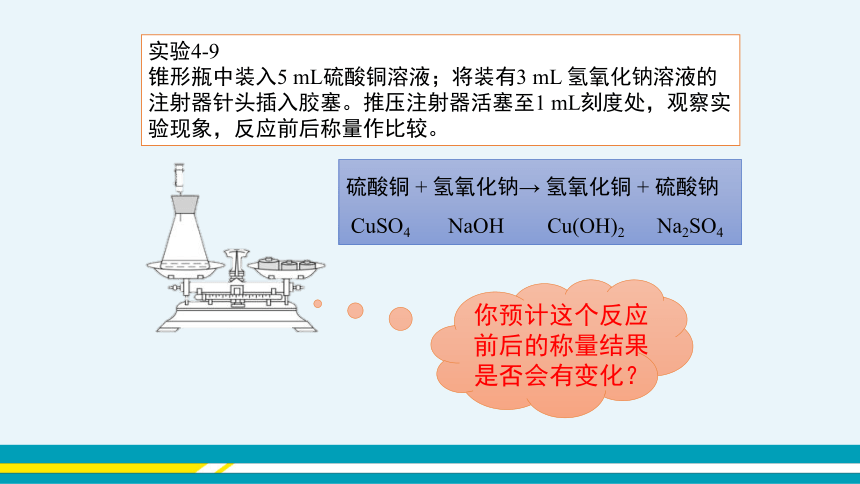
实验4-9
锥形瓶中装入5 mL硫酸铜溶液;将装有3 mL 氢氧化钠溶液的注射器针头插入胶塞。推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
硫酸铜 + 氢氧化钠→ 氢氧化铜 + 硫酸钠
CuSO4 NaOH Cu(OH)2 Na2SO4
0
0
你预计这个反应
前后的称量结果
是否会有变化?
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验结论
m5
m6
产生蓝色絮状沉淀
m5= m6
反应前后物质的总质量不变
0
1.为什么【实验4-7】和【实验4-8】都属于同一个反应,反应前后各物质的总质量,前者不相等,而后者相等?
【实验4-7】中有气体逸出。
讨论与交流:
2.我们应当以哪些实验为依据来探究化学反应前后物质质量总和的关系?能从中得到什么结论?
【实验4-8】和【实验4-9】;化学反应前参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
实验结论
1.质量守恒定律只能解释化学变化不能解释物理变化。
2.凡参加了反应的物质,都要计入反应物的总质量。如果反应物过量,过量部分并没有参加化学反应,其过量部分的质量不能计入反应物的总质量。
3.不能遗漏:参加反应的气体、反应后生成的气体及沉淀。
4.质量守恒是物质的“质量”守恒,而非“体积”守恒。
参加反应的各
物质的质量
总和
生成的各物质的质量
总和
化学反应前后物质的总质量为什么不变?
+
氧分子
氧原子
氢原子
氢分子
水分子
化学变化的微观本质
分子
原子
分解为
新分子
重组
质量守恒原因:
化学反应前后原子的种类和数目没有改变。
元素种类变了吗?
元素质量变了吗?
分子数目变了吗?
化学反应前后
物质种类呢?
分子种类呢?
动动脑
不变
改变
可能改变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
反应物和生成物总质量不变
元素的化合价
在化学反应中有六不变、两改变、两个可能改变
1.为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段经过砂纸打磨过的镁条,称重。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称重,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
镁条燃烧是镁与空气中的氧气反应,生成白色固体氧化镁,反应物的总质量应包含参加反应的镁的质量和参加反应的氧气的质量,所以生成物氧化镁的质量比镁条质量增大了。
讨论与交流:
2.你能从微观的角度,用图示表明上述实验也是符合质量守恒定律的?
例 植物的光合作用可表示为:
水+二氧化碳 淀粉+氧气,由此推断淀
粉中一定含有___元素,可能含有___元素。
光照
叶绿素
例 根据质量守恒定律解释现象:铁丝在氧气中燃烧后,生成物的质量比原来铁丝的质量大。
答:铁丝在氧气中燃烧时有氧气参加,所以生成物四氧化三铁的质量比原来铁丝的质量大。
1.解释一些实验事实
2.推测一些物质的组成
C 、H
O
二、质量守恒定律的应用
例1 现有4.6g某可燃物与足量氧气完全燃烧生成8.8gCO2和5.4gH2O,则该可燃物中含有碳元素_______,含有氢元素_______; 该物质中是否含有氧元素?___________,若含有氧元素,其质量为_______。
例2 在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
则:反应后X待测的质量____,该反应属于______反应.
55
提示:质量减少的是反应物,质量增加的是生成物,质量不变的物质可能是催化剂。
3.进行有关的计算
2.4g
0.6g
1.6g
含有氧元素
分解
课 堂 达 标
1.下列说法正确的是( )
A.5g酒精溶解在55g水中形成60g溶液,这符合质量守恒定律
B.细铁丝在氧气中燃烧,生成物质量比细铁丝大,这个反应不遵守质量守恒定律
C.2L氢气和1L氧气点燃后,可生成3L水
D.完全电解10g水得到的氢气和氧气的质量之和仍是10g
D
2.生活中有时发生把亚硝酸钠误当食盐的中毒事件,确保食品安全的警钟再次敲响。亚硝酸钠(NaNO2)外观与食盐极相似,有咸味,区别它们的有效方法是隔绝空气加热,没有明显变化的是食盐,能分解放出刺激性气味气体的是亚硝酸钠,此气体可能是( )
A.S02 B.NH3 C.N2 D.N02
D
3.质量守恒定律是自然界最基本的规律之一。下列实验装置(天平省略)能用来验证质量守恒定律的是( )
A
4.将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁。则丁物质的质量是
( )
A.12 g B.9 g C.4 g D.17 g
A
5.化学反应前后肯定没有变化的是( )
①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
A. ①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
B
谢 谢 观 看
第四章 生命之源——水
4.3 质量守恒定律
第四章 生命之源——水
1.通过实验测定几个化学反应前后质量的变化以及对反应实质的分析,理解和掌握质量守恒定律的含义。
2.从化学变化实质及原子、分子的知识理解质量守恒定律。
3.增强应用实验方法来定量研究问题和分析问题的能力。
学 习 目 标
自主 探 究
1.木炭物质燃烧成为灰烬,质量如何变化?
2.小树苗长成参天大树,质量又如何变化呢?
1.参加化学反应的各物质的质量之和大于生成的各物质的质量之和。
2.参加化学反应的各物质的质量之和等于生成的各物质的质量之和。
3.参加化学反应的各物质的质量之和小于生成的各物质的质量之和。
猜想和假设
物质发生化学变化,反应物的质量同生成物的质量之间究竟存在什么关系?
提出问题
一、探究质量守恒定律
实验4-7
锥形瓶中装入0.5 g粉末状石灰石,将一支注射器的针头插入胶塞,使瓶内与大气相通。另将一支量程为 5 mL的注射器的针头插入胶塞,事先在其针筒内吸进 2 mL稀盐酸。实验时,推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl Na2CO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
0
实验4-8
锥形瓶中装入0.5 g粉末状石灰石,将装有2 mL稀盐酸的注射器针头插入胶塞。推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
盐酸 + 碳酸钙 → 氯化钙 + 二氧化碳 + 水
HCl CaCO3 CaCl2 CO2 H2O
你预计这个反应
前后的称量结果
是否会有变化?
0
实验序号 实验4-7 实验4-8
实验现象 反应前总质量
反应后总质量
反应前后总质量的关系
实验分析 m1
m2
产生气泡,石灰石逐渐溶解
m1> m2
实验4-7中生成的气体逸散到空气中,反应后质量减少,实验4-8在密闭容器内进行,反应前后物质的总质量不变
m3
m4
m3= m4
实验4-9
锥形瓶中装入5 mL硫酸铜溶液;将装有3 mL 氢氧化钠溶液的注射器针头插入胶塞。推压注射器活塞至1 mL刻度处,观察实验现象,反应前后称量作比较。
硫酸铜 + 氢氧化钠→ 氢氧化铜 + 硫酸钠
CuSO4 NaOH Cu(OH)2 Na2SO4
0
0
你预计这个反应
前后的称量结果
是否会有变化?
实验现象
反应前总质量
反应后总质量
反应前后总质量的关系
实验结论
m5
m6
产生蓝色絮状沉淀
m5= m6
反应前后物质的总质量不变
0
1.为什么【实验4-7】和【实验4-8】都属于同一个反应,反应前后各物质的总质量,前者不相等,而后者相等?
【实验4-7】中有气体逸出。
讨论与交流:
2.我们应当以哪些实验为依据来探究化学反应前后物质质量总和的关系?能从中得到什么结论?
【实验4-8】和【实验4-9】;化学反应前参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
实验结论
1.质量守恒定律只能解释化学变化不能解释物理变化。
2.凡参加了反应的物质,都要计入反应物的总质量。如果反应物过量,过量部分并没有参加化学反应,其过量部分的质量不能计入反应物的总质量。
3.不能遗漏:参加反应的气体、反应后生成的气体及沉淀。
4.质量守恒是物质的“质量”守恒,而非“体积”守恒。
参加反应的各
物质的质量
总和
生成的各物质的质量
总和
化学反应前后物质的总质量为什么不变?
+
氧分子
氧原子
氢原子
氢分子
水分子
化学变化的微观本质
分子
原子
分解为
新分子
重组
质量守恒原因:
化学反应前后原子的种类和数目没有改变。
元素种类变了吗?
元素质量变了吗?
分子数目变了吗?
化学反应前后
物质种类呢?
分子种类呢?
动动脑
不变
改变
可能改变
原子数目
原子质量
原子种类
微观
元素质量
元素种类
不 变
物质的种类
分子的种类
改变
宏观
可能
改变
分子数目
反应物和生成物总质量不变
元素的化合价
在化学反应中有六不变、两改变、两个可能改变
1.为了验证质量守恒定律,某同学在托盘天平的左盘上放一块石棉网,在石棉网上放一段经过砂纸打磨过的镁条,称重。然后点燃镁条,将生成的白色固体全部收集在石棉网上,冷却后再称重,发现质量比实验前的质量增大了。怎样解释反应前后质量不等的现象?
镁条燃烧是镁与空气中的氧气反应,生成白色固体氧化镁,反应物的总质量应包含参加反应的镁的质量和参加反应的氧气的质量,所以生成物氧化镁的质量比镁条质量增大了。
讨论与交流:
2.你能从微观的角度,用图示表明上述实验也是符合质量守恒定律的?
例 植物的光合作用可表示为:
水+二氧化碳 淀粉+氧气,由此推断淀
粉中一定含有___元素,可能含有___元素。
光照
叶绿素
例 根据质量守恒定律解释现象:铁丝在氧气中燃烧后,生成物的质量比原来铁丝的质量大。
答:铁丝在氧气中燃烧时有氧气参加,所以生成物四氧化三铁的质量比原来铁丝的质量大。
1.解释一些实验事实
2.推测一些物质的组成
C 、H
O
二、质量守恒定律的应用
例1 现有4.6g某可燃物与足量氧气完全燃烧生成8.8gCO2和5.4gH2O,则该可燃物中含有碳元素_______,含有氢元素_______; 该物质中是否含有氧元素?___________,若含有氧元素,其质量为_______。
例2 在一定密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应后,测得反应前后各物质的质量如下:
物质 X Y Z Q
反应前质量 2 2 84 5
反应后质量 待测 24 0 14
则:反应后X待测的质量____,该反应属于______反应.
55
提示:质量减少的是反应物,质量增加的是生成物,质量不变的物质可能是催化剂。
3.进行有关的计算
2.4g
0.6g
1.6g
含有氧元素
分解
课 堂 达 标
1.下列说法正确的是( )
A.5g酒精溶解在55g水中形成60g溶液,这符合质量守恒定律
B.细铁丝在氧气中燃烧,生成物质量比细铁丝大,这个反应不遵守质量守恒定律
C.2L氢气和1L氧气点燃后,可生成3L水
D.完全电解10g水得到的氢气和氧气的质量之和仍是10g
D
2.生活中有时发生把亚硝酸钠误当食盐的中毒事件,确保食品安全的警钟再次敲响。亚硝酸钠(NaNO2)外观与食盐极相似,有咸味,区别它们的有效方法是隔绝空气加热,没有明显变化的是食盐,能分解放出刺激性气味气体的是亚硝酸钠,此气体可能是( )
A.S02 B.NH3 C.N2 D.N02
D
3.质量守恒定律是自然界最基本的规律之一。下列实验装置(天平省略)能用来验证质量守恒定律的是( )
A
4.将20克甲、5克乙、8克丙三种纯净物混合,在密闭容器中加热发生化学反应,经分析可知:反应后混合物中含有5克甲、16克丙,还含有一种新物质丁。则丁物质的质量是
( )
A.12 g B.9 g C.4 g D.17 g
A
5.化学反应前后肯定没有变化的是( )
①原子数目;②分子数目;③元素种类;④物质种类;⑤原子种类;⑥物质的总质量。
A. ①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
B
谢 谢 观 看
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
