【轻松备课】科粤版化学九年级上 第二章 2.3 构成物质的微观粒子(Ⅱ)——原子和离子 第1课时 教学课件
文档属性
| 名称 | 【轻松备课】科粤版化学九年级上 第二章 2.3 构成物质的微观粒子(Ⅱ)——原子和离子 第1课时 教学课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 16:42:47 | ||
图片预览










文档简介
(共31张PPT)
第二章 空气、物质的构成
2.3 构成物质的微观粒子(Ⅱ)——原子和离子
第二章 空气、物质的构成
第1课时
1.原子的定义。
2.知道原子、离子也是构成物质的微粒。
3.理解分子、原子的区别和联系。
4.简单了解原子的结构。
学 习 目 标
讨论
当物质发生变化时,构成物质的分子会如何变化呢?
自 主 探 究
由分子构成的物质,在物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;在化学变化中,分子本身发生改变,生成化学性质跟原物质不同的新物质分子。
通过氧化汞分解过程分析原子和分子的关系
实验步骤:将红色粉末氧化汞装在试管里加强热,收集产生的气体。
实验现象:红色粉末渐渐变化,试管内壁上出现银光闪闪的物质,收集的气体可以支持可燃物燃烧。
加热
氧化汞(HgO) 汞(Hg) + 氧气(O2)
实验结论:
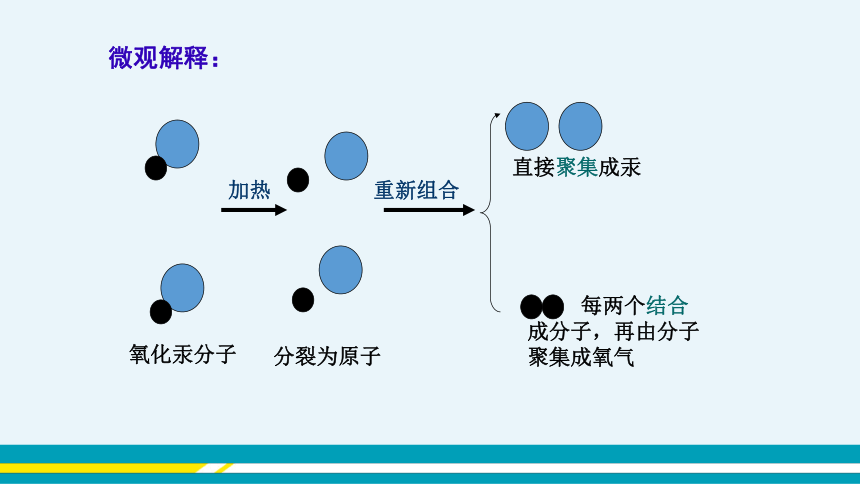
重新组合
加热
氧化汞分子
分裂为原子
直接聚集成汞
每两个结合成分子,再由分子聚集成氧气
微观解释:
结论:
1.在化学变化中,氧化汞分子分解成为汞原子和氧原子,氧化汞分子是由汞原子和氧原子构成的,可见分子由原子构成。
2.有的物质可由原子直接构成,如金属汞是由汞原子直接构成的。
3.汞原子和氧原子本身在化学变化中没有变化,只是组合方式发生改变,它们重新组合后构成新的物质。
一、原子
1.定义:原子是化学变化中的最小微粒。
在化学变化中,分子本身发生变化,分解为原子,原子本身没有发生变化,只是重新组合成新分子,构成新物质。
分子可以分为原子,原子也可以构成分子。
由原子构成的物质如下:
所有金属,
少数带“石”字旁的非金属,
稀有气体,
如汞(Hg)是由汞原子构成。
如氩气由氩原子构成。
如碳由碳原子构成。
如氩气(Ar)、氖气(Ne)。
如汞(Hg)、铜(Cu)、镁(Mg)、铁(Fe)。
如碳(C)、硅(Si)。
2.原子也是构成物质的一种微粒
3.原子的基本性质
(1)原子的质量和体积都很小;
(2)原子都在不断的运动着;
(3)原子间有间隔;
(4)同种物质原子的性质相同,不同种物质原子的性质不同。
在化学变化中,分子可以分成原子,而原子不能再分。
4.分子、原子的根本区别
分子和原子的比较
分子 原子
相似点 (1)分子的质量和体积都很小 (2)分子是不断运动的。温度升高,分子运动加快 (3)分子间有间隔 (4)同种分子,性质相同;不同的分子,性质不同 (1)原子的质量和体积都很小
(2)原子是不断运动的。温度升高,原子运动加快
(3)原子间有间隔
(4)同种原子,性质相同;不同的原子,性质不同
区别 在化学变化后,分子变成了新的分子 在化学变化前后,原子的种类、大小、性质都不变
联系 分子由原子构成 原子是构成分子的粒子,也是直接构成物质的一种粒子
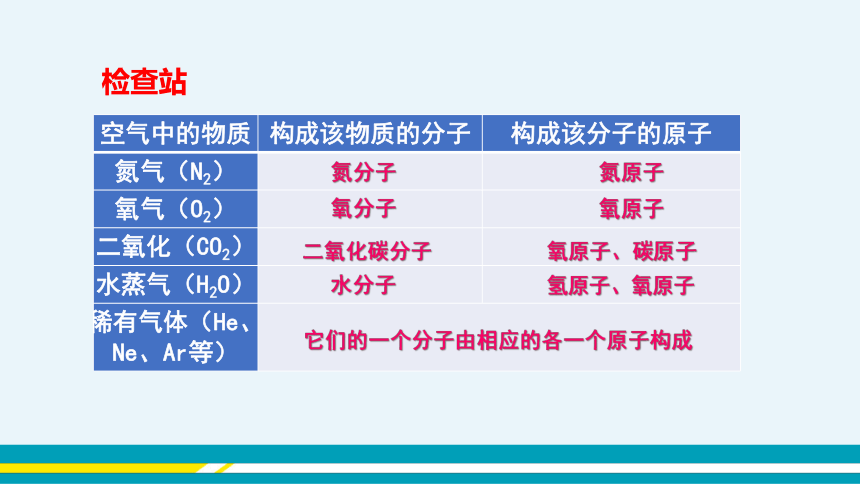
注意 分子和原子都可以直接构成物质。分子与构成这种分子的原子相比,分子要大些。但不能笼统认为分子比原子大。 空气中的物质 构成该物质的分子 构成该分子的原子
氮气(N2)
氧气(O2)
二氧化(CO2)
水蒸气(H2O)
稀有气体(He、Ne、Ar等) 氮分子
氮原子
氧分子
氧原子
二氧化碳分子
氧原子、碳原子
水分子
氢原子、氧原子
它们的一个分子由相应的各一个原子构成
检查站
问题
原子是化学变化中的最小微粒,原子还能再分吗
二、原子的构成
原子核
高速运动的电子
原子的内部是什么样子呢?
1897年汤姆生发现电子
卢瑟福和他的助手做了著名的α粒子散射实验
英国科学家
卢瑟福
(E.Rutherford,1871~1937)
卢瑟福实验
α粒子发射源
1911年著名物理学家卢瑟福做了著名的卢瑟福实验,用一束带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔并不改变原来的方向,但也有一小部分改变了原来的方向,甚至有极少数α粒子被反弹了回来。
金
箔
由此可得出的结论有:
(1)原子不是实心的,内部有很大部分是空的。
(2)原子内部存在着带正电的组成部分,α粒子受到斥力而改变了原有的运动路径。
(3)原子内部存在着的带正电部分是实心的,且所占空间很小。
原子
原子核
(+)
核外电子(-)
质子(+)
中子
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
所带正电荷数称为核电荷数
核电荷数=质子数=核外电子数
1.原子的构成
原子种类 核电荷数 原子核 核外电子数
质子数 中子数 氢(H) 1 1 0 1
氦(He) 2 2 2 2
氮(N) 7 7 7 7
氧(O) 8 8 8 8
铁(Fe) 26 26 30 26
铀(U-235) 92 92 143 92
分析下表可以获得哪些信息?
1.不同种类的原子,其核电荷数、质子数是不同的。
2.原子的核内质子数与中子数不一定相同。
3.同种原子其核电荷数=质子数=核外电子数。
通过上表分析可知:同一种原子中,其原子核里的质子数和核外电子数相等,所带电量相等且电性相反,故整个原子不显电性。
不一定所有的原子核内都有中子
一个氧原子
原子核
电子
氧原子的构成
原子核
子中
子 质
以碳原子为例描述原子的构成
其中6个质子和6个中子构成了原子核作为原子的中心,而6个电子在核外一定空间内绕核做高速运动。
已知一种碳原子的构成粒子是6个质子,6个中子和6个电子。请描述原子的构成情况。
(1)能直接构成物质的粒子有:
(2)在化学变化中最小的粒子有:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)构成原子核的微粒有:
分子 原子
原子
分子 原子 中子
质子
电子
电子
质子 中子 电子
质子 中子
在分子、原子、质子、中子、电子这些粒子中,选择合适的答案,填在空格上。
练一练
检查站
我国早已启动“嫦娥工程”探月计划。2020年12月17日,嫦娥五号带着1731克月球样本返回地球,宣告我国探月工程“绕、落、回”三步走战略圆满完成。月球上含有丰富的核聚变染料——“氦-3(3He)”。已知“碳-13(13C)”是指原子核内含有6个质子、7个中子的碳原子,则3He所指的氦原子,核内含有_____质子,_____中子,核外有_____电子。
1
2
2
1.下列现象的微观解释中,不正确的是()A.冰融化为水——分子没有改变,分子间的间隔发生变化B.用警犬搜救地震中被埋人员——分子在不断运动C.氢分子是由氢原子构成的——分子比原子大D.酒精温度计测较高温度时——温度升高,分子间隔增大C课 堂 达 标2.下列变化中,构成物质的分子没有变化的是()A.隔夜的米饭变馊B.酒精灯忘记盖帽,长时间酒精变少C.氢气燃烧生成水D.过氧化氢分解生成水和氧气B找发生物理变化的选项3.有关分子与原子的说法正确的是( )A.分子可分,而原子在任何情况下不可再分B.分子可直接构成物质,而原子要先构成分子才能构成物质C.分子能保持物质的化学性质,原子不能保持物质的化学性质D.分子在化学变化中可分解成原子,这些原子又可重新组合构成新的分子D4.下列变化能证明分子在化学反应中可分的是( )。
A.铁矿石磨成粉末
B.碘受热升华
C.加热水有水蒸气生成
D.过氧化氢分解生成水和氧气
D
找发生化学变化的选项
5.在学习分子和原子的知识后,四位同学对它们的区别作了如下发言,正确的是( )A.小倩说:“区别在于是否在不停地运动。”B.小丹说:“区别在于化学反应中是否可分。”C.小鑫说:“区别在于是否能够构成物质。”D.小娜说:“区别在于分子和原子的大小和质量都不同。”B6.下列有关分子与原子的说法不正确的是( )A.分子不同性质不同B.有些物质是由原子构成的C.分子在不断运动D.干冰升华时分子间的间隔不变D 7.下列关于原子的叙述正确的是 ( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子中不存在电荷,因而原子不带电
A.②③④ B.①②④
C.①③⑤ D.①②③④⑤
A
8.某原子的质子数为26,中子数比质子数多4,
则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
C
9.构成氧原子的微粒有( )
A.8个质子,8个中子,16个电子
B.8个质子,8个电子
C.8个质子,8个中子,8个电子
D.8个原子核,8个中子,8个电子
C
谢 谢 观 看
第二章 空气、物质的构成
2.3 构成物质的微观粒子(Ⅱ)——原子和离子
第二章 空气、物质的构成
第1课时
1.原子的定义。
2.知道原子、离子也是构成物质的微粒。
3.理解分子、原子的区别和联系。
4.简单了解原子的结构。
学 习 目 标
讨论
当物质发生变化时,构成物质的分子会如何变化呢?
自 主 探 究
由分子构成的物质,在物理变化中,分子本身不发生改变,仍然保持该物质的化学性质;在化学变化中,分子本身发生改变,生成化学性质跟原物质不同的新物质分子。
通过氧化汞分解过程分析原子和分子的关系
实验步骤:将红色粉末氧化汞装在试管里加强热,收集产生的气体。
实验现象:红色粉末渐渐变化,试管内壁上出现银光闪闪的物质,收集的气体可以支持可燃物燃烧。
加热
氧化汞(HgO) 汞(Hg) + 氧气(O2)
实验结论:
重新组合
加热
氧化汞分子
分裂为原子
直接聚集成汞
每两个结合成分子,再由分子聚集成氧气
微观解释:
结论:
1.在化学变化中,氧化汞分子分解成为汞原子和氧原子,氧化汞分子是由汞原子和氧原子构成的,可见分子由原子构成。
2.有的物质可由原子直接构成,如金属汞是由汞原子直接构成的。
3.汞原子和氧原子本身在化学变化中没有变化,只是组合方式发生改变,它们重新组合后构成新的物质。
一、原子
1.定义:原子是化学变化中的最小微粒。
在化学变化中,分子本身发生变化,分解为原子,原子本身没有发生变化,只是重新组合成新分子,构成新物质。
分子可以分为原子,原子也可以构成分子。
由原子构成的物质如下:
所有金属,
少数带“石”字旁的非金属,
稀有气体,
如汞(Hg)是由汞原子构成。
如氩气由氩原子构成。
如碳由碳原子构成。
如氩气(Ar)、氖气(Ne)。
如汞(Hg)、铜(Cu)、镁(Mg)、铁(Fe)。
如碳(C)、硅(Si)。
2.原子也是构成物质的一种微粒
3.原子的基本性质
(1)原子的质量和体积都很小;
(2)原子都在不断的运动着;
(3)原子间有间隔;
(4)同种物质原子的性质相同,不同种物质原子的性质不同。
在化学变化中,分子可以分成原子,而原子不能再分。
4.分子、原子的根本区别
分子和原子的比较
分子 原子
相似点 (1)分子的质量和体积都很小 (2)分子是不断运动的。温度升高,分子运动加快 (3)分子间有间隔 (4)同种分子,性质相同;不同的分子,性质不同 (1)原子的质量和体积都很小
(2)原子是不断运动的。温度升高,原子运动加快
(3)原子间有间隔
(4)同种原子,性质相同;不同的原子,性质不同
区别 在化学变化后,分子变成了新的分子 在化学变化前后,原子的种类、大小、性质都不变
联系 分子由原子构成 原子是构成分子的粒子,也是直接构成物质的一种粒子
注意 分子和原子都可以直接构成物质。分子与构成这种分子的原子相比,分子要大些。但不能笼统认为分子比原子大。 空气中的物质 构成该物质的分子 构成该分子的原子
氮气(N2)
氧气(O2)
二氧化(CO2)
水蒸气(H2O)
稀有气体(He、Ne、Ar等) 氮分子
氮原子
氧分子
氧原子
二氧化碳分子
氧原子、碳原子
水分子
氢原子、氧原子
它们的一个分子由相应的各一个原子构成
检查站
问题
原子是化学变化中的最小微粒,原子还能再分吗
二、原子的构成
原子核
高速运动的电子
原子的内部是什么样子呢?
1897年汤姆生发现电子
卢瑟福和他的助手做了著名的α粒子散射实验
英国科学家
卢瑟福
(E.Rutherford,1871~1937)
卢瑟福实验
α粒子发射源
1911年著名物理学家卢瑟福做了著名的卢瑟福实验,用一束带正电的质量比电子大很多的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔并不改变原来的方向,但也有一小部分改变了原来的方向,甚至有极少数α粒子被反弹了回来。
金
箔
由此可得出的结论有:
(1)原子不是实心的,内部有很大部分是空的。
(2)原子内部存在着带正电的组成部分,α粒子受到斥力而改变了原有的运动路径。
(3)原子内部存在着的带正电部分是实心的,且所占空间很小。
原子
原子核
(+)
核外电子(-)
质子(+)
中子
每个质子带一个单位的正电荷
不带电
每个电子带一个单位的负电荷
所带正电荷数称为核电荷数
核电荷数=质子数=核外电子数
1.原子的构成
原子种类 核电荷数 原子核 核外电子数
质子数 中子数 氢(H) 1 1 0 1
氦(He) 2 2 2 2
氮(N) 7 7 7 7
氧(O) 8 8 8 8
铁(Fe) 26 26 30 26
铀(U-235) 92 92 143 92
分析下表可以获得哪些信息?
1.不同种类的原子,其核电荷数、质子数是不同的。
2.原子的核内质子数与中子数不一定相同。
3.同种原子其核电荷数=质子数=核外电子数。
通过上表分析可知:同一种原子中,其原子核里的质子数和核外电子数相等,所带电量相等且电性相反,故整个原子不显电性。
不一定所有的原子核内都有中子
一个氧原子
原子核
电子
氧原子的构成
原子核
子中
子 质
以碳原子为例描述原子的构成
其中6个质子和6个中子构成了原子核作为原子的中心,而6个电子在核外一定空间内绕核做高速运动。
已知一种碳原子的构成粒子是6个质子,6个中子和6个电子。请描述原子的构成情况。
(1)能直接构成物质的粒子有:
(2)在化学变化中最小的粒子有:
(3)不显电性的粒子有:
(4)带正电的粒子有:
(5)带负电的粒子有:
(6)质量最小的粒子有:
(7)构成原子的微粒有:
(8)构成原子核的微粒有:
分子 原子
原子
分子 原子 中子
质子
电子
电子
质子 中子 电子
质子 中子
在分子、原子、质子、中子、电子这些粒子中,选择合适的答案,填在空格上。
练一练
检查站
我国早已启动“嫦娥工程”探月计划。2020年12月17日,嫦娥五号带着1731克月球样本返回地球,宣告我国探月工程“绕、落、回”三步走战略圆满完成。月球上含有丰富的核聚变染料——“氦-3(3He)”。已知“碳-13(13C)”是指原子核内含有6个质子、7个中子的碳原子,则3He所指的氦原子,核内含有_____质子,_____中子,核外有_____电子。
1
2
2
1.下列现象的微观解释中,不正确的是()A.冰融化为水——分子没有改变,分子间的间隔发生变化B.用警犬搜救地震中被埋人员——分子在不断运动C.氢分子是由氢原子构成的——分子比原子大D.酒精温度计测较高温度时——温度升高,分子间隔增大C课 堂 达 标2.下列变化中,构成物质的分子没有变化的是()A.隔夜的米饭变馊B.酒精灯忘记盖帽,长时间酒精变少C.氢气燃烧生成水D.过氧化氢分解生成水和氧气B找发生物理变化的选项3.有关分子与原子的说法正确的是( )A.分子可分,而原子在任何情况下不可再分B.分子可直接构成物质,而原子要先构成分子才能构成物质C.分子能保持物质的化学性质,原子不能保持物质的化学性质D.分子在化学变化中可分解成原子,这些原子又可重新组合构成新的分子D4.下列变化能证明分子在化学反应中可分的是( )。
A.铁矿石磨成粉末
B.碘受热升华
C.加热水有水蒸气生成
D.过氧化氢分解生成水和氧气
D
找发生化学变化的选项
5.在学习分子和原子的知识后,四位同学对它们的区别作了如下发言,正确的是( )A.小倩说:“区别在于是否在不停地运动。”B.小丹说:“区别在于化学反应中是否可分。”C.小鑫说:“区别在于是否能够构成物质。”D.小娜说:“区别在于分子和原子的大小和质量都不同。”B6.下列有关分子与原子的说法不正确的是( )A.分子不同性质不同B.有些物质是由原子构成的C.分子在不断运动D.干冰升华时分子间的间隔不变D 7.下列关于原子的叙述正确的是 ( )
①一切原子都是由质子、中子和电子构成的
②原子在不停地运动
③原子是化学变化中的最小粒子
④原子由原子核和核外电子构成
⑤原子中不存在电荷,因而原子不带电
A.②③④ B.①②④
C.①③⑤ D.①②③④⑤
A
8.某原子的质子数为26,中子数比质子数多4,
则该原子中所含微粒总数为( )
A.26 B.56 C.82 D.86
C
9.构成氧原子的微粒有( )
A.8个质子,8个中子,16个电子
B.8个质子,8个电子
C.8个质子,8个中子,8个电子
D.8个原子核,8个中子,8个电子
C
谢 谢 观 看
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
