化学人教版(2019)选择性必修1 3.3.1盐类的水解 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.3.1盐类的水解 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-11 21:21:09 | ||
图片预览








文档简介
(共26张PPT)
第1讲 盐类的水解
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
视频导入
为什么Na2CO3可被当作“碱”使用呢?
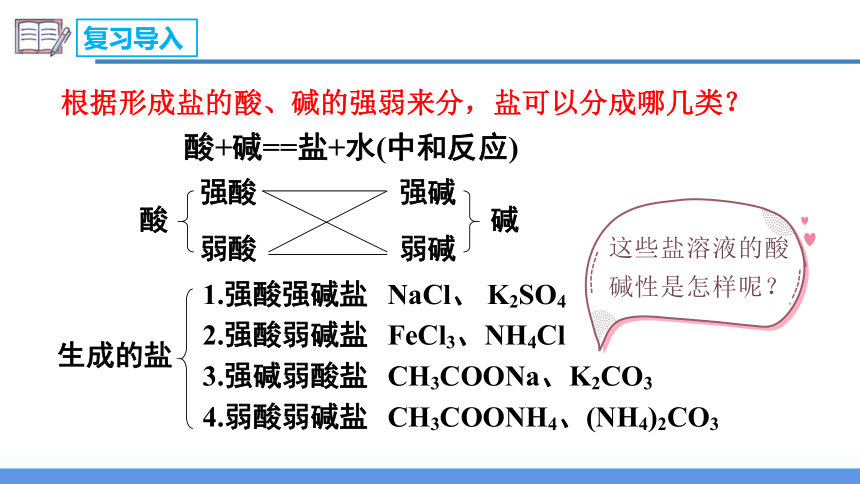
复习导入
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
这些盐溶液的酸碱性是怎样呢?
模块一 盐溶液的酸碱性
一、盐溶液的酸碱性
一、盐溶液的酸碱性
盐溶液 盐的类型 酸碱性
NaCl溶液
KNO3溶液 NH4Cl溶液
(NH4) 2SO4溶液 Na2CO3溶液
CH3COONa溶液 中性
碱性
酸性
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
谁强显谁性,同强显中性
什么原因呢?
模块二 盐溶液呈现不同酸碱性的原因
二、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。
酸性 碱性 中性
c(H+)>c(OH-) c(H+)二、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
(对水的电离平衡无影响)
NaCl Cl– + Na+
=
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NaCl溶液
二、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NH4+、Cl–、H+、OH–、H2O、NH3·H2O
生成NH3·H2O
c(H+) c(OH–)
>
酸性
二、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
酸性
(促进水的电离)
NH4Cl + H2O HCl + NH3·H2O
总反应:
离子方程式:
NH4+ + H2O H+ + NH3·H2O
二、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
Na+、CH3COO–、H+、OH–、H2O、CH3COOH
生成CH3COOH
c(H+) c(OH–)
<
碱性
二、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
碱性
(促进水的电离)
CH3COONa + H2O CH3COOH + NaOH
总反应:
离子方程式:
CH3COO– + H2O CH3COOH + OH–
二、盐溶液呈现不同酸碱性的原因
1.盐类的水解
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成弱电解质的反应,叫做盐类的水解。
弱酸阴离子
或弱碱阳离子
弱酸或弱碱
二、盐溶液呈现不同酸碱性的原因
2.盐类水解的实质
在溶液中盐电离出来的弱酸根阴离子或弱碱阳离子与水电离出来的H+或OH -结合生成弱电解质,从而促进了水的电离平衡,增大了水的电离度。
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成
弱电解质
是中和反应的逆反应
二、盐溶液呈现不同酸碱性的原因
可逆、微弱、吸热,存在水解平衡状态
有弱才水解,无弱不水解;
都弱都水解,越弱越水解;
谁强显谁性,同强显中性。
3.盐类水解的特点
4.盐类水解的规律
二、盐溶液呈现不同酸碱性的原因
CO32– + H2O HCO3– + OH–
Na2CO3溶液
第一步水解:
第二步水解:
HCO3– + H2O H2CO3 + OH–
第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小
不会放出CO2 气体
二、盐溶液呈现不同酸碱性的原因
微提醒
第一步水解程度比第二步水解程度大得多(与电离类似),以第一步为主,绝对不能两步合并写。
盐类水解(单一离子水解)一般是比较微弱的过程
通常用“ ”表示,水解生成的难溶物及气体,
一般不标“↓”或“↑”
多元弱酸的酸根离子水解是分步进行的
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
eg:Al3+ 和 HCO3- 在溶液中完全水解
+
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
H2O
两离子产生的 H+、OH-相反应生成水,促使两水解平衡均向右移动。当 H2CO3 浓度增大到一定程度时便放出 CO2,同时析出 Al(OH)3 沉淀,最终促使 HCO3-、Al3+ 均完全水解。
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
②Al3+与CO32-、HCO3- 、SO32-、HSO3-、
S2-、HS- 、AlO2-、SiO32-、ClO-
③NH4+ 与 SiO32-、 AlO2-等。
①Fe3+与CO32-、HCO3-、ClO-、SiO32-、AlO2-
弱酸弱碱盐发生完全水解,相互促进,通常用“ = ”
表示,水解生成的难溶物及气体,标“↓”或“↑”
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
④NH4+ 与 CH3COO-、 HCO3-、 S2-、CO32-
虽然发生相互促进,但水解程度较小,能大量共存。
二、盐溶液呈现不同酸碱性的原因
微提醒
酸式盐 (NaHA) 的酸碱性
①强酸的酸式盐只有电离而无水解,则呈酸性(如NaHSO4)
②弱酸的酸式盐既有电离又有水解,取决于两者相对大小
电离:HA- H+ + A2- (显酸性)
水解:HA- + H2O H2A + OH- (显碱性)
电离>水解,呈酸性:如HSO3-、H2PO4-
电离<水解,呈碱性:如HCO3-、HS-、 HPO42-
课堂检测
1.写出下列盐类水解的离子方程式:
①NaClO:_______________________________________________,
②(NH4)2SO4:______________________________________________,
③Na2CO3:______________________________________________,
④AlCl3:_________________________________________________。
ClO-+H2O HClO+OH-
NH4++H2O NH3·H2O+H+
CO32-+H2O HCO3-+OH-
Al3++3H2O Al(OH)3+3H+
课堂检测
2.下列有关盐类水解的说法不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液不一定呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
答案 D
课堂检测
3.下列关于盐溶液呈酸性或碱性的说法错误的是( )
A.盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离出的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
答案 C
谢谢欣赏
第1讲 盐类的水解
新人教版 化学 选择性必修一
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
视频导入
为什么Na2CO3可被当作“碱”使用呢?
复习导入
酸+碱==盐+水(中和反应)
酸
强酸
弱酸
弱碱
强碱
碱
生成的盐
1.强酸强碱盐
2.强酸弱碱盐
3.强碱弱酸盐
4.弱酸弱碱盐
NaCl、 K2SO4
FeCl3、NH4Cl
CH3COONH4、(NH4)2CO3
CH3COONa、K2CO3
根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?
这些盐溶液的酸碱性是怎样呢?
模块一 盐溶液的酸碱性
一、盐溶液的酸碱性
一、盐溶液的酸碱性
盐溶液 盐的类型 酸碱性
NaCl溶液
KNO3溶液 NH4Cl溶液
(NH4) 2SO4溶液 Na2CO3溶液
CH3COONa溶液 中性
碱性
酸性
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
谁强显谁性,同强显中性
什么原因呢?
模块二 盐溶液呈现不同酸碱性的原因
二、盐溶液呈现不同酸碱性的原因
H2O H+ + OH–
纯水中:
溶液呈酸性、碱性还是中性,取决于溶液中c(H+)和c(OH-)的相对大小。
酸性 碱性 中性
c(H+)>c(OH-) c(H+)
H2O H+ + OH–
Na+、Cl–、H+、OH–、H2O
无
c(H+) c(OH–)
=
中性
(对水的电离平衡无影响)
NaCl Cl– + Na+
=
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NaCl溶液
二、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
NH4+、Cl–、H+、OH–、H2O、NH3·H2O
生成NH3·H2O
c(H+) c(OH–)
>
酸性
二、盐溶液呈现不同酸碱性的原因
NH4Cl溶液
H2O H+ + OH–
NH4Cl Cl– + NH4+
=
NH3·H2O
酸性
(促进水的电离)
NH4Cl + H2O HCl + NH3·H2O
总反应:
离子方程式:
NH4+ + H2O H+ + NH3·H2O
二、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
盐溶液中的粒子:
离子间能否相互作用生成弱电解质:
c(H+)和c(OH-) 的相对大小:
Na+、CH3COO–、H+、OH–、H2O、CH3COOH
生成CH3COOH
c(H+) c(OH–)
<
碱性
二、盐溶液呈现不同酸碱性的原因
CH3COONa溶液
H2O OH– + H+
CH3COONa Na+ + CH3COO–
=
CH3COOH
碱性
(促进水的电离)
CH3COONa + H2O CH3COOH + NaOH
总反应:
离子方程式:
CH3COO– + H2O CH3COOH + OH–
二、盐溶液呈现不同酸碱性的原因
1.盐类的水解
在水溶液中,盐电离出来的离子跟水电离出来的 H+或 OH- 结合生成弱电解质的反应,叫做盐类的水解。
弱酸阴离子
或弱碱阳离子
弱酸或弱碱
二、盐溶液呈现不同酸碱性的原因
2.盐类水解的实质
在溶液中盐电离出来的弱酸根阴离子或弱碱阳离子与水电离出来的H+或OH -结合生成弱电解质,从而促进了水的电离平衡,增大了水的电离度。
弱酸阴离子
弱碱阳离子
结合H+
破坏了水的电离平衡
促进水的电离
c(H+)≠c(OH-)
使盐溶液呈现酸性或碱性
盐电离
结合OH-
生成
弱电解质
是中和反应的逆反应
二、盐溶液呈现不同酸碱性的原因
可逆、微弱、吸热,存在水解平衡状态
有弱才水解,无弱不水解;
都弱都水解,越弱越水解;
谁强显谁性,同强显中性。
3.盐类水解的特点
4.盐类水解的规律
二、盐溶液呈现不同酸碱性的原因
CO32– + H2O HCO3– + OH–
Na2CO3溶液
第一步水解:
第二步水解:
HCO3– + H2O H2CO3 + OH–
第二步水解程度很小
平衡时溶液中H2CO3 的浓度很小
不会放出CO2 气体
二、盐溶液呈现不同酸碱性的原因
微提醒
第一步水解程度比第二步水解程度大得多(与电离类似),以第一步为主,绝对不能两步合并写。
盐类水解(单一离子水解)一般是比较微弱的过程
通常用“ ”表示,水解生成的难溶物及气体,
一般不标“↓”或“↑”
多元弱酸的酸根离子水解是分步进行的
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
eg:Al3+ 和 HCO3- 在溶液中完全水解
+
Al3+ + 3H2O Al(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
H2O
两离子产生的 H+、OH-相反应生成水,促使两水解平衡均向右移动。当 H2CO3 浓度增大到一定程度时便放出 CO2,同时析出 Al(OH)3 沉淀,最终促使 HCO3-、Al3+ 均完全水解。
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
②Al3+与CO32-、HCO3- 、SO32-、HSO3-、
S2-、HS- 、AlO2-、SiO32-、ClO-
③NH4+ 与 SiO32-、 AlO2-等。
①Fe3+与CO32-、HCO3-、ClO-、SiO32-、AlO2-
弱酸弱碱盐发生完全水解,相互促进,通常用“ = ”
表示,水解生成的难溶物及气体,标“↓”或“↑”
二、盐溶液呈现不同酸碱性的原因
微提醒
弱酸弱碱盐发生双水解(完全水解)
④NH4+ 与 CH3COO-、 HCO3-、 S2-、CO32-
虽然发生相互促进,但水解程度较小,能大量共存。
二、盐溶液呈现不同酸碱性的原因
微提醒
酸式盐 (NaHA) 的酸碱性
①强酸的酸式盐只有电离而无水解,则呈酸性(如NaHSO4)
②弱酸的酸式盐既有电离又有水解,取决于两者相对大小
电离:HA- H+ + A2- (显酸性)
水解:HA- + H2O H2A + OH- (显碱性)
电离>水解,呈酸性:如HSO3-、H2PO4-
电离<水解,呈碱性:如HCO3-、HS-、 HPO42-
课堂检测
1.写出下列盐类水解的离子方程式:
①NaClO:_______________________________________________,
②(NH4)2SO4:______________________________________________,
③Na2CO3:______________________________________________,
④AlCl3:_________________________________________________。
ClO-+H2O HClO+OH-
NH4++H2O NH3·H2O+H+
CO32-+H2O HCO3-+OH-
Al3++3H2O Al(OH)3+3H+
课堂检测
2.下列有关盐类水解的说法不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆过程
C.盐类水解的结果使溶液不一定呈中性
D.Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
答案 D
课堂检测
3.下列关于盐溶液呈酸性或碱性的说法错误的是( )
A.盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离出的c(OH-)≠c(H+)
D.水电离出的H+和OH-与盐电离出的弱酸阴离子或弱碱阳离子结合,造成盐溶液呈碱性或酸性
答案 C
谢谢欣赏
