【轻松备课】沪教版(全国)化学九年级上 第4章 第1节 常见的化学反应——燃烧 第1课时 教学课件
文档属性
| 名称 | 【轻松备课】沪教版(全国)化学九年级上 第4章 第1节 常见的化学反应——燃烧 第1课时 教学课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 09:56:52 | ||
图片预览







文档简介
(共23张PPT)
第4章 认识化学变化
第1节 常见的化学反应——燃烧
第4章 认识化学变化
第 1课时
学 习 目 标
1.认识燃烧的条件,能用控制变量法对燃烧条件进行探究。
2.认识燃料完全燃烧的重要性。
3.燃烧可造福人类,又会给人类带来灾害,学会用辨证的观点看问题。
4.通过对燃烧条件的探究活动,进一步认识与体验科学探究的过程。
自 主 探 究
在人类发展的历史长河中,燃烧燃尽了茹毛饮血的历史,燃烧点燃了现代社会的辉煌。生活中处处离不开燃烧。说到火,我们就会想到燃烧,火是物质燃烧时的一种现象。燃烧能造福于人类,也可能给人类带来灾难。
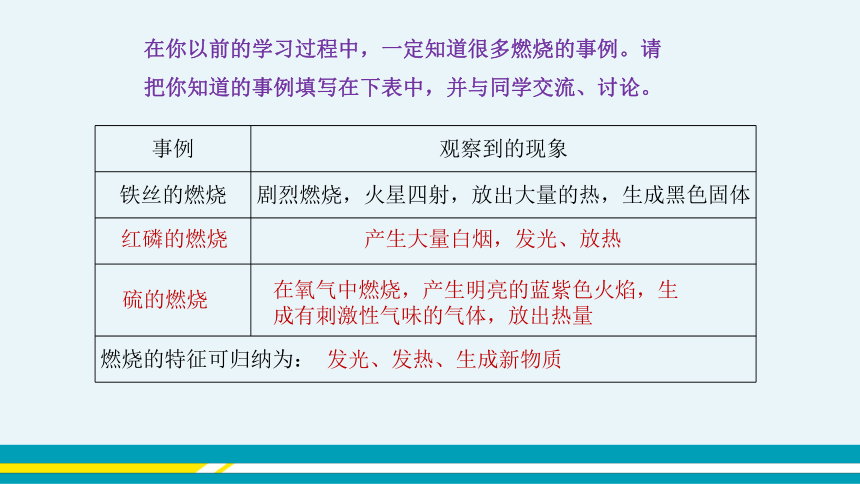
在你以前的学习过程中,一定知道很多燃烧的事例。请把你知道的事例填写在下表中,并与同学交流、讨论。
事例 观察到的现象
铁丝的燃烧 剧烈燃烧,火星四射,放出大量的热,生成黑色固体
燃烧的特征可归纳为: 红磷的燃烧
产生大量白烟,发光、放热
硫的燃烧
在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体,放出热量
发光、发热、生成新物质
一、燃烧
1.燃烧的定义
燃烧是一种发光、发热的剧烈的化学反应。
2.对燃烧的理解
(1)通常所说的燃烧是可燃物与氧气发生的发光、发热的剧烈的氧化反应。其实燃烧不一定要有氧气参加,如H2能在Cl2中燃烧,镁条(Mg)能在CO2中燃烧等。
(2)物质在燃烧过程中一定有发光、发热现象产生,但有发光、发热现
象产生的变化不一定是燃烧,如电灯通电后发光、发热。
(3)并不是所有物质燃烧都会有火焰产生,气体或蒸气燃烧时才会有火焰,如CO、H2在空气(或O2)中燃烧会产生火焰。有些可燃物受热后会气化为蒸气(如酒精、汽油、硫等),它们燃烧时也会产生火焰。熔、沸点很高的固体,如木炭、铁丝等燃烧时就没有火焰。
加热、点燃和燃烧的区别
(1)“加热”是指利用热源放出的热量使某个体系达到一定的温度范围,一般用酒精灯作为热源,且热源一般不与被加热物质直接接触。
(2)“点燃”是指物质能发生燃烧所必需的温度条件,点燃时热源与可燃物直接接触。
(3)“燃烧”是一种发光、发热的剧烈的化学反应,描述的是一种现象。
3.燃烧与人类生产、生活的关系
人们利用可燃物燃烧时发出的光和热来照明、取暖、烧煮食物、冶炼钢铁等,燃烧能够造福于人类,但一旦失控,也会给人类带来灾难。因此,我们要正确认识燃烧,科学地利用和控制燃烧,使燃烧更好地为人类服务。
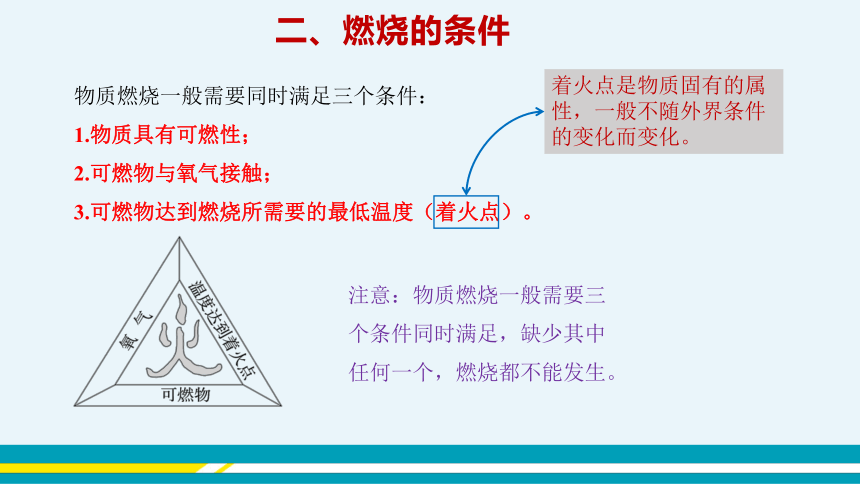
二、燃烧的条件
物质燃烧一般需要同时满足三个条件:
1.物质具有可燃性;
2.可燃物与氧气接触;
3.可燃物达到燃烧所需要的最低温度(着火点)。
注意:物质燃烧一般需要三个条件同时满足,缺少其中任何一个,燃烧都不能发生。
着火点是物质固有的属性,一般不随外界条件的变化而变化。
在日常生活中,燃烧现象屡见不鲜。你知道燃烧发生的条件吗
交流
与
讨论
答:燃烧需要同时满足三个条件:
(1)物质具有可燃性;
(2)与氧气接触;
(3)达到燃烧所需要的最低温度。
依据你的生活经验和已学知识,思考下列问题,试着总结燃烧发生的条件。
1.所有的物质都能燃烧吗
答:不是所有的物质都能燃烧。如纸张可以燃烧,而水却不能燃烧。
2.具有可燃性的物质在什么条件下能燃烧 用玻璃杯罩住燃着的小蜡烛,小蜡烛能长时间持续燃烧吗
答:具有可燃性的物质在空气或氧气中,温度达到燃烧所需的最低温度时就会燃烧。
用玻璃杯罩住燃着的小蜡烛,一段时间后,小蜡烛会因氧气不足而熄灭。
3.火柴、蜡烛、木条和煤,哪个比较容易被点燃 点燃它们的方式有什么差异 “点燃”在引发燃烧中起了什么作用
答:火柴最容易被点燃;火柴摩擦就能被点燃,蜡烛需要明火才能燃烧,木条需要持续加热,而煤则需要更高的温度;“点燃”在引发燃烧中的作用是使可燃物达到燃烧所需要的最低温度。
4.为什么在高温干燥的季节里,在没有明火的情况下,森林里也可能发生火灾
答:在高温干燥的季节,暴露在空气中的枯枝落叶达到了燃烧所需要的最低温度。
观察
与
思考
答:实验现象:火焰熄灭后,手绢没有变化。
实验解释:因为酒精燃烧释放的热量被手绢上的水吸收,水变成水蒸气带走大量热使手绢的温度达不到着火点,故手绢没有变化。
将20 mL 95%的酒精和10 mL水混合。将一块棉布手绢浸入配好的混合液中,浸透后取出,轻轻拧干,用坩埚钳夹持,在酒精灯上点燃,并轻轻抖动手绢。火焰熄灭后,你观察到浸透酒精的手绢发生了什么变化?你能解释其中的原因吗?
【教师拓展】
控制变量法探究燃烧条件
当有多种因素的变化都可能影响实验结果时,应明确哪种因素真正起了作用,这就必须控制其他因素不变而只改变这种因素,从而考查该因素对实验结果所起的作用,这种方法在科学探究中称为控制变量法。若要探究燃烧需要与氧气接触,则需要使用相同的可燃物白磷并控制温度相同,采用与氧气接触和不与氧气接触两种形式;若要探究燃烧需要达到可燃物的着火点,则需要控制温度相同并都与氧气接触,采用着火点不同的红磷和白磷。
三、完全燃烧与不完全燃烧
1.完全燃烧与不完全燃烧
(1)完全燃烧:当氧气充足时,可燃物完全燃烧,燃烧得快,放出的热量多。当含碳、氢元素的可燃物完全燃烧时,可燃物中的碳、氢元素分别生成二氧化碳和水。
如:碳 + 氧气(充足) 二氧化碳
C O2 CO2
(2)不完全燃烧:当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少。当含碳、氢元素的可燃物不完全燃烧时,可燃物中的部分碳、氢元素主要生成一氧化碳、碳氢化合物等有毒气体和微小的炭黑颗粒等物质。
如:碳 + 氧气(不充足) 一氧化碳
C O2 CO
2.物质完全燃烧的条件
(1)增大氧气的浓度;
(2)增大可燃物跟氧气的接触面积。
3.燃料完全燃烧的意义
(1)使有限的能源发挥最大的作用。通过计算煤、石油、天然气的使用年限,知道节约能源的必要性。
(2)降低环境污染的程度。现在使用的燃料中含有碳元素,这些燃料燃烧不充分时会产生大量的一氧化碳气体。一氧化碳气体有毒,会污染环境,危害人体健康。当固体燃料不充分燃烧时,还会增加烟尘的排放而加重环境污染。
交流
与
讨论
在日常生活中,你也许见过这样的情景:液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节;学校、工厂等单位使用的锅炉要用风机鼓风。你知道其中的道理吗
答:液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节,目的是保证氧气充足,使燃料充分燃烧。
用风机给锅炉鼓风能加速空气流动,增大煤与氧气的接触面积,使煤燃烧更充分。
请观察老师演示的蜡烛不完全燃烧的实验(教材第94页图4-3),并与同学交流你的看法。
答:玻璃片上有黑色物质生成,蜡烛不完全燃烧有炭黑生成。
4.一氧化碳的性质
(1)一氧化碳的物理性质
无色、无味的气体,难溶于水,标准状况下密度是1.25 g/L,比空气略小。不能用排空气法收集一氧化碳。
(2)一氧化碳的化学性质
①可燃性:一氧化碳燃烧火焰呈蓝色,燃烧放出大量的热。反应的文字表达式如下:
②还原性:一氧化碳在加热的条件下能将金属氧化物还原为金属单质,是冶炼金属的原料。
③毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去输氧能力而中毒。
一氧化碳 + 氧气 二氧化碳
CO O2 CO2
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.关于燃烧的叙述正确的是( )
A.燃烧一定有发光、发热的现象产生
B.燃烧一定有气体生成
C.有发光、发热的变化一定是燃烧
D.凡是燃烧的物质,一定有火焰产生
2.下列有关一氧化碳的说法错误的是( )
A.一氧化碳可以燃烧,可作气体燃料
B.一氧化碳有剧毒
C.一氧化碳能溶于水生成酸
D.一氧化碳能与血液中的血红蛋白结合
C
A
3.为探究物质的燃烧条件,某同学进行了如下图所示的实验,下列说法错误的是( )
A.白磷是可燃物,红磷不是可燃物
B.热水中的白磷不燃烧是因为没有与氧气接触
C.铜片上的红磷不燃烧是因为温度未达到它的着火点
D.实验中水的作用是提供热量及隔绝氧气
A
4.在下列蜡烛燃烧的实验中,对有关实验现象的描述错误的是( )
实验1 实验2 实验3 实验4
A.实验1中蜡烛火焰逐渐熄灭
B.实验2中白瓷板表面无明显变化
C.实验3中外焰部分的火柴杆最先炭化
D.实验4中烧杯内有气泡生成,蜡烛火焰熄灭
B
5.为了探究燃烧的条件,小军查阅资料得知:白磷的着火点为40 ℃,红磷的着火点为240 ℃,五氧化二磷能刺激人的呼吸道。他设计了如图所示的实验装置。将分别盛有少量白磷和少量红磷的两支试管,放到盛水的烧杯中,另将少量白磷直接投入烧杯的水中。观察到的实验现象如下:①试管中的白磷燃烧,产生大量的白烟;②试管中的红磷不燃烧;③烧杯中的白磷不燃烧。
(1)白磷燃烧的文字表达式为 。
(2)分析实验现象,得出结论:由现象①②得到的燃烧条件是 。
由现象①③得到的燃烧条件是 。
(3)请举一例说明燃烧必须有可燃物参加: 。
(4)请你根据小军查阅的资料和实验现象,指出他设计的装置的不足:
。
与氧气(或空气)接触
温度达到着火点
磷+氧气
五氧化二磷
关闭燃气灶阀门,火焰熄灭
白磷燃烧没有在密闭装置中进行,生成的五氧化二磷会污染空气
谢 谢 观 看
第4章 认识化学变化
第1节 常见的化学反应——燃烧
第4章 认识化学变化
第 1课时
学 习 目 标
1.认识燃烧的条件,能用控制变量法对燃烧条件进行探究。
2.认识燃料完全燃烧的重要性。
3.燃烧可造福人类,又会给人类带来灾害,学会用辨证的观点看问题。
4.通过对燃烧条件的探究活动,进一步认识与体验科学探究的过程。
自 主 探 究
在人类发展的历史长河中,燃烧燃尽了茹毛饮血的历史,燃烧点燃了现代社会的辉煌。生活中处处离不开燃烧。说到火,我们就会想到燃烧,火是物质燃烧时的一种现象。燃烧能造福于人类,也可能给人类带来灾难。
在你以前的学习过程中,一定知道很多燃烧的事例。请把你知道的事例填写在下表中,并与同学交流、讨论。
事例 观察到的现象
铁丝的燃烧 剧烈燃烧,火星四射,放出大量的热,生成黑色固体
燃烧的特征可归纳为: 红磷的燃烧
产生大量白烟,发光、放热
硫的燃烧
在氧气中燃烧,产生明亮的蓝紫色火焰,生成有刺激性气味的气体,放出热量
发光、发热、生成新物质
一、燃烧
1.燃烧的定义
燃烧是一种发光、发热的剧烈的化学反应。
2.对燃烧的理解
(1)通常所说的燃烧是可燃物与氧气发生的发光、发热的剧烈的氧化反应。其实燃烧不一定要有氧气参加,如H2能在Cl2中燃烧,镁条(Mg)能在CO2中燃烧等。
(2)物质在燃烧过程中一定有发光、发热现象产生,但有发光、发热现
象产生的变化不一定是燃烧,如电灯通电后发光、发热。
(3)并不是所有物质燃烧都会有火焰产生,气体或蒸气燃烧时才会有火焰,如CO、H2在空气(或O2)中燃烧会产生火焰。有些可燃物受热后会气化为蒸气(如酒精、汽油、硫等),它们燃烧时也会产生火焰。熔、沸点很高的固体,如木炭、铁丝等燃烧时就没有火焰。
加热、点燃和燃烧的区别
(1)“加热”是指利用热源放出的热量使某个体系达到一定的温度范围,一般用酒精灯作为热源,且热源一般不与被加热物质直接接触。
(2)“点燃”是指物质能发生燃烧所必需的温度条件,点燃时热源与可燃物直接接触。
(3)“燃烧”是一种发光、发热的剧烈的化学反应,描述的是一种现象。
3.燃烧与人类生产、生活的关系
人们利用可燃物燃烧时发出的光和热来照明、取暖、烧煮食物、冶炼钢铁等,燃烧能够造福于人类,但一旦失控,也会给人类带来灾难。因此,我们要正确认识燃烧,科学地利用和控制燃烧,使燃烧更好地为人类服务。
二、燃烧的条件
物质燃烧一般需要同时满足三个条件:
1.物质具有可燃性;
2.可燃物与氧气接触;
3.可燃物达到燃烧所需要的最低温度(着火点)。
注意:物质燃烧一般需要三个条件同时满足,缺少其中任何一个,燃烧都不能发生。
着火点是物质固有的属性,一般不随外界条件的变化而变化。
在日常生活中,燃烧现象屡见不鲜。你知道燃烧发生的条件吗
交流
与
讨论
答:燃烧需要同时满足三个条件:
(1)物质具有可燃性;
(2)与氧气接触;
(3)达到燃烧所需要的最低温度。
依据你的生活经验和已学知识,思考下列问题,试着总结燃烧发生的条件。
1.所有的物质都能燃烧吗
答:不是所有的物质都能燃烧。如纸张可以燃烧,而水却不能燃烧。
2.具有可燃性的物质在什么条件下能燃烧 用玻璃杯罩住燃着的小蜡烛,小蜡烛能长时间持续燃烧吗
答:具有可燃性的物质在空气或氧气中,温度达到燃烧所需的最低温度时就会燃烧。
用玻璃杯罩住燃着的小蜡烛,一段时间后,小蜡烛会因氧气不足而熄灭。
3.火柴、蜡烛、木条和煤,哪个比较容易被点燃 点燃它们的方式有什么差异 “点燃”在引发燃烧中起了什么作用
答:火柴最容易被点燃;火柴摩擦就能被点燃,蜡烛需要明火才能燃烧,木条需要持续加热,而煤则需要更高的温度;“点燃”在引发燃烧中的作用是使可燃物达到燃烧所需要的最低温度。
4.为什么在高温干燥的季节里,在没有明火的情况下,森林里也可能发生火灾
答:在高温干燥的季节,暴露在空气中的枯枝落叶达到了燃烧所需要的最低温度。
观察
与
思考
答:实验现象:火焰熄灭后,手绢没有变化。
实验解释:因为酒精燃烧释放的热量被手绢上的水吸收,水变成水蒸气带走大量热使手绢的温度达不到着火点,故手绢没有变化。
将20 mL 95%的酒精和10 mL水混合。将一块棉布手绢浸入配好的混合液中,浸透后取出,轻轻拧干,用坩埚钳夹持,在酒精灯上点燃,并轻轻抖动手绢。火焰熄灭后,你观察到浸透酒精的手绢发生了什么变化?你能解释其中的原因吗?
【教师拓展】
控制变量法探究燃烧条件
当有多种因素的变化都可能影响实验结果时,应明确哪种因素真正起了作用,这就必须控制其他因素不变而只改变这种因素,从而考查该因素对实验结果所起的作用,这种方法在科学探究中称为控制变量法。若要探究燃烧需要与氧气接触,则需要使用相同的可燃物白磷并控制温度相同,采用与氧气接触和不与氧气接触两种形式;若要探究燃烧需要达到可燃物的着火点,则需要控制温度相同并都与氧气接触,采用着火点不同的红磷和白磷。
三、完全燃烧与不完全燃烧
1.完全燃烧与不完全燃烧
(1)完全燃烧:当氧气充足时,可燃物完全燃烧,燃烧得快,放出的热量多。当含碳、氢元素的可燃物完全燃烧时,可燃物中的碳、氢元素分别生成二氧化碳和水。
如:碳 + 氧气(充足) 二氧化碳
C O2 CO2
(2)不完全燃烧:当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少。当含碳、氢元素的可燃物不完全燃烧时,可燃物中的部分碳、氢元素主要生成一氧化碳、碳氢化合物等有毒气体和微小的炭黑颗粒等物质。
如:碳 + 氧气(不充足) 一氧化碳
C O2 CO
2.物质完全燃烧的条件
(1)增大氧气的浓度;
(2)增大可燃物跟氧气的接触面积。
3.燃料完全燃烧的意义
(1)使有限的能源发挥最大的作用。通过计算煤、石油、天然气的使用年限,知道节约能源的必要性。
(2)降低环境污染的程度。现在使用的燃料中含有碳元素,这些燃料燃烧不充分时会产生大量的一氧化碳气体。一氧化碳气体有毒,会污染环境,危害人体健康。当固体燃料不充分燃烧时,还会增加烟尘的排放而加重环境污染。
交流
与
讨论
在日常生活中,你也许见过这样的情景:液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节;学校、工厂等单位使用的锅炉要用风机鼓风。你知道其中的道理吗
答:液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节,目的是保证氧气充足,使燃料充分燃烧。
用风机给锅炉鼓风能加速空气流动,增大煤与氧气的接触面积,使煤燃烧更充分。
请观察老师演示的蜡烛不完全燃烧的实验(教材第94页图4-3),并与同学交流你的看法。
答:玻璃片上有黑色物质生成,蜡烛不完全燃烧有炭黑生成。
4.一氧化碳的性质
(1)一氧化碳的物理性质
无色、无味的气体,难溶于水,标准状况下密度是1.25 g/L,比空气略小。不能用排空气法收集一氧化碳。
(2)一氧化碳的化学性质
①可燃性:一氧化碳燃烧火焰呈蓝色,燃烧放出大量的热。反应的文字表达式如下:
②还原性:一氧化碳在加热的条件下能将金属氧化物还原为金属单质,是冶炼金属的原料。
③毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去输氧能力而中毒。
一氧化碳 + 氧气 二氧化碳
CO O2 CO2
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.关于燃烧的叙述正确的是( )
A.燃烧一定有发光、发热的现象产生
B.燃烧一定有气体生成
C.有发光、发热的变化一定是燃烧
D.凡是燃烧的物质,一定有火焰产生
2.下列有关一氧化碳的说法错误的是( )
A.一氧化碳可以燃烧,可作气体燃料
B.一氧化碳有剧毒
C.一氧化碳能溶于水生成酸
D.一氧化碳能与血液中的血红蛋白结合
C
A
3.为探究物质的燃烧条件,某同学进行了如下图所示的实验,下列说法错误的是( )
A.白磷是可燃物,红磷不是可燃物
B.热水中的白磷不燃烧是因为没有与氧气接触
C.铜片上的红磷不燃烧是因为温度未达到它的着火点
D.实验中水的作用是提供热量及隔绝氧气
A
4.在下列蜡烛燃烧的实验中,对有关实验现象的描述错误的是( )
实验1 实验2 实验3 实验4
A.实验1中蜡烛火焰逐渐熄灭
B.实验2中白瓷板表面无明显变化
C.实验3中外焰部分的火柴杆最先炭化
D.实验4中烧杯内有气泡生成,蜡烛火焰熄灭
B
5.为了探究燃烧的条件,小军查阅资料得知:白磷的着火点为40 ℃,红磷的着火点为240 ℃,五氧化二磷能刺激人的呼吸道。他设计了如图所示的实验装置。将分别盛有少量白磷和少量红磷的两支试管,放到盛水的烧杯中,另将少量白磷直接投入烧杯的水中。观察到的实验现象如下:①试管中的白磷燃烧,产生大量的白烟;②试管中的红磷不燃烧;③烧杯中的白磷不燃烧。
(1)白磷燃烧的文字表达式为 。
(2)分析实验现象,得出结论:由现象①②得到的燃烧条件是 。
由现象①③得到的燃烧条件是 。
(3)请举一例说明燃烧必须有可燃物参加: 。
(4)请你根据小军查阅的资料和实验现象,指出他设计的装置的不足:
。
与氧气(或空气)接触
温度达到着火点
磷+氧气
五氧化二磷
关闭燃气灶阀门,火焰熄灭
白磷燃烧没有在密闭装置中进行,生成的五氧化二磷会污染空气
谢 谢 观 看
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
