【轻松备课】沪教版(全国)化学九年级上 第2章 第1节 性质活泼的氧气 第1课时 教学课件
文档属性
| 名称 | 【轻松备课】沪教版(全国)化学九年级上 第2章 第1节 性质活泼的氧气 第1课时 教学课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 09:56:52 | ||
图片预览







文档简介
(共22张PPT)
第2章 身边的化学物质
第1节 性质活泼的氧气
第2章 身边的化学物质
第 1 课 时
1.能说出氧气的主要物理性质。
2.知道氧气能与木炭、蜡烛、铁丝等物质发生化学反应,能描述反应中的现象。
3.了解氧气的主要用途。认识物质的用途决定物质的性质,认识化学与社会生活实际的密切关系。
学 习 目 标
自 主 探 究
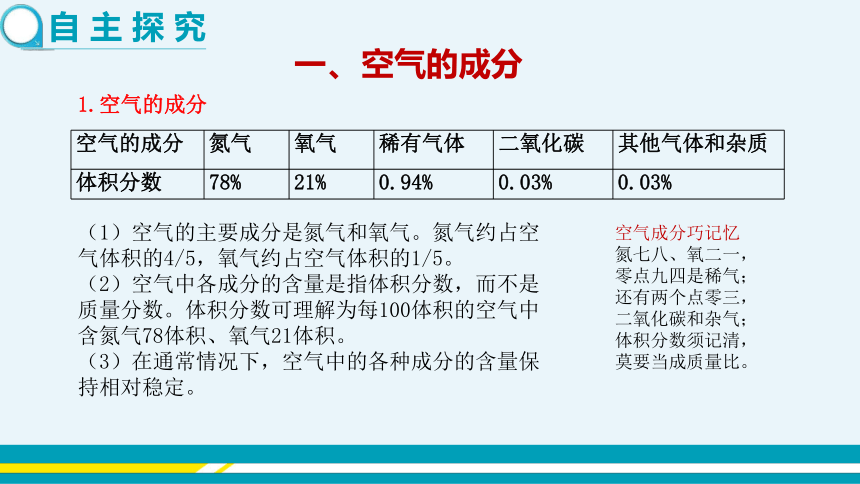
一、空气的成分
空气的成分 氮气 氧气 稀有气体 二氧化碳 其他气体和杂质
体积分数 78% 21% 0.94% 0.03% 0.03%
1.空气的成分
(1)空气的主要成分是氮气和氧气。氮气约占空气体积的4/5,氧气约占空气体积的1/5。
(2)空气中各成分的含量是指体积分数,而不是质量分数。体积分数可理解为每100体积的空气中含氮气78体积、氧气21体积。
(3)在通常情况下,空气中的各种成分的含量保持相对稳定。
空气成分巧记忆
氮七八、氧二一,
零点九四是稀气;
还有两个点零三,
二氧化碳和杂气;
体积分数须记清,
莫要当成质量比。
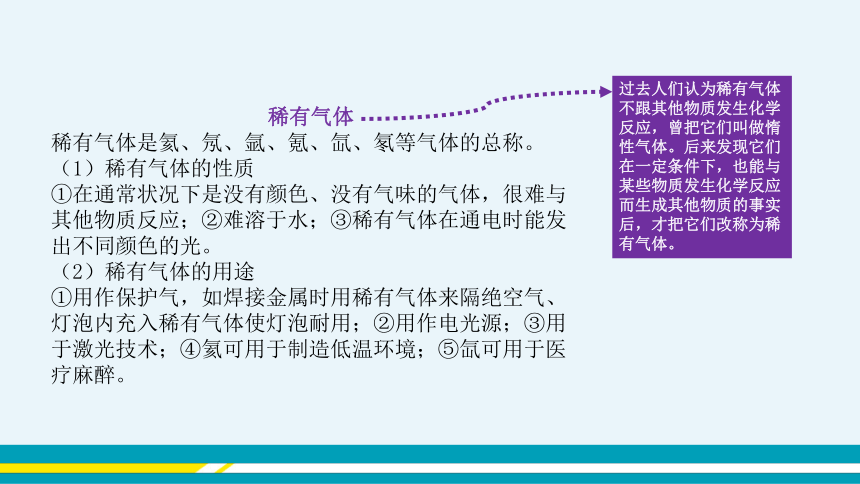
稀有气体
稀有气体是氦、氖、氩、氪、氙、氡等气体的总称。
(1)稀有气体的性质
①在通常状况下是没有颜色、没有气味的气体,很难与其他物质反应;②难溶于水;③稀有气体在通电时能发出不同颜色的光。
(2)稀有气体的用途
①用作保护气,如焊接金属时用稀有气体来隔绝空气、灯泡内充入稀有气体使灯泡耐用;②用作电光源;③用于激光技术;④氦可用于制造低温环境;⑤氙可用于医疗麻醉。
过去人们认为稀有气体不跟其他物质发生化学反应,曾把它们叫做惰性气体。后来发现它们在一定条件下,也能与某些物质发生化学反应而生成其他物质的事实后,才把它们改称为稀有气体。
2.氧气在自然界中的循环
(1)氧气的产生途径:主要是植物的光合作用。
(2)氧气的消耗途径:主要有动植物的呼吸作用、燃料的燃烧、金属的锈蚀等。
吸收二氧化碳,释放氧气。
通常情况下,空气中氧气不会大幅减少,这是因为绿色植物的光合作用所放出的氧气,弥补了自然界中氧气的消耗,正是这种持续、稳定的氧循环,维持了相对恒定的大气含氧量,不会使大气中氧气的含量越来越低。
空气中的氧气会不会增多或减少呢?
二、氧气的性质
1.氧气的物理性质
(1)在通常状况下,氧气是一种无色、无气味的气体。
(2)在标准状况下,氧气的密度为1.429g·L-1,空气的密度为 1.293 g·L-1,氧气的密度比空气的密度略大。
(3)氧气不易溶于水,在通常状况下,1L水中大约能溶解30 mL氧气。
(4)氧气的三态变化(1.01×105 Pa下)
描述气体状态时一定要指明条件。
不易溶于水不是不溶于水,只不过是溶解的量较少而已。
2.氧气的化学性质
(1)吸入生物体内的氧气能和体内许多物质发生复杂的化学反应,释放出能量,保证生命活动的需要。
(2)木炭、蜡烛、铁丝在氧气中的燃烧
活动
与
探究
①木炭在氧气中的燃烧
实验步骤:用坩埚钳夹住木炭在空气中点燃后,再将点燃的木炭放入燃烧匙,由上而下缓慢伸入集满氧气的集气瓶中。
实验现象:在空气中燃烧持续红热;在氧气中燃烧更旺,发出白光;放出热量;生成的气体能使澄清石灰水变浑浊。
注意事项:做木炭在氧气中燃烧的实验时,将夹木炭的坩埚钳由上而下慢慢伸入是为了确保木炭和氧气充分反应,使现象明显,同时防止氧气受热从瓶口逸散出去。
木炭是灰黑色固体
点燃
文字表达式:碳+氧气 二氧化碳
②蜡烛在氧气中的燃烧
实验步骤:将蜡烛固定在燃烧匙内,在空气中点燃。将燃着的蜡烛由上而下缓慢伸入集满氧气的集气瓶中。
实验现象:在氧气中燃烧更旺,火焰明亮,发出白光;放出热量;集气瓶内壁上有水雾出现;生成能使澄清石灰水变浑浊的无色、无味气体。
注意事项:做蜡烛在氧气中燃烧的实验时,氧气应用向上排空气法收集,通过观察到水蒸气凝结在集气瓶内壁上证明有水生成。
文字表达式:石蜡+氧气 二氧化碳+水
点燃
②铁丝在氧气中的燃烧
实验步骤:在螺旋状的细铁丝末端系上火柴梗,用坩埚钳夹住铁丝并点燃末端的火柴梗,待火柴梗即将燃尽时,将它们由上而下缓慢伸入集满氧气的集气瓶中。预先在集气瓶底加少量水(或铺少量沙子)。
实验现象:在氧气中剧烈燃烧;火星四射;放出大量的热;生成黑色固体。
注意事项:
铁丝使用前打磨——目的是除锈。火柴的作用——预热引燃铁丝。
将铁丝绕成螺旋状——目的是增大铁丝的受热面积。
待火柴即将燃尽时再将铁丝伸入氧气瓶中——目的是防止火柴燃烧消耗过多氧气而使铁丝不能顺利燃烧。
预先在集气瓶中装少量水或在瓶底铺一薄层细沙——目的是防止熔化物溅落炸裂集气瓶底。燃着的铁丝不能碰到集气瓶内壁——目的是防止瓶壁炸裂。
文字表达式:铁丝+氧气 四氧化三铁
点燃
物质 红磷 硫
颜色状态 暗红色固体 淡黄色固体
反应现象 ①红磷在空气中燃烧产生大量白烟; ②放出热量; ③发出黄色火焰 ①在空气中燃烧发出微弱的淡蓝色火焰;②在氧气(O2)中燃烧发出明亮的蓝紫色火焰;③放出热量;④生成有刺激性气味的无色气体
文字表达式 磷+氧气 五氧化二磷 硫+氧气 二氧化硫
注意事项 五氧化二磷是白色固体,实验现象应描述为产生大量白烟 硫的用量不能过多,防止对空气造成污染;实验应在通风橱中进行(或在实验的集气瓶底部加少量水或碱液,吸收生成的二氧化硫)
红磷、硫在空气或氧气中的燃烧
小结:氧气是一种化学性质比较活泼的气体,在一定条件下,可以跟多种物质发生化学反应,同时放出热量。
3.氧化反应和缓慢氧化
(1)氧化反应:物质与氧气的反应称为氧化反应。
(2)氧化反应的分类:氧化反应可分为剧烈氧化反应(燃烧)和缓慢氧化反应。
剧烈氧化反应(燃烧) 缓慢氧化反应
概念 物质与氧气发生的剧烈的发热、发光的化学反应 物质与氧气发生的缓慢的、甚至不易被察觉的氧化反应
举例 木炭在氧气中燃烧、蜡烛燃烧等 动植物的新陈代谢、金属器皿的锈蚀、食物腐烂、有机肥的腐熟等
区别 反应的剧烈程度不同、单位时间内反应放出热量的多少不同 联系 都属于氧化反应,都放出热量 物质在氧气中燃烧实验的一般规律
(1)都需将可燃物在空气中点燃;(2)可燃物要由上到下缓慢伸入集气瓶中;(3)反应中都发光、发热;(4)氧气浓度越大,燃烧越剧烈。
4.化学实验现象的观察与描述
(1)
(2)
化学实验现象是指物质在变化中所表现出来的外部形态,而不是变化的实质。反应后的生成物是什么,就不属于现象的范畴了。
(3)描述实验现象时注意化学用语的准确性
①
②
规律总结:(1)描述物质的燃烧现象,一般为“一光(或火焰)、二热、三生成(物)”。例如镁带在空气中燃烧的现象为发出耀眼的白光,放出大量的热,生成白色固体,并伴有白烟。
(2)可燃物在氧气中燃烧要比在空气中更剧烈,有些物质能在氧气中燃烧,但不能在空气中燃烧,原因是空气中氧气浓度小。
(3)燃烧都是发光、发热的剧烈的化学反应,都能将化学能转化为光能和热能,因此描述现象时一定要说“放出大量热”这一共有的实验现象。
三、氧气的用途
氧气的用途是由氧气的性质决定的。氧气有易与其他物质发生反应并放出热量的性质,因此氧气的主要用途如下:
1.供给呼吸
如医疗急救、潜水、航空等。
氧气在生活、生产和科研方面应用广泛,是有利的一面,但物质的性质往往具有两面性,氧气也有其有害的一面,如频繁发生的火灾、钢铁制品的锈蚀、食物的氧化变质、塑料制品的老化等都与氧气有关。
2.支持燃烧
如燃料燃烧、炼钢、焊接和切割金属等。
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.空气中体积分数约为 21% 的气体是( )
A.氮气 B. 氧气
C. 二氧化碳 D. 稀有气体
B
2.如图所示表示氧气的几种用途,其中利用氧气能支持燃烧这一性质的是( )
A B C D
A
4.下列说法正确的是( )
A.绿色植物通过呼吸作用放出氧气
B.空气中氧气的质量分数约为21%
C.空气中各成分所占的比例是永恒不变的
D.空气是一种十分重要的天然资源
3.下列变化过程中,不包含缓慢氧化的是( )
A.动植物的呼吸 B.蔗糖的溶解
C.酒和醋的酿造 D.食物的腐烂
B
D
5.下列关于氧气物理性质的叙述正确的是( )
A.氧气易溶于水
B.氧气密度比空气略小
C.液态氧为无色液体
D.通常状况下,氧气是一种无色、无气味的气体
6.下列有关实验现象的描述,错误的是( )
A.木炭在氧气中燃烧,生成无色气体
B.硫在氧气中燃烧,发出淡蓝色火焰
C.红磷在空气中燃烧,产生大量白烟
D.铁丝在氧气中燃烧,火星四射,生成黑色固体
B
D
谢 谢 观 看
第2章 身边的化学物质
第1节 性质活泼的氧气
第2章 身边的化学物质
第 1 课 时
1.能说出氧气的主要物理性质。
2.知道氧气能与木炭、蜡烛、铁丝等物质发生化学反应,能描述反应中的现象。
3.了解氧气的主要用途。认识物质的用途决定物质的性质,认识化学与社会生活实际的密切关系。
学 习 目 标
自 主 探 究
一、空气的成分
空气的成分 氮气 氧气 稀有气体 二氧化碳 其他气体和杂质
体积分数 78% 21% 0.94% 0.03% 0.03%
1.空气的成分
(1)空气的主要成分是氮气和氧气。氮气约占空气体积的4/5,氧气约占空气体积的1/5。
(2)空气中各成分的含量是指体积分数,而不是质量分数。体积分数可理解为每100体积的空气中含氮气78体积、氧气21体积。
(3)在通常情况下,空气中的各种成分的含量保持相对稳定。
空气成分巧记忆
氮七八、氧二一,
零点九四是稀气;
还有两个点零三,
二氧化碳和杂气;
体积分数须记清,
莫要当成质量比。
稀有气体
稀有气体是氦、氖、氩、氪、氙、氡等气体的总称。
(1)稀有气体的性质
①在通常状况下是没有颜色、没有气味的气体,很难与其他物质反应;②难溶于水;③稀有气体在通电时能发出不同颜色的光。
(2)稀有气体的用途
①用作保护气,如焊接金属时用稀有气体来隔绝空气、灯泡内充入稀有气体使灯泡耐用;②用作电光源;③用于激光技术;④氦可用于制造低温环境;⑤氙可用于医疗麻醉。
过去人们认为稀有气体不跟其他物质发生化学反应,曾把它们叫做惰性气体。后来发现它们在一定条件下,也能与某些物质发生化学反应而生成其他物质的事实后,才把它们改称为稀有气体。
2.氧气在自然界中的循环
(1)氧气的产生途径:主要是植物的光合作用。
(2)氧气的消耗途径:主要有动植物的呼吸作用、燃料的燃烧、金属的锈蚀等。
吸收二氧化碳,释放氧气。
通常情况下,空气中氧气不会大幅减少,这是因为绿色植物的光合作用所放出的氧气,弥补了自然界中氧气的消耗,正是这种持续、稳定的氧循环,维持了相对恒定的大气含氧量,不会使大气中氧气的含量越来越低。
空气中的氧气会不会增多或减少呢?
二、氧气的性质
1.氧气的物理性质
(1)在通常状况下,氧气是一种无色、无气味的气体。
(2)在标准状况下,氧气的密度为1.429g·L-1,空气的密度为 1.293 g·L-1,氧气的密度比空气的密度略大。
(3)氧气不易溶于水,在通常状况下,1L水中大约能溶解30 mL氧气。
(4)氧气的三态变化(1.01×105 Pa下)
描述气体状态时一定要指明条件。
不易溶于水不是不溶于水,只不过是溶解的量较少而已。
2.氧气的化学性质
(1)吸入生物体内的氧气能和体内许多物质发生复杂的化学反应,释放出能量,保证生命活动的需要。
(2)木炭、蜡烛、铁丝在氧气中的燃烧
活动
与
探究
①木炭在氧气中的燃烧
实验步骤:用坩埚钳夹住木炭在空气中点燃后,再将点燃的木炭放入燃烧匙,由上而下缓慢伸入集满氧气的集气瓶中。
实验现象:在空气中燃烧持续红热;在氧气中燃烧更旺,发出白光;放出热量;生成的气体能使澄清石灰水变浑浊。
注意事项:做木炭在氧气中燃烧的实验时,将夹木炭的坩埚钳由上而下慢慢伸入是为了确保木炭和氧气充分反应,使现象明显,同时防止氧气受热从瓶口逸散出去。
木炭是灰黑色固体
点燃
文字表达式:碳+氧气 二氧化碳
②蜡烛在氧气中的燃烧
实验步骤:将蜡烛固定在燃烧匙内,在空气中点燃。将燃着的蜡烛由上而下缓慢伸入集满氧气的集气瓶中。
实验现象:在氧气中燃烧更旺,火焰明亮,发出白光;放出热量;集气瓶内壁上有水雾出现;生成能使澄清石灰水变浑浊的无色、无味气体。
注意事项:做蜡烛在氧气中燃烧的实验时,氧气应用向上排空气法收集,通过观察到水蒸气凝结在集气瓶内壁上证明有水生成。
文字表达式:石蜡+氧气 二氧化碳+水
点燃
②铁丝在氧气中的燃烧
实验步骤:在螺旋状的细铁丝末端系上火柴梗,用坩埚钳夹住铁丝并点燃末端的火柴梗,待火柴梗即将燃尽时,将它们由上而下缓慢伸入集满氧气的集气瓶中。预先在集气瓶底加少量水(或铺少量沙子)。
实验现象:在氧气中剧烈燃烧;火星四射;放出大量的热;生成黑色固体。
注意事项:
铁丝使用前打磨——目的是除锈。火柴的作用——预热引燃铁丝。
将铁丝绕成螺旋状——目的是增大铁丝的受热面积。
待火柴即将燃尽时再将铁丝伸入氧气瓶中——目的是防止火柴燃烧消耗过多氧气而使铁丝不能顺利燃烧。
预先在集气瓶中装少量水或在瓶底铺一薄层细沙——目的是防止熔化物溅落炸裂集气瓶底。燃着的铁丝不能碰到集气瓶内壁——目的是防止瓶壁炸裂。
文字表达式:铁丝+氧气 四氧化三铁
点燃
物质 红磷 硫
颜色状态 暗红色固体 淡黄色固体
反应现象 ①红磷在空气中燃烧产生大量白烟; ②放出热量; ③发出黄色火焰 ①在空气中燃烧发出微弱的淡蓝色火焰;②在氧气(O2)中燃烧发出明亮的蓝紫色火焰;③放出热量;④生成有刺激性气味的无色气体
文字表达式 磷+氧气 五氧化二磷 硫+氧气 二氧化硫
注意事项 五氧化二磷是白色固体,实验现象应描述为产生大量白烟 硫的用量不能过多,防止对空气造成污染;实验应在通风橱中进行(或在实验的集气瓶底部加少量水或碱液,吸收生成的二氧化硫)
红磷、硫在空气或氧气中的燃烧
小结:氧气是一种化学性质比较活泼的气体,在一定条件下,可以跟多种物质发生化学反应,同时放出热量。
3.氧化反应和缓慢氧化
(1)氧化反应:物质与氧气的反应称为氧化反应。
(2)氧化反应的分类:氧化反应可分为剧烈氧化反应(燃烧)和缓慢氧化反应。
剧烈氧化反应(燃烧) 缓慢氧化反应
概念 物质与氧气发生的剧烈的发热、发光的化学反应 物质与氧气发生的缓慢的、甚至不易被察觉的氧化反应
举例 木炭在氧气中燃烧、蜡烛燃烧等 动植物的新陈代谢、金属器皿的锈蚀、食物腐烂、有机肥的腐熟等
区别 反应的剧烈程度不同、单位时间内反应放出热量的多少不同 联系 都属于氧化反应,都放出热量 物质在氧气中燃烧实验的一般规律
(1)都需将可燃物在空气中点燃;(2)可燃物要由上到下缓慢伸入集气瓶中;(3)反应中都发光、发热;(4)氧气浓度越大,燃烧越剧烈。
4.化学实验现象的观察与描述
(1)
(2)
化学实验现象是指物质在变化中所表现出来的外部形态,而不是变化的实质。反应后的生成物是什么,就不属于现象的范畴了。
(3)描述实验现象时注意化学用语的准确性
①
②
规律总结:(1)描述物质的燃烧现象,一般为“一光(或火焰)、二热、三生成(物)”。例如镁带在空气中燃烧的现象为发出耀眼的白光,放出大量的热,生成白色固体,并伴有白烟。
(2)可燃物在氧气中燃烧要比在空气中更剧烈,有些物质能在氧气中燃烧,但不能在空气中燃烧,原因是空气中氧气浓度小。
(3)燃烧都是发光、发热的剧烈的化学反应,都能将化学能转化为光能和热能,因此描述现象时一定要说“放出大量热”这一共有的实验现象。
三、氧气的用途
氧气的用途是由氧气的性质决定的。氧气有易与其他物质发生反应并放出热量的性质,因此氧气的主要用途如下:
1.供给呼吸
如医疗急救、潜水、航空等。
氧气在生活、生产和科研方面应用广泛,是有利的一面,但物质的性质往往具有两面性,氧气也有其有害的一面,如频繁发生的火灾、钢铁制品的锈蚀、食物的氧化变质、塑料制品的老化等都与氧气有关。
2.支持燃烧
如燃料燃烧、炼钢、焊接和切割金属等。
本节课你学会了哪些知识?
收获了什么方法?
还有什么疑惑吗?
课 堂 达 标
1.空气中体积分数约为 21% 的气体是( )
A.氮气 B. 氧气
C. 二氧化碳 D. 稀有气体
B
2.如图所示表示氧气的几种用途,其中利用氧气能支持燃烧这一性质的是( )
A B C D
A
4.下列说法正确的是( )
A.绿色植物通过呼吸作用放出氧气
B.空气中氧气的质量分数约为21%
C.空气中各成分所占的比例是永恒不变的
D.空气是一种十分重要的天然资源
3.下列变化过程中,不包含缓慢氧化的是( )
A.动植物的呼吸 B.蔗糖的溶解
C.酒和醋的酿造 D.食物的腐烂
B
D
5.下列关于氧气物理性质的叙述正确的是( )
A.氧气易溶于水
B.氧气密度比空气略小
C.液态氧为无色液体
D.通常状况下,氧气是一种无色、无气味的气体
6.下列有关实验现象的描述,错误的是( )
A.木炭在氧气中燃烧,生成无色气体
B.硫在氧气中燃烧,发出淡蓝色火焰
C.红磷在空气中燃烧,产生大量白烟
D.铁丝在氧气中燃烧,火星四射,生成黑色固体
B
D
谢 谢 观 看
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
