湖南省株洲市炎陵县2023-2024学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 湖南省株洲市炎陵县2023-2024学年高二上学期10月月考化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 552.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 00:00:00 | ||
图片预览


文档简介
炎陵县2023-2024学年高二上学期10月月考
化学
一、单向选择(每小题3分)。
1.下列物质按强电解质、弱电解质、非电解质顺序排列正确的是( )
A.氯化钠、硫酸钡、水 B.氢氧化钠、氯水、铜
C.硫酸、硫化氢、氨气 D.硫酸亚铁、硝酸、二氧化碳
2.对于可逆反应3H2+N22NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是 ( )
A.增大压强 B.充入更多N2
C.使用高效催化剂 D.降低温度
3.下列关于电离常数的说法正确的是( )
A.电离常数随着弱电解质浓度的增大而增大
B.CH3COOH的电离常数表达式为Ka=
C.电离常数只受温度影响,与浓度无关
D.向CH3COOH溶液中加入少量CH3COONa固体,电离常数减小
4.下列有关反应热及相关知识的说法正确的是( )
A.的燃烧热热化学方程式是
B.已知转化过程C(石墨,s)=(金刚石,s) ,则石墨比金刚石更稳定
C.中和热测定实验中,应把稀硫酸缓慢并分次倒入NaOH溶液中并搅拌
D.锌与稀硫酸的反应是放热反应,放热反应在常温常压下均能自发进行
5.如图为等量和反应生成的微观示意图。下列说法正确的是( )
A.a>b
B.过程I断开化学键,放出热量
C.、、HCl中均只存在共价键
D.HCl具有的能量低于和具有的能量
6.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
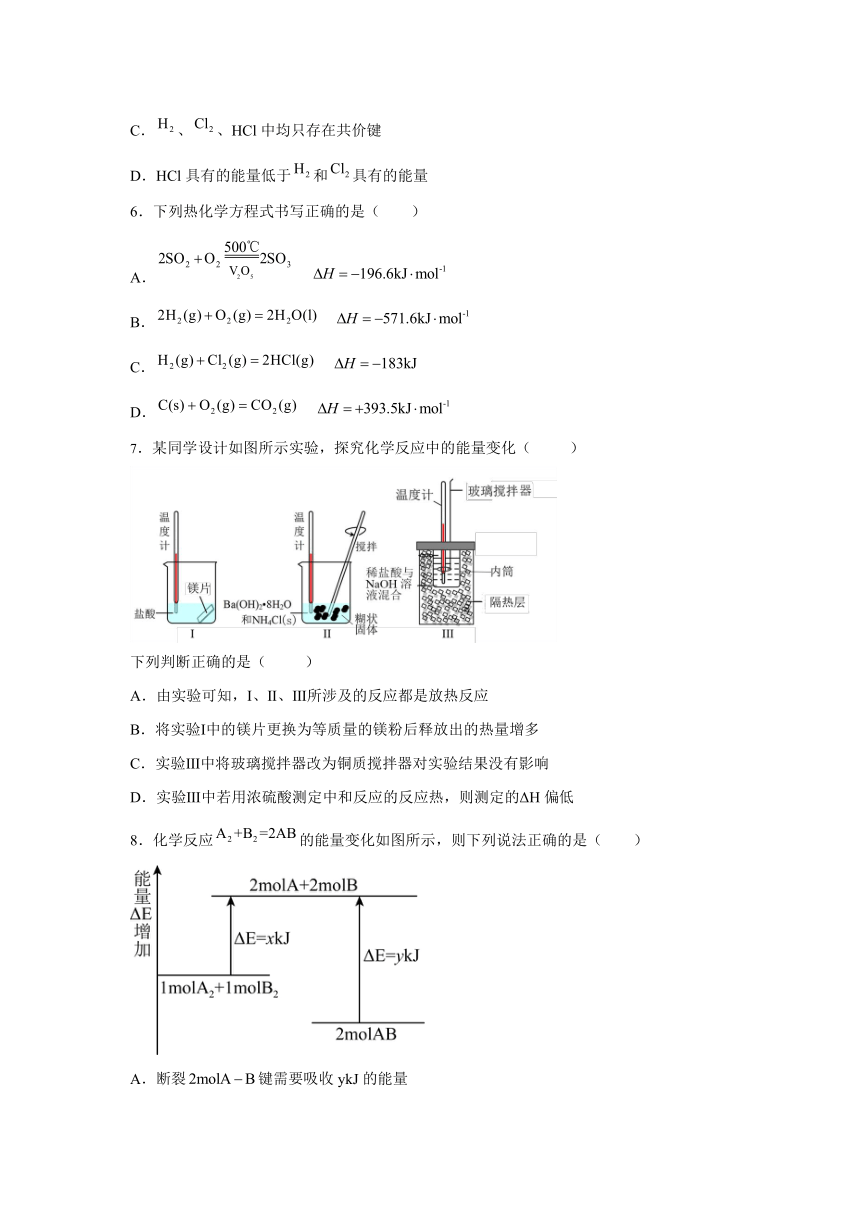
7.某同学设计如图所示实验,探究化学反应中的能量变化( )
下列判断正确的是( )
A.由实验可知,Ⅰ、Ⅱ、Ⅲ所涉及的反应都是放热反应
B.将实验Ⅰ中的镁片更换为等质量的镁粉后释放出的热量增多
C.实验Ⅲ中将玻璃搅拌器改为铜质搅拌器对实验结果没有影响
D.实验Ⅲ中若用浓硫酸测定中和反应的反应热,则测定的ΔH偏低
8.化学反应的能量变化如图所示,则下列说法正确的是( )
A.断裂键需要吸收ykJ的能量
B.断裂键和键能放出的能量
C.该反应是吸热反应
D.的总能量高于1molA2和1molB2的总能量
9. 在25℃时,用蒸馏水稀释1mol·L-1的醋酸溶液至0.01mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A. B.
C. D.
10. 常温下,若溶液中由水电离产生的c(OH-)=10-12mol·L-1,满足此条件的溶液中一定可以大量共存的是( )
A. Al3+、Na+、NO、CO B. K+、Na+、Cl-、NO
C. K+、Na+、Cl-、S2- D. K+、NH、SO、NO
11.在一定温度下的密闭容器中发生反应x A(g)+y B(g)z C(g) , 平衡后时测得A的浓度为0.5mol/L。保持温度不变,将容器的容积扩大到原来的2倍,再达平衡,测得A的浓度为0.3mol/L下列有关判断不正确的是( )
A. x + y > z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数减小
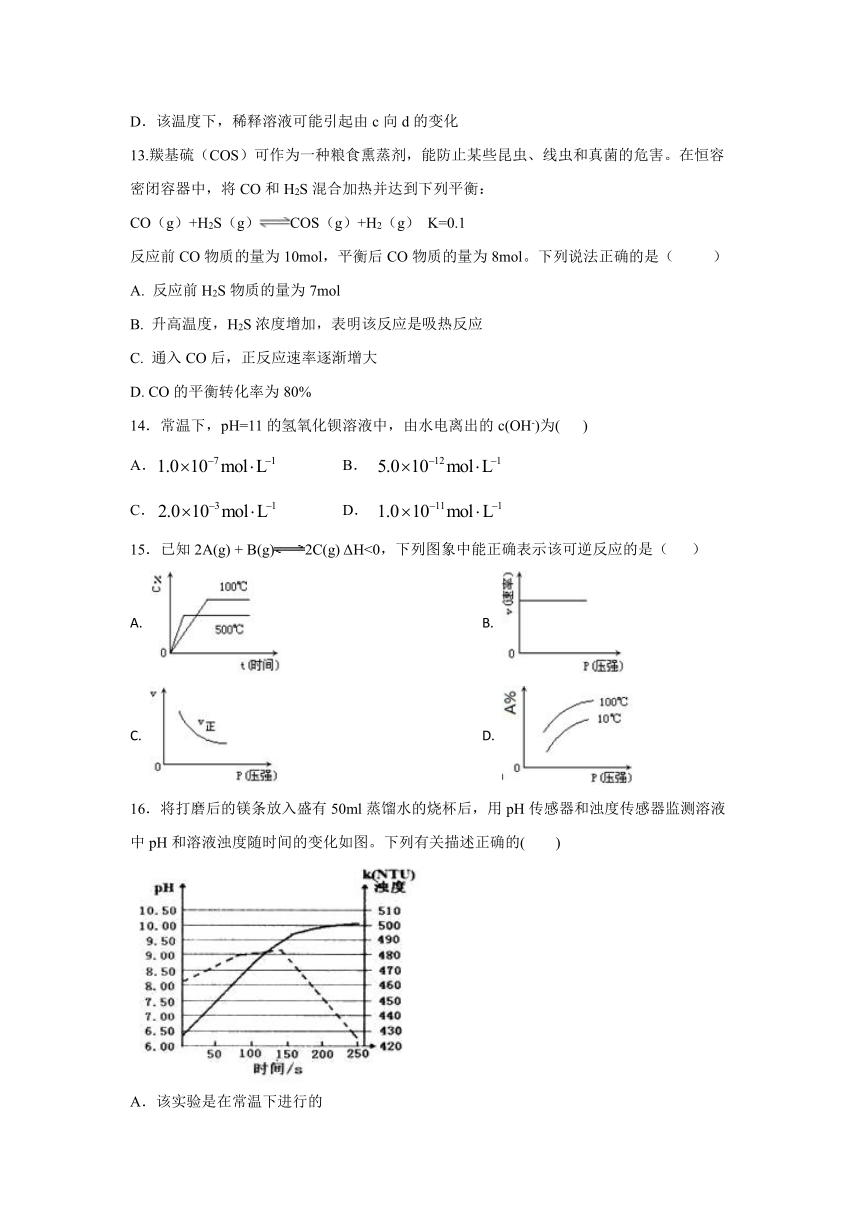
12.一定温度下,水溶液中和的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
13.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 反应前H2S物质的量为7mol
B. 升高温度,H2S浓度增加,表明该反应是吸热反应
C. 通入CO后,正反应速率逐渐增大
D. CO的平衡转化率为80%
14.常温下,pH=11的氢氧化钡溶液中,由水电离出的c(OH-)为( )
A. B.
C. D.
15.已知2A(g) + B(g)2C(g) ΔH<0,下列图象中能正确表示该可逆反应的是( )
A. B.
C. D.
16.将打磨后的镁条放入盛有50ml蒸馏水的烧杯后,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.150s后溶液浊度下降是因为生成的Mg(OH)2沉降
二、填空题。(52分)
17. (10分) H2S、SO2、NO和CO都是常见的大气污染物。目前治理汽车尾气是在催化剂条件下发生反应2NO+2CON2+2CO2。实验室模拟上述反应,已知t℃时在2 L恒容密闭容器中加入2 mol NO与1 mol CO气体,经10 min达到平衡,测得此时CO2的体积分数为。回答下列问题。
(1)这段时间内用CO表示的化学反应速率为 。
(2)该反应的平衡常数为 (结果精确至0.001)。
(3)平衡后再向密闭容器中通入0.4 mol CO和0.4 mol CO2,平衡将 (填“正向”“逆向”或“不”)移动。判断理由是 。
(4)若升温发现体系气体平均相对分子质量增大,则该反应的ΔH (填“>”“<”或“=”)0。
18.(14分)I.实验室利用下列方案探究影响化学反应速率的因素。回答下列问题:
编号 温度/℃ 溶液 酸性溶液
浓度/ 体积/ 浓度/ 体积/
① 25 0.10 2.0 0.010 4.0
② 25 0.20 2.0 0.010 4.0
③ 50 0.20 2.0 0.010 4.0
(1)实验时,分别量取溶液和酸性溶液,迅速混合并开始计时,通过测定____________________来判断反应的快慢。
(2)实验①和实验②是探究_____________对化学反应速率的影响,实验②和③是探究____________对化学反应速率的影响。
(3)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是______________ _______ ___。
II.在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示,请分析并回答如下问题:
(4)分析可知X为________________(填化学式)。
(5)时间段的温度为________________。
(6)时间段用SO2表示的化学反应速率为________ ________。
19.(14分) 2018年,美国退出了《巴黎协定》实行在工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究。实现可持续发展。
(1)以CO2(g)和H2(g)为原料合成甲醇,反应过程的能量变化如图所示
①补全上图:图中A处应填入__________。
②该反应需要加入钢-锌基催化剂。加入催化刺后。该反应的△H_______(填“变大”“变小”“不变”)
③为提高CH3OH的产率。理论上规采用的反应条件是________。(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(2)250℃,在恒容密团容器中由CO2催化氢化合成CH3OH(g)。如图为不同投料比(n(H2)/n(CO2)时某反应物X的平衡转化率变化曲线。反应物X是____(填CO2或H2)。
(3)甲醇可以替代汽油和柴油作为内燃机燃料。某研究者分别以甲醇和汽油做燃料。实骑侧得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。根据图信息分析,与汽油相比。甲醇作为燃料的优点是_______。
(4)250℃在容积为2.0L的恒容密闭容器中加入6molH2、2molCO2,和催化剂。10min时反应达到平衡,测得c(CH3OH)=0.75mol L-1
①10min的平均反应速率v(H2)=______;
②该温度下平衡常数K的数值为_____(结果保留两位小数)。
20.(14分)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol/L,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图Ⅰ所示。回答下列问题。
Ⅰ Ⅱ
(1)该反应的ΔH (填“<”“>”或“=”)0。
(2)压强p1、p2、p3由大到小的顺序为 ;压强为p2时,Y点处v正 (填“<”“>”或“=”)v逆。
(3)X点时CH4的转化率为 。
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率-浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图Ⅱ所示。
①与曲线v正~c(CH4)相对应的是图中曲线 (填“甲”或“乙”)。
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为 (填字母)。
答案
1.C
2.D
3.C
4.B
5.C
6.B
7.D
8.A
二、填空题。
17.(10分)
(1) 0.02 mol/(L·min) (2分)
(2) 0.069(2分)
(3) 逆向(2分) 通入气体后Q大于平衡常数(2分)
(4) >(2分)
18.(14分)
(1)溶液褪色时间(2分)
(2)浓度(2分) 温度(2分)
(3)反应生成了具有催化作用的物质,其中可能起催化作用为(2分)
(4)H2S(2分)
(5)300℃(2分)
(6)0.2/t1 mol L-1 min-1(2分)
19.(14分)
(1)①. 1molCO2(g)+3molH2(g)(2分) ②. 不变 (2分) ③. d (2分)
(2)CO2 (2分) (3)汽车的加速性能相同的情况下,CO 排放量低,污染小(2分)
(4)①. 0.225mol/(L·min) (2分) ②. 5.33 (2分)
20.(14分)
(1)> (2分)
(2)p3>p2>p1(2分) > (2分)
(3)80% (3分)
(4)①乙 (2分)
②B、F (3分)
化学
一、单向选择(每小题3分)。
1.下列物质按强电解质、弱电解质、非电解质顺序排列正确的是( )
A.氯化钠、硫酸钡、水 B.氢氧化钠、氯水、铜
C.硫酸、硫化氢、氨气 D.硫酸亚铁、硝酸、二氧化碳
2.对于可逆反应3H2+N22NH3,下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是 ( )
A.增大压强 B.充入更多N2
C.使用高效催化剂 D.降低温度
3.下列关于电离常数的说法正确的是( )
A.电离常数随着弱电解质浓度的增大而增大
B.CH3COOH的电离常数表达式为Ka=
C.电离常数只受温度影响,与浓度无关
D.向CH3COOH溶液中加入少量CH3COONa固体,电离常数减小
4.下列有关反应热及相关知识的说法正确的是( )
A.的燃烧热热化学方程式是
B.已知转化过程C(石墨,s)=(金刚石,s) ,则石墨比金刚石更稳定
C.中和热测定实验中,应把稀硫酸缓慢并分次倒入NaOH溶液中并搅拌
D.锌与稀硫酸的反应是放热反应,放热反应在常温常压下均能自发进行
5.如图为等量和反应生成的微观示意图。下列说法正确的是( )
A.a>b
B.过程I断开化学键,放出热量
C.、、HCl中均只存在共价键
D.HCl具有的能量低于和具有的能量
6.下列热化学方程式书写正确的是( )
A.
B.
C.
D.
7.某同学设计如图所示实验,探究化学反应中的能量变化( )
下列判断正确的是( )
A.由实验可知,Ⅰ、Ⅱ、Ⅲ所涉及的反应都是放热反应
B.将实验Ⅰ中的镁片更换为等质量的镁粉后释放出的热量增多
C.实验Ⅲ中将玻璃搅拌器改为铜质搅拌器对实验结果没有影响
D.实验Ⅲ中若用浓硫酸测定中和反应的反应热,则测定的ΔH偏低
8.化学反应的能量变化如图所示,则下列说法正确的是( )
A.断裂键需要吸收ykJ的能量
B.断裂键和键能放出的能量
C.该反应是吸热反应
D.的总能量高于1molA2和1molB2的总能量
9. 在25℃时,用蒸馏水稀释1mol·L-1的醋酸溶液至0.01mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A. B.
C. D.
10. 常温下,若溶液中由水电离产生的c(OH-)=10-12mol·L-1,满足此条件的溶液中一定可以大量共存的是( )
A. Al3+、Na+、NO、CO B. K+、Na+、Cl-、NO
C. K+、Na+、Cl-、S2- D. K+、NH、SO、NO
11.在一定温度下的密闭容器中发生反应x A(g)+y B(g)z C(g) , 平衡后时测得A的浓度为0.5mol/L。保持温度不变,将容器的容积扩大到原来的2倍,再达平衡,测得A的浓度为0.3mol/L下列有关判断不正确的是( )
A. x + y > z B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数减小
12.一定温度下,水溶液中和的浓度变化曲线如图,下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
13.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 反应前H2S物质的量为7mol
B. 升高温度,H2S浓度增加,表明该反应是吸热反应
C. 通入CO后,正反应速率逐渐增大
D. CO的平衡转化率为80%
14.常温下,pH=11的氢氧化钡溶液中,由水电离出的c(OH-)为( )
A. B.
C. D.
15.已知2A(g) + B(g)2C(g) ΔH<0,下列图象中能正确表示该可逆反应的是( )
A. B.
C. D.
16.将打磨后的镁条放入盛有50ml蒸馏水的烧杯后,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.150s后溶液浊度下降是因为生成的Mg(OH)2沉降
二、填空题。(52分)
17. (10分) H2S、SO2、NO和CO都是常见的大气污染物。目前治理汽车尾气是在催化剂条件下发生反应2NO+2CON2+2CO2。实验室模拟上述反应,已知t℃时在2 L恒容密闭容器中加入2 mol NO与1 mol CO气体,经10 min达到平衡,测得此时CO2的体积分数为。回答下列问题。
(1)这段时间内用CO表示的化学反应速率为 。
(2)该反应的平衡常数为 (结果精确至0.001)。
(3)平衡后再向密闭容器中通入0.4 mol CO和0.4 mol CO2,平衡将 (填“正向”“逆向”或“不”)移动。判断理由是 。
(4)若升温发现体系气体平均相对分子质量增大,则该反应的ΔH (填“>”“<”或“=”)0。
18.(14分)I.实验室利用下列方案探究影响化学反应速率的因素。回答下列问题:
编号 温度/℃ 溶液 酸性溶液
浓度/ 体积/ 浓度/ 体积/
① 25 0.10 2.0 0.010 4.0
② 25 0.20 2.0 0.010 4.0
③ 50 0.20 2.0 0.010 4.0
(1)实验时,分别量取溶液和酸性溶液,迅速混合并开始计时,通过测定____________________来判断反应的快慢。
(2)实验①和实验②是探究_____________对化学反应速率的影响,实验②和③是探究____________对化学反应速率的影响。
(3)实验①和②起初反应均很慢,过了一会儿速率突然增大,可能原因是______________ _______ ___。
II.在恒容密闭容器中,用H2还原SO2,生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示,请分析并回答如下问题:
(4)分析可知X为________________(填化学式)。
(5)时间段的温度为________________。
(6)时间段用SO2表示的化学反应速率为________ ________。
19.(14分) 2018年,美国退出了《巴黎协定》实行在工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究。实现可持续发展。
(1)以CO2(g)和H2(g)为原料合成甲醇,反应过程的能量变化如图所示
①补全上图:图中A处应填入__________。
②该反应需要加入钢-锌基催化剂。加入催化刺后。该反应的△H_______(填“变大”“变小”“不变”)
③为提高CH3OH的产率。理论上规采用的反应条件是________。(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(2)250℃,在恒容密团容器中由CO2催化氢化合成CH3OH(g)。如图为不同投料比(n(H2)/n(CO2)时某反应物X的平衡转化率变化曲线。反应物X是____(填CO2或H2)。
(3)甲醇可以替代汽油和柴油作为内燃机燃料。某研究者分别以甲醇和汽油做燃料。实骑侧得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。根据图信息分析,与汽油相比。甲醇作为燃料的优点是_______。
(4)250℃在容积为2.0L的恒容密闭容器中加入6molH2、2molCO2,和催化剂。10min时反应达到平衡,测得c(CH3OH)=0.75mol L-1
①10min的平均反应速率v(H2)=______;
②该温度下平衡常数K的数值为_____(结果保留两位小数)。
20.(14分)在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0 mol/L,在一定条件下发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g)。测得平衡时CH4的体积分数与温度及压强的关系如图Ⅰ所示。回答下列问题。
Ⅰ Ⅱ
(1)该反应的ΔH (填“<”“>”或“=”)0。
(2)压强p1、p2、p3由大到小的顺序为 ;压强为p2时,Y点处v正 (填“<”“>”或“=”)v逆。
(3)X点时CH4的转化率为 。
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率-浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图Ⅱ所示。
①与曲线v正~c(CH4)相对应的是图中曲线 (填“甲”或“乙”)。
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为 (填字母)。
答案
1.C
2.D
3.C
4.B
5.C
6.B
7.D
8.A
二、填空题。
17.(10分)
(1) 0.02 mol/(L·min) (2分)
(2) 0.069(2分)
(3) 逆向(2分) 通入气体后Q大于平衡常数(2分)
(4) >(2分)
18.(14分)
(1)溶液褪色时间(2分)
(2)浓度(2分) 温度(2分)
(3)反应生成了具有催化作用的物质,其中可能起催化作用为(2分)
(4)H2S(2分)
(5)300℃(2分)
(6)0.2/t1 mol L-1 min-1(2分)
19.(14分)
(1)①. 1molCO2(g)+3molH2(g)(2分) ②. 不变 (2分) ③. d (2分)
(2)CO2 (2分) (3)汽车的加速性能相同的情况下,CO 排放量低,污染小(2分)
(4)①. 0.225mol/(L·min) (2分) ②. 5.33 (2分)
20.(14分)
(1)> (2分)
(2)p3>p2>p1(2分) > (2分)
(3)80% (3分)
(4)①乙 (2分)
②B、F (3分)
同课章节目录
