苏教版(2019)高中化学必修第二册 9.3.1金属材料的性能同步练习(含解析)
文档属性
| 名称 | 苏教版(2019)高中化学必修第二册 9.3.1金属材料的性能同步练习(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
9.3.1金属材料的性能同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
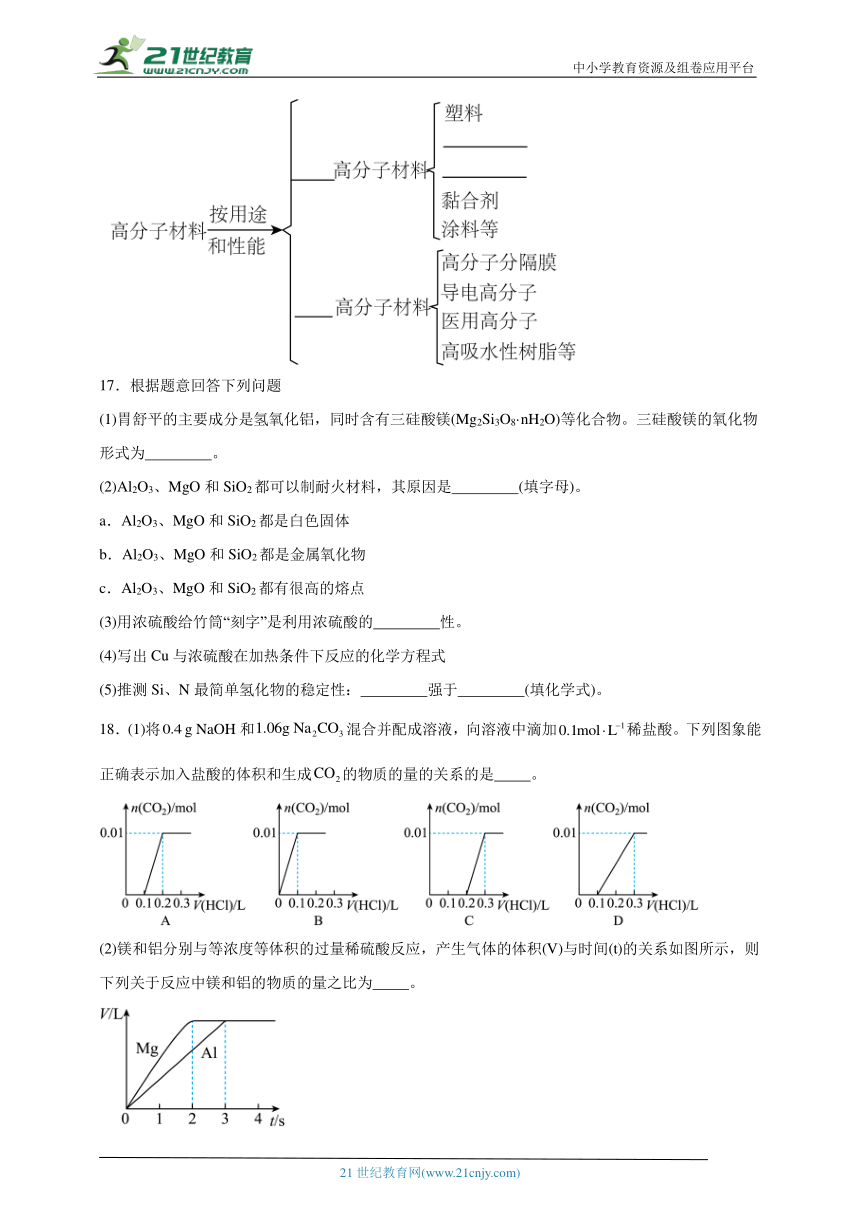
1.以含铁废渣(主要成分为,还含有等杂质)为原料制备的一种实验流程如图所示,下列说法正确的是
A.含铁废渣中的为红棕色,称为磁性氧化铁
B.通过图甲所示操作配制“酸浸”所需的的盐酸
C.用装置乙灼烧固体制
D.若制取,则含铁废渣中铁元素的质量分数为
2.可用于制造飞机部件的金属材料是
A.玻璃 B.橡胶 C.铝合金 D.塑料
3.化学与生活密切相关,下列说法不正确的是( )
A.中国天眼传输信息用的光纤材料是二氧化硅
B.人们常利用碘化银实现人工降雨
C.港珠澳大桥用到的合金材料,具有熔点高、强度大、密度小等性能
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
4.中华文化源远流长、博大精深。下列文物主要是由金属材料制成的是
文物
选项 A.鎏金高士图银杯 B.山居图扇面 C.兽首玛瑙杯 D.战国青瓷罐
A.A B.B C.C D.D
5.嫦娥五号月球采样、北斗导航系统实现信号全覆盖、国产航母福建舰下水、国产“C919”大飞机正式交付,都向世界展示了我国的科技实力,下列材料为金属材料的是
A.嫦娥五号探采回来的月壤“嫦娥石” B.北斗卫星中的光伏太阳能电池板 C.舰体材料中用到的耐腐蚀低磁合金钢 D.飞机机身使用的碳纤维
A.A B.B C.C D.D
6.化学与生活、社会密切相关,下列有关说法中不正确的是
A.为了防止蛋白质变性,疫苗等生物制剂应冷藏保存
B.中国天眼FAST用到的碳化硅是一种新型的有机高分子材料
C.高铁车大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D.2020年3月9日,发射了北斗系统的第五十四颗导航卫星,其计算机芯片材料是高纯度的硅
7.下列有关金属的应用与相应性质不对应的是
序号 金属 应用 相应性质
A 铝 包装用的铝箔 延展性好,易被空气中的O2氧化,表面形成致密的氧化膜
B 镁 镁合金做汽车部件 密度小,化学性质活泼
C 钨 白炽灯灯丝 熔点高,导电性好
D 锌 锌锰干电池 还原性强,导电性好
A.A B.B C.C D.D
8.下列说法不正确的是( )
A.充有钠蒸气的高压钠灯常用于道路和广场的照明
B.镁合金密度小、强度大,可用于制飞机的部件
C.纯碱是焙制糕点所用的发酵粉的主要成分,也是治疗胃酸过多的药剂
D.硫酸可用于金属矿石的处理和金属材料的表面清洗
9.党的二十大报告提出, 坚决打赢关键核心技术攻坚战。制造5G芯片的氮化铝属于
A.无机非金属材料 B.金属材料 C.有机高分子材料 D.复合材料
10.伍德合金的熔点低(仅为70℃),根据该性质可制作
A.厨具 B.保险丝 C.钢轨 D.导线
二、填空题
11.“钢精锅”是一种由铝合金制成的炊具,曾在家庭中被广泛使用。请简述“钢精锅”能长期使用的原因。
12.金属有许多特殊的物理性能,请将其用途与对应的性质用短线连接起来。
(1)油罐车行驶时罐内油品摇晃产生静电,易发生火险,故车尾常连着拖地的铁链 A.强度,硬度大
(2)黄金可制成比纸还薄的金箔 B.导电性好
(3)用铁锅烧菜 C.具有延展性
(4)用铝合金做门窗框架 D.有良好的导热性
13.金属及其材料在人类文明进步和社会发展中起着至关重要的作用。
(1)下列性质中,不属于金属的物理性质的是_______。
A.反应中易失去电子 B.良好的延展性
C.良好的导电性和传热性 D.有光泽
(2)下列属于金属材料的是_______。
A.塑料 B.陶瓷 C.金刚石 D.钢铁
(3)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是_______。
A.水银 B.青铜 C.白银 D.黄金
(4)室温下金属钠长期露置在空气中,最终将变为_______。
A.Na2O B.Na2O2 C.Na2CO3 D.NaOH
(5)为了检验FeCl2溶液是否被氧化,可向溶液中加入_______。
A.新制氯水 B.铁片 C.KSCN溶液 D.石蕊试液
(6)金属钠在空气中受热,先熔化成银色的小球,然后剧烈燃烧,写出发生反应的化学方程式: 。
(7)写出铁和水蒸气在高温下发生反应的方程式 。
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,写出反应过程中产生的现象 ,并依次写出发生反应的化学方程式 、 。
14.请阅读下列科普短文,并回答有关问题:
石墨烯是一种二维的单层石墨,这种神奇的材料是人类已知的最强材料,具有极其广泛的用途。石墨烯比①合成橡胶更有弹性,比②铝更轻,比③金刚石和④钢更硬。石墨烯还具有其他显著特征:石墨烯是完全不透⑤水的(对⑥空气也是如此);它比人的⑦头发薄10万倍;它的导电性比⑧铜强10倍以上;它的电迁移率比⑨单质硅快100倍。
(1)钢和空气均属于 (填“纯净物”或“混合物”),石墨和金刚石互为 (填“同素异形体”或“同位素”)。
(2)以上划线物质中属于金属材料的是 (填序号,下同),可以作为半导体材料的是 ,属于合成材料的是 。
15.2021年7月,第32届奥运会在东京召开,我国运动健儿在奥运会上取得了非凡的成绩。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式 。
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是 (填序号)。
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是 (填序号)。
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式 。
16.高分子材料的分类 。
17.根据题意回答下列问题
(1)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。三硅酸镁的氧化物形式为 。
(2)Al2O3、MgO和SiO2都可以制耐火材料,其原因是 (填字母)。
a.Al2O3、MgO和SiO2都是白色固体
b.Al2O3、MgO和SiO2都是金属氧化物
c.Al2O3、MgO和SiO2都有很高的熔点
(3)用浓硫酸给竹筒“刻字”是利用浓硫酸的 性。
(4)写出Cu与浓硫酸在加热条件下反应的化学方程式
(5)推测Si、N最简单氢化物的稳定性: 强于 (填化学式)。
18.(1)将g NaOH和混合并配成溶液,向溶液中滴加稀盐酸。下列图象能正确表示加入盐酸的体积和生成的物质的量的关系的是 。
(2)镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的物质的量之比为 。
(3)下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有 。
①向饱和碳酸钠溶液中通入至过量
②向胶体中逐滴滴加稀至过量
③向溶液中通入至过量
④向澄清石灰水中逐渐通入至过量
⑤向溶液中逐滴滴加至过量
⑥向溶液中逐滴滴加盐酸至过量
⑦向溶液中逐渐通入至过量
(4)在新制氯水参加的反应中,有如下几种情况:
①向氯化亚铁溶液中加入氯水,氯水中起作用的主要微粒是 ,反应的离子方程式为 。
②向硝酸银溶液中加入氯水,氯水中起作用的主要微粒是 。
③向氯水中滴加石蕊溶液,溶液变红,氯水中起作用的物质是 ,然后又褪色,起作用的物质是 。
19.结合Na、Al、Fe的有关性质,回答下列问题。
(1)金属钠是具有银白色金属光泽的固体,常温下能与冷水剧烈反应,其反应的化学方程式为 。
(2)铝既能与强酸反应,也能与强碱反应,且都放出H2,据此可区别铝和其他金属,请写出铝与氢氧化钠溶液反应的化学方程式 。
(3)如下图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体。
①有关反应的化学方程式是 。
②干燥管内可装入的试剂是 。
20.磁性材料A由两种元素组成,取2.960 g A在足量的空气中充分煅烧,得到2.400 g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强。请回答下列问题:
(1)溶液C也可用于处理污水,用离子方程式表示污水处理原理: 。
(2)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式: 。
(3)用离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因 。
三、实验题
21.根据实验室中测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写) 。
A.电子天平 B.试管夹 C.酒精灯 D.蒸发皿 E.坩埚 F.石棉网
除上述仪器外,还需要的仪器是 、 (任意填写二种)。
(2)某学生实验后得到表中数据:
加热前质量 加热后质量
m1(容器) m2(容器+晶体) m3(容器+无水硫酸铜)
5.400 g 7.900 g 7.100 g
①根据以上数据计算该硫酸铜晶体中结晶水x的值为 (精确到0.1)。
②该学生测定结果 (填“偏高”、“偏低”或“正确”)。
③从下列分析中选出该学生产生实验误差的原因可能是(填写字母) 。
a.没有进行恒重操作
b.加热后在干燥器中冷却至室温后称量
c.加热固体到白色后,露置在空气中冷却
d.加热过程中晶体有少量溅失
22.无水FeCl3常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和SiO2杂质)为原料制备无水FeCl3(s)。
已知:氯化亚砜()熔点-101 ℃,沸点76 ℃,易水解。
回答问题:
(1)操作①过滤所得的固体的主要成分为 。
(2)为避免引入新的杂质,试剂B可以选用 (填编号)。
A.溶液 B.水 C.水 D.溶液
(3)操作②的名称是 、 、过滤、洗涤,加热的同时通入HCl(g)的目的是 。
(4)取少量D晶体,溶于水并滴加KSCN溶液,现象是 。
(5)反应D→E的化学方程式为 。
(6)由D转化成E的过程中可能产生少量亚铁盐,写出一种可能的还原剂 ,并设计实验验证是该还原剂将Fe3+还原 。
23.钙钛矿是一类陶瓷卤化物,通式为,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物的方法如下:
实验用品:氯化锌、溴化铅、碳酸铯、十八烯、油酸、油胺。
已知:通过调节反应的温度,可以实现产物粒子的大小可控。
实验步骤:
将适量、、十八烯加入仪器中,抽气后通入,重复次;
将混合物升温至进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到,迅速注入铯前体,调节不同的温度,分钟后将溶液用水浴降至室温;
将步骤中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀;
将步骤中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为纳米晶体的分散系。
回答下列问题:
(1)仪器的名称是 。
(2)铯前体是由碳酸铯与油酸加热时反应得到的产物,反应的化学方程式是 。
(3)为什么步骤中要调节不同的温度 。
(4)步骤中乙酸甲酯的作用是 。
(5)证明步骤剩余固体中含有未反应完的不考虑溴元素干扰的操作是 。
(6)可用电感耦合等离子体质谱来确定产品中各元素的含量。取产品溶于稀硝酸,测得锌、铅,则的值是 。保留小数点后位
参考答案:
1.D
【分析】含铁废渣中加入1mol/L的盐酸酸浸,FeO、Fe2O3、Al2O3分别与盐酸反应生成Fe2+、Fe3+、Cu2+,然后通入氯气氧化,Fe2+被氧化为Fe3+,再加入过量的氢氧化钠溶液沉铁,Fe3+转化为Fe(OH)3沉淀,而不沉淀Cu2+,过滤得到氢氧化铁,最后灼烧Fe(OH)3获得Fe2O3,以此分析解答。
【详解】A.磁性氧化铁为Fe3O4,故A错误;
B.定容时胶头滴管不能伸入容量瓶中,图示操作方法不合理,故B错误;
C.灼烧Fe(OH)3固体制Fe2O3时需要坩埚中进行,不能在烧杯中灼烧,图示操作方法不合理,故C错误;
D.的物质的量为,m(Fe)= n(Fe) M=,根据铁元素质量守恒,mg铁废渣中铁元素的质量分数为,故D正确;
故选:D。
2.C
【详解】A.玻璃不属于金属材料,A错误;
B.橡胶不属于金属材料,B错误;
C.铝合金为金属材料,且可用于制造飞机部件,C正确;
D.塑料不属于金属材料,D错误;
故答案选C。
3.C
【详解】A.光纤材料的主要成分为二氧化硅,A正确;
B.利用碘化银能进行人工降雨,降雨时用高炮将碘化银炮弹发射到高空云团的零高度层以上,利用碘化银在高空分解生成银单质和碘单质,形成人工冰核,这些冰核经过水汽凝聚,形成冰晶,冰晶发展到一定程度,它们将通过零高度层下降,之后融化形成雨滴,所以碘化银是很好的人工降雨剂,B正确;
C.跨海大桥使用的合金材料,必须具有强度大、密度小、耐腐蚀等特性,不要求熔点高,C不正确;
D.半导体材料的主要成分为硅,D正确;
故选C。
4.A
【详解】A.鎏金高士图银杯的主要成分为金、银,是金属材料,故A正确;
B.山居图扇面的主要材质是纸,属于纤维素,故B错误;
C.兽首玛瑙杯的主要材质是二氧化硅,故C错误;
D.战国青瓷罐的主要材质是硅酸盐,故D错误;
故选A。
5.C
【详解】A.月壤“嫦娥石”属于非金属材料,故A错误;
B.太阳能电池板属于无机非金属材料,故B错误;
C.合金钢属于金属材料,故C正确;
D.碳纤维属于无机非金属材料,故D错误;
故选C。
6.B
【详解】A.高温下蛋白质易发生变性,为了防止蛋白质变性,疫苗等生物制剂应冷藏保存,A正确;
B.中国天眼FAST用到的碳化硅是一种新型的无机非金属材料,不是有机高分子材料,B错误;
C.铝合金材料具有质量轻、抗腐蚀能力强等优点,因此高铁车大部分材料是铝合金,C正确;
D.硅是常用的半导体材料,计算机芯片材料是高纯度的硅,D正确;答案选B。
7.B
【详解】A.金属铝的延展性好,易被空气中的氧气氧化,在金属铝的表面形成致密的氧化膜保护金属铝,所以金属铝可以制成包装用的铝箔,故A不符合题意;
B.镁合金做汽车部件是因为合金具有密度小、强度高的特性,与镁的化学性质活泼无关,故B符合题意;
C.钨是熔点高、导电性好的金属,所以钨常用于做白炽灯灯丝,故C不符合题意;
D.锌是还原性强导电性好的金属,所以锌常用于做锌锰干电池的原料,故D不符合题意;
故选B。
8.C
【详解】A. 钠的焰色反应为黄色,穿透力强,可用于广场、道路照明,故A说法正确;
B. 因为镁合金的密度小,机械性能好,强度大,常用于制造飞机的部件,故B说法正确;
C. 纯碱是Na2CO3,制作糕点所用的发酵粉的主要成分之一是NaHCO3,不是碳酸钠,碳酸钠水溶液碱性较强,不能用于治疗胃酸过多,故C说法错误;
D. 金属氧化物能溶解于硫酸,因此硫酸可用于金属矿石的处理,金属材料表面的清洗,故D说法正确;
答案:C。
9.A
【详解】A.氮化铝是一种新型陶瓷材料,属于无机非金属材料,故选A;
B.氮化铝是化合物,不含金属键,不属于金属材料,故不选B;
C.氮化铝不含碳元素,不属于有机物,故不选C;
D.氮化铝是一种新型陶瓷,不属于复合材料,故不选D;
选A。
10.B
【详解】伍德合金的熔点低(仅为70℃),可用于制造保险丝,故选B。
11.铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在
【详解】“钢精锅”是一种由铝合金制成的炊具,铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在;
故答案为:铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在。
12.(1)——B;(2)——C;(3)——D;(4)——A;
【详解】(1)金属具有导电性,油罐车行驶时罐内油品摇晃产生静电,易发生火险,故车尾常连着拖地的铁链,与大地相连;(2)金属具有延展性,黄金可制成比纸还薄的金箔;(3)金属具有导热性,故用铁锅烧菜;(4)合金的强度、硬度大,故用铝合金做门窗框架;
13.(1)A
(2)D
(3)B
(4)C
(5)C
(6)
(7)
(8) 生成白色沉淀,迅速变为灰绿色最终变为红褐色
【详解】(1)化学性质是在化学变化中体现出来的性质,例如可燃性、助燃性、氧化性等;物理性质是不需要发生化学变化就能体现出来的性质,例如色态味、熔沸点、密度、溶解性、挥发性、导电导热性、延展性、金属光泽等;
反应中易失去电子属于物质的化学性质;故选A;
(2)金属和合金属于金属材料;塑料属于合成材料;陶瓷、金刚石属于无机非金属材料;
故选D;
(3)合金是金属与金属或非金属熔合而成的具有金属特性的物质;水银、白银、黄金都属于纯金属,青铜为铜的合金;
故选B;
(4)钠和空气中氧气生成氧化钠,氧化钠和水生成氢氧化钠,氢氧化钠吸收二氧化碳生成碳酸钠;
故选C;
(5)亚铁离子被氧化生成铁离子,铁离子和KSCN反应生成红色溶液,检验FeCl2溶液是否被氧化,可向溶液中加入KSCN溶液;
故选C;
(6)钠和氧气点燃生成过氧化钠,;
(7)铁和水蒸气在高温下发生反应生成四氧化三铁、氢气,;
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,反应生成氢氧化亚铁白色沉淀,氢氧化亚铁迅速被空气中氧气氧化,变为灰绿色最终变为红褐色,反应为、。
14. 混合物 同素异形体 ②④⑧ ⑨ ①
【分析】结合物质的组成分析;结合金属材料、半导体材料和合成材料的概念分析。
【详解】(1)钢是铁碳合金,空气的主要成分是氮气和氧气,则二者均属于混合物;石墨和金刚石是碳元素组成的不同单质,互为同素异形体;
(2)以上划线物质中②铝、④钢、⑧铜均属于金属材料的是;硅的导电性介于导体和绝缘体之间,则⑨单质硅可以作为半导体材料;①合成橡胶是人工合成的有机高分子化合物属于合成材料。
【点睛】明确各种不同类型材料的概念是解题关键,其中金属材料包括铁、铝、铜等纯金属或合金,特别注意金属材料中可能含有非金属单质,特别注意半导体材料是晶体硅,而二氧化硅是光导纤维的主要成分,易混淆。
15.(1)
(2)A
(3)B
(4)(或)
【分析】(1)
氢气是可燃性气体,其燃烧产生H2O,该反应的化学方程式为:;
(2)
铅是金属单质,由Pb原子构成,故合理选项是A;
(3)
A.航空级铝合金跳板是合金,属于金属材料,A不符合题意; B.聚酯纤维泳衣属于有机合成材料,B符合题意;
C.金牌是金属材料,C不符合题意;
故合理选项是B;
(4)
①氯酸钾受撞击迅速分解产生氯化钾和氧气,反应方程式为;
红磷与O2在点燃时反应产生P2O5,反应的化学方程式为:。
16.通用 合成纤维 合成橡胶 功能
【解析】略
17. 2MgO·3SiO2·nH2O c 脱水 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O NH3 SiH4
【详解】(1)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。三硅酸镁的氧化物可以理解为MgO、SiO2,则表达形式为:2MgO·3SiO2·nH2O;
(2)Al2O3、MgO和SiO2都可以制耐火材料,其原因是Al2O3、MgO和SiO2都有很高的熔点;
(3)用浓硫酸给竹筒“刻字”是利用浓硫酸的脱水性,使竹简碳化;
(4)Cu与浓硫酸在加热条件下反应生成硫酸铜、水和二氧化硫,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(5)推测Si、N最简单氢化物的稳定性:NH3强于SiH4,因为非金属性越强,简单氢化物越稳定。
18. C ②④⑥ HCl HClO
【详解】(1)n(NaOH)===0.01mol,n(Na2CO3)===0.01mol;滴加盐酸的过程中,盐酸先和NaOH反应,再和Na2CO3发生反应生成NaHCO3,最后和NaHCO3反应生成CO2,由三个阶段的反应对应的关系式NaOH~HCl、Na2CO3~HCl~NaHCO3、NaHCO3~HCl~CO2可知,三个阶段均消耗0.01mol HCl(对应盐酸的体积均为0.1L),并生成0.01mol CO2,C符合题意,故选C;
(2)Mg、Al和硫酸反应的关系式分别为:Mg~H2、2Al~3H2;图中Mg、Al和稀硫酸反应生成的H2的体积一样多,则说明H2的物质的量一样多,生成1份H2,分别需要1份Mg、份Al,故镁和铝的物质的量之比为3:2;
(3)①向饱和Na2CO3溶液中那个通入CO2至过量,会生成NaHCO3,由于该温度下,NaHCO3的溶解度比Na2CO3的溶解度小,故在该操作中可以观察到有沉淀生成,但是沉淀不会溶解,①不符合题意;
②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量,胶体先聚沉,生成Fe(OH)3沉淀,Fe(OH)3沉淀再溶解于稀H2SO4中,②符合题意;
③向BaCl2溶液中通入CO2过量,始终无沉淀产生,③不符合题意;
④向澄清石灰水中逐渐通入CO2至过量,刚开始生成CaCO3沉淀,使澄清石灰水变浑浊,当Ca(OH)2反应完全后,CaCO3会和CO2、H2O继续反应生成可溶性的Ca(HCO3)2,沉淀又完全溶解,④符合题意;
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量,刚开始反应生成Al(OH)3沉淀和BaSO4沉淀,但是当Al3+完全沉淀时,随着Ba(OH)2的继续加入,Al(OH)3沉淀逐渐溶解,而BaSO4沉淀不会溶解,故可以观察到沉淀部分溶解,⑤不符合题意;
⑥向NaAlO2溶液中逐滴滴加盐酸至过量,刚开始反应生成Al(OH)3沉淀,但是当Al3+完全沉淀时,随着盐酸的继续加入,Al(OH)3沉淀逐渐溶解,⑥符合题意;
⑦向NaAlO2溶液中逐渐通入CO2至过量,反应生成Al(OH)3沉淀,由于Al(OH)3沉淀不会和CO2反应,故沉淀不会溶解,⑦不符合题意;
综上所述,符合题意的有②④⑥;
(4)①向氯化亚铁溶液中加入氯水,FeCl2会被氧化为FeCl3,氯水中起作用的主要微粒是Cl2,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
②向硝酸银溶液中加入氯水,可以观察到有白色沉淀生成,氯水中起主要作用的微粒是Cl-;
③向氯水中滴加石蕊溶液,溶液变红,是因为氯水中含有H+,其中H+主要来自于HCl的电离,故使石蕊变红的物质是HCl;然后又褪色,起作用的是HClO,因为该物质具有漂白性。
19. 2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+4H2OFe3O4+4H2 CaCl2或无水CuSO4
【详解】试题分析:(1)金属钠常温下能与冷水剧烈反应,其反应的化学方程式为2Na+2H2O=2NaOH+H2↑。(2)铝与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3)①反应的化学方程式是3Fe+4H2OFe3O4+4H2 ②干燥管内利用CaCl2或无水CuSO4吸水;
考点:考查钠、铝与铁的性质
20. Fe3+ + 3H2OFe(OH)3+ 3H+ 或Fe3+ + 3H2OFe(OH)3(胶体)+ 3H+ Fe3S4+3H2SO4===3H2S↑+3FeSO4+S↓ H2SO3+I2+H2O===SO42-+4H++2I-
【详解】试题分析:磁性材料A由两种元素组成,取2.960 g A在足量的空气中充分煅烧,得到2.400 g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色,说明棕黄色溶液C是氯化铁溶液,B为氧化铁。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强,可以推断D为二氧化硫,E为亚硫酸,亚硫酸可以被碘氧化为硫酸,碘被还原为氢碘酸,所以酸性增强。2.400 g红棕色氧化铁的物质的量为0.015mol,其中含铁0.03mol,铁元素的质量为1.68g,由铁元素守恒求得2.960 g A中含硫元素的质量为1.28g,S 的物质的量为0.04mol,所以A中的化学式为Fe3S4。
(1)氯化铁溶液可用于处理污水,用离子方程式表示污水处理原理为Fe3+ + 3H2OFe(OH)3+ 3H+ 或Fe3+ + 3H2OFe(OH)3(胶体)+ 3H+。
(2)化合物A能与稀硫酸反应,反应后得到浅绿色硫酸亚铁溶液,同时生成一种淡黄色不溶物硫和一种臭鸡蛋气味气体硫化氢,该反应的化学方程式为Fe3S4+3H2SO4===3H2S↑+3FeSO4+S↓。
(3)E中加足量碘的碘化钾溶液后溶液酸性增强的原因用离子方程式可表示为H2SO3+I2+H2O===SO42-+4H++2I-。
21.(1) ACE 玻璃棒 研钵(或干燥器)
(2) 4.2 偏低 ac
【详解】(1)测定CuSO4·nH2O的结晶水含量的步骤有:研钵中研磨固体物质、称量样品、在坩埚中加热、干燥器中冷却、称量无水硫酸铜质量、恒重等,所需仪器有:研钵、天平、坩埚(附带坩埚钳、泥三角、三脚架)、酒精灯、干燥器、玻璃棒等,不用的仪器为试管夹、蒸发皿、石棉网,故选ACE;还需要玻璃棒、研钵(或干燥器)等;
(2)①结晶水的质量m=m2(容器+晶体)-m3(容器+无水硫酸铜)=7.900g-7.100g=0.800g,无水硫酸铜的质量m=m3(容器+无水硫酸铜)-m1(容器)=7.100g-5.400g=1.700g,n(H2O)=≈0.0444mol,n(CuSO4) =≈0.010625mol,结晶水x=≈4.2。
②实验测定x的值为4.2,小于准确值5,故测定结果偏低;
③a.没有进行恒重操作,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,a符合题意;
b.加热后在干燥器中冷却至室温后称量,属于正确操作,无影响,b不符合题意;
c.加热固体到白色后,露置在空气中冷却,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,c符合题意;
d.加热过程中有少量晶体溅出,导致水的质量测定结果偏大,d不符合题意;
故选ac。
22.(1)碳和SiO2
(2)BD
(3) 蒸发浓缩 冷却结晶 防止Fe3+水解
(4)溶液变为血红色
(5)
(6) SO2 先加盐酸酸化,再加BaCl2溶液,产生白色沉淀,则是SO2将Fe3+还原
【分析】废铁屑(含有少量碳和SiO2杂质)加入盐酸,铁粉反应生成氯化亚铁,过滤除去少量碳和SiO2杂质,A(氯化亚铁)加入氧化剂B生成C(氯化铁),蒸发结晶生成,通入SOCl2生成FeCl3,以此来解析;
(1)
根据上述分析,操作①过滤所得的固体的主要成分为碳和SiO2杂质;
(2)
有分析可知,A(氯化亚铁)加入B生成C(氯化铁),铁由+2变成+3价化合价升高,被氧化,需要加入氧化剂,A、C都引入杂质离子,BD符合题意;
故选BD。
(3)
操作②氯化铁溶液在氯化氢气体的情况下得到FeCl3 6H2O,蒸发浓缩、冷却结晶;加热促进的水解,会生成氢氧化铁,故加入HCl(g)的目的是防止水解;
(4)
因Fe3++3SCN-=Fe(SCN)3(血红色),KSCN溶液遇Fe3+变为红色;
(5)
根据已知信息氯化亚砜熔点-101℃,沸点76℃,易水解,可得FeCl3 6H2O与SOCl2生成FeCl3的化学方程式为:FeCl3 6H2O+6SOCl2FeCl3+6SO2↑+12HCl;
(6)
可能反应中生成的二氧化硫将氯化铁还原为氯化亚铁,若二氧化硫作还原剂,则氧化产物为硫酸盐,故若加盐酸酸化,再加BaCl2溶液溶液,产生白色沉淀,则是二氧化硫作还原剂;
23.(1)三颈烧瓶
(2)
(3)得到不同大小的产物粒子
(4)溶解并除去未反应的油酸、油胺、十八烯;降低产物的溶解度
(5)取少量最后固体加入稀硝酸溶解,再加入硝酸银溶液,出现白色沉淀,说明剩余固体中含有未反应完的氯化锌
(6)0.22
【详解】(1)A的名称是三颈烧瓶。
(2)碳酸铯与油酸反应生成油酸铯、二氧化碳和水,方程式为
(3)根据已知:通过调节反应的温度,可以实现产物粒子的大小可控,故步骤②中要调节不同的温度是为了得到不同大小的产物粒子。
(4)乙酸甲酯作为有机溶剂,可以溶解并除去未反应的油酸、油胺、十八烯,同时降低产物的溶解度,便于析出。
(5)鉴别ZnCl2可用硝酸银溶液,故取少量最后固体加入稀硝酸溶解,再加入硝酸银溶液,出现白色沉淀,说明剩余固体中含有未反应完的氯化锌。
(6)由化学式,解之x=0.22。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
9.3.1金属材料的性能同步练习-苏教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.以含铁废渣(主要成分为,还含有等杂质)为原料制备的一种实验流程如图所示,下列说法正确的是
A.含铁废渣中的为红棕色,称为磁性氧化铁
B.通过图甲所示操作配制“酸浸”所需的的盐酸
C.用装置乙灼烧固体制
D.若制取,则含铁废渣中铁元素的质量分数为
2.可用于制造飞机部件的金属材料是
A.玻璃 B.橡胶 C.铝合金 D.塑料
3.化学与生活密切相关,下列说法不正确的是( )
A.中国天眼传输信息用的光纤材料是二氧化硅
B.人们常利用碘化银实现人工降雨
C.港珠澳大桥用到的合金材料,具有熔点高、强度大、密度小等性能
D.华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
4.中华文化源远流长、博大精深。下列文物主要是由金属材料制成的是
文物
选项 A.鎏金高士图银杯 B.山居图扇面 C.兽首玛瑙杯 D.战国青瓷罐
A.A B.B C.C D.D
5.嫦娥五号月球采样、北斗导航系统实现信号全覆盖、国产航母福建舰下水、国产“C919”大飞机正式交付,都向世界展示了我国的科技实力,下列材料为金属材料的是
A.嫦娥五号探采回来的月壤“嫦娥石” B.北斗卫星中的光伏太阳能电池板 C.舰体材料中用到的耐腐蚀低磁合金钢 D.飞机机身使用的碳纤维
A.A B.B C.C D.D
6.化学与生活、社会密切相关,下列有关说法中不正确的是
A.为了防止蛋白质变性,疫苗等生物制剂应冷藏保存
B.中国天眼FAST用到的碳化硅是一种新型的有机高分子材料
C.高铁车大部分材料是铝合金,铝合金材料具有质量轻、抗腐蚀能力强等优点
D.2020年3月9日,发射了北斗系统的第五十四颗导航卫星,其计算机芯片材料是高纯度的硅
7.下列有关金属的应用与相应性质不对应的是
序号 金属 应用 相应性质
A 铝 包装用的铝箔 延展性好,易被空气中的O2氧化,表面形成致密的氧化膜
B 镁 镁合金做汽车部件 密度小,化学性质活泼
C 钨 白炽灯灯丝 熔点高,导电性好
D 锌 锌锰干电池 还原性强,导电性好
A.A B.B C.C D.D
8.下列说法不正确的是( )
A.充有钠蒸气的高压钠灯常用于道路和广场的照明
B.镁合金密度小、强度大,可用于制飞机的部件
C.纯碱是焙制糕点所用的发酵粉的主要成分,也是治疗胃酸过多的药剂
D.硫酸可用于金属矿石的处理和金属材料的表面清洗
9.党的二十大报告提出, 坚决打赢关键核心技术攻坚战。制造5G芯片的氮化铝属于
A.无机非金属材料 B.金属材料 C.有机高分子材料 D.复合材料
10.伍德合金的熔点低(仅为70℃),根据该性质可制作
A.厨具 B.保险丝 C.钢轨 D.导线
二、填空题
11.“钢精锅”是一种由铝合金制成的炊具,曾在家庭中被广泛使用。请简述“钢精锅”能长期使用的原因。
12.金属有许多特殊的物理性能,请将其用途与对应的性质用短线连接起来。
(1)油罐车行驶时罐内油品摇晃产生静电,易发生火险,故车尾常连着拖地的铁链 A.强度,硬度大
(2)黄金可制成比纸还薄的金箔 B.导电性好
(3)用铁锅烧菜 C.具有延展性
(4)用铝合金做门窗框架 D.有良好的导热性
13.金属及其材料在人类文明进步和社会发展中起着至关重要的作用。
(1)下列性质中,不属于金属的物理性质的是_______。
A.反应中易失去电子 B.良好的延展性
C.良好的导电性和传热性 D.有光泽
(2)下列属于金属材料的是_______。
A.塑料 B.陶瓷 C.金刚石 D.钢铁
(3)合金具有许多优良的性能,我国C919大型飞机上就使用了大量新型材料铝合金。下列物质属于合金的是_______。
A.水银 B.青铜 C.白银 D.黄金
(4)室温下金属钠长期露置在空气中,最终将变为_______。
A.Na2O B.Na2O2 C.Na2CO3 D.NaOH
(5)为了检验FeCl2溶液是否被氧化,可向溶液中加入_______。
A.新制氯水 B.铁片 C.KSCN溶液 D.石蕊试液
(6)金属钠在空气中受热,先熔化成银色的小球,然后剧烈燃烧,写出发生反应的化学方程式: 。
(7)写出铁和水蒸气在高温下发生反应的方程式 。
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,写出反应过程中产生的现象 ,并依次写出发生反应的化学方程式 、 。
14.请阅读下列科普短文,并回答有关问题:
石墨烯是一种二维的单层石墨,这种神奇的材料是人类已知的最强材料,具有极其广泛的用途。石墨烯比①合成橡胶更有弹性,比②铝更轻,比③金刚石和④钢更硬。石墨烯还具有其他显著特征:石墨烯是完全不透⑤水的(对⑥空气也是如此);它比人的⑦头发薄10万倍;它的导电性比⑧铜强10倍以上;它的电迁移率比⑨单质硅快100倍。
(1)钢和空气均属于 (填“纯净物”或“混合物”),石墨和金刚石互为 (填“同素异形体”或“同位素”)。
(2)以上划线物质中属于金属材料的是 (填序号,下同),可以作为半导体材料的是 ,属于合成材料的是 。
15.2021年7月,第32届奥运会在东京召开,我国运动健儿在奥运会上取得了非凡的成绩。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式 。
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是 (填序号)。
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是 (填序号)。
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式 。
16.高分子材料的分类 。
17.根据题意回答下列问题
(1)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。三硅酸镁的氧化物形式为 。
(2)Al2O3、MgO和SiO2都可以制耐火材料,其原因是 (填字母)。
a.Al2O3、MgO和SiO2都是白色固体
b.Al2O3、MgO和SiO2都是金属氧化物
c.Al2O3、MgO和SiO2都有很高的熔点
(3)用浓硫酸给竹筒“刻字”是利用浓硫酸的 性。
(4)写出Cu与浓硫酸在加热条件下反应的化学方程式
(5)推测Si、N最简单氢化物的稳定性: 强于 (填化学式)。
18.(1)将g NaOH和混合并配成溶液,向溶液中滴加稀盐酸。下列图象能正确表示加入盐酸的体积和生成的物质的量的关系的是 。
(2)镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的物质的量之比为 。
(3)下列各项操作中符合“先出现沉淀后沉淀完全溶解”现象的有 。
①向饱和碳酸钠溶液中通入至过量
②向胶体中逐滴滴加稀至过量
③向溶液中通入至过量
④向澄清石灰水中逐渐通入至过量
⑤向溶液中逐滴滴加至过量
⑥向溶液中逐滴滴加盐酸至过量
⑦向溶液中逐渐通入至过量
(4)在新制氯水参加的反应中,有如下几种情况:
①向氯化亚铁溶液中加入氯水,氯水中起作用的主要微粒是 ,反应的离子方程式为 。
②向硝酸银溶液中加入氯水,氯水中起作用的主要微粒是 。
③向氯水中滴加石蕊溶液,溶液变红,氯水中起作用的物质是 ,然后又褪色,起作用的物质是 。
19.结合Na、Al、Fe的有关性质,回答下列问题。
(1)金属钠是具有银白色金属光泽的固体,常温下能与冷水剧烈反应,其反应的化学方程式为 。
(2)铝既能与强酸反应,也能与强碱反应,且都放出H2,据此可区别铝和其他金属,请写出铝与氢氧化钠溶液反应的化学方程式 。
(3)如下图所示,在玻璃管中放入还原铁粉和石棉绒的混合物,加热并通入水蒸气,用试管收集产生的经干燥的气体。
①有关反应的化学方程式是 。
②干燥管内可装入的试剂是 。
20.磁性材料A由两种元素组成,取2.960 g A在足量的空气中充分煅烧,得到2.400 g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强。请回答下列问题:
(1)溶液C也可用于处理污水,用离子方程式表示污水处理原理: 。
(2)已知化合物A能与稀硫酸反应,反应后得到浅绿色溶液,同时生成一种淡黄色不溶物和一种臭鸡蛋气味气体,写出该反应的化学方程式: 。
(3)用离子方程式解释E中加足量碘的碘化钾溶液后溶液酸性增强的原因 。
三、实验题
21.根据实验室中测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写) 。
A.电子天平 B.试管夹 C.酒精灯 D.蒸发皿 E.坩埚 F.石棉网
除上述仪器外,还需要的仪器是 、 (任意填写二种)。
(2)某学生实验后得到表中数据:
加热前质量 加热后质量
m1(容器) m2(容器+晶体) m3(容器+无水硫酸铜)
5.400 g 7.900 g 7.100 g
①根据以上数据计算该硫酸铜晶体中结晶水x的值为 (精确到0.1)。
②该学生测定结果 (填“偏高”、“偏低”或“正确”)。
③从下列分析中选出该学生产生实验误差的原因可能是(填写字母) 。
a.没有进行恒重操作
b.加热后在干燥器中冷却至室温后称量
c.加热固体到白色后,露置在空气中冷却
d.加热过程中晶体有少量溅失
22.无水FeCl3常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和SiO2杂质)为原料制备无水FeCl3(s)。
已知:氯化亚砜()熔点-101 ℃,沸点76 ℃,易水解。
回答问题:
(1)操作①过滤所得的固体的主要成分为 。
(2)为避免引入新的杂质,试剂B可以选用 (填编号)。
A.溶液 B.水 C.水 D.溶液
(3)操作②的名称是 、 、过滤、洗涤,加热的同时通入HCl(g)的目的是 。
(4)取少量D晶体,溶于水并滴加KSCN溶液,现象是 。
(5)反应D→E的化学方程式为 。
(6)由D转化成E的过程中可能产生少量亚铁盐,写出一种可能的还原剂 ,并设计实验验证是该还原剂将Fe3+还原 。
23.钙钛矿是一类陶瓷卤化物,通式为,在高温催化及光催化方面应用前景广泛。实验室制备一种钙钛矿型复合物的方法如下:
实验用品:氯化锌、溴化铅、碳酸铯、十八烯、油酸、油胺。
已知:通过调节反应的温度,可以实现产物粒子的大小可控。
实验步骤:
将适量、、十八烯加入仪器中,抽气后通入,重复次;
将混合物升温至进行干燥,注入一定量油酸、油胺,待溶液澄清透明后升温到,迅速注入铯前体,调节不同的温度,分钟后将溶液用水浴降至室温;
将步骤中所得混合物与乙酸甲酯按一定比例混合后离心,分离出沉淀;
将步骤中所得沉淀,经过多次溶解,离心分离,最后得到上层清液即为纳米晶体的分散系。
回答下列问题:
(1)仪器的名称是 。
(2)铯前体是由碳酸铯与油酸加热时反应得到的产物,反应的化学方程式是 。
(3)为什么步骤中要调节不同的温度 。
(4)步骤中乙酸甲酯的作用是 。
(5)证明步骤剩余固体中含有未反应完的不考虑溴元素干扰的操作是 。
(6)可用电感耦合等离子体质谱来确定产品中各元素的含量。取产品溶于稀硝酸,测得锌、铅,则的值是 。保留小数点后位
参考答案:
1.D
【分析】含铁废渣中加入1mol/L的盐酸酸浸,FeO、Fe2O3、Al2O3分别与盐酸反应生成Fe2+、Fe3+、Cu2+,然后通入氯气氧化,Fe2+被氧化为Fe3+,再加入过量的氢氧化钠溶液沉铁,Fe3+转化为Fe(OH)3沉淀,而不沉淀Cu2+,过滤得到氢氧化铁,最后灼烧Fe(OH)3获得Fe2O3,以此分析解答。
【详解】A.磁性氧化铁为Fe3O4,故A错误;
B.定容时胶头滴管不能伸入容量瓶中,图示操作方法不合理,故B错误;
C.灼烧Fe(OH)3固体制Fe2O3时需要坩埚中进行,不能在烧杯中灼烧,图示操作方法不合理,故C错误;
D.的物质的量为,m(Fe)= n(Fe) M=,根据铁元素质量守恒,mg铁废渣中铁元素的质量分数为,故D正确;
故选:D。
2.C
【详解】A.玻璃不属于金属材料,A错误;
B.橡胶不属于金属材料,B错误;
C.铝合金为金属材料,且可用于制造飞机部件,C正确;
D.塑料不属于金属材料,D错误;
故答案选C。
3.C
【详解】A.光纤材料的主要成分为二氧化硅,A正确;
B.利用碘化银能进行人工降雨,降雨时用高炮将碘化银炮弹发射到高空云团的零高度层以上,利用碘化银在高空分解生成银单质和碘单质,形成人工冰核,这些冰核经过水汽凝聚,形成冰晶,冰晶发展到一定程度,它们将通过零高度层下降,之后融化形成雨滴,所以碘化银是很好的人工降雨剂,B正确;
C.跨海大桥使用的合金材料,必须具有强度大、密度小、耐腐蚀等特性,不要求熔点高,C不正确;
D.半导体材料的主要成分为硅,D正确;
故选C。
4.A
【详解】A.鎏金高士图银杯的主要成分为金、银,是金属材料,故A正确;
B.山居图扇面的主要材质是纸,属于纤维素,故B错误;
C.兽首玛瑙杯的主要材质是二氧化硅,故C错误;
D.战国青瓷罐的主要材质是硅酸盐,故D错误;
故选A。
5.C
【详解】A.月壤“嫦娥石”属于非金属材料,故A错误;
B.太阳能电池板属于无机非金属材料,故B错误;
C.合金钢属于金属材料,故C正确;
D.碳纤维属于无机非金属材料,故D错误;
故选C。
6.B
【详解】A.高温下蛋白质易发生变性,为了防止蛋白质变性,疫苗等生物制剂应冷藏保存,A正确;
B.中国天眼FAST用到的碳化硅是一种新型的无机非金属材料,不是有机高分子材料,B错误;
C.铝合金材料具有质量轻、抗腐蚀能力强等优点,因此高铁车大部分材料是铝合金,C正确;
D.硅是常用的半导体材料,计算机芯片材料是高纯度的硅,D正确;答案选B。
7.B
【详解】A.金属铝的延展性好,易被空气中的氧气氧化,在金属铝的表面形成致密的氧化膜保护金属铝,所以金属铝可以制成包装用的铝箔,故A不符合题意;
B.镁合金做汽车部件是因为合金具有密度小、强度高的特性,与镁的化学性质活泼无关,故B符合题意;
C.钨是熔点高、导电性好的金属,所以钨常用于做白炽灯灯丝,故C不符合题意;
D.锌是还原性强导电性好的金属,所以锌常用于做锌锰干电池的原料,故D不符合题意;
故选B。
8.C
【详解】A. 钠的焰色反应为黄色,穿透力强,可用于广场、道路照明,故A说法正确;
B. 因为镁合金的密度小,机械性能好,强度大,常用于制造飞机的部件,故B说法正确;
C. 纯碱是Na2CO3,制作糕点所用的发酵粉的主要成分之一是NaHCO3,不是碳酸钠,碳酸钠水溶液碱性较强,不能用于治疗胃酸过多,故C说法错误;
D. 金属氧化物能溶解于硫酸,因此硫酸可用于金属矿石的处理,金属材料表面的清洗,故D说法正确;
答案:C。
9.A
【详解】A.氮化铝是一种新型陶瓷材料,属于无机非金属材料,故选A;
B.氮化铝是化合物,不含金属键,不属于金属材料,故不选B;
C.氮化铝不含碳元素,不属于有机物,故不选C;
D.氮化铝是一种新型陶瓷,不属于复合材料,故不选D;
选A。
10.B
【详解】伍德合金的熔点低(仅为70℃),可用于制造保险丝,故选B。
11.铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在
【详解】“钢精锅”是一种由铝合金制成的炊具,铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在;
故答案为:铝表面形成一层致密的氧化膜,阻碍铝的进一步氧化,使铝稳定的存在。
12.(1)——B;(2)——C;(3)——D;(4)——A;
【详解】(1)金属具有导电性,油罐车行驶时罐内油品摇晃产生静电,易发生火险,故车尾常连着拖地的铁链,与大地相连;(2)金属具有延展性,黄金可制成比纸还薄的金箔;(3)金属具有导热性,故用铁锅烧菜;(4)合金的强度、硬度大,故用铝合金做门窗框架;
13.(1)A
(2)D
(3)B
(4)C
(5)C
(6)
(7)
(8) 生成白色沉淀,迅速变为灰绿色最终变为红褐色
【详解】(1)化学性质是在化学变化中体现出来的性质,例如可燃性、助燃性、氧化性等;物理性质是不需要发生化学变化就能体现出来的性质,例如色态味、熔沸点、密度、溶解性、挥发性、导电导热性、延展性、金属光泽等;
反应中易失去电子属于物质的化学性质;故选A;
(2)金属和合金属于金属材料;塑料属于合成材料;陶瓷、金刚石属于无机非金属材料;
故选D;
(3)合金是金属与金属或非金属熔合而成的具有金属特性的物质;水银、白银、黄金都属于纯金属,青铜为铜的合金;
故选B;
(4)钠和空气中氧气生成氧化钠,氧化钠和水生成氢氧化钠,氢氧化钠吸收二氧化碳生成碳酸钠;
故选C;
(5)亚铁离子被氧化生成铁离子,铁离子和KSCN反应生成红色溶液,检验FeCl2溶液是否被氧化,可向溶液中加入KSCN溶液;
故选C;
(6)钠和氧气点燃生成过氧化钠,;
(7)铁和水蒸气在高温下发生反应生成四氧化三铁、氢气,;
(8)向FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间,反应生成氢氧化亚铁白色沉淀,氢氧化亚铁迅速被空气中氧气氧化,变为灰绿色最终变为红褐色,反应为、。
14. 混合物 同素异形体 ②④⑧ ⑨ ①
【分析】结合物质的组成分析;结合金属材料、半导体材料和合成材料的概念分析。
【详解】(1)钢是铁碳合金,空气的主要成分是氮气和氧气,则二者均属于混合物;石墨和金刚石是碳元素组成的不同单质,互为同素异形体;
(2)以上划线物质中②铝、④钢、⑧铜均属于金属材料的是;硅的导电性介于导体和绝缘体之间,则⑨单质硅可以作为半导体材料;①合成橡胶是人工合成的有机高分子化合物属于合成材料。
【点睛】明确各种不同类型材料的概念是解题关键,其中金属材料包括铁、铝、铜等纯金属或合金,特别注意金属材料中可能含有非金属单质,特别注意半导体材料是晶体硅,而二氧化硅是光导纤维的主要成分,易混淆。
15.(1)
(2)A
(3)B
(4)(或)
【分析】(1)
氢气是可燃性气体,其燃烧产生H2O,该反应的化学方程式为:;
(2)
铅是金属单质,由Pb原子构成,故合理选项是A;
(3)
A.航空级铝合金跳板是合金,属于金属材料,A不符合题意; B.聚酯纤维泳衣属于有机合成材料,B符合题意;
C.金牌是金属材料,C不符合题意;
故合理选项是B;
(4)
①氯酸钾受撞击迅速分解产生氯化钾和氧气,反应方程式为;
红磷与O2在点燃时反应产生P2O5,反应的化学方程式为:。
16.通用 合成纤维 合成橡胶 功能
【解析】略
17. 2MgO·3SiO2·nH2O c 脱水 Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O NH3 SiH4
【详解】(1)胃舒平的主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8·nH2O)等化合物。三硅酸镁的氧化物可以理解为MgO、SiO2,则表达形式为:2MgO·3SiO2·nH2O;
(2)Al2O3、MgO和SiO2都可以制耐火材料,其原因是Al2O3、MgO和SiO2都有很高的熔点;
(3)用浓硫酸给竹筒“刻字”是利用浓硫酸的脱水性,使竹简碳化;
(4)Cu与浓硫酸在加热条件下反应生成硫酸铜、水和二氧化硫,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O;
(5)推测Si、N最简单氢化物的稳定性:NH3强于SiH4,因为非金属性越强,简单氢化物越稳定。
18. C ②④⑥ HCl HClO
【详解】(1)n(NaOH)===0.01mol,n(Na2CO3)===0.01mol;滴加盐酸的过程中,盐酸先和NaOH反应,再和Na2CO3发生反应生成NaHCO3,最后和NaHCO3反应生成CO2,由三个阶段的反应对应的关系式NaOH~HCl、Na2CO3~HCl~NaHCO3、NaHCO3~HCl~CO2可知,三个阶段均消耗0.01mol HCl(对应盐酸的体积均为0.1L),并生成0.01mol CO2,C符合题意,故选C;
(2)Mg、Al和硫酸反应的关系式分别为:Mg~H2、2Al~3H2;图中Mg、Al和稀硫酸反应生成的H2的体积一样多,则说明H2的物质的量一样多,生成1份H2,分别需要1份Mg、份Al,故镁和铝的物质的量之比为3:2;
(3)①向饱和Na2CO3溶液中那个通入CO2至过量,会生成NaHCO3,由于该温度下,NaHCO3的溶解度比Na2CO3的溶解度小,故在该操作中可以观察到有沉淀生成,但是沉淀不会溶解,①不符合题意;
②向Fe(OH)3胶体中逐滴滴加稀H2SO4至过量,胶体先聚沉,生成Fe(OH)3沉淀,Fe(OH)3沉淀再溶解于稀H2SO4中,②符合题意;
③向BaCl2溶液中通入CO2过量,始终无沉淀产生,③不符合题意;
④向澄清石灰水中逐渐通入CO2至过量,刚开始生成CaCO3沉淀,使澄清石灰水变浑浊,当Ca(OH)2反应完全后,CaCO3会和CO2、H2O继续反应生成可溶性的Ca(HCO3)2,沉淀又完全溶解,④符合题意;
⑤向Al2(SO4)3溶液中逐滴滴加Ba(OH)2至过量,刚开始反应生成Al(OH)3沉淀和BaSO4沉淀,但是当Al3+完全沉淀时,随着Ba(OH)2的继续加入,Al(OH)3沉淀逐渐溶解,而BaSO4沉淀不会溶解,故可以观察到沉淀部分溶解,⑤不符合题意;
⑥向NaAlO2溶液中逐滴滴加盐酸至过量,刚开始反应生成Al(OH)3沉淀,但是当Al3+完全沉淀时,随着盐酸的继续加入,Al(OH)3沉淀逐渐溶解,⑥符合题意;
⑦向NaAlO2溶液中逐渐通入CO2至过量,反应生成Al(OH)3沉淀,由于Al(OH)3沉淀不会和CO2反应,故沉淀不会溶解,⑦不符合题意;
综上所述,符合题意的有②④⑥;
(4)①向氯化亚铁溶液中加入氯水,FeCl2会被氧化为FeCl3,氯水中起作用的主要微粒是Cl2,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
②向硝酸银溶液中加入氯水,可以观察到有白色沉淀生成,氯水中起主要作用的微粒是Cl-;
③向氯水中滴加石蕊溶液,溶液变红,是因为氯水中含有H+,其中H+主要来自于HCl的电离,故使石蕊变红的物质是HCl;然后又褪色,起作用的是HClO,因为该物质具有漂白性。
19. 2Na+2H2O=2NaOH+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 3Fe+4H2OFe3O4+4H2 CaCl2或无水CuSO4
【详解】试题分析:(1)金属钠常温下能与冷水剧烈反应,其反应的化学方程式为2Na+2H2O=2NaOH+H2↑。(2)铝与氢氧化钠溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑(3)①反应的化学方程式是3Fe+4H2OFe3O4+4H2 ②干燥管内利用CaCl2或无水CuSO4吸水;
考点:考查钠、铝与铁的性质
20. Fe3+ + 3H2OFe(OH)3+ 3H+ 或Fe3+ + 3H2OFe(OH)3(胶体)+ 3H+ Fe3S4+3H2SO4===3H2S↑+3FeSO4+S↓ H2SO3+I2+H2O===SO42-+4H++2I-
【详解】试题分析:磁性材料A由两种元素组成,取2.960 g A在足量的空气中充分煅烧,得到2.400 g红棕色固体B和无色刺激性气体D。固体B溶于盐酸形成棕黄色溶液C,再加入KSCN溶液变为血红色,说明棕黄色溶液C是氯化铁溶液,B为氧化铁。气体D溶于水得到无色酸性溶液E,向E中加足量碘的碘化钾溶液(红棕色)得到溶液F,同时溶液酸性增强,可以推断D为二氧化硫,E为亚硫酸,亚硫酸可以被碘氧化为硫酸,碘被还原为氢碘酸,所以酸性增强。2.400 g红棕色氧化铁的物质的量为0.015mol,其中含铁0.03mol,铁元素的质量为1.68g,由铁元素守恒求得2.960 g A中含硫元素的质量为1.28g,S 的物质的量为0.04mol,所以A中的化学式为Fe3S4。
(1)氯化铁溶液可用于处理污水,用离子方程式表示污水处理原理为Fe3+ + 3H2OFe(OH)3+ 3H+ 或Fe3+ + 3H2OFe(OH)3(胶体)+ 3H+。
(2)化合物A能与稀硫酸反应,反应后得到浅绿色硫酸亚铁溶液,同时生成一种淡黄色不溶物硫和一种臭鸡蛋气味气体硫化氢,该反应的化学方程式为Fe3S4+3H2SO4===3H2S↑+3FeSO4+S↓。
(3)E中加足量碘的碘化钾溶液后溶液酸性增强的原因用离子方程式可表示为H2SO3+I2+H2O===SO42-+4H++2I-。
21.(1) ACE 玻璃棒 研钵(或干燥器)
(2) 4.2 偏低 ac
【详解】(1)测定CuSO4·nH2O的结晶水含量的步骤有:研钵中研磨固体物质、称量样品、在坩埚中加热、干燥器中冷却、称量无水硫酸铜质量、恒重等,所需仪器有:研钵、天平、坩埚(附带坩埚钳、泥三角、三脚架)、酒精灯、干燥器、玻璃棒等,不用的仪器为试管夹、蒸发皿、石棉网,故选ACE;还需要玻璃棒、研钵(或干燥器)等;
(2)①结晶水的质量m=m2(容器+晶体)-m3(容器+无水硫酸铜)=7.900g-7.100g=0.800g,无水硫酸铜的质量m=m3(容器+无水硫酸铜)-m1(容器)=7.100g-5.400g=1.700g,n(H2O)=≈0.0444mol,n(CuSO4) =≈0.010625mol,结晶水x=≈4.2。
②实验测定x的值为4.2,小于准确值5,故测定结果偏低;
③a.没有进行恒重操作,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,a符合题意;
b.加热后在干燥器中冷却至室温后称量,属于正确操作,无影响,b不符合题意;
c.加热固体到白色后,露置在空气中冷却,会导致测定的硫酸铜的质量偏大,测定的水的质量偏小,c符合题意;
d.加热过程中有少量晶体溅出,导致水的质量测定结果偏大,d不符合题意;
故选ac。
22.(1)碳和SiO2
(2)BD
(3) 蒸发浓缩 冷却结晶 防止Fe3+水解
(4)溶液变为血红色
(5)
(6) SO2 先加盐酸酸化,再加BaCl2溶液,产生白色沉淀,则是SO2将Fe3+还原
【分析】废铁屑(含有少量碳和SiO2杂质)加入盐酸,铁粉反应生成氯化亚铁,过滤除去少量碳和SiO2杂质,A(氯化亚铁)加入氧化剂B生成C(氯化铁),蒸发结晶生成,通入SOCl2生成FeCl3,以此来解析;
(1)
根据上述分析,操作①过滤所得的固体的主要成分为碳和SiO2杂质;
(2)
有分析可知,A(氯化亚铁)加入B生成C(氯化铁),铁由+2变成+3价化合价升高,被氧化,需要加入氧化剂,A、C都引入杂质离子,BD符合题意;
故选BD。
(3)
操作②氯化铁溶液在氯化氢气体的情况下得到FeCl3 6H2O,蒸发浓缩、冷却结晶;加热促进的水解,会生成氢氧化铁,故加入HCl(g)的目的是防止水解;
(4)
因Fe3++3SCN-=Fe(SCN)3(血红色),KSCN溶液遇Fe3+变为红色;
(5)
根据已知信息氯化亚砜熔点-101℃,沸点76℃,易水解,可得FeCl3 6H2O与SOCl2生成FeCl3的化学方程式为:FeCl3 6H2O+6SOCl2FeCl3+6SO2↑+12HCl;
(6)
可能反应中生成的二氧化硫将氯化铁还原为氯化亚铁,若二氧化硫作还原剂,则氧化产物为硫酸盐,故若加盐酸酸化,再加BaCl2溶液溶液,产生白色沉淀,则是二氧化硫作还原剂;
23.(1)三颈烧瓶
(2)
(3)得到不同大小的产物粒子
(4)溶解并除去未反应的油酸、油胺、十八烯;降低产物的溶解度
(5)取少量最后固体加入稀硝酸溶解,再加入硝酸银溶液,出现白色沉淀,说明剩余固体中含有未反应完的氯化锌
(6)0.22
【详解】(1)A的名称是三颈烧瓶。
(2)碳酸铯与油酸反应生成油酸铯、二氧化碳和水,方程式为
(3)根据已知:通过调节反应的温度,可以实现产物粒子的大小可控,故步骤②中要调节不同的温度是为了得到不同大小的产物粒子。
(4)乙酸甲酯作为有机溶剂,可以溶解并除去未反应的油酸、油胺、十八烯,同时降低产物的溶解度,便于析出。
(5)鉴别ZnCl2可用硝酸银溶液,故取少量最后固体加入稀硝酸溶解,再加入硝酸银溶液,出现白色沉淀,说明剩余固体中含有未反应完的氯化锌。
(6)由化学式,解之x=0.22。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
