2024年高三化学专题复习 BOPPPS模型在化学核心概念建构教学中的实践-以“变量思想在阿伦尼乌斯公式中的应用”为例 课件(共18张PPT)
文档属性
| 名称 | 2024年高三化学专题复习 BOPPPS模型在化学核心概念建构教学中的实践-以“变量思想在阿伦尼乌斯公式中的应用”为例 课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
BOPPPS模型在化学核心概念建构教学中的实践
变量思想在阿伦尼乌斯公式中的应用
瑞典物理化学家
猜一猜这位诺贝尔奖获得者的名字?
阿伦尼乌斯
1859年
以《电解质的导电性研究》《电解质的化学理论》论文申请博士
生于瑞典
1884年
博士毕业论文与法拉第电离理论冲突答辩委员会不支持研究成果
1885年
德国物理化学
家奥斯特瓦尔
实验室工作
1903
因建立电离学说
获得诺贝尔化学奖
作为新时代的你们,要从理性的高度大胆挑战权威。之后作为权威,我们亦要从理性的角度接受新人。本节课,我们共同努力,提出新的速率方程,致谢前辈!
学 习 目 标
1.从定量的角度理解温度、催化剂、浓度对反应速率的影响
2.通过阿伦尼乌斯公式、速率方程等体会变量思想在解决复杂问题中的应用
3.体验数学作为工具在解决化学问题时带来的乐趣
4.通过对系列问题的深度思考,发展学生高阶思维能力和证据推理学科素养
[探讨]鲁科版化学反应原理教材P70页:温度会影响反应速率常数,从而影响反应速率。
(1)哪个公式能定量表达温度和反应速率常数两者的定量关系?
k=Ae
Ea>0,温度升高,速率常数k _______(填“增大”或“减小”)。
k为反应速率常数,A为指前因子,也叫碰撞频率因子,e为自然对数的底,Ea为反应活化能,R为摩尔气体常量,一般取值8.314J·mol-1·k-1。
增大
阿伦尼乌斯公式
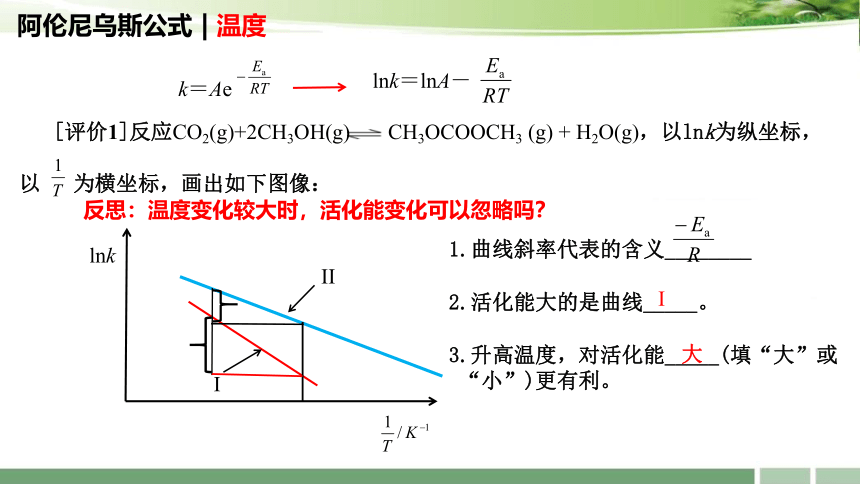
阿伦尼乌斯公式 | 温度
Ea<0,温度升高,速率常数k _______(填“增大”或“减小”)。
减小
Ea<0,从催化剂的角度分析可能的原因?
温度升高催化剂失去活性,使反应速率下降。
lnk=lnA-
lnk
I
II
1.曲线斜率代表的含义________
2.活化能大的是曲线_____。
I
大
k=Ae
3.升高温度,对活化能_____(填“大”或
“小”)更有利。
[评价1]反应CO2(g)+2CH3OH(g) CH3OCOOCH3 (g) + H2O(g),以lnk为纵坐标,
以 为横坐标,画出如下图像:
反思:温度变化较大时,活化能变化可以忽略吗?
阿伦尼乌斯公式 | 温度
小
k=Ae
(2)统计力学认为:活化分子的平均能量与全部反应物分子平均能量之差称为活
化能。温度升高,反应物分子平均能量增大而活化分子的平均能量不变,则
活化能变___(填“大”或“小”)。
(3)阿伦尼乌斯公式是完美的吗?
k=ATm e
温度范围适当放宽或对于较复杂的反应,Ea与温度有关。
阿伦尼乌斯公式 | 活化能
引入一个 变量。
与温度和活化能有关联的
阿伦尼乌斯公式中A为碰撞频率因子,它与碰撞频率以及有利于化学反应的碰撞几率有关。催化剂在催化反应中起双重作用:一是降低活化能,使反应容易进行。二是减少碰撞次数使反应速率减慢。
k=Ae
(4)降低活化能的物质一定能加快反应速率吗?
不一定。两个变量,活化能降低和碰撞数减少,主变量起决定作用。
阿伦尼乌斯公式 | 活化能
(5)若催化剂在可逆反应中也起双重作用,如乙酸乙酯制备实验中浓硫酸作催化剂和吸水剂,浓硫酸能提高反应的转化率吗?
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
加热
吸水之后,反应正向移动,提高反应的转化率。
[评价2]催化剂ILS可使CH3OH和CO2直接合成CH3OCOOCH3(g) (DMC) ,发生反应CO2(g)+2CH3OH(g)
CH3OCOOCH3 (g) + H2O(g),提高CO2转化率,反应机理如下
图所示:
催化循环 脱水循环
(1)催化剂ILS是________。(填A或B)
(2)结合反应机理分析提高CO2转化率的原因 。
脱水循环过程将产物水脱离反应
体系,促使平衡正向移动,提高转化率
迁移应用
①
②
A
B
B
k=Ae
(6)阿伦尼乌斯公式中A为碰撞频率因子,催化剂参与的反应会使碰撞次数减少,理论值仅为非催化反应的10-12。根据阿伦尼乌斯公式计算理论活化能(J·mol-1)至少降低多少才能起到催化作用?(R=8.314J·mol-1·k-1,T=300K,ln10=2.3)
=-12ln10
=10-12
E非-E催=(8.314×300×12×2.3)kJ·mol-1=68839.92J·mol-1
阿伦尼乌斯公式 | 活化能
活化能可以降低几万焦耳,但温度不可能
上万度提高。温度高,耗能大,成本高。
k=Ae
(7)催化剂降低活化能68839.92J·mol-1可以增大反应速率常数,由阿伦尼乌斯公式
可知:升高同样的温度也可达到同样的效果,为什么工业生产中更重视催化剂
对速率的影响?
阿伦尼乌斯公式 | 活化能与温度
k=Ae
(8)阿伦尼乌斯公式中为什么没有浓度这个物理量?
速率常数k与温度、催化剂、固体表面性质有关,与浓度无关。
(9)哪个方程能表达浓度与速率间的定量关系?
速率方程
阿伦尼乌斯公式 | 速率方程
(10)当速率方程中m和n满足什么关系,速率与浓度没有关系?
m=n=0,零级反应。
某些表面催化反应,例如氨在金属钨表面上的分解反应,其分解速率在一定条件下与氨的浓度无关就属于零级反应。
已知:反应a A(g) + b B(g) → g G(g) + h H(g)的速率方程可以表示为:
若为基元反应,则速率方程可表示为: ,其中m为物质A
的反应级数,n为物质B的反应级数,m+n=总反应级数 3。
v=k·c(A)m·c(B)n
v=k·c(A)a·c(B)b
≤
当m=0,n=1,曲线是___次函数,图像是________;当m=0,n=2,曲线是___次函数,图像是__________。
一
直线
二
抛物线
迁移应用
(1)m=__, n=__,该反应的总反应级数为_____。
(2)p(CO2)分压升高到约25KPa后,对速率几乎无影响,可能的原因?
[评价3]CO2(g)+CH4(g) 2CO(g)+2H2(g)的化学反应速率v=k·p(CH4)m·p(CO2)n,k为速率常数。1123K和1173K时,分别保持p(CO2)或p(CH4)不变,测得速率v与p(CH4)、p(CO2)的关系如图所示:
1
1
压强变大,分子间距离变小,分子间作用力增大,气体变为液体。
一次函数图像
一次函数图像
信息:每种物质都有一个特定的温度,在这个温度以上,无论怎样增大压强,气态物质不会液化,这就是临界温度。CO2的临界温度为31.2℃左右,CO和H2的临界温度分别为-140.2℃、-239.97℃。
2
催化剂
催化剂活性中心吸附的CO2分子数达到饱和。
Ae
v= ·c(A)m·c(B)n
反应a A + b B → g G + h H
(11)如何将阿伦尼乌斯公式和速率方程结合,创造出一个新的速率方程?
k=Ae
v=k·c(A)m·c(B)n
阿伦尼乌斯公式 | 新速率方程
(12)结合新速率方程分析,当温度升高,浓度下降,反应速率变大、变小
还是无法确定,判断的依据是?
两个变量,主要变量起决定性作用。
NO氧化反应:2NO(g)+O2(g)??2NO2(g)分两步进行,
Ⅰ: 2NO(g)??N2O2(g) 快反应 ΔH1<0
Ⅱ: N2O2(g)+O2(g) 2NO2(g) 慢反应 ΔH2<0
在恒容的密闭容器中充入一定量的NO和O2气体,保持其它
条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)
随t(时间)的变化曲线如图。
[评价4]研究NOx之间的转化具有重要意义。
慢
素 养 提 升
1.温度高,NO转化速度变____(填“快”“慢”)。
2.温度升高,反应Ⅰ、II平衡____向移动(填“正”“逆”),I中c(N2O2)减小的速率____(填“大”“小”)于II中c(N2O2)生成的速率。浓度降低的影响____(填“大”“小”)于温度对反应Ⅱ速率的影响。
大
逆
大
感悟|收获
概况总结|变量思想
变量意识
寻找变量
单一变量
多个变量
主变量(决定)
次变量
典型事实
认知冲突
学习过程中由于未知变量的存在,常导致已知结论与原有认知冲突,请以案例报告的形式呈现:问题、困惑、解决方案、总结原因。
成果应用
祝同学们春风得意
马到成功
BOPPPS模型在化学核心概念建构教学中的实践
变量思想在阿伦尼乌斯公式中的应用
瑞典物理化学家
猜一猜这位诺贝尔奖获得者的名字?
阿伦尼乌斯
1859年
以《电解质的导电性研究》《电解质的化学理论》论文申请博士
生于瑞典
1884年
博士毕业论文与法拉第电离理论冲突答辩委员会不支持研究成果
1885年
德国物理化学
家奥斯特瓦尔
实验室工作
1903
因建立电离学说
获得诺贝尔化学奖
作为新时代的你们,要从理性的高度大胆挑战权威。之后作为权威,我们亦要从理性的角度接受新人。本节课,我们共同努力,提出新的速率方程,致谢前辈!
学 习 目 标
1.从定量的角度理解温度、催化剂、浓度对反应速率的影响
2.通过阿伦尼乌斯公式、速率方程等体会变量思想在解决复杂问题中的应用
3.体验数学作为工具在解决化学问题时带来的乐趣
4.通过对系列问题的深度思考,发展学生高阶思维能力和证据推理学科素养
[探讨]鲁科版化学反应原理教材P70页:温度会影响反应速率常数,从而影响反应速率。
(1)哪个公式能定量表达温度和反应速率常数两者的定量关系?
k=Ae
Ea>0,温度升高,速率常数k _______(填“增大”或“减小”)。
k为反应速率常数,A为指前因子,也叫碰撞频率因子,e为自然对数的底,Ea为反应活化能,R为摩尔气体常量,一般取值8.314J·mol-1·k-1。
增大
阿伦尼乌斯公式
阿伦尼乌斯公式 | 温度
Ea<0,温度升高,速率常数k _______(填“增大”或“减小”)。
减小
Ea<0,从催化剂的角度分析可能的原因?
温度升高催化剂失去活性,使反应速率下降。
lnk=lnA-
lnk
I
II
1.曲线斜率代表的含义________
2.活化能大的是曲线_____。
I
大
k=Ae
3.升高温度,对活化能_____(填“大”或
“小”)更有利。
[评价1]反应CO2(g)+2CH3OH(g) CH3OCOOCH3 (g) + H2O(g),以lnk为纵坐标,
以 为横坐标,画出如下图像:
反思:温度变化较大时,活化能变化可以忽略吗?
阿伦尼乌斯公式 | 温度
小
k=Ae
(2)统计力学认为:活化分子的平均能量与全部反应物分子平均能量之差称为活
化能。温度升高,反应物分子平均能量增大而活化分子的平均能量不变,则
活化能变___(填“大”或“小”)。
(3)阿伦尼乌斯公式是完美的吗?
k=ATm e
温度范围适当放宽或对于较复杂的反应,Ea与温度有关。
阿伦尼乌斯公式 | 活化能
引入一个 变量。
与温度和活化能有关联的
阿伦尼乌斯公式中A为碰撞频率因子,它与碰撞频率以及有利于化学反应的碰撞几率有关。催化剂在催化反应中起双重作用:一是降低活化能,使反应容易进行。二是减少碰撞次数使反应速率减慢。
k=Ae
(4)降低活化能的物质一定能加快反应速率吗?
不一定。两个变量,活化能降低和碰撞数减少,主变量起决定作用。
阿伦尼乌斯公式 | 活化能
(5)若催化剂在可逆反应中也起双重作用,如乙酸乙酯制备实验中浓硫酸作催化剂和吸水剂,浓硫酸能提高反应的转化率吗?
CH3COOH+CH3CH2OH CH3COOC2H5+H2O
浓硫酸
加热
吸水之后,反应正向移动,提高反应的转化率。
[评价2]催化剂ILS可使CH3OH和CO2直接合成CH3OCOOCH3(g) (DMC) ,发生反应CO2(g)+2CH3OH(g)
CH3OCOOCH3 (g) + H2O(g),提高CO2转化率,反应机理如下
图所示:
催化循环 脱水循环
(1)催化剂ILS是________。(填A或B)
(2)结合反应机理分析提高CO2转化率的原因 。
脱水循环过程将产物水脱离反应
体系,促使平衡正向移动,提高转化率
迁移应用
①
②
A
B
B
k=Ae
(6)阿伦尼乌斯公式中A为碰撞频率因子,催化剂参与的反应会使碰撞次数减少,理论值仅为非催化反应的10-12。根据阿伦尼乌斯公式计算理论活化能(J·mol-1)至少降低多少才能起到催化作用?(R=8.314J·mol-1·k-1,T=300K,ln10=2.3)
=-12ln10
=10-12
E非-E催=(8.314×300×12×2.3)kJ·mol-1=68839.92J·mol-1
阿伦尼乌斯公式 | 活化能
活化能可以降低几万焦耳,但温度不可能
上万度提高。温度高,耗能大,成本高。
k=Ae
(7)催化剂降低活化能68839.92J·mol-1可以增大反应速率常数,由阿伦尼乌斯公式
可知:升高同样的温度也可达到同样的效果,为什么工业生产中更重视催化剂
对速率的影响?
阿伦尼乌斯公式 | 活化能与温度
k=Ae
(8)阿伦尼乌斯公式中为什么没有浓度这个物理量?
速率常数k与温度、催化剂、固体表面性质有关,与浓度无关。
(9)哪个方程能表达浓度与速率间的定量关系?
速率方程
阿伦尼乌斯公式 | 速率方程
(10)当速率方程中m和n满足什么关系,速率与浓度没有关系?
m=n=0,零级反应。
某些表面催化反应,例如氨在金属钨表面上的分解反应,其分解速率在一定条件下与氨的浓度无关就属于零级反应。
已知:反应a A(g) + b B(g) → g G(g) + h H(g)的速率方程可以表示为:
若为基元反应,则速率方程可表示为: ,其中m为物质A
的反应级数,n为物质B的反应级数,m+n=总反应级数 3。
v=k·c(A)m·c(B)n
v=k·c(A)a·c(B)b
≤
当m=0,n=1,曲线是___次函数,图像是________;当m=0,n=2,曲线是___次函数,图像是__________。
一
直线
二
抛物线
迁移应用
(1)m=__, n=__,该反应的总反应级数为_____。
(2)p(CO2)分压升高到约25KPa后,对速率几乎无影响,可能的原因?
[评价3]CO2(g)+CH4(g) 2CO(g)+2H2(g)的化学反应速率v=k·p(CH4)m·p(CO2)n,k为速率常数。1123K和1173K时,分别保持p(CO2)或p(CH4)不变,测得速率v与p(CH4)、p(CO2)的关系如图所示:
1
1
压强变大,分子间距离变小,分子间作用力增大,气体变为液体。
一次函数图像
一次函数图像
信息:每种物质都有一个特定的温度,在这个温度以上,无论怎样增大压强,气态物质不会液化,这就是临界温度。CO2的临界温度为31.2℃左右,CO和H2的临界温度分别为-140.2℃、-239.97℃。
2
催化剂
催化剂活性中心吸附的CO2分子数达到饱和。
Ae
v= ·c(A)m·c(B)n
反应a A + b B → g G + h H
(11)如何将阿伦尼乌斯公式和速率方程结合,创造出一个新的速率方程?
k=Ae
v=k·c(A)m·c(B)n
阿伦尼乌斯公式 | 新速率方程
(12)结合新速率方程分析,当温度升高,浓度下降,反应速率变大、变小
还是无法确定,判断的依据是?
两个变量,主要变量起决定性作用。
NO氧化反应:2NO(g)+O2(g)??2NO2(g)分两步进行,
Ⅰ: 2NO(g)??N2O2(g) 快反应 ΔH1<0
Ⅱ: N2O2(g)+O2(g) 2NO2(g) 慢反应 ΔH2<0
在恒容的密闭容器中充入一定量的NO和O2气体,保持其它
条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)
随t(时间)的变化曲线如图。
[评价4]研究NOx之间的转化具有重要意义。
慢
素 养 提 升
1.温度高,NO转化速度变____(填“快”“慢”)。
2.温度升高,反应Ⅰ、II平衡____向移动(填“正”“逆”),I中c(N2O2)减小的速率____(填“大”“小”)于II中c(N2O2)生成的速率。浓度降低的影响____(填“大”“小”)于温度对反应Ⅱ速率的影响。
大
逆
大
感悟|收获
概况总结|变量思想
变量意识
寻找变量
单一变量
多个变量
主变量(决定)
次变量
典型事实
认知冲突
学习过程中由于未知变量的存在,常导致已知结论与原有认知冲突,请以案例报告的形式呈现:问题、困惑、解决方案、总结原因。
成果应用
祝同学们春风得意
马到成功
同课章节目录
