化学人教版(2019)必修第一册1.3.2氧化剂与还原剂(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂与还原剂(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 15:18:50 | ||
图片预览





文档简介
(共20张PPT)
第三节 氧化还原反应
第二课时 氧化剂还原剂
本节重、难点
本节重点
本节难点
氧化剂、还原剂及相关概念
比较物质氧化性或还原性的强弱。
温故知新
1.在反应 MnO2 + 4HCl==MnCl2 + 2H2O + Cl2↑中,____ 元素化合价升高,被______(填“氧化”或“还原”),发生__ __(填“氧化”或“还原”)反应
______元素化合价降低,被_________ (填“氧化”或“还原”),发生_________(填“氧化”或“还原”)反应。
2.下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
氧化
氧化
Mn
还原
还原
BD
Cl
温故知新
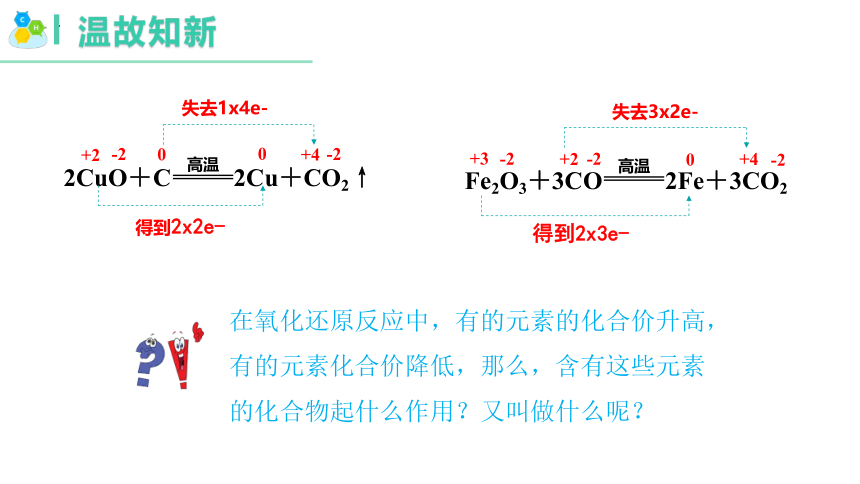
在氧化还原反应中,有的元素的化合价升高,有的元素化合价降低,那么,含有这些元素的化合物起什么作用?又叫做什么呢?
高温
2CuO+C 2Cu+CO2↑
得到2x2e-
高温
Fe2O3+3CO 2Fe+3CO2
得到2x3e-
失去3x2e-
+2
-2
0
0
+4
-2
-2
+4
-2
+2
-2
0
+3
失去1x4e-
一、氧化剂、还原剂及相关概念
高温
2CuO+C 2Cu+CO2↑
化合价降低,还原反应
高温
Fe2O3+3CO 2Fe+3CO2
化合价降低,还原反应
化合价升高,氧化反应
+2
-2
0
0
+4
-2
-2
+4
-2
+2
-2
0
+3
化合价升高, 氧化反应
还原剂
氧化剂
还原产物
氧化产物
还原剂
氧化剂
还原产物
氧化产物
一、氧化剂、还原剂及相关概念
2
氧化产物与还原产物
1
氧化剂与还原剂
氧化剂:所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
氧化产物:还原剂失去电子被氧化所得的产物。
还原产物:氧化剂得到电子被还原所得的产物。
生成物
反应物
一、氧化剂、还原剂及相关概念
3
氧化性与还原性
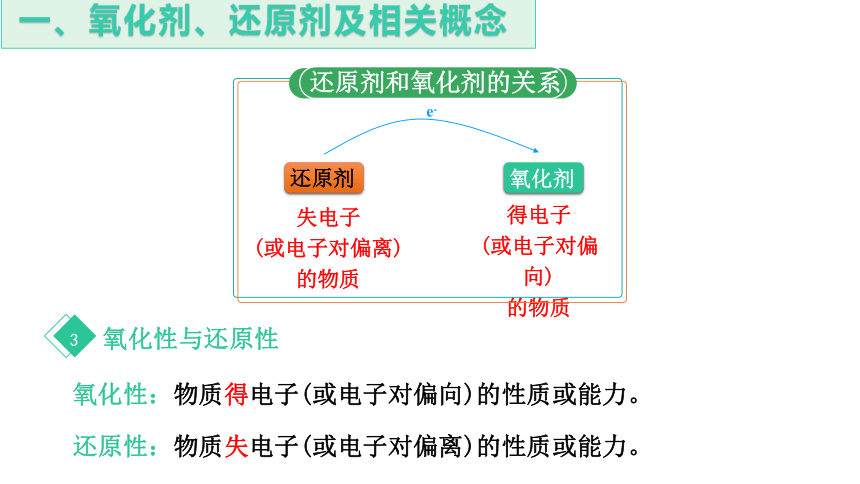
氧化性:物质得电子(或电子对偏向)的性质或能力。
还原性:物质失电子(或电子对偏离)的性质或能力。
还原剂
氧化剂
e-
失电子
(或电子对偏离)
的物质
得电子
(或电子对偏向)
的物质
还原剂和氧化剂的关系
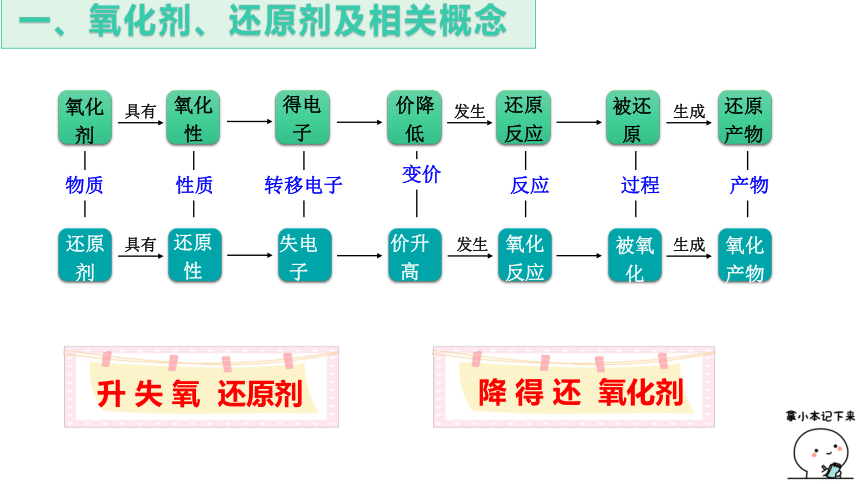
氧化剂
氧化
性
得电子
价降低
还原
反应
被还
原
还原
产物
还原
剂
还原
性
失电子
价升高
氧化
反应
被氧
化
氧化
产物
具有
发生
生成
具有
生成
物质
性质
转移电子
变价
反应
过程
产物
发生
升 失 氧 还原剂
降 得 还 氧化剂
一、氧化剂、还原剂及相关概念
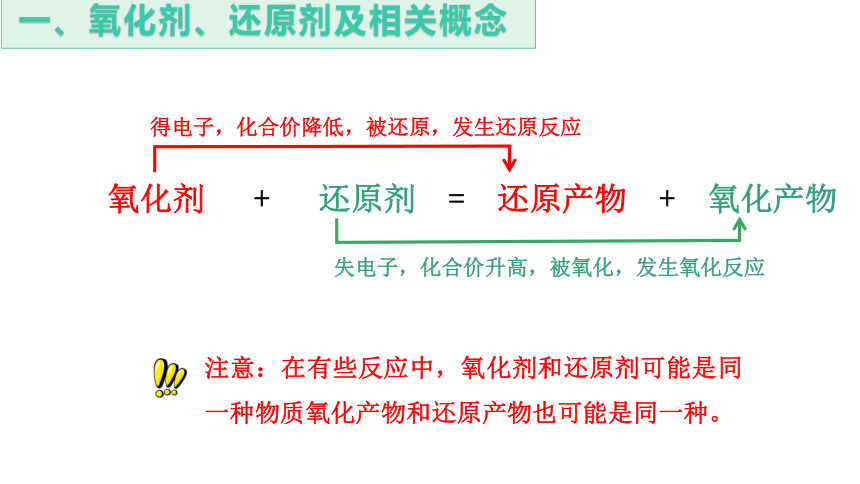
注意:在有些反应中,氧化剂和还原剂可能是同一种物质氧化产物和还原产物也可能是同一种。
一、氧化剂、还原剂及相关概念
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
1. 判断下列反应的氧化剂和还原剂:
① Fe + CuSO4 == Cu + FeSO4
② MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③ 3NO2+H2O == 2HNO3+NO
④ 2KMnO4 K2MnO4+MnO2+O2↑
随堂检测
氧化产物
某种物质没有“身份”
某种物质有两种“身份”
还原剂
氧化剂
还原产物
氧化剂
还原剂
还原剂
氧化剂
还原产物
还原产物
氧化产物
某些物质“身份”相同
还原剂
氧化剂
氧化产物
还原产物
还原产物
氧化产物
一、氧化剂、还原剂及相关概念
4
常见的氧化剂与还原剂
常见的氧化剂:
① 活泼的非金属单质:如Cl2、O2等;
② 变价元素的高价态化合物:
如浓H2SO4、HNO3、H2O2、Na2O2、KMnO4、FeCl3、NaClO等。
常见的还原剂:
① 活泼的金属单质:如Al、Fe、Zn等。
② 某些非金属单质:如H2、S、C等。
③变价元素的低价态化合物:如CO、SO2、H2S、Na2S、FeCl2等。
二、比较物质氧化性和还原性的强弱
【思考1】如何判断某物质在氧化还原反应中是做氧化剂是还原剂?
中心元素具有降价趋势的物质常做氧化剂
中心元素具有升价趋势的物质常做还原剂
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
含锰元素的常见物质:Mn、 MnCl2、MnO2、K2MnO4、 KMnO4
0
+2
+4
+7
+6
容易变价的元素
为什么KMnO4做氧化剂?
+7
1.根据元素价态判断物质的氧化性、还原性强弱
【思考2】 H2S、 S、SO2 和浓H2SO4各自体现什么性质呢?
化合价
0
+4
+6
-2
浓H2SO4
SO2
S
H2S
只有氧化性
只有还原性
既有氧化性
又有还原性
结论:元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性;
即”高价氧,低价还,中间价态两边转“
2.根据反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物。
微点拨
氧化性强
氧化性弱
还原性强
还原性弱
随堂检测
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+
A
3.根据金属和非金属活动性顺序表
K+
Ca+
Na+
Mg+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
单质的还原性逐渐减弱
阳离子的氧化性逐渐增强
单质易失电子,
对应阳离子不易得电子
F2 Cl2 Br2 I2 S
F-
Cl-
Br-
I-
S2-
单质的氧化性逐渐减弱
即“易失不易得,易得不易失”
单质易得电子,
对应阴离子不易失电子
阴离子的还原性逐渐增强
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
4.根据反应条件
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,
如是否加热、有无催化剂和反应物浓度大小等。
由反应条件知氧化性:KMnO4>MnO2>O2。
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl MnCl2 +Cl2↑+2H2O
O2+4HCl 2Cl2+2H2O
4.根据反应条件
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCI>稀HCI
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强
同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
浓度
温度
酸碱性
教材延伸
5.根据产物中变价元素的价态
氧化性:Cl2>S
(2)相同条件下不同还原剂作用于同一种氧化剂,
还原产物价态低的其还原性强。
例如:根据Cu+2Fe3+===Cu2++2Fe2+
3Zn+2Fe3+===3Zn2++2Fe
还原性:Zn>Cu
(1)相同条件下不同氧化剂作用于同一种还原剂,
氧化产物价态高的其氧化性强。
例如:根据2Fe+3Cl2 2FeCl3
Fe+S FeS
三、氧化还原反应的存在应用
食品包装中的脱氧剂——还原铁粉
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利: 、 、
易燃物的自燃
食物的腐败
钢铁的锈蚀
红酒中添加SO2具有抗氧化的作用
第三节 氧化还原反应
第二课时 氧化剂还原剂
本节重、难点
本节重点
本节难点
氧化剂、还原剂及相关概念
比较物质氧化性或还原性的强弱。
温故知新
1.在反应 MnO2 + 4HCl==MnCl2 + 2H2O + Cl2↑中,____ 元素化合价升高,被______(填“氧化”或“还原”),发生__ __(填“氧化”或“还原”)反应
______元素化合价降低,被_________ (填“氧化”或“还原”),发生_________(填“氧化”或“还原”)反应。
2.下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
氧化
氧化
Mn
还原
还原
BD
Cl
温故知新
在氧化还原反应中,有的元素的化合价升高,有的元素化合价降低,那么,含有这些元素的化合物起什么作用?又叫做什么呢?
高温
2CuO+C 2Cu+CO2↑
得到2x2e-
高温
Fe2O3+3CO 2Fe+3CO2
得到2x3e-
失去3x2e-
+2
-2
0
0
+4
-2
-2
+4
-2
+2
-2
0
+3
失去1x4e-
一、氧化剂、还原剂及相关概念
高温
2CuO+C 2Cu+CO2↑
化合价降低,还原反应
高温
Fe2O3+3CO 2Fe+3CO2
化合价降低,还原反应
化合价升高,氧化反应
+2
-2
0
0
+4
-2
-2
+4
-2
+2
-2
0
+3
化合价升高, 氧化反应
还原剂
氧化剂
还原产物
氧化产物
还原剂
氧化剂
还原产物
氧化产物
一、氧化剂、还原剂及相关概念
2
氧化产物与还原产物
1
氧化剂与还原剂
氧化剂:所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
氧化产物:还原剂失去电子被氧化所得的产物。
还原产物:氧化剂得到电子被还原所得的产物。
生成物
反应物
一、氧化剂、还原剂及相关概念
3
氧化性与还原性
氧化性:物质得电子(或电子对偏向)的性质或能力。
还原性:物质失电子(或电子对偏离)的性质或能力。
还原剂
氧化剂
e-
失电子
(或电子对偏离)
的物质
得电子
(或电子对偏向)
的物质
还原剂和氧化剂的关系
氧化剂
氧化
性
得电子
价降低
还原
反应
被还
原
还原
产物
还原
剂
还原
性
失电子
价升高
氧化
反应
被氧
化
氧化
产物
具有
发生
生成
具有
生成
物质
性质
转移电子
变价
反应
过程
产物
发生
升 失 氧 还原剂
降 得 还 氧化剂
一、氧化剂、还原剂及相关概念
注意:在有些反应中,氧化剂和还原剂可能是同一种物质氧化产物和还原产物也可能是同一种。
一、氧化剂、还原剂及相关概念
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
1. 判断下列反应的氧化剂和还原剂:
① Fe + CuSO4 == Cu + FeSO4
② MnO2 + 4HCl MnCl2+Cl2↑+2H2O
③ 3NO2+H2O == 2HNO3+NO
④ 2KMnO4 K2MnO4+MnO2+O2↑
随堂检测
氧化产物
某种物质没有“身份”
某种物质有两种“身份”
还原剂
氧化剂
还原产物
氧化剂
还原剂
还原剂
氧化剂
还原产物
还原产物
氧化产物
某些物质“身份”相同
还原剂
氧化剂
氧化产物
还原产物
还原产物
氧化产物
一、氧化剂、还原剂及相关概念
4
常见的氧化剂与还原剂
常见的氧化剂:
① 活泼的非金属单质:如Cl2、O2等;
② 变价元素的高价态化合物:
如浓H2SO4、HNO3、H2O2、Na2O2、KMnO4、FeCl3、NaClO等。
常见的还原剂:
① 活泼的金属单质:如Al、Fe、Zn等。
② 某些非金属单质:如H2、S、C等。
③变价元素的低价态化合物:如CO、SO2、H2S、Na2S、FeCl2等。
二、比较物质氧化性和还原性的强弱
【思考1】如何判断某物质在氧化还原反应中是做氧化剂是还原剂?
中心元素具有降价趋势的物质常做氧化剂
中心元素具有升价趋势的物质常做还原剂
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
含锰元素的常见物质:Mn、 MnCl2、MnO2、K2MnO4、 KMnO4
0
+2
+4
+7
+6
容易变价的元素
为什么KMnO4做氧化剂?
+7
1.根据元素价态判断物质的氧化性、还原性强弱
【思考2】 H2S、 S、SO2 和浓H2SO4各自体现什么性质呢?
化合价
0
+4
+6
-2
浓H2SO4
SO2
S
H2S
只有氧化性
只有还原性
既有氧化性
又有还原性
结论:元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性;
即”高价氧,低价还,中间价态两边转“
2.根据反应方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
氧化性:氧化剂大于氧化产物; 还原性:还原剂大于还原产物。
微点拨
氧化性强
氧化性弱
还原性强
还原性弱
随堂检测
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+,Sn2++2Fe3+===2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ce3+
B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+、Ce3+
A
3.根据金属和非金属活动性顺序表
K+
Ca+
Na+
Mg+
Al3+
Zn2+
Fe2+
Sn2+
Pb2+
(H+)
Cu2+
Hg2+
Ag+
单质的还原性逐渐减弱
阳离子的氧化性逐渐增强
单质易失电子,
对应阳离子不易得电子
F2 Cl2 Br2 I2 S
F-
Cl-
Br-
I-
S2-
单质的氧化性逐渐减弱
即“易失不易得,易得不易失”
单质易得电子,
对应阴离子不易失电子
阴离子的还原性逐渐增强
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
4.根据反应条件
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,
如是否加热、有无催化剂和反应物浓度大小等。
由反应条件知氧化性:KMnO4>MnO2>O2。
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
MnO2+4HCl MnCl2 +Cl2↑+2H2O
O2+4HCl 2Cl2+2H2O
4.根据反应条件
同一种物质,浓度越大,氧化性(或还原性)越强。
如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;
还原性:浓HCI>稀HCI
同一种物质,温度越高其氧化性越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强
同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
浓度
温度
酸碱性
教材延伸
5.根据产物中变价元素的价态
氧化性:Cl2>S
(2)相同条件下不同还原剂作用于同一种氧化剂,
还原产物价态低的其还原性强。
例如:根据Cu+2Fe3+===Cu2++2Fe2+
3Zn+2Fe3+===3Zn2++2Fe
还原性:Zn>Cu
(1)相同条件下不同氧化剂作用于同一种还原剂,
氧化产物价态高的其氧化性强。
例如:根据2Fe+3Cl2 2FeCl3
Fe+S FeS
三、氧化还原反应的存在应用
食品包装中的脱氧剂——还原铁粉
1.有利于人类生活和生产:金属的冶炼、电镀、燃料的燃烧等。
2.对人类生活和生产不利: 、 、
易燃物的自燃
食物的腐败
钢铁的锈蚀
红酒中添加SO2具有抗氧化的作用
