山西省运城市2023-2024学年高二上学期10月月考化学试题(含答案)
文档属性
| 名称 | 山西省运城市2023-2024学年高二上学期10月月考化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 510.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 00:00:00 | ||
图片预览



文档简介
运城市2023-2024学年高二上学期10月月考
化学
考生注意:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:选择性必修1第一章~第二章。
5.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5
一、单项选择题(本题共9小题,每小题3分,共27分。在每小题给出的四个选项中只有一项是符合题目要求的)
1.使用下列装置给液体升温时,将化学能转化为热能的是( )
A. B. C. D.
2.下列有关化学反应速率的叙述正确的是( )
A.NaCl溶液与溶液反应时,增大压强,可以使化学反应速率明显增大
B.升高温度,反应物分子中活化分子百分数增加,化学反应速率增大
C.反应体系中加入相同浓度的反应物,活化分子百分数增大,化学反应速率增大
D.Na与水反应时,增加水的用量,可以使化学反应速率明显增大
3.下列依据热化学方程式得出的结论正确的是( )
选项 热化学方程式 结论
A 金刚石比石墨稳定
B 燃烧热为
C 浓硫酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
D 、
4.在一定温度下,向2L的密闭容器中充入和一定量的氧气发生反应,当反应进行到4min时,测得此时为0.4mol,反应进行到2min时,密闭容器中的物质的量是( )
A.1.6mol B.1.2mol C.小于1.2mol D.大于1.6mol
5.已知:。若反应速率分别用、、、表示,则下列关系正确的是( )
A. B.
C. D.
6.在密闭容器中,发生反应 ,当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
A.增大容器体积 B.降低温度
C.恒容下充入HI气体 D.加入催化剂
7.下列叙述中错误的是( )
A.常温下,不能自发进行,则该反应一定大于0
B.对于反应,恒温恒压条件下,充入稀有气体,平衡不移动
C.工业合成氨中,采取迅速冷却的方法,使气态氨变成液氨后从平衡混合物中分离出去,有利于提高反应物的转化率
D.CO、与人体血液中的血红蛋白(Hb)建立平衡:,当CO中毒时,应将中毒患者转移至高压氧仓吸氧
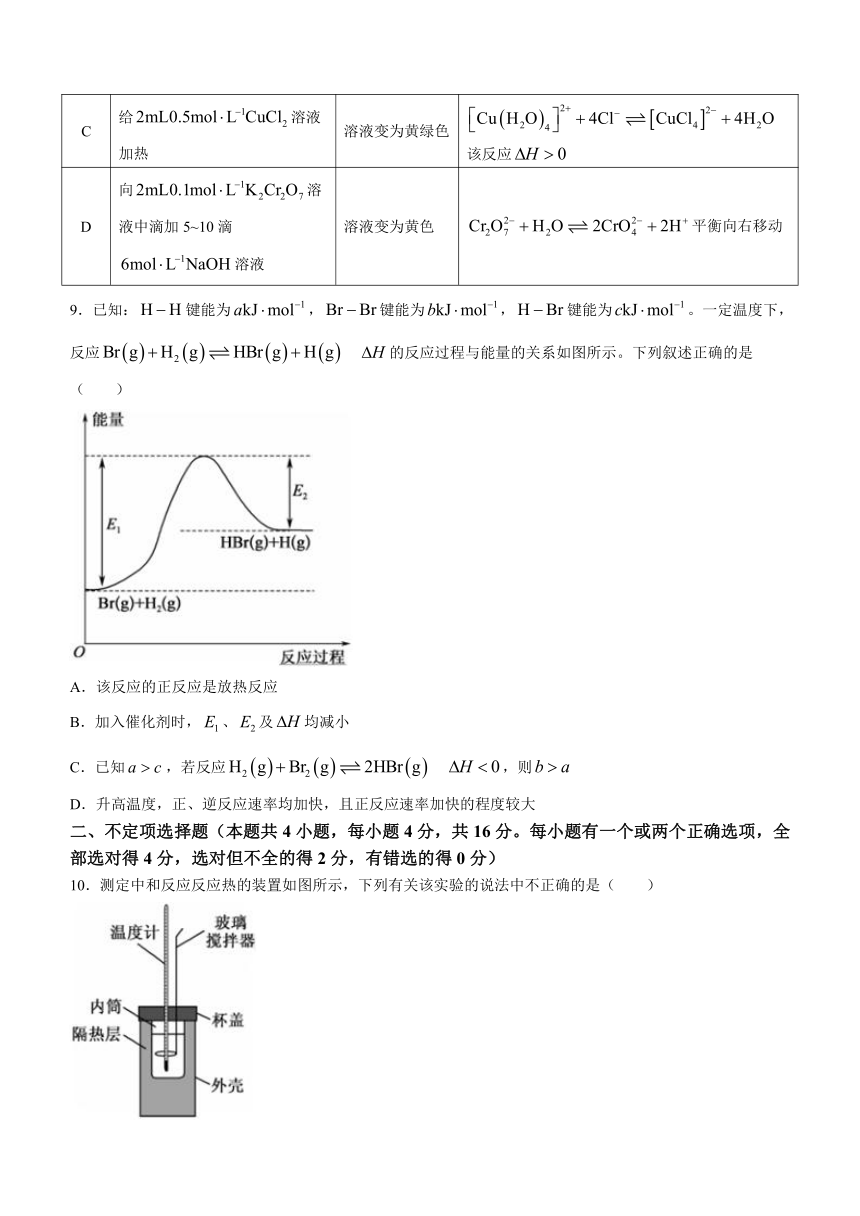
8.下列表格中对实验操作和实验现象所做的解释或结论错误的是( )
选项 实验操作 实验现象 解释或结论
A 将装有红棕色气体的注射器由10mL压缩至5mL 压缩后的气体颜色比压缩前的深 平衡向左移动
B 向含有的红色溶液中加入少量铁粉,振荡静置 溶液红色变浅 平衡向左移动
C 给溶液加热 溶液变为黄绿色 该反应
D 向溶液中滴加5~10滴溶液 溶液变为黄色 平衡向右移动
9.已知:键能为,键能为,键能为。一定温度下,反应 的反应过程与能量的关系如图所示。下列叙述正确的是( )
A.该反应的正反应是放热反应
B.加入催化剂时,、及均减小
C.已知,若反应 ,则
D.升高温度,正、逆反应速率均加快,且正反应速率加快的程度较大
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一个或两个正确选项,全部选对得4分,选对但不全的得2分,有错选的得0分)
10.测定中和反应反应热的装置如图所示,下列有关该实验的说法中不正确的是( )
A.杯盖和外壳的作用是隔热,减少热量的散失
B.使用玻璃搅拌器使反应更充分
C.实验需要记录反应前初始温度及反应后溶液达到的最高温度
D.测定中和反应热时,可以选用NaOH固体和稀盐酸
11.一定温度下,溶液发生催化分解。不同时刻测得生成的的体积(已折算为标准状况下)如表。
t/min 0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
下列叙述正确的是( )(溶液体积变化忽略不计)
A.或可以催化分解
B.第4min时的瞬时速率小于第6min时的瞬时速率
C.反应至6min时,分解率为50%
D.0~6min的平均反应速率:
12.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知和的相对能量为0,下列说法不正确的是( )
A.在历程II中作催化剂
B.相同条件下,的平衡转化率:历程II>历程I
C.的
D.历程I、历程II中速率最快的一步反应的热化学方程式为
13.在容积为2L的密闭容器中发生反应:。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始的变化关系,下列说法正确的是( )
A.中,
B.200℃,反应从开始到平衡的平均速率
C.由图乙可知,反应的,且
D.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正、逆反应速率均增大
三、非选择题(本题包括4小题,共57分)
14.(15分)化学变化中既存在物质间的相互转化,也存在能量间的相互转化,依据题意回答下列问题:
(1)生活中处处与化学反应有关,下列生活中发生的反应属于吸热反应的是________(填字母)。
a.食物的腐败 b.生石灰制熟石灰 c.烘焙糕点时小苏打受热分解
(2)在标准状况下,11.2L仅由C、H两种元素组成的某气体质量为8g,在25℃和101kPa下完全燃烧生成和时,放出445.15kJ的热量。
①该气体的分子式为________。
②表示该气体燃烧热的热化学方程式为________。
(3)以、为原料生产尿素的反应历程与能量变化如图所示。
①以、为原料生产尿素的热化学方程式为________。
②两步反应中,________(填“第一步”或“第二步”)反应是快反应。
(4)火箭发射时可以用肼(,液态)作燃料,作氧化剂,已知① ;② ,则和反应只生成氮气和水蒸气的热化学方程式为________。
15.(14分)可作为水溶液中歧化反应的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
实验编号 反应物 试剂组成 实验现象
① 饱和溶液 a 无明显现象
② 饱和溶液 一段时间出现浑浊
③ 稀溶液 出现浑浊较②慢
④ 饱和溶液 、 出现浑浊较②快
⑤ 饱和溶液 无明显现象
回答下列问题:
(1)实验①、②说明是水溶液中歧化反应的催化剂,则a应是________(填化学式)。
(2)实验②、③的目的是________。
(3)实验①、⑤说明________,实验②是实验④的对比实验,则________,可得出的结论是________。
(4)可作为水溶液中歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.
ii.________________
16.(14分)“碳达峰·碳中和”是我国社会发展重大战略之一,以、为原料合成甲醇是实现“双碳”经济的有效途径之一。回答下列问题:
已知:①
②
(1)以、为原料合成甲醇:。
①该反应的________。
②为同时提高的平衡转化率和的平衡产率,应选择的反应条件为________(填字母)。
A.低温、低压 B.高温、低压 C.低温、高压 D.高温、高压
(2)T℃时,向容积为2L的密闭容器中充入和,并加入催化剂合成甲醇:,容器中的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,的物质的量随时间的变化。
①该反应在0~8min内,的平均反应速率是________。
②T℃时,该反应的化学平衡常数________。
③曲线I、II改变的条件分别可能是________、________。
(3)在一定温度下的恒容密闭容器中,能说明达到平衡状态的是________(填字母)。
a.容器中混合气体的密度不再改变
b.容器中的压强不再改变
c.和的浓度之比为3:1
17.(14分)2018年是哈伯因发明用氮气和氢气合成氨的方法而获得诺贝尔奖100周年。氨是重要的化学品之一,我国目前的生产能力位居世界首位,回答下列问题:
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中和物质的量之比为1:2.8的条件下合成氨。分析说明原料气中过量的理由是________。
(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应: ,其化学平衡常数K与温度T的关系如表所示。
T/℃ 200 300 400
K 0.5
①试比较、的大小,________(填“>”“<”或“=”)。
②400℃时,反应的化学平衡常数为________。
③400℃时,反应中,当测得、和物质的量分别为3mol、2mol和1mol时,则该反应________(填“达到平衡状态”“正向进行”或“逆向进行”)。
(3)已知物质i的摩尔分数:,在不同压强下,以、进料,反应达到平衡时氨的摩尔分数与温度间的关系如下图所示。
①图中压强由大到小的顺序是________,判断的依据是________。
②当、时,氢气的转化率________(计算结果保留三位有效数字)。
运城市2023-2024学年高二上学期10月月考
化学
参考答案、解析及评分细则
1.C 2.B 3.D 4.C 5.A
6.C 7.B 8.A 9.D 10.D
11.AD 12.B 13.BC
14.(1)c(2分)
(2)①(2分) ② (3分)
(3)① (3分)
②第一步(2分)
(4) (3分)
15.(1)(2分)
(2)探究浓度对水溶液中歧化反应速率的影响(2分)
(3)单独存在时不具有催化作用(2分) 0.4(2分) 存在时,可以加快水溶液中歧化反应速率(2分)
(4)(2分) (2分)
16.(1)①(2分) ②C(2分)
(2)①(2分,数字和单位有1处错误,均不得分) ②0.5(2分,单位不做要求)
③升高温度(2分) 增大压强(或增大浓度)(2分)
(3)b(2分)
17.(1)原料气中相对易得,适度过量有利于提高的转化率(2分)
(2)①>(2分) ②2(2分) ③逆向进行(2分)
(3)①(2分) 该反应为气体分子数减小的反应,当温度不变时,压强越大,的摩尔分数越大(2分) ②33.3%(2分)
化学
考生注意:
1.本试卷满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:选择性必修1第一章~第二章。
5.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5
一、单项选择题(本题共9小题,每小题3分,共27分。在每小题给出的四个选项中只有一项是符合题目要求的)
1.使用下列装置给液体升温时,将化学能转化为热能的是( )
A. B. C. D.
2.下列有关化学反应速率的叙述正确的是( )
A.NaCl溶液与溶液反应时,增大压强,可以使化学反应速率明显增大
B.升高温度,反应物分子中活化分子百分数增加,化学反应速率增大
C.反应体系中加入相同浓度的反应物,活化分子百分数增大,化学反应速率增大
D.Na与水反应时,增加水的用量,可以使化学反应速率明显增大
3.下列依据热化学方程式得出的结论正确的是( )
选项 热化学方程式 结论
A 金刚石比石墨稳定
B 燃烧热为
C 浓硫酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
D 、
4.在一定温度下,向2L的密闭容器中充入和一定量的氧气发生反应,当反应进行到4min时,测得此时为0.4mol,反应进行到2min时,密闭容器中的物质的量是( )
A.1.6mol B.1.2mol C.小于1.2mol D.大于1.6mol
5.已知:。若反应速率分别用、、、表示,则下列关系正确的是( )
A. B.
C. D.
6.在密闭容器中,发生反应 ,当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
A.增大容器体积 B.降低温度
C.恒容下充入HI气体 D.加入催化剂
7.下列叙述中错误的是( )
A.常温下,不能自发进行,则该反应一定大于0
B.对于反应,恒温恒压条件下,充入稀有气体,平衡不移动
C.工业合成氨中,采取迅速冷却的方法,使气态氨变成液氨后从平衡混合物中分离出去,有利于提高反应物的转化率
D.CO、与人体血液中的血红蛋白(Hb)建立平衡:,当CO中毒时,应将中毒患者转移至高压氧仓吸氧
8.下列表格中对实验操作和实验现象所做的解释或结论错误的是( )
选项 实验操作 实验现象 解释或结论
A 将装有红棕色气体的注射器由10mL压缩至5mL 压缩后的气体颜色比压缩前的深 平衡向左移动
B 向含有的红色溶液中加入少量铁粉,振荡静置 溶液红色变浅 平衡向左移动
C 给溶液加热 溶液变为黄绿色 该反应
D 向溶液中滴加5~10滴溶液 溶液变为黄色 平衡向右移动
9.已知:键能为,键能为,键能为。一定温度下,反应 的反应过程与能量的关系如图所示。下列叙述正确的是( )
A.该反应的正反应是放热反应
B.加入催化剂时,、及均减小
C.已知,若反应 ,则
D.升高温度,正、逆反应速率均加快,且正反应速率加快的程度较大
二、不定项选择题(本题共4小题,每小题4分,共16分。每小题有一个或两个正确选项,全部选对得4分,选对但不全的得2分,有错选的得0分)
10.测定中和反应反应热的装置如图所示,下列有关该实验的说法中不正确的是( )
A.杯盖和外壳的作用是隔热,减少热量的散失
B.使用玻璃搅拌器使反应更充分
C.实验需要记录反应前初始温度及反应后溶液达到的最高温度
D.测定中和反应热时,可以选用NaOH固体和稀盐酸
11.一定温度下,溶液发生催化分解。不同时刻测得生成的的体积(已折算为标准状况下)如表。
t/min 0 2 4 6 8 10
0.0 9.9 17.2 22.4 26.5 29.9
下列叙述正确的是( )(溶液体积变化忽略不计)
A.或可以催化分解
B.第4min时的瞬时速率小于第6min时的瞬时速率
C.反应至6min时,分解率为50%
D.0~6min的平均反应速率:
12.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下,已知和的相对能量为0,下列说法不正确的是( )
A.在历程II中作催化剂
B.相同条件下,的平衡转化率:历程II>历程I
C.的
D.历程I、历程II中速率最快的一步反应的热化学方程式为
13.在容积为2L的密闭容器中发生反应:。图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始的变化关系,下列说法正确的是( )
A.中,
B.200℃,反应从开始到平衡的平均速率
C.由图乙可知,反应的,且
D.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正、逆反应速率均增大
三、非选择题(本题包括4小题,共57分)
14.(15分)化学变化中既存在物质间的相互转化,也存在能量间的相互转化,依据题意回答下列问题:
(1)生活中处处与化学反应有关,下列生活中发生的反应属于吸热反应的是________(填字母)。
a.食物的腐败 b.生石灰制熟石灰 c.烘焙糕点时小苏打受热分解
(2)在标准状况下,11.2L仅由C、H两种元素组成的某气体质量为8g,在25℃和101kPa下完全燃烧生成和时,放出445.15kJ的热量。
①该气体的分子式为________。
②表示该气体燃烧热的热化学方程式为________。
(3)以、为原料生产尿素的反应历程与能量变化如图所示。
①以、为原料生产尿素的热化学方程式为________。
②两步反应中,________(填“第一步”或“第二步”)反应是快反应。
(4)火箭发射时可以用肼(,液态)作燃料,作氧化剂,已知① ;② ,则和反应只生成氮气和水蒸气的热化学方程式为________。
15.(14分)可作为水溶液中歧化反应的催化剂。某实验小组为探究浓度、催化剂和溶液酸性对歧化反应速率的影响,分别在盛有反应物的试管中加入2mL相应试剂,密闭放置观察现象。
实验编号 反应物 试剂组成 实验现象
① 饱和溶液 a 无明显现象
② 饱和溶液 一段时间出现浑浊
③ 稀溶液 出现浑浊较②慢
④ 饱和溶液 、 出现浑浊较②快
⑤ 饱和溶液 无明显现象
回答下列问题:
(1)实验①、②说明是水溶液中歧化反应的催化剂,则a应是________(填化学式)。
(2)实验②、③的目的是________。
(3)实验①、⑤说明________,实验②是实验④的对比实验,则________,可得出的结论是________。
(4)可作为水溶液中歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.
ii.________________
16.(14分)“碳达峰·碳中和”是我国社会发展重大战略之一,以、为原料合成甲醇是实现“双碳”经济的有效途径之一。回答下列问题:
已知:①
②
(1)以、为原料合成甲醇:。
①该反应的________。
②为同时提高的平衡转化率和的平衡产率,应选择的反应条件为________(填字母)。
A.低温、低压 B.高温、低压 C.低温、高压 D.高温、高压
(2)T℃时,向容积为2L的密闭容器中充入和,并加入催化剂合成甲醇:,容器中的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,的物质的量随时间的变化。
①该反应在0~8min内,的平均反应速率是________。
②T℃时,该反应的化学平衡常数________。
③曲线I、II改变的条件分别可能是________、________。
(3)在一定温度下的恒容密闭容器中,能说明达到平衡状态的是________(填字母)。
a.容器中混合气体的密度不再改变
b.容器中的压强不再改变
c.和的浓度之比为3:1
17.(14分)2018年是哈伯因发明用氮气和氢气合成氨的方法而获得诺贝尔奖100周年。氨是重要的化学品之一,我国目前的生产能力位居世界首位,回答下列问题:
(1)工业上通常采用铁触媒作催化剂,在400℃~500℃、10~30MPa,原料气中和物质的量之比为1:2.8的条件下合成氨。分析说明原料气中过量的理由是________。
(2)若在1L的密闭容器中,一定量的氮气和氢气进行如下反应: ,其化学平衡常数K与温度T的关系如表所示。
T/℃ 200 300 400
K 0.5
①试比较、的大小,________(填“>”“<”或“=”)。
②400℃时,反应的化学平衡常数为________。
③400℃时,反应中,当测得、和物质的量分别为3mol、2mol和1mol时,则该反应________(填“达到平衡状态”“正向进行”或“逆向进行”)。
(3)已知物质i的摩尔分数:,在不同压强下,以、进料,反应达到平衡时氨的摩尔分数与温度间的关系如下图所示。
①图中压强由大到小的顺序是________,判断的依据是________。
②当、时,氢气的转化率________(计算结果保留三位有效数字)。
运城市2023-2024学年高二上学期10月月考
化学
参考答案、解析及评分细则
1.C 2.B 3.D 4.C 5.A
6.C 7.B 8.A 9.D 10.D
11.AD 12.B 13.BC
14.(1)c(2分)
(2)①(2分) ② (3分)
(3)① (3分)
②第一步(2分)
(4) (3分)
15.(1)(2分)
(2)探究浓度对水溶液中歧化反应速率的影响(2分)
(3)单独存在时不具有催化作用(2分) 0.4(2分) 存在时,可以加快水溶液中歧化反应速率(2分)
(4)(2分) (2分)
16.(1)①(2分) ②C(2分)
(2)①(2分,数字和单位有1处错误,均不得分) ②0.5(2分,单位不做要求)
③升高温度(2分) 增大压强(或增大浓度)(2分)
(3)b(2分)
17.(1)原料气中相对易得,适度过量有利于提高的转化率(2分)
(2)①>(2分) ②2(2分) ③逆向进行(2分)
(3)①(2分) 该反应为气体分子数减小的反应,当温度不变时,压强越大,的摩尔分数越大(2分) ②33.3%(2分)
同课章节目录
