化学人教版(2019)必修第一册1.3.1氧化还原反应 课件(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应 课件(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 741.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-12 19:54:14 | ||
图片预览





文档简介
(共23张PPT)
课题导入
问题一
Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种呢
△
第一章 物质及其变化
第三节 氧化还原反应
第1课时
目标引领
1.知道什么是氧化还原反应
如何判断氧化还原反应;
2.知道氧化还原反应和四种基本反应类型的关系
3.氧化还原反应中电子转移的表示方法
氧化反应
硫在氧气中燃烧
镁条在氧气中燃烧
钢铁生锈
初中学过哪些氧化反应和还原反应?
还原反应
氢气还原氧化铜
思考与交流
CuO+H2= Cu+H2O
△
2CuO+C = 2Cu+CO2↑
高温
2Mg+O2==2MgO
点燃
S + O2== SO2
点燃
氧化反应和还原反应都是独立进行的吗
氧化反应:得到氧的反应。
还原反应:失去氧的反应。
引导探究
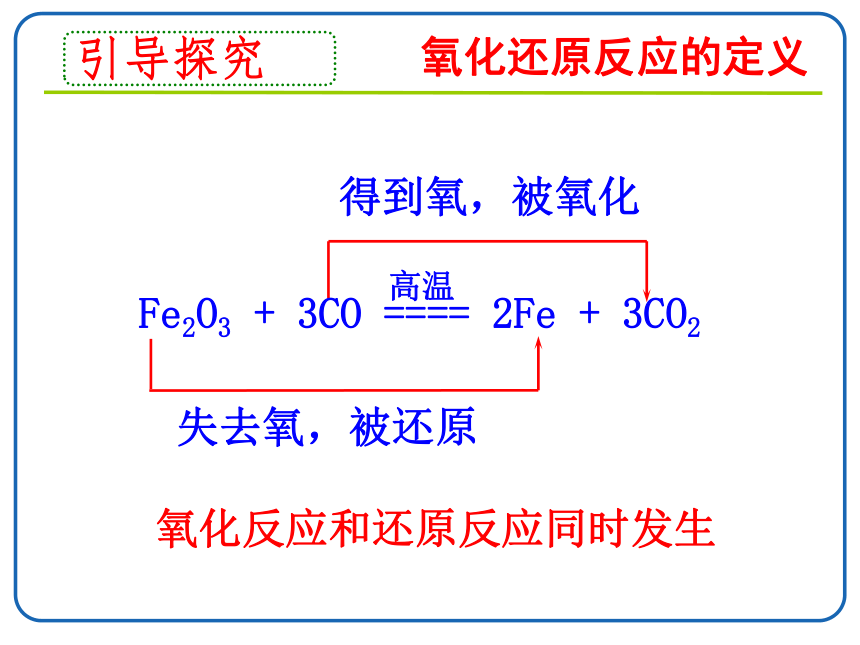
氧化还原反应的定义
引导探究
得到氧,被氧化
失去氧,被还原
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
氧化反应和还原反应同时发生
归纳小结1
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
一、氧化还原反应
1、从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应
叫做氧化还原反应。
氧化反应和还原反应同时发生!
氧化还原反应的定义
引导探究
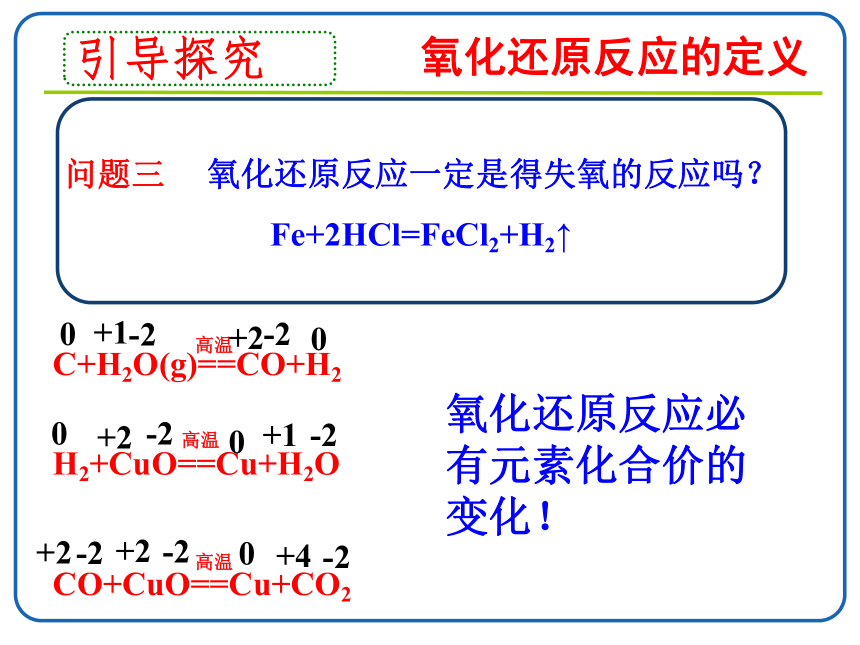
问题三 氧化还原反应一定是得失氧的反应吗?Fe+2HCl=FeCl2+H2↑
C+H2O(g)==CO+H2
H2+CuO==Cu+H2O
CO+CuO==Cu+CO2
高温
高温
高温
0
0
-2
+1
+2
-2
0
0
+2
-2
+1
-2
+2
-2
+2
-2
0
+4
-2
氧化还原反应必有元素化合价的变化!
氧化还原反应的定义
引导探究
得到氧,氧化反应
失去氧,还原反应
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
化合价降低,还原反应
化合价升高,氧化反应
归纳小结2
氧化反应:
还原反应:
一、氧化还原反应定义
2、从化合价升降的角度:
有元素化合价升降的反应叫做氧化还原反应。
3、特征:有元素化合价的升降
4、判据:有无元素化合价的升降
化合价升高的反应
化合价降低的反应
引导探究
问题:氧化还原反应中元素化合价为什么发生升降?
即氧化还原反应的本质是什么呢
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
点燃
氯气与钠的反应:
点燃
氯原子, 1个电子,生成 ,化合价 ,发生 反应。
钠原子, 1个电子,生成 ,化合价 ,发生 反应。
得到
降低
还原
氧化
升高
失去
引导探究
+11
+17
+17
+11
Na+ Cl-
点燃
氯气与氢气的反应:
氯原子,共用电子对 ,化合价 ,发生 反应。
钠原子,共用电子对 ,化合价 ,发生 反应。
降低
还原
氧化
升高
引导探究
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
H2 + Cl2 = 2HCl
0
0
+1
归纳小结3
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化反应:失去电子(或共用电子对偏离)的反应
还原反应:得到电子(或共用电子对偏向)的反应
小结
从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化
还原反应的判断依据)
从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
1、Fe+CuSO4=FeSO4+Cu
2、Zn+H2SO4=ZnSO4+H2↑
3、NaOH+HCl=NaCl+H2O
4、BaCl2+H2SO4=BaSO4↓+2HCl
7、CaO+H2O = Ca(OH)2
置换
置换
复分解
复分解
分解
分解
化合
化合
6、CaCO3===CaO+CO2↑
高温
5、2KClO3==2KCl+3O2↑
△
MnO2
判断下列反应是否为氧化还原反应
小小练
氧化还原反应
8、2Cu+O2===2CuO
△
氧化还原反应与四大基本反应关系
引导探究2
分解反应
化合反应
复分解反应
置换反应
氧化还原反应和四大基本反应类型的关系:
氧化还原反应
当堂诊学
1.有单质参加的化合反应一定是氧化还原反应( )
2.有单质生成的分解反应一定是氧化还原反应( )
3.有单质参加或有单质生成的反应一定是氧化还原反
应。( )
判断正误
3O2===2O3
放电
2KClO3==2KCl+3O2↑
△
MnO2
4Fe+3O2===2Fe2O3
△
√
×
√
氧化还原反应表示的方法
引导探究
+3 0 0 +3
得到2x3e-
失去2x3e-
1.双线桥表示法
一写:写出正确的氧化还原反应方程式;
二标:标出变价元素的化合价;
三画:画两条箭桥,一条升价的箭桥,一条降价的箭桥。(由反应物中的变价元素指向生成物中的同种元素) ;
四注: 在箭桥上注明得失电子数;
注意:箭头不表示电子转移的方向
氧化还原反应表示的方法
引导探究
难点: “得”“失”电子数目的判断
+3 0 0 +3
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
单个Fe原子得到3个电子
两个Fe原子
单个Al原子失去3个电子
两个Al原子
小结:电子转移数=“得到”或“失去”的电子数
=变价原子的个数×单个变价原子得到(失去)的电子数
氧化还原反应表示的方法
引导探究
用双线桥法表示下列方程式电子转移的数目
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4×e-。
部分氧化还原反应
完全氧化还原反应
自身氧化还原反应
该反应中,两种变价元素在同一种物质中。
(4) Cl2+2NaOH NaCl+NaClO+H2O
歧化反应
该反应中,同一反应物中同种元素的化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为1:1。
(5) 2H2S+SO2 3S+2H2O
归中反应
该反应中,不同反应物中的硫原子化合价既升高又降低,氧化产物和还原产物的硫原子个数比为2:1。
(2) MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
(1)Fe + CuSO4 FeSO4 + Cu
(3)Cl2+2NaOH=NaCl+NaClO+H2O
氧化还原反应表示的方法
引导探究
书写方法
一写:写出正确的氧化还原反应方程式;
三画:画一条箭桥;(箭头总是失去电子化合价升高的元素
指向得到电子化合价降低的元素)
四注:在箭桥上标出转移电子数目,不写“得” “ 失”。
2.单线桥表示法
二标:标出变价元素的化合价;
4e-
2CuO + C 2Cu + CO2↑
注意:箭头表示的就是电子转移的方向
+2 0 0 +4
(3) Cl2+2NaOH NaCl+NaClO+H2O
(4) 2H2S+SO2 3S+2H2O
(2) MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
(1)Fe + CuSO4 FeSO4 + Cu
用单线桥法表示下列方程式电子转移的数目
课题导入
问题一
Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种呢
△
第一章 物质及其变化
第三节 氧化还原反应
第1课时
目标引领
1.知道什么是氧化还原反应
如何判断氧化还原反应;
2.知道氧化还原反应和四种基本反应类型的关系
3.氧化还原反应中电子转移的表示方法
氧化反应
硫在氧气中燃烧
镁条在氧气中燃烧
钢铁生锈
初中学过哪些氧化反应和还原反应?
还原反应
氢气还原氧化铜
思考与交流
CuO+H2= Cu+H2O
△
2CuO+C = 2Cu+CO2↑
高温
2Mg+O2==2MgO
点燃
S + O2== SO2
点燃
氧化反应和还原反应都是独立进行的吗
氧化反应:得到氧的反应。
还原反应:失去氧的反应。
引导探究
氧化还原反应的定义
引导探究
得到氧,被氧化
失去氧,被还原
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
氧化反应和还原反应同时发生
归纳小结1
氧化反应:物质得到氧的反应
还原反应:物质失去氧的反应
一、氧化还原反应
1、从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应
叫做氧化还原反应。
氧化反应和还原反应同时发生!
氧化还原反应的定义
引导探究
问题三 氧化还原反应一定是得失氧的反应吗?Fe+2HCl=FeCl2+H2↑
C+H2O(g)==CO+H2
H2+CuO==Cu+H2O
CO+CuO==Cu+CO2
高温
高温
高温
0
0
-2
+1
+2
-2
0
0
+2
-2
+1
-2
+2
-2
+2
-2
0
+4
-2
氧化还原反应必有元素化合价的变化!
氧化还原反应的定义
引导探究
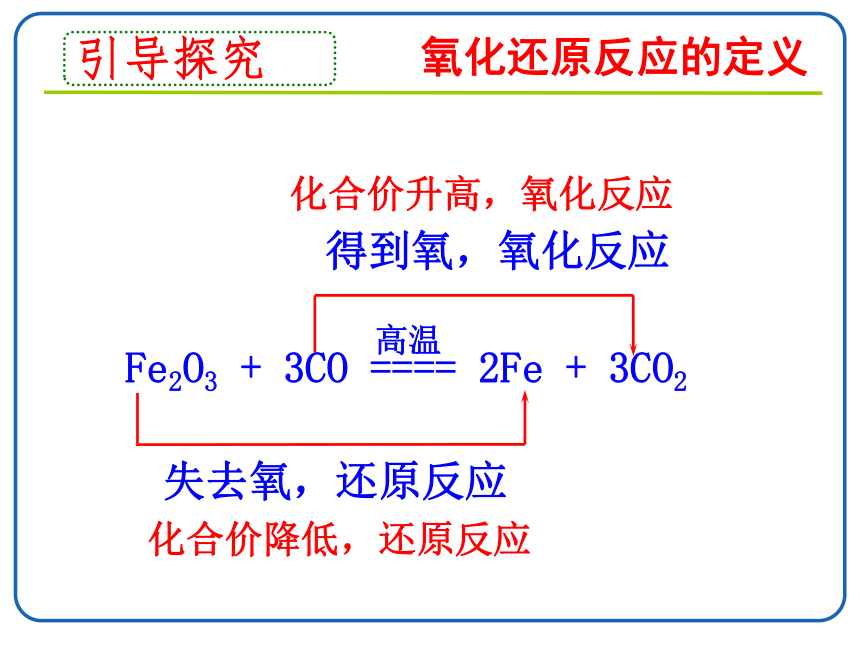
得到氧,氧化反应
失去氧,还原反应
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
化合价降低,还原反应
化合价升高,氧化反应
归纳小结2
氧化反应:
还原反应:
一、氧化还原反应定义
2、从化合价升降的角度:
有元素化合价升降的反应叫做氧化还原反应。
3、特征:有元素化合价的升降
4、判据:有无元素化合价的升降
化合价升高的反应
化合价降低的反应
引导探究
问题:氧化还原反应中元素化合价为什么发生升降?
即氧化还原反应的本质是什么呢
电子走开,我要
形成相对稳定
结构!
来!我需要电子,
我也要形成相对
稳定结构!
点燃
氯气与钠的反应:
点燃
氯原子, 1个电子,生成 ,化合价 ,发生 反应。
钠原子, 1个电子,生成 ,化合价 ,发生 反应。
得到
降低
还原
氧化
升高
失去
引导探究
+11
+17
+17
+11
Na+ Cl-
点燃
氯气与氢气的反应:
氯原子,共用电子对 ,化合价 ,发生 反应。
钠原子,共用电子对 ,化合价 ,发生 反应。
降低
还原
氧化
升高
引导探究
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
H2 + Cl2 = 2HCl
0
0
+1
归纳小结3
电子得失
电子偏移
氧化还原反应的本质:电子转移(得失或偏移)
氧化还原反应是电子发生转移(得失或偏移)的反应
氧化反应:失去电子(或共用电子对偏离)的反应
还原反应:得到电子(或共用电子对偏向)的反应
小结
从得氧失氧角度分析
物质得到氧被氧化,物质失去氧被还原。
(仅局限于得氧失氧的反应)
从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
(元素化合价升降是氧化还原反应的表观特征,可作为氧化
还原反应的判断依据)
从电子转移角度分析(氧化还原反应的本质是电子转移)
有电子转移(得失或偏移)的化学反应是氧化还原反应。
1、Fe+CuSO4=FeSO4+Cu
2、Zn+H2SO4=ZnSO4+H2↑
3、NaOH+HCl=NaCl+H2O
4、BaCl2+H2SO4=BaSO4↓+2HCl
7、CaO+H2O = Ca(OH)2
置换
置换
复分解
复分解
分解
分解
化合
化合
6、CaCO3===CaO+CO2↑
高温
5、2KClO3==2KCl+3O2↑
△
MnO2
判断下列反应是否为氧化还原反应
小小练
氧化还原反应
8、2Cu+O2===2CuO
△
氧化还原反应与四大基本反应关系
引导探究2
分解反应
化合反应
复分解反应
置换反应
氧化还原反应和四大基本反应类型的关系:
氧化还原反应
当堂诊学
1.有单质参加的化合反应一定是氧化还原反应( )
2.有单质生成的分解反应一定是氧化还原反应( )
3.有单质参加或有单质生成的反应一定是氧化还原反
应。( )
判断正误
3O2===2O3
放电
2KClO3==2KCl+3O2↑
△
MnO2
4Fe+3O2===2Fe2O3
△
√
×
√
氧化还原反应表示的方法
引导探究
+3 0 0 +3
得到2x3e-
失去2x3e-
1.双线桥表示法
一写:写出正确的氧化还原反应方程式;
二标:标出变价元素的化合价;
三画:画两条箭桥,一条升价的箭桥,一条降价的箭桥。(由反应物中的变价元素指向生成物中的同种元素) ;
四注: 在箭桥上注明得失电子数;
注意:箭头不表示电子转移的方向
氧化还原反应表示的方法
引导探究
难点: “得”“失”电子数目的判断
+3 0 0 +3
得到2x3e-,化合价降低,被还原
失去2x3e-,化合价升高,被氧化
单个Fe原子得到3个电子
两个Fe原子
单个Al原子失去3个电子
两个Al原子
小结:电子转移数=“得到”或“失去”的电子数
=变价原子的个数×单个变价原子得到(失去)的电子数
氧化还原反应表示的方法
引导探究
用双线桥法表示下列方程式电子转移的数目
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4×e-。
部分氧化还原反应
完全氧化还原反应
自身氧化还原反应
该反应中,两种变价元素在同一种物质中。
(4) Cl2+2NaOH NaCl+NaClO+H2O
歧化反应
该反应中,同一反应物中同种元素的化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为1:1。
(5) 2H2S+SO2 3S+2H2O
归中反应
该反应中,不同反应物中的硫原子化合价既升高又降低,氧化产物和还原产物的硫原子个数比为2:1。
(2) MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
(1)Fe + CuSO4 FeSO4 + Cu
(3)Cl2+2NaOH=NaCl+NaClO+H2O
氧化还原反应表示的方法
引导探究
书写方法
一写:写出正确的氧化还原反应方程式;
三画:画一条箭桥;(箭头总是失去电子化合价升高的元素
指向得到电子化合价降低的元素)
四注:在箭桥上标出转移电子数目,不写“得” “ 失”。
2.单线桥表示法
二标:标出变价元素的化合价;
4e-
2CuO + C 2Cu + CO2↑
注意:箭头表示的就是电子转移的方向
+2 0 0 +4
(3) Cl2+2NaOH NaCl+NaClO+H2O
(4) 2H2S+SO2 3S+2H2O
(2) MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
(1)Fe + CuSO4 FeSO4 + Cu
用单线桥法表示下列方程式电子转移的数目
