2.4.1化学反应的调控课件(共38张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4.1化学反应的调控课件(共38张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 00:00:00 | ||
图片预览









文档简介
(共38张PPT)
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
学习目标 1min
1、认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2、能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
自学指导 6min
阅读课本第44-47页,完成课堂新坐标第35-36页
B
自学检测 3min
生成的NH3分离出后,再将未反应的N2、H2循环利用,可使氨的产率较高
选择500 ℃左右的温度,主要从
反应速率和催化剂活性两方面考虑
压强太大,对设备、动力的要求太高
自学检测 3min
×
×
×
充入的N2越多,H2的转化率越大,但过多未反应的N2会浪费。
×
ΔH<0, ΔS<0,低温自发
教师点拨 20min
氨是重要的无机化工产品之一,合成氨工业在国民经济中占有重要地位。农业上使用的氮肥,例如尿素、硝酸铵、磷酸铵、氯化铵以及各种含氮复合肥,都是以氨为原料的。
合成氨是大宗化工产品之一,世界每年合成氨产量已达到1亿吨以上,其中约有80%的氨用来生产化学肥料,20% 作为其它化工产品的原料。
N2+O2 2NO
放电
或高温
======
①电弧法固氮:
②人工合成氨
N2+3H2 2NH3
高温、高压
催化剂
用空气制造面包的圣人
——弗里茨·哈伯
如何从空气中获得肥料?
以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
请根据焓变和熵变分析在298K时合成氨反应能否自发进行?
ΔG = ΔH-TΔS = -33.14 kJ·mol-1<0,可以自发
且K(298K)=4 × 106,接近完全
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了土壤可吸收的形式。最好的原料是空气,因为它其中富含氮元素。
——卡尔 ·博施
N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2kJ mol-1 ΔS=-198.2J K-1 mol-1
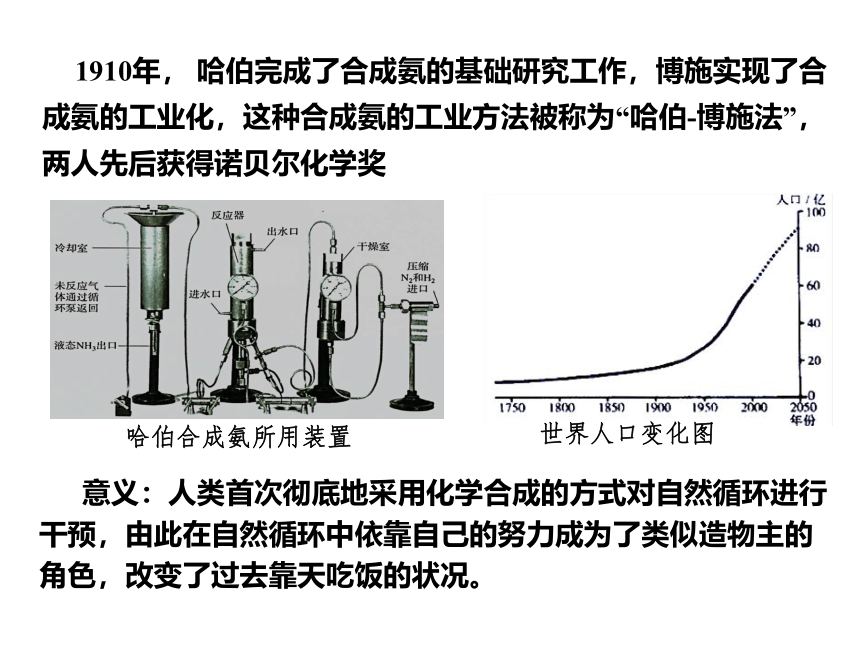
1910年, 哈伯完成了合成氨的基础研究工作,博施实现了合成氨的工业化,这种合成氨的工业方法被称为“哈伯-博施法”,两人先后获得诺贝尔化学奖
意义:人类首次彻底地采用化学合成的方式对自然循环进行干预,由此在自然循环中依靠自己的努力成为了类似造物主的角色,改变了过去靠天吃饭的状况。
哈伯合成氨所用装置
世界人口变化图
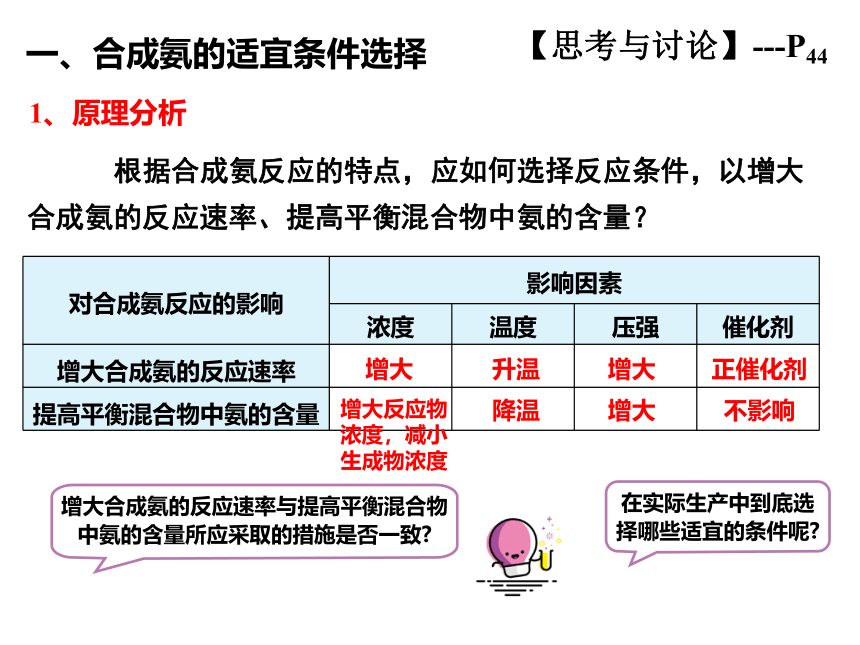
1、原理分析
一、合成氨的适宜条件选择
【思考与讨论】---P44
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致
在实际生产中到底选择哪些适宜的条件呢
对合成氨反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大
增大反应物浓度,减小生成物浓度
升温
降温
增大
增大
正催化剂
不影响
下表中的实验数据是在不同温度、压强下,平衡混合物中氨的含量变化情况(初始时氮气和氢气的体积比是1:3)。分析表中数据,结合成成氨反应的特点,讨论应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量。
压强↑,NH3%↑。
温度↓,NH3%↑。
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
2、数据分析
图1:平衡混合物中氨的含量与温度、压强的关系
温度升高,氨的含量降低
压强增大,氨的含量增大
高压、低温有利于合成氨
NH3含量的实验测定结果
2、数据分析
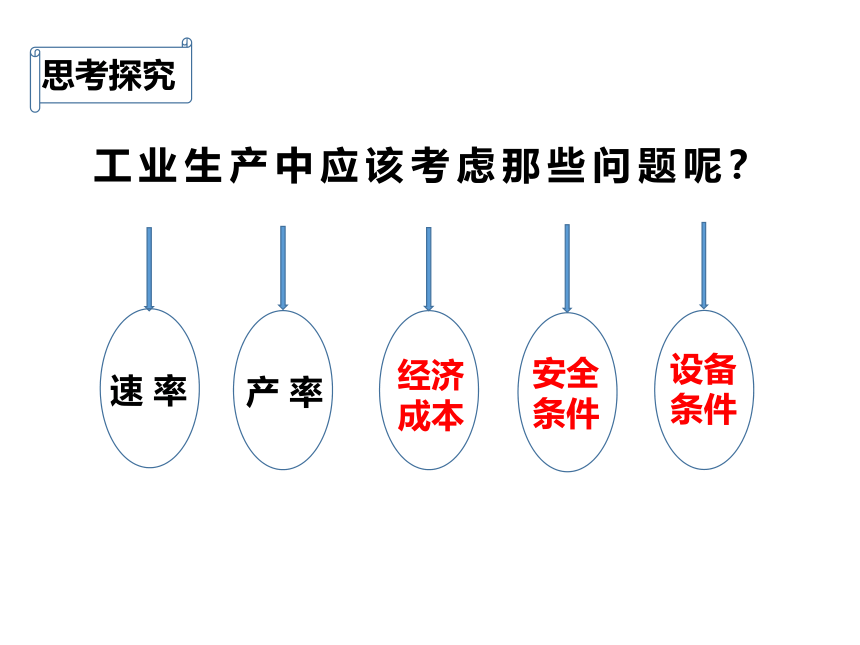
工业生产中应该考虑那些问题呢?
速 率
产 率
经济
成本
设备
条件
安全条件
思考探究
升高温度、增大压强、增大反应物浓度及使用催化剂等,都可以使合成氨的反应速率增大;降低温度、增大压强、增大反应物浓度等有利于提高平衡混合物中氨的含量。催化剂可以增大反应速率,但不改变平衡混合物的组成。那么,在实际生产中到底选择哪些适宜的条件呢?
1. 压强
合成氨时压强越大越好;但压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。目前,我国的合成氨厂一般采用的压强为
10 MPa~30 MPa。
2.温度
根据平衡移动原理,合成氨应采用低温以提高平衡转化率。但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。因此,需要选择一个适宜的温度。目前,在实际生产中一般采用的温度为400 ~500 ℃。
目前工业普遍使用铁触媒催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。该催化剂在500℃左右时的活性最大。这也是合成氨反应一般选择400-500℃进行的重要原因。另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。
3.催化剂
效果好,但储量极少且锇蒸汽有剧毒。且铀的价格昂贵 ,性质过于敏感
25000多次试验,2500种不同配方,终于筛选出合成氨工业用催化剂铁触媒。
铁触媒
卡尔·博施:寻找廉价、安全、稳定的催化剂
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
即使在高温、高压下,合成氨反应仍然进行得十分缓慢。
例如,采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去,以促使化学平衡向生成氨的方向移动。
此外,应将氨分离后的原料气循环使用,并及时补充氮气和氢气,使反应物保持一定的浓度,以利于合成氨反应。
4. 浓度
由表2-2可以看出,即使在500 ℃和30MPa时,合氨平衡混合物中NH3的体积分数也只为26.4%,即平衡时N2和H2的转化率仍不够高。在实际生产中,还需要考虑浓度对化学平衡的影响等。
从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
归纳总结
工业合成氨的适宜条件
压强
温度
催化剂
浓度
10~30 MPa
400~500 ℃
铁触媒
N2和H2的的投料比为1∶2.8,及时分离氨
从实际生产分析合成氨
N2 、H2循环使用,并及时补充
及时分离NH3
图2-13 合成氨生产流程示意图
制气→净化除杂→压缩→合成→冷却分离→循环压缩
液化空气分离法
水煤气
(1)原料气干燥净化:除去原料气中的水蒸气及其他气体杂质,防止催化剂“中毒”而降低或丧失催化活性
(2)压缩机加压:增大压强
(3)热交换:合成氨反应放热,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
合成氨流程分析
(4)冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
(5)循环使用原料气:因合成氨反应为可逆反应,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
1、选择工业合成适宜条件的原则
(1)考虑参加反应的物质组成、结构和性质等本身因素
(2)考虑温度、压强、浓度、催化剂等反应条件
(3)实际生产中还要考虑设备条件、安全操作和经济成本等情况
(4)还要考虑环境保护及社会效益等方面的规定和要求
2、选择工业合成适宜条件的分析角度
分析角度 原则要求
化学反应速率
化学平衡移动
原料的利用率
实际生产能力
催化剂的使用活性
尽量越快越好
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
增加廉价原料,提高高价原料的利用率,从而降低生产成本
如设备承受高温、高压能力等
注意催化剂的活性对温度的限制
外界条件 有利于加快速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度
催化剂 加合适的 催化剂 不需要
温度 高温 ΔH<0 低温
ΔH>0 高温
压强 高压 (有气体参加) Δνg<0 高压
Δνg>0 低压
不断地补充反应物、及时地分离出生成物
加合适的催化剂
兼顾速率和平衡,
在设备条件允许的前提下,
考虑催化剂的活性,选取适宜的温度
兼顾速率和平衡,
在设备条件允许的前提下,
选取适宜的压强
3、选择工业合成适宜条件的参考依据
哈伯(1918年)
完成合成氨的
基础开发工作
P47科学·技术·社会
——合成氨与三次诺贝尔化学奖
博施(1931年)
实现了
合成氨的工业化
埃特尔(2007年)
揭开了
合成氨的“天机”
(催化反应原理)
据统计,全世界在合成氨工业上消耗的能源占全人类能源消耗的1%-2%。为了降低合成氨的消耗,人们一直试图对合成条件进行优化。2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
解题思路:
a、抓住反应特点
反应热:ΔH>0 或者ΔH<0
反应前后气体体积变化:ΔVg >或ΔVg<0
b、运用平衡规律:把外界条件对化学反应速率和化学平衡的影响和实际情况相结合起来
c、准确分析数据:结合测定的实验数据准确分析反应条件,解决化学反应的调控
活学活用
综合分析
(1)数据找到答案
(2)分析题设信息找到答案
在硫酸工业中,通过下列反应使SO2转化成SO3,2SO2 (g)+O2(g) 2SO3(g) ΔH=-198KJ/mol,(已知制备SO3的过程中催化剂使是V2O5,在400--500℃效果最好),下表为不同温度和压强下的二氧化硫的转化率
(3)分析数据找到答案
常压450℃催化剂
此温度下催化效果最好
常压下转化率已经很高
增大O2浓度提高SO2 转化率
防止污染环境
工业上选择适宜生产条件的原则
C
都不能改变
还要考虑取向
D
如SO2和O2在常压下催化剂加热反应生成SO3
吸热反应,T↑,平衡逆向移动,反应物的转化率降低
增大反应速率,提高单位时间内产量
NH3
BC
c
a
随堂自测P37
C
B
D
B
瞬间v正增大、v逆随之增大,K不变
反应速率加快但反应限度降低
低温、高压
高温、低压
合成氨的反应历程
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2007 年 Ertl 证实了 N2与 H2在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
埃特尔合成氨催化剂表面化学过程模型
合成氨机理图
①
②
③
④
⑤
⑥
①
②
⑥
③
④
⑤
① N2 (g)+ H2 (g)= N2 (吸)+ H2(吸)
② N2 (吸)+ H2(吸) =N(吸)+3H(吸)
③N(吸)+3H(吸) =NH(吸)+ 2H(吸)
④NH (吸)+2H(吸) =NH2(吸)+ H(吸)
⑤NH2 (吸)+H(吸) =NH3(吸)
⑥NH3 (吸)=NH3(g)
(决速步骤,活化能最大)
(吸附)
(解吸)
N2 (g)+ H2 (g)= NH3(g) =-46kJ/mol
总反应:
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
学习目标 1min
1、认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要意义,能讨论化学反应条件的选择和优化。
2、能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
自学指导 6min
阅读课本第44-47页,完成课堂新坐标第35-36页
B
自学检测 3min
生成的NH3分离出后,再将未反应的N2、H2循环利用,可使氨的产率较高
选择500 ℃左右的温度,主要从
反应速率和催化剂活性两方面考虑
压强太大,对设备、动力的要求太高
自学检测 3min
×
×
×
充入的N2越多,H2的转化率越大,但过多未反应的N2会浪费。
×
ΔH<0, ΔS<0,低温自发
教师点拨 20min
氨是重要的无机化工产品之一,合成氨工业在国民经济中占有重要地位。农业上使用的氮肥,例如尿素、硝酸铵、磷酸铵、氯化铵以及各种含氮复合肥,都是以氨为原料的。
合成氨是大宗化工产品之一,世界每年合成氨产量已达到1亿吨以上,其中约有80%的氨用来生产化学肥料,20% 作为其它化工产品的原料。
N2+O2 2NO
放电
或高温
======
①电弧法固氮:
②人工合成氨
N2+3H2 2NH3
高温、高压
催化剂
用空气制造面包的圣人
——弗里茨·哈伯
如何从空气中获得肥料?
以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
请根据焓变和熵变分析在298K时合成氨反应能否自发进行?
ΔG = ΔH-TΔS = -33.14 kJ·mol-1<0,可以自发
且K(298K)=4 × 106,接近完全
先合成氨,再进一步将之转化为铵盐或者硝酸盐,变成了土壤可吸收的形式。最好的原料是空气,因为它其中富含氮元素。
——卡尔 ·博施
N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2kJ mol-1 ΔS=-198.2J K-1 mol-1
1910年, 哈伯完成了合成氨的基础研究工作,博施实现了合成氨的工业化,这种合成氨的工业方法被称为“哈伯-博施法”,两人先后获得诺贝尔化学奖
意义:人类首次彻底地采用化学合成的方式对自然循环进行干预,由此在自然循环中依靠自己的努力成为了类似造物主的角色,改变了过去靠天吃饭的状况。
哈伯合成氨所用装置
世界人口变化图
1、原理分析
一、合成氨的适宜条件选择
【思考与讨论】---P44
根据合成氨反应的特点,应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量?
增大合成氨的反应速率与提高平衡混合物中氨的含量所应采取的措施是否一致
在实际生产中到底选择哪些适宜的条件呢
对合成氨反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率
提高平衡混合物中氨的含量
增大
增大反应物浓度,减小生成物浓度
升温
降温
增大
增大
正催化剂
不影响
下表中的实验数据是在不同温度、压强下,平衡混合物中氨的含量变化情况(初始时氮气和氢气的体积比是1:3)。分析表中数据,结合成成氨反应的特点,讨论应如何选择反应条件,以增大合成氨的反应速率、提高平衡混合物中氨的含量。
压强↑,NH3%↑。
温度↓,NH3%↑。
温度/℃ 氨的含量/%
0.1MPa 10MPa 20MPa 30MPa 60MPa 100MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.1 13.8 23.1 31.4
2、数据分析
图1:平衡混合物中氨的含量与温度、压强的关系
温度升高,氨的含量降低
压强增大,氨的含量增大
高压、低温有利于合成氨
NH3含量的实验测定结果
2、数据分析
工业生产中应该考虑那些问题呢?
速 率
产 率
经济
成本
设备
条件
安全条件
思考探究
升高温度、增大压强、增大反应物浓度及使用催化剂等,都可以使合成氨的反应速率增大;降低温度、增大压强、增大反应物浓度等有利于提高平衡混合物中氨的含量。催化剂可以增大反应速率,但不改变平衡混合物的组成。那么,在实际生产中到底选择哪些适宜的条件呢?
1. 压强
合成氨时压强越大越好;但压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大,这将会大大增加生产投资,并可能降低综合经济效益。目前,我国的合成氨厂一般采用的压强为
10 MPa~30 MPa。
2.温度
根据平衡移动原理,合成氨应采用低温以提高平衡转化率。但温度降低会使反应速率减小,达到平衡时间变长,这在工业生产中是很不经济的。因此,需要选择一个适宜的温度。目前,在实际生产中一般采用的温度为400 ~500 ℃。
目前工业普遍使用铁触媒催化剂,改变反应历程,降低反应的活化能,使反应物在较低温度时能较快地进行反应。该催化剂在500℃左右时的活性最大。这也是合成氨反应一般选择400-500℃进行的重要原因。另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。
3.催化剂
效果好,但储量极少且锇蒸汽有剧毒。且铀的价格昂贵 ,性质过于敏感
25000多次试验,2500种不同配方,终于筛选出合成氨工业用催化剂铁触媒。
铁触媒
卡尔·博施:寻找廉价、安全、稳定的催化剂
弗里茨·哈伯:锇或用铀—碳化铀作催化剂
即使在高温、高压下,合成氨反应仍然进行得十分缓慢。
例如,采取迅速冷却的方法,使气态氨变成液氨后及时从平衡混合物中分离出去,以促使化学平衡向生成氨的方向移动。
此外,应将氨分离后的原料气循环使用,并及时补充氮气和氢气,使反应物保持一定的浓度,以利于合成氨反应。
4. 浓度
由表2-2可以看出,即使在500 ℃和30MPa时,合氨平衡混合物中NH3的体积分数也只为26.4%,即平衡时N2和H2的转化率仍不够高。在实际生产中,还需要考虑浓度对化学平衡的影响等。
从化学平衡的角度分析,在氮气和氢气的物质的量比为1:3时,平衡转化率最大,但是实验测得适当提高N2的浓度,即N2和H2的物质的量比为1:2.8时,更能促进氨的合成。
归纳总结
工业合成氨的适宜条件
压强
温度
催化剂
浓度
10~30 MPa
400~500 ℃
铁触媒
N2和H2的的投料比为1∶2.8,及时分离氨
从实际生产分析合成氨
N2 、H2循环使用,并及时补充
及时分离NH3
图2-13 合成氨生产流程示意图
制气→净化除杂→压缩→合成→冷却分离→循环压缩
液化空气分离法
水煤气
(1)原料气干燥净化:除去原料气中的水蒸气及其他气体杂质,防止催化剂“中毒”而降低或丧失催化活性
(2)压缩机加压:增大压强
(3)热交换:合成氨反应放热,反应体系温度逐渐升高,为原料气反应提供热量,故热交换可充分利用能源,提高经济效益。
合成氨流程分析
(4)冷却:生成物NH3的液化需较低温度采取迅速冷却的方法,可使气态氨变成液氨后及时从平衡混合物中分离出来,以促使平衡向生成NH3的方向移动。
(5)循环使用原料气:因合成氨反应为可逆反应,将NH3分离后的原料气循环利用,并及时补充N2和H2,使反应物保持一定的浓度,以利于合成氨反应,提高经济效益。
1、选择工业合成适宜条件的原则
(1)考虑参加反应的物质组成、结构和性质等本身因素
(2)考虑温度、压强、浓度、催化剂等反应条件
(3)实际生产中还要考虑设备条件、安全操作和经济成本等情况
(4)还要考虑环境保护及社会效益等方面的规定和要求
2、选择工业合成适宜条件的分析角度
分析角度 原则要求
化学反应速率
化学平衡移动
原料的利用率
实际生产能力
催化剂的使用活性
尽量越快越好
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
增加廉价原料,提高高价原料的利用率,从而降低生产成本
如设备承受高温、高压能力等
注意催化剂的活性对温度的限制
外界条件 有利于加快速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度
催化剂 加合适的 催化剂 不需要
温度 高温 ΔH<0 低温
ΔH>0 高温
压强 高压 (有气体参加) Δνg<0 高压
Δνg>0 低压
不断地补充反应物、及时地分离出生成物
加合适的催化剂
兼顾速率和平衡,
在设备条件允许的前提下,
考虑催化剂的活性,选取适宜的温度
兼顾速率和平衡,
在设备条件允许的前提下,
选取适宜的压强
3、选择工业合成适宜条件的参考依据
哈伯(1918年)
完成合成氨的
基础开发工作
P47科学·技术·社会
——合成氨与三次诺贝尔化学奖
博施(1931年)
实现了
合成氨的工业化
埃特尔(2007年)
揭开了
合成氨的“天机”
(催化反应原理)
据统计,全世界在合成氨工业上消耗的能源占全人类能源消耗的1%-2%。为了降低合成氨的消耗,人们一直试图对合成条件进行优化。2016年中科院大连化学物理研究所研究团队研制合成了一种新型催化剂,将合成氨的温度、压强分别降到了350 ℃、1 MPa 。
更加节能、降低成本
解题思路:
a、抓住反应特点
反应热:ΔH>0 或者ΔH<0
反应前后气体体积变化:ΔVg >或ΔVg<0
b、运用平衡规律:把外界条件对化学反应速率和化学平衡的影响和实际情况相结合起来
c、准确分析数据:结合测定的实验数据准确分析反应条件,解决化学反应的调控
活学活用
综合分析
(1)数据找到答案
(2)分析题设信息找到答案
在硫酸工业中,通过下列反应使SO2转化成SO3,2SO2 (g)+O2(g) 2SO3(g) ΔH=-198KJ/mol,(已知制备SO3的过程中催化剂使是V2O5,在400--500℃效果最好),下表为不同温度和压强下的二氧化硫的转化率
(3)分析数据找到答案
常压450℃催化剂
此温度下催化效果最好
常压下转化率已经很高
增大O2浓度提高SO2 转化率
防止污染环境
工业上选择适宜生产条件的原则
C
都不能改变
还要考虑取向
D
如SO2和O2在常压下催化剂加热反应生成SO3
吸热反应,T↑,平衡逆向移动,反应物的转化率降低
增大反应速率,提高单位时间内产量
NH3
BC
c
a
随堂自测P37
C
B
D
B
瞬间v正增大、v逆随之增大,K不变
反应速率加快但反应限度降低
低温、高压
高温、低压
合成氨的反应历程
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2007 年 Ertl 证实了 N2与 H2在催化剂表面合成氨的反应历程如图所示。
扩散→吸附→表面反应→脱附→扩散。
埃特尔合成氨催化剂表面化学过程模型
合成氨机理图
①
②
③
④
⑤
⑥
①
②
⑥
③
④
⑤
① N2 (g)+ H2 (g)= N2 (吸)+ H2(吸)
② N2 (吸)+ H2(吸) =N(吸)+3H(吸)
③N(吸)+3H(吸) =NH(吸)+ 2H(吸)
④NH (吸)+2H(吸) =NH2(吸)+ H(吸)
⑤NH2 (吸)+H(吸) =NH3(吸)
⑥NH3 (吸)=NH3(g)
(决速步骤,活化能最大)
(吸附)
(解吸)
N2 (g)+ H2 (g)= NH3(g) =-46kJ/mol
总反应:
