2.2.1化学反应平衡课件(共16页)2023-2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.1化学反应平衡课件(共16页)2023-2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 00:00:00 | ||
图片预览






文档简介
(共16张PPT)
第二章 化学反应速率与化学平衡
第二节 第一课时
化学平衡状态
学习目标 1min
1.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。
2.能判断化学平衡状态的标志。
自学指导 6min
阅读课本第30-31页,完成课堂新坐标第21页
教师点拨
化学平衡状态
1.概念:在相同条件下,既能向 ,
同时又能向 的反应。
2.特征:三同:
, ,
;反应不能进行完全,即任一反应物的转化率均 100%。
3.表示:化学方程式中用 表示。
一.可逆反应
正反应方向进行
逆反应方向进行
相同条件
正逆反应同时进行
反应物、生成物同时存在
小于
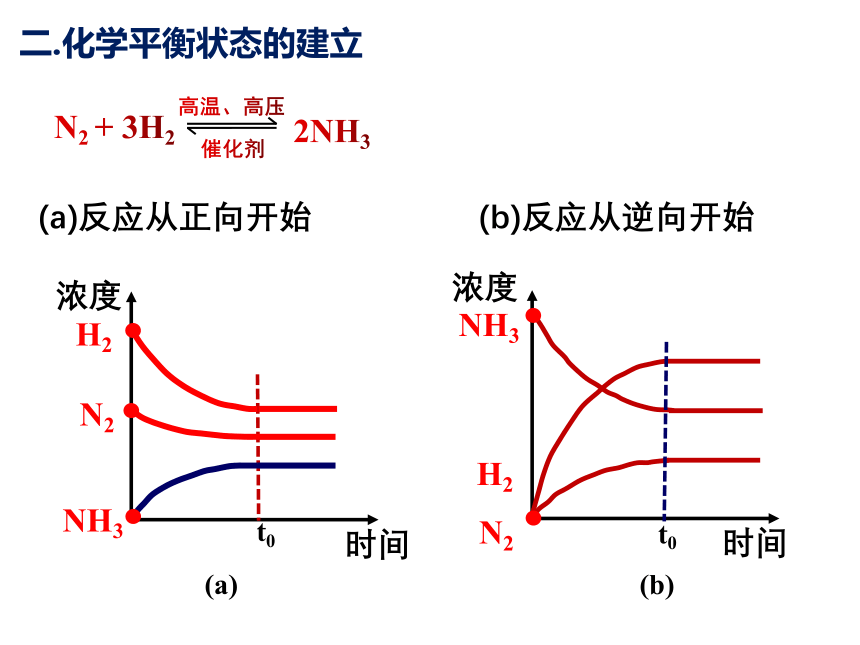
二.化学平衡状态的建立
反应开始时:
反应物浓度最大,V正 最大;生成物浓度为 0, V逆为0。
反应进行中:
反应物浓度减少,V正 ↓;生成物浓度增大,V逆 ↑。
反应到平衡状态:
各反应物和生成物的浓度不再变化,达到了化学平衡。
反应物 生成物
密闭容器中投入一定量反应物
V正>V逆
V正= V逆 ≠ 0
≠ 0
V正>V逆
浓度
时间
2NH3
N2 + 3H2
催化剂
高温、高压
(a) (b)
H2
N2
NH3
t0
(a)反应从正向开始
二.化学平衡状态的建立
(b)反应从逆向开始
浓度
时间
t0
H2
N2
NH3
三、化学平衡状态
在一定条件下的可逆反应里,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
α = ×100%
转化量
起始量
转化率:
__________
化学平衡状态的特征:逆、动、等、定、变
研究对象为________
V正= V逆≠ 0
化学平衡是一种表面静止状态,______________
达到平衡后,各组分浓度_______
外界条件改变时,原平衡将_______ , 再在新条件下建立起新的平衡状态
一定
被打破
可逆反应
反应并未停止
四.化学平衡状态的判定
直接标志
(1)正、逆反应速率相等
(2)各组分的浓度保持不变
(3)间接标志——“变量不变”
①总压强不变
(适用于反应前后气体物质的量不等的反应)。
②颜色不变
(适用于反应混合物中存在有颜色变化的物质)。
③气体平均相对分子质量不变
(适用于全是气体参加的反应前后物质的量不等的反应
或有固体参加的反应前后气体物质的量相等的反应)。
④温度保持不变
(适用于绝热密闭容器的反应)。
⑤气体密度不变
(适用于恒温恒容下有固体和气体参加的反应
或恒压下全是气体参加的反应前后物质的量不等的反应)。
选定反应中“变量”,即随反应进行而变化的量,
当变量不再变化时,反应已达平衡状态。
m总
ρ =
V
n总
M气 =
m总
五、化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到或完成的 ,即该反应进行的限度。
(2)对化学反应限度的理解
①化学反应的限度决定了反应物在一定条件下的最大 。
②同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的 。
最大程度
转化率
限度
化学平衡状态的判断方法
大本P22
2NH3
N2 + 3H2
催化剂
高温、高压
m总
ρ =
V
不变
不变
不变 不能判断
大本P22
B
正反应速率与逆反应速率相等
C
同方向
c(NO2)不变
红棕色 无色
大本P23
abc
abe
abce
B
A B C D
第二章 化学反应速率与化学平衡
第二节 第一课时
化学平衡状态
学习目标 1min
1.通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡。
2.能判断化学平衡状态的标志。
自学指导 6min
阅读课本第30-31页,完成课堂新坐标第21页
教师点拨
化学平衡状态
1.概念:在相同条件下,既能向 ,
同时又能向 的反应。
2.特征:三同:
, ,
;反应不能进行完全,即任一反应物的转化率均 100%。
3.表示:化学方程式中用 表示。
一.可逆反应
正反应方向进行
逆反应方向进行
相同条件
正逆反应同时进行
反应物、生成物同时存在
小于
二.化学平衡状态的建立
反应开始时:
反应物浓度最大,V正 最大;生成物浓度为 0, V逆为0。
反应进行中:
反应物浓度减少,V正 ↓;生成物浓度增大,V逆 ↑。
反应到平衡状态:
各反应物和生成物的浓度不再变化,达到了化学平衡。
反应物 生成物
密闭容器中投入一定量反应物
V正>V逆
V正= V逆 ≠ 0
≠ 0
V正>V逆
浓度
时间
2NH3
N2 + 3H2
催化剂
高温、高压
(a) (b)
H2
N2
NH3
t0
(a)反应从正向开始
二.化学平衡状态的建立
(b)反应从逆向开始
浓度
时间
t0
H2
N2
NH3
三、化学平衡状态
在一定条件下的可逆反应里,当正、逆反应的速率相等时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,这表明该反应中物质的转化达到了“限度”,这时的状态我们称之为化学平衡状态,简称化学平衡。
达到化学平衡时,反应达到该条件下物质转化的最大“限度”,即反应物的转化率最大。
α = ×100%
转化量
起始量
转化率:
__________
化学平衡状态的特征:逆、动、等、定、变
研究对象为________
V正= V逆≠ 0
化学平衡是一种表面静止状态,______________
达到平衡后,各组分浓度_______
外界条件改变时,原平衡将_______ , 再在新条件下建立起新的平衡状态
一定
被打破
可逆反应
反应并未停止
四.化学平衡状态的判定
直接标志
(1)正、逆反应速率相等
(2)各组分的浓度保持不变
(3)间接标志——“变量不变”
①总压强不变
(适用于反应前后气体物质的量不等的反应)。
②颜色不变
(适用于反应混合物中存在有颜色变化的物质)。
③气体平均相对分子质量不变
(适用于全是气体参加的反应前后物质的量不等的反应
或有固体参加的反应前后气体物质的量相等的反应)。
④温度保持不变
(适用于绝热密闭容器的反应)。
⑤气体密度不变
(适用于恒温恒容下有固体和气体参加的反应
或恒压下全是气体参加的反应前后物质的量不等的反应)。
选定反应中“变量”,即随反应进行而变化的量,
当变量不再变化时,反应已达平衡状态。
m总
ρ =
V
n总
M气 =
m总
五、化学反应的限度
(1)化学平衡状态是可逆反应在一定条件下所能达到或完成的 ,即该反应进行的限度。
(2)对化学反应限度的理解
①化学反应的限度决定了反应物在一定条件下的最大 。
②同一可逆反应,不同条件下,化学反应的限度不同,即改变条件可以在一定程度上改变一个化学反应的 。
最大程度
转化率
限度
化学平衡状态的判断方法
大本P22
2NH3
N2 + 3H2
催化剂
高温、高压
m总
ρ =
V
不变
不变
不变 不能判断
大本P22
B
正反应速率与逆反应速率相等
C
同方向
c(NO2)不变
红棕色 无色
大本P23
abc
abe
abce
B
A B C D
