2023-2024学年九年级化学人教版上册4.4化学式与化合价 (共27张PPT)
文档属性
| 名称 | 2023-2024学年九年级化学人教版上册4.4化学式与化合价 (共27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 977.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 13:46:20 | ||
图片预览






文档简介
(共27张PPT)
课题4 化学式与化合价
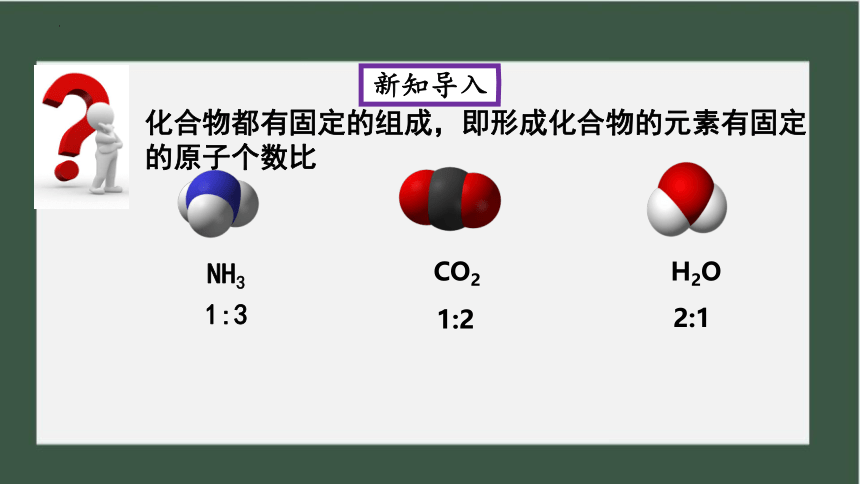
NH3
CO2
H2O
1:3
1:2
2:1
化合物都有固定的组成,即形成化合物的元素有固定的原子个数比
新知导入
学习目标
1、熟记常见元素和原子团的化合价;
2、会利用化合价写化学式,会根据化学式求化合价
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
思考交流
我们如何知道不同元素是以什么样的原子个数比相互结合呢?
1.稀有气体元素原子的最外层都有 个电子(氦有2个),属于 结构。
2.金属元素原子最外层电子一般 个,在化学反应中容易 最外层电子,趋向达到相对稳定结构。
3.非金属元素原子最外层电子一般 个,在化学反应中容易 电子,趋向达到相对稳定结构。
还记得元素的性质与原子核外电子排布的关系吗?
8
稳定
少于4
失去
多于4
得到
原子性质与最外层电子数
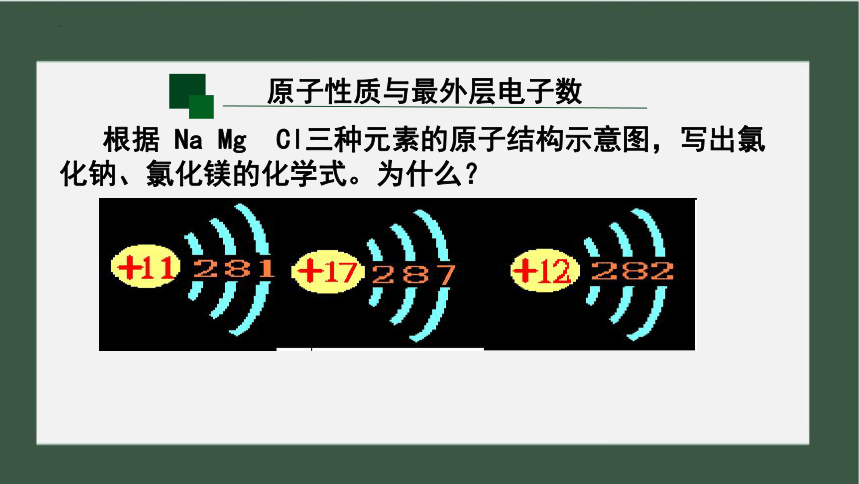
根据 Na Mg Cl三种元素的原子结构示意图,写出氯化钠、氯化镁的化学式。为什么?
原子性质与最外层电子数
失去1个电子
得到1个电子
Na
Na+
Cl
Cl-
Na+
Cl-
Cl-
NaCl
钠原子和氯原子必须按1:1的比例化合
失去2个电子
得到1个电子
Cl
Cl-
镁原子和氯原子必须按1:2的比例化合
Mg
得到1个电子
Cl
Cl-
Cl-
Cl-
Mg2+
MgCl2
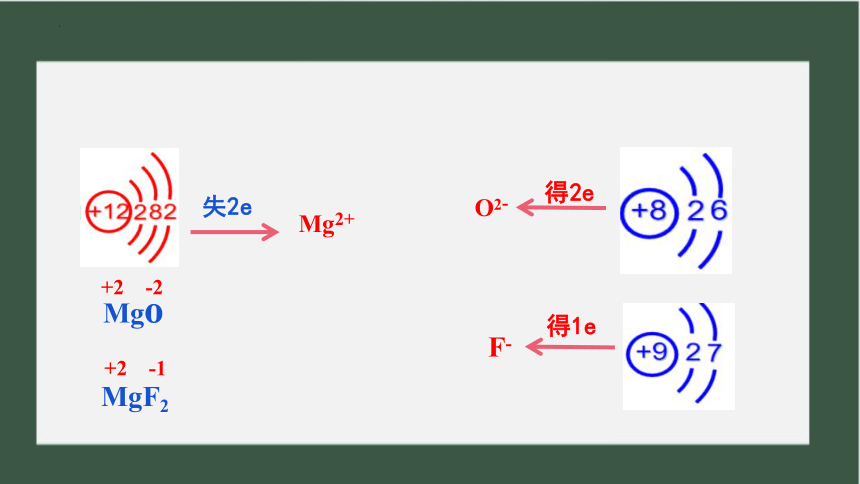
失2e
Mg2+
得2e
得1e
O2-
F-
Mgo
MgF2
+2 -2
+2 -1
金属原子和非金属原子通过得失电子化合,失电子显正价,得电子显负价,价数与得失电子数相同。
(化合价的性质由最外层电子数决定)
如失1e,显 价;失2e,显 价;失3e,显 价;
如得1e,显 价;得2e,显 价;得3e,显 价;
+1
+2
+3
-1
-2
-3
化合价
化合价的数值,就是一个原子得失电子的数目
失去几个电子就显正几价,得到几个电子显负几价
NaCl
MgCl2
+1 -1
+2 -1
①图中铝元素一般显示的化合价为 价,
氯元素一般显示的化合价为 价。
②图中两种元素组成的化合物的化学式是_______。
+3
AlCl3
如图是两种粒子的结构示意图:
-1
即学即练
2.表示:在元素符号或原子团的 用“+/-n”表示。
正上方
1.化合价:元素在形成化合物时表现出来的一种化学性质。
(表示原子之间互相化合时原子得失电子的数目)
H______________;
+1
O______________。
-2
NaCl______________。
+1
MgO_____________;
+2
正一价的氢元素
负二价的氧元素
氧化镁中镁元素显+2价
氯化钠中钠元素显+1价
化合价
常见元素和原子团的化合价
⑴化合价有正价和负价,在化合物中:
①氧元素通常显-2价
②氢元素通常显+1价
③金属元素跟非金属化合时,金属元素通常显正价,非金属通常元素显负价
三个通常
化合价
3.规律(P85表4-2)
①在单质分子里,元素化合价为0
②在化合物里正负化合价的代数和为0
两个零
化合价
0 0 0 0
O2 N2 H2 Fe
+1-2
H2 O
正价数(+1×2) + 负价数(-2×1)=0
元素的变价:一些元素在不同的化合物中可显不同的化合价.
+3
+2
+7
+6
Fe2O3 FeO KMnO4 K2MnO4
氧化铁
氧化亚铁
高锰酸钾
锰酸钾
Na+ Mg2+ Al3+ F- O2-
Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法:
离子符号歪带帽,先写数值后写号。
化合价正带帽,后写数值先写号。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
“1”忽略不写
“1”不忽略
原子最外层电子数 离子符号 化合价 相同之处
Mg 2
Al 3
Cl 7
O 6
原子结构与元素化合价及离子符号的关系
Mg2+
Mg
+2
Al3+
Al
+3
Cl-
Cl
-1
O2-
O
-2
数值相等
正负相同
名称 符号 化合价 化合物 读法
氢氧根 OH- -1 NaOH
硝酸根 NO3- -1 KNO3
硫酸根 SO42- -2 CuSO4
碳酸根 CO32- -2 CaCO3
铵根 NH4+ +1 NH4Cl
氢氧化*
*酸*
氯化铵
常见原子团的化合价
原子团是在化合物中和在化学反应中常作为一个整体的原子的集团。又叫根。 原子团作为一个整体,当个数不为1时要用括号括起来
常见元素化合价口诀
负一硝酸氢氧根;
负二硫酸碳酸根;
负三记住磷酸根;
正一价的是铵根。
钾钠氢银正一价,钙镁钡锌正二价
氟氯溴碘负一价,通常氧是负二价
铜汞正二铝正三,铁有正二和正三
碳有正二和正四,硫有负二正四六
条件不同价不同,单质零价记心中;
(1)根据化学式确定某元素的化合价
尝试确定氯酸钾中氯元素的化合价
【思路】
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式(正负总价和为0)
+1+X+(-2) ×3=0
解答
X=+5
答:氯酸钾中氯元素的化合价为+5
+ 5
依据:以代数和为零的原则,由不变推可变
5.化合价的应用
小结:化合物中元素化合价的代数和为零
即:(各元素化合价×其原子个数)之和=0
HCl H2O NaCl Na2S
Fe2O3
1:1 2:1 1:1 2:1 2:3
+1
-2
-1
+1
-1
-2
+1
+1
+3
-2
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零。
练习1:试确定高锰酸钾(KMnO4)中锰元素的化合价(O为-2价)
解:设锰元素的化合价为x,则
(+1)+ x +(-2)×4=0
x = +7
所以,在氯酸钾中,氯元素的化合价为+7价
5.化合价的应用
(2)根据化合价书写化学式:
尝试题1、已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
P O
P O
(2)标出各元素的化合价(正上)
+ 3 -2
P O
依据:正前、负后、和为零
P O
+ 5 -2
(3)把化合价数值化为最简
(4)把化简后的数字交叉写在
相应元素符号的右下角(1省略不写)
P2 O 3
+ 3 -2
+ 5 -2
P2 O 5
P2 O3
P2O5
省略
根据化合价求化学式的一般步骤:
(2)根据化合价求化学式
一标顺序二标价
价数交叉写右下
约简价数做脚码
总价为零去检查
1、当硫元素显 +4 价时,试确定其氧化物的化学式
2、填表:写出各物质的化学式
H Mg
Al
Cl
SO4
负价元素
正价元素
化学式
-1
-2
+1
+2
+3
SO2
(S O
S O
+4 -2
S O
+2 -1
SO2)
HCl
MgCl2
AlCl3
H2SO4
MgSO4
Al 2(SO4)3
随堂达标
氧化钙 ______,
氯化铁______,
氯化锌 ______,
硫化铝 ______,
氢氧化铜__________,
氯化镁_____,
CaO
FeCl3
ZnCl2
Al2S3
Cu(OH)2
MgCl2
3、写出下列物质的化学式:
4、已知在H3RO4 中,氢元素为+1价,氧为-2价,则其中 R的化合价为( )
A.+3 B.+4 C.+5 D.+6
5、下列化合物中,氮元素为+5价的是( )
A.NO B.NO2 C.HNO2 D.KNO3
6、元素R的氧化物的化学式为R2O3,则R 元素与OH-组 成 的物质的化学式为( )
A.ROH B.R(OH) 2 C.R(OH) 3 D.R(OH) 4
C
D
C
随堂达标
课题4 化学式与化合价
NH3
CO2
H2O
1:3
1:2
2:1
化合物都有固定的组成,即形成化合物的元素有固定的原子个数比
新知导入
学习目标
1、熟记常见元素和原子团的化合价;
2、会利用化合价写化学式,会根据化学式求化合价
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
思考交流
我们如何知道不同元素是以什么样的原子个数比相互结合呢?
1.稀有气体元素原子的最外层都有 个电子(氦有2个),属于 结构。
2.金属元素原子最外层电子一般 个,在化学反应中容易 最外层电子,趋向达到相对稳定结构。
3.非金属元素原子最外层电子一般 个,在化学反应中容易 电子,趋向达到相对稳定结构。
还记得元素的性质与原子核外电子排布的关系吗?
8
稳定
少于4
失去
多于4
得到
原子性质与最外层电子数
根据 Na Mg Cl三种元素的原子结构示意图,写出氯化钠、氯化镁的化学式。为什么?
原子性质与最外层电子数
失去1个电子
得到1个电子
Na
Na+
Cl
Cl-
Na+
Cl-
Cl-
NaCl
钠原子和氯原子必须按1:1的比例化合
失去2个电子
得到1个电子
Cl
Cl-
镁原子和氯原子必须按1:2的比例化合
Mg
得到1个电子
Cl
Cl-
Cl-
Cl-
Mg2+
MgCl2
失2e
Mg2+
得2e
得1e
O2-
F-
Mgo
MgF2
+2 -2
+2 -1
金属原子和非金属原子通过得失电子化合,失电子显正价,得电子显负价,价数与得失电子数相同。
(化合价的性质由最外层电子数决定)
如失1e,显 价;失2e,显 价;失3e,显 价;
如得1e,显 价;得2e,显 价;得3e,显 价;
+1
+2
+3
-1
-2
-3
化合价
化合价的数值,就是一个原子得失电子的数目
失去几个电子就显正几价,得到几个电子显负几价
NaCl
MgCl2
+1 -1
+2 -1
①图中铝元素一般显示的化合价为 价,
氯元素一般显示的化合价为 价。
②图中两种元素组成的化合物的化学式是_______。
+3
AlCl3
如图是两种粒子的结构示意图:
-1
即学即练
2.表示:在元素符号或原子团的 用“+/-n”表示。
正上方
1.化合价:元素在形成化合物时表现出来的一种化学性质。
(表示原子之间互相化合时原子得失电子的数目)
H______________;
+1
O______________。
-2
NaCl______________。
+1
MgO_____________;
+2
正一价的氢元素
负二价的氧元素
氧化镁中镁元素显+2价
氯化钠中钠元素显+1价
化合价
常见元素和原子团的化合价
⑴化合价有正价和负价,在化合物中:
①氧元素通常显-2价
②氢元素通常显+1价
③金属元素跟非金属化合时,金属元素通常显正价,非金属通常元素显负价
三个通常
化合价
3.规律(P85表4-2)
①在单质分子里,元素化合价为0
②在化合物里正负化合价的代数和为0
两个零
化合价
0 0 0 0
O2 N2 H2 Fe
+1-2
H2 O
正价数(+1×2) + 负价数(-2×1)=0
元素的变价:一些元素在不同的化合物中可显不同的化合价.
+3
+2
+7
+6
Fe2O3 FeO KMnO4 K2MnO4
氧化铁
氧化亚铁
高锰酸钾
锰酸钾
Na+ Mg2+ Al3+ F- O2-
Na Mg Al F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法:
离子符号歪带帽,先写数值后写号。
化合价正带帽,后写数值先写号。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
“1”忽略不写
“1”不忽略
原子最外层电子数 离子符号 化合价 相同之处
Mg 2
Al 3
Cl 7
O 6
原子结构与元素化合价及离子符号的关系
Mg2+
Mg
+2
Al3+
Al
+3
Cl-
Cl
-1
O2-
O
-2
数值相等
正负相同
名称 符号 化合价 化合物 读法
氢氧根 OH- -1 NaOH
硝酸根 NO3- -1 KNO3
硫酸根 SO42- -2 CuSO4
碳酸根 CO32- -2 CaCO3
铵根 NH4+ +1 NH4Cl
氢氧化*
*酸*
氯化铵
常见原子团的化合价
原子团是在化合物中和在化学反应中常作为一个整体的原子的集团。又叫根。 原子团作为一个整体,当个数不为1时要用括号括起来
常见元素化合价口诀
负一硝酸氢氧根;
负二硫酸碳酸根;
负三记住磷酸根;
正一价的是铵根。
钾钠氢银正一价,钙镁钡锌正二价
氟氯溴碘负一价,通常氧是负二价
铜汞正二铝正三,铁有正二和正三
碳有正二和正四,硫有负二正四六
条件不同价不同,单质零价记心中;
(1)根据化学式确定某元素的化合价
尝试确定氯酸钾中氯元素的化合价
【思路】
先写出化学式
KClO3
设未知数
解:设KClO3中Cl的化合价为X
列等式(正负总价和为0)
+1+X+(-2) ×3=0
解答
X=+5
答:氯酸钾中氯元素的化合价为+5
+ 5
依据:以代数和为零的原则,由不变推可变
5.化合价的应用
小结:化合物中元素化合价的代数和为零
即:(各元素化合价×其原子个数)之和=0
HCl H2O NaCl Na2S
Fe2O3
1:1 2:1 1:1 2:1 2:3
+1
-2
-1
+1
-1
-2
+1
+1
+3
-2
(1)根据化学式求某一元素化合价
原则:化合物里正负化合价的代数和为零。
练习1:试确定高锰酸钾(KMnO4)中锰元素的化合价(O为-2价)
解:设锰元素的化合价为x,则
(+1)+ x +(-2)×4=0
x = +7
所以,在氯酸钾中,氯元素的化合价为+7价
5.化合价的应用
(2)根据化合价书写化学式:
尝试题1、已知磷元素有两种氧化物,其中磷的化合价分别为+3和+5,写出这两种磷的氧化物的化学式
【思路】
(1)先写元素符号(正前负后)
P O
P O
(2)标出各元素的化合价(正上)
+ 3 -2
P O
依据:正前、负后、和为零
P O
+ 5 -2
(3)把化合价数值化为最简
(4)把化简后的数字交叉写在
相应元素符号的右下角(1省略不写)
P2 O 3
+ 3 -2
+ 5 -2
P2 O 5
P2 O3
P2O5
省略
根据化合价求化学式的一般步骤:
(2)根据化合价求化学式
一标顺序二标价
价数交叉写右下
约简价数做脚码
总价为零去检查
1、当硫元素显 +4 价时,试确定其氧化物的化学式
2、填表:写出各物质的化学式
H Mg
Al
Cl
SO4
负价元素
正价元素
化学式
-1
-2
+1
+2
+3
SO2
(S O
S O
+4 -2
S O
+2 -1
SO2)
HCl
MgCl2
AlCl3
H2SO4
MgSO4
Al 2(SO4)3
随堂达标
氧化钙 ______,
氯化铁______,
氯化锌 ______,
硫化铝 ______,
氢氧化铜__________,
氯化镁_____,
CaO
FeCl3
ZnCl2
Al2S3
Cu(OH)2
MgCl2
3、写出下列物质的化学式:
4、已知在H3RO4 中,氢元素为+1价,氧为-2价,则其中 R的化合价为( )
A.+3 B.+4 C.+5 D.+6
5、下列化合物中,氮元素为+5价的是( )
A.NO B.NO2 C.HNO2 D.KNO3
6、元素R的氧化物的化学式为R2O3,则R 元素与OH-组 成 的物质的化学式为( )
A.ROH B.R(OH) 2 C.R(OH) 3 D.R(OH) 4
C
D
C
随堂达标
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
