2024届高中化学一轮复习课件:科学探究——以非金属及其化合物为主体的 “微实验”和“微流程” 课件(共33张PPT)
文档属性
| 名称 | 2024届高中化学一轮复习课件:科学探究——以非金属及其化合物为主体的 “微实验”和“微流程” 课件(共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 15:35:23 | ||
图片预览









文档简介
(共33张PPT)
科学探究——以非金属及其化合物为主体的 “微实验”和“微流程”
探究命题角度 发展核心素养
以非金属及其化合物的制备为主体的“微实验”“微流程”及分析是高考命题的热点之一,考查非金属及其化合物的性质与转化、化学实验基本操作、反应条件的控制等,突出考查考生的综合分析能力、实验探究能力、创新思维能力等 [科学探究与创新意识] 通过对非金属及其化合物为主体的“微实验”“微流程”及分析,能发现和提出有探究价值的问题;能从问题和假设出发,确定探究目的,运用化学实验、调查等方法进行实验探究
探究点1 非金属及其化合物的制备“微实验”
例1 已知Ca3N2遇水发生水解反应,需密封保存。利用如图所示装置制取氮气,并用氮气制备Ca3N2,下列说法不正确的是(焦性没食子酸溶液用于吸收少量氧气) ( )
A.装置①中发生反应的化学方程式为NaNO2+NH4Cl NaCl+N2↑+2H2O
B.装置③④⑥中依次盛装浓硫酸、焦性没食子酸溶液、碱石灰
C.装置②为安全瓶,防止停止加热时,装置③中的溶液进入装置①中
D.实验结束后,取装置⑤中少量产物于试管中,加适量蒸馏水,再滴加石蕊溶液,溶液变蓝
[解析]由实验装置图可知,装置①为氯化铵溶液与亚硝酸钠固体共热反应制备氮气的装置,装置②作安全瓶,防止停止加热时,装置③中的溶液进入装置①中,装置③中盛有的焦性没食子酸溶液用于除去氮气中混有的氧气,防止氧气与装置⑤中的钙反应,装置④中盛有的浓硫酸用于干燥氮气,防止钙与水蒸气反应,装置⑤为钙与氮气共热反应制备氮化钙的装置,装置⑥中盛有的碱石灰用于吸收水蒸气,防止水蒸气进入装置⑤中导致氮化钙水解,装置⑦中盛有的焦性没食子酸溶液用于吸收空气中的氧气,防止氧气与装置⑤中的钙反应。
由分析可知,装置①中氯化铵溶液与亚硝酸钠固体共热反应生成氯化钠、氮气和水,反应的化学方程式为NaNO2+NH4Cl NaCl+N2↑+2H2O,故A正确;
装置③中盛有的试剂为焦性没食子酸溶液,装置④中盛有的试剂为浓硫酸,故B错误;
装置②作安全瓶,防止停止加热时,装置③中的溶液进入装置①中,故C正确;
向氮化钙中加适量蒸馏水,氮化钙与水发生水解反应生成氢氧化钙和氨,氢氧化钙溶液能使石蕊溶液变蓝色,故D正确。
[方法技巧] 分析非金属及其化合物为主体的“微实验”类题的方法
基本方法
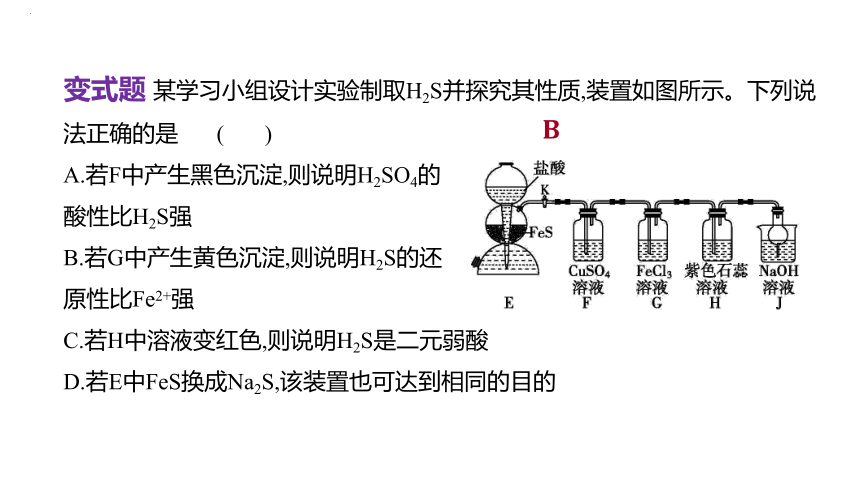
变式题 某学习小组设计实验制取H2S并探究其性质,装置如图所示。下列说法正确的是 ( )
A.若F中产生黑色沉淀,则说明H2SO4的
酸性比H2S强
B.若G中产生黄色沉淀,则说明H2S的还
原性比Fe2+强
C.若H中溶液变红色,则说明H2S是二元弱酸
D.若E中FeS换成Na2S,该装置也可达到相同的目的
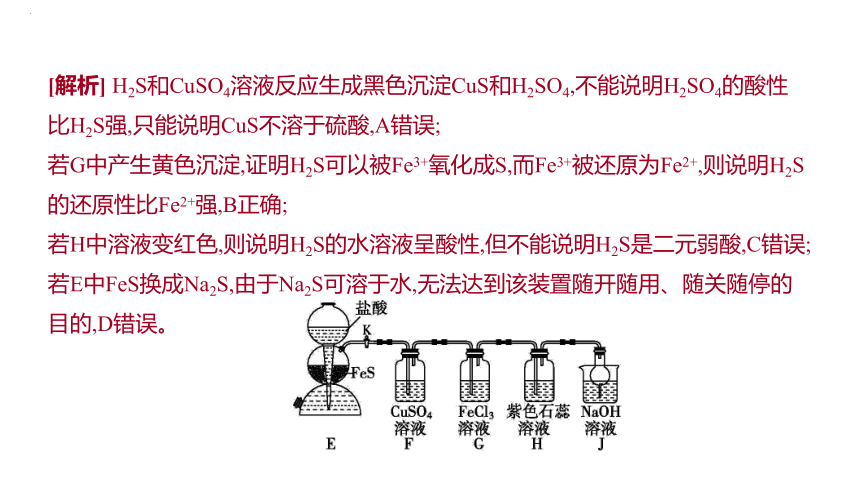
[解析] H2S和CuSO4溶液反应生成黑色沉淀CuS和H2SO4,不能说明H2SO4的酸性比H2S强,只能说明CuS不溶于硫酸,A错误;
若G中产生黄色沉淀,证明H2S可以被Fe3+氧化成S,而Fe3+被还原为Fe2+,则说明H2S的还原性比Fe2+强,B正确;
若H中溶液变红色,则说明H2S的水溶液呈酸性,但不能说明H2S是二元弱酸,C错误;
若E中FeS换成Na2S,由于Na2S可溶于水,无法达到该装置随开随用、随关随停的目的,D错误。
探究点2 非金属及其化合物的制备“微流程”
例2 水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如图所示。下列说法错误的是 ( )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中,消耗1 mol CO(NH2)2转移电子数为NA(设NA为阿伏伽德罗常数的值)
D.反应2完成后要用到过滤操作
[解析]反应1是氯气和氢氧化钠反应生成氯化钠和次氯酸钠,氯元素化合价变化;次氯酸钠把尿素氧化为水合肼,Cl元素、N元素化合价变化;反应2是{[Cu(NH3)4]2+}被水合肼还原为Cu,Cu、N元素化合价变化,上述三步反应过程均为氧化还原反应,A正确。
反应1是氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应1的目的是制备NaClO,用NaClO将尿素氧化为水合肼,B正确
。NaClO将尿素氧化为水合肼,氮元素化合价由-3价升高为-2价,消耗1 mol CO(NH2)2转移电子数为2NA,C错误。
反应2完成后要把铜粉分离出来,用到过滤操作,D正确。
[方法技巧] 分析非金属及其化合物为主体的“微流程”类题的方法
基本方法
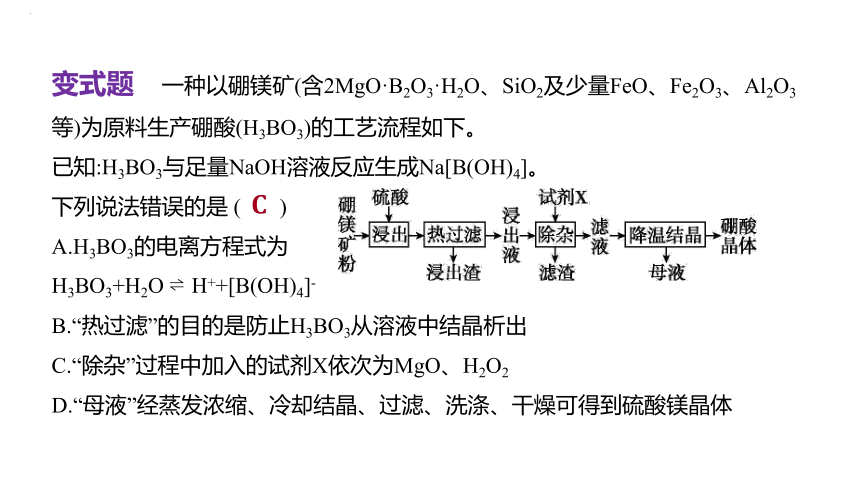
变式题 一种以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量FeO、Fe2O3、Al2O3等)为原料生产硼酸(H3BO3)的工艺流程如下。
已知:H3BO3与足量NaOH溶液反应生成Na[B(OH)4]。
下列说法错误的是 ( )
A.H3BO3的电离方程式为
H3BO3+H2O H++[B(OH)4]-
B.“热过滤”的目的是防止H3BO3从溶液中结晶析出
C.“除杂”过程中加入的试剂X依次为MgO、H2O2
D.“母液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到硫酸镁晶体
[解析]根据H3BO3与足量NaOH溶液反应生成Na[B(OH)4],则H3BO3是一元酸,电离方程式为H3BO3+H2O H++[B(OH)4]-,A正确;
“热过滤”的目的是防止 H3BO3从溶液中结晶析出,B正确;
“除杂”过程中加入的试剂X应该首先是H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH,使铁离子、铝离子均转化为沉淀,C错误;
“母液”中主要含有硫酸镁和硼酸,则经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到硫酸镁晶体,D正确。
1.实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( )
A.用装置甲制取SO2气体
B.用装置乙制取SO2水溶液
C.用装置丙吸收尾气中的SO2
D.用干燥pH试纸检验SO2水溶液的酸性
探究点一 以非金属及其化合物为主体的“微实验”
[解析]硫酸的酸性强于H2SO3,利用60%硫酸与NaHSO3(s)发生反应,可制得SO2气体,A正确;
SO2溶于水,装置乙中左侧安全瓶起到防止倒吸的作用,右侧集气瓶可制取SO2水溶液,B正确;
SO2不易溶于饱和NaHSO3溶液,也不发生反应,不能吸收尾气中的SO2,C错误;
SO2水溶液呈酸性,但不能漂白指示剂,故可用干燥pH试纸检验SO2水溶液的酸性,D正确。
2.实验室可用反应2CuSO4+2KI+SO2+2H2O =2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是 ( )
A.制备SO2 B.制备CuI C.分离出CuI D.干燥CuI固体
[解析] Cu与浓硫酸加热生成SO2,可制备SO2,A正确;
由制备CuI反应原理可知,SO2通入CuSO4、KI混合液,发生氧化还原反应可制备CuI,B正确;
CuI难溶于水,可利用过滤的方法分离出CuI,C正确;
CuI受热易被氧化,干燥CuI固体要在干燥器中进行,不能选用蒸发装置,D错误。
3. 利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2与饱和食盐水反应先制备NaHCO3。下列说法正确的是 ( )
A.实验时装置Ⅰ产生的气体要最先通入装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a→e,f←d←c←b
D.实验过程中,装置Ⅳ内会出现浑浊现象
[解析]利用装置Ⅰ(碳酸钙和稀盐酸反应)产生的气体是CO2,用饱和NaHCO3溶液除去CO2气体中混有的HCl杂质;利用装置Ⅱ(熟石灰与氯化铵反应)产生氨气,氨气极易溶于水(注意防倒吸),且水溶液显碱性,利于CO2气体的吸收,实验过程先通氨气,后通二氧化碳。实验时装置Ⅰ产生的气体是CO2,应后通入装置Ⅳ中,A错误;
装置Ⅲ中的试剂为饱和NaHCO3溶液,主要吸收CO2中的HCl杂质,B错误;
实验室制得的氨气先通入饱和食盐水中,再把已经除杂的CO2气体通入饱和食盐水中,导管口的连接顺序为a→d→c→e,f←b,C错误;
实验过程中,二氧化碳、氨气和饱和食盐水
共同作用生成NaHCO3晶体,装置Ⅳ内会出
现浑浊现象,D正确。
4.探究是培养创新精神和实践能力的手段。
用如图所示装置探究氯气的性质,三支试
管口均放置浸有NaOH溶液的棉花。
下列对实验现象的分析错误的是 ( )
A.①中淀粉KI试纸变蓝,说明Cl2的氧化性强于I2
B.②中产生白色沉淀,说明氯气与水反应生成Cl-
C.③中的溶液变为棕黄色,说明氯气具有氧化性
D.④中溶液先变红后褪色,说明氯水有酸性和漂白性
[解析] Cl2可与KI反应生成I2,使淀粉KI试纸
变蓝,Cl2是氧化剂,I2是氧化产物,则Cl2的氧
化性强于I2,A正确;
浓盐酸易挥发出HCl,伴随Cl2进入AgNO3
溶液,故不能说明Cl2与水反应生成Cl-,B错误;
Cl2与FeCl2溶液反应,FeCl2被氧化生成FeCl3,溶液变为棕黄色,Cl2作氧化剂,表现氧化性,C正确;
Cl2与水反应生成HCl和HClO,溶液呈酸性,使紫色石蕊溶液变红色,HClO具有漂白性,可使指示剂褪色,D正确。
5. 碳酸镧[La2(CO3)3]常用于慢性肾衰患者高磷血病的治疗,实验室用如图所示装置,利用反应2LaCl3+6NH4HCO3 =La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O来制取。下列说法错误的是 ( )
A.装置X中盛放的试剂应为饱和NaHCO3溶液
B.实验中各装置导管口的连接方式为F→B→A→D,E←C
C.实验时可以不用X装置,将W中的盐酸用稀硫酸代替,实验效果相同
D.实验时,应先打开Y中分液漏斗的活塞,一段时间后再打开W中分液漏斗的活塞
[解析]装置X是为了除去二氧化碳中混有的HCl杂质,试剂应为饱和NaHCO3溶液,A正确;
装置Y用于制氨气,氨气极易溶于水,通入LaCl3溶液时要注意防倒吸,则C连E,装置W用于制二氧化碳,制取的二氧化碳中混有HCl杂质,需通过装置X除去HCl气体,则F连接B,A连接D,导管口的连接方式为F→B→A→D,E←C,B正确;
装置W用于制取二氧化碳,将盐酸用稀硫酸代替,生成的CaSO4附着在石灰石表面,不利于气体的产生,C错误;
实验开始时,先打开Y中分液漏斗的活塞,
先通入氨气,使LaCl3溶液呈碱性以吸收更
多的二氧化碳,一段时间后再打开W中分
液漏斗的活塞,D正确。
6.某小组利用如图所示装置,正确检验出了草酸的分解产物CO和CO2,下列有关实验现象描述错误的是 ( )
A.装置前后的澄清石灰水都会
变浑浊
B.盛浓硫酸的洗气瓶,瓶外壁或
溶液温度上升
C.红色氧化铁变黑
D.倒扣的玻璃漏斗尖端燃烧时有蓝色火焰,同时火焰夹带黄色
[解析]第一个澄清石灰水的作用是判断氢氧化钠溶液是否除尽CO2,保证结论正确,此石灰水没有变浑浊,A错误;
浓硫酸吸收水蒸气放热,洗气瓶外壁或溶液温度上升,B正确;
草酸分解生成二氧化碳和一氧化碳,一氧化碳还原氧化铁生成黑色铁,C正确;
倒扣玻璃漏斗尖端有剩余CO燃烧,产生淡蓝色火焰,由于玻璃漏斗含有钠元素,燃烧时存在钠的焰色,带有黄色,D正确。
7.实验室中利用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,实验流程如图所示(其中NCl3中N为-3价)。下列说法错误的是 ( )
A.气体X和Y均为还原产物
B.整个过程,Cl元素至少参与了2个氧化
还原反应
C.若有0.1 mol NH4Cl参与反应,n(X)+n(Y)≤0.40 mol
D.制取1 mol ClO2至少需要 mol NH4Cl
探究点二 以非金属及其化合物为主体的“微流程”
[解析]电解NH4Cl溶液和稀盐酸混合液得到NCl3和气体X,NH4Cl→NCl3发生氧化反应,酸性条件下不能生成NH3,气体X必然是还原产物,则X应为H2,电解方程式为NH4Cl+2HCl 3H2↑ + NCl3;NCl3溶液中加入NaClO2溶液,得到ClO2、气体Y和溶液Z,化学方程式为6NaClO2+NCl3+3H2O =6ClO2↑+NH3↑+3NaCl+3NaOH,则Y为NH3,Z为NaCl和NaOH的混合溶液。
气体X为H2,为阴极的还原产物,气体Y为NH3,既不是氧化产物,又不是还原产物,A错误。
由上述分析可知,Cl在2个反应中均有化合价的变化,B正确。
有0.1 mol NH4Cl参与反应,生成0.3 mol H2和0.1 mol NCl3,0.1 mol NCl3与NaClO2反应,生成0.1 mol NH3,由于每步反应不一定进行完全且可能有副反应,则有n(X)+n(Y)≤0.40 mol,C正确。
制取1 mol ClO2,需要 mol NCl3,据N原子守恒可知,至少需要 mol NH4Cl,D正确。
8. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法不正确的是 ( )
已知:NaHSO3溶液呈弱酸性
A.工业上用黄铁矿(FeS2,其中
硫元素为-1价)在高温下和氧
气反应制备SO2
B.结晶后母液中含有NaHCO3
C.中和后溶液中含Na2SO3和NaHCO3
D.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
[解析]由流程可知,结晶析出大量NaHSO3晶体,分离得到的湿料进行气流干燥,最终得到纯净的NaHSO3产品,母液含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,中和时发生H2SO3+2Na2CO3 =Na2SO3+2NaHCO3、NaHSO3+Na2CO3 =Na2SO3+NaHCO3,所以调节pH为8进行中和后得到Na2SO3和NaHCO3,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应为Na2SO3+SO2+H2O= 2NaHSO3、SO2+NaHCO3 =CO2+NaHSO3。
黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2,同时生成Fe2O3,发生反应的化学方程式为4FeS2+11O2 8SO2+2Fe2O3,故A正确;
母液含NaHSO3和过量的二氧化硫溶于水形成的亚硫酸,不含NaHCO3,故B错误;
中和时发生H2SO3+2Na2CO3 =Na2SO3+2NaHCO3,NaHSO3+Na2CO3 =Na2SO3+NaHCO3,则中和后溶液中含Na2SO3和NaHCO3,故C正确;
侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl,反应原理为NH3+CO2+H2O+NaCl =NaHCO3↓+NH4Cl,故D正确。
9.某工厂拟综合处理含N废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图所示流程:
下列说法不正确的是 ( )
A.固体1中主要含有CaCO3、
CaSO3、Ca(OH)2
B.X可以是空气,但不能过量
C.捕获剂所捕获的气体主要是CO、N2
D.处理含N废水时,发生的反应为N+N =N2↑+2H2O
[解析]工业废气中CO2、SO2可被石灰乳吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则固体1为主要含有Ca(OH)2、CaCO3、CaSO3,A正确;
气体1是不能被过量石灰乳吸收的N2、NO、CO,气体1中通入气体X,用NaOH溶液处理后得到NaNO2,X可为空气,但不能过量,否则得到硝酸钠,B正确;
气体2含有CO、N2,经捕获剂得到无污染性气体氮气和捕获产物,所捕获的气体主要是CO,防止污染空气,C错误;
NaOH溶液处理后到的NaNO2与含有N的废水反应生成无污染气体,应生成氮气,反应的离子方程式为N+N =N2↑+2H2O,D正确。
科学探究——以非金属及其化合物为主体的 “微实验”和“微流程”
探究命题角度 发展核心素养
以非金属及其化合物的制备为主体的“微实验”“微流程”及分析是高考命题的热点之一,考查非金属及其化合物的性质与转化、化学实验基本操作、反应条件的控制等,突出考查考生的综合分析能力、实验探究能力、创新思维能力等 [科学探究与创新意识] 通过对非金属及其化合物为主体的“微实验”“微流程”及分析,能发现和提出有探究价值的问题;能从问题和假设出发,确定探究目的,运用化学实验、调查等方法进行实验探究
探究点1 非金属及其化合物的制备“微实验”
例1 已知Ca3N2遇水发生水解反应,需密封保存。利用如图所示装置制取氮气,并用氮气制备Ca3N2,下列说法不正确的是(焦性没食子酸溶液用于吸收少量氧气) ( )
A.装置①中发生反应的化学方程式为NaNO2+NH4Cl NaCl+N2↑+2H2O
B.装置③④⑥中依次盛装浓硫酸、焦性没食子酸溶液、碱石灰
C.装置②为安全瓶,防止停止加热时,装置③中的溶液进入装置①中
D.实验结束后,取装置⑤中少量产物于试管中,加适量蒸馏水,再滴加石蕊溶液,溶液变蓝
[解析]由实验装置图可知,装置①为氯化铵溶液与亚硝酸钠固体共热反应制备氮气的装置,装置②作安全瓶,防止停止加热时,装置③中的溶液进入装置①中,装置③中盛有的焦性没食子酸溶液用于除去氮气中混有的氧气,防止氧气与装置⑤中的钙反应,装置④中盛有的浓硫酸用于干燥氮气,防止钙与水蒸气反应,装置⑤为钙与氮气共热反应制备氮化钙的装置,装置⑥中盛有的碱石灰用于吸收水蒸气,防止水蒸气进入装置⑤中导致氮化钙水解,装置⑦中盛有的焦性没食子酸溶液用于吸收空气中的氧气,防止氧气与装置⑤中的钙反应。
由分析可知,装置①中氯化铵溶液与亚硝酸钠固体共热反应生成氯化钠、氮气和水,反应的化学方程式为NaNO2+NH4Cl NaCl+N2↑+2H2O,故A正确;
装置③中盛有的试剂为焦性没食子酸溶液,装置④中盛有的试剂为浓硫酸,故B错误;
装置②作安全瓶,防止停止加热时,装置③中的溶液进入装置①中,故C正确;
向氮化钙中加适量蒸馏水,氮化钙与水发生水解反应生成氢氧化钙和氨,氢氧化钙溶液能使石蕊溶液变蓝色,故D正确。
[方法技巧] 分析非金属及其化合物为主体的“微实验”类题的方法
基本方法
变式题 某学习小组设计实验制取H2S并探究其性质,装置如图所示。下列说法正确的是 ( )
A.若F中产生黑色沉淀,则说明H2SO4的
酸性比H2S强
B.若G中产生黄色沉淀,则说明H2S的还
原性比Fe2+强
C.若H中溶液变红色,则说明H2S是二元弱酸
D.若E中FeS换成Na2S,该装置也可达到相同的目的
[解析] H2S和CuSO4溶液反应生成黑色沉淀CuS和H2SO4,不能说明H2SO4的酸性比H2S强,只能说明CuS不溶于硫酸,A错误;
若G中产生黄色沉淀,证明H2S可以被Fe3+氧化成S,而Fe3+被还原为Fe2+,则说明H2S的还原性比Fe2+强,B正确;
若H中溶液变红色,则说明H2S的水溶液呈酸性,但不能说明H2S是二元弱酸,C错误;
若E中FeS换成Na2S,由于Na2S可溶于水,无法达到该装置随开随用、随关随停的目的,D错误。
探究点2 非金属及其化合物的制备“微流程”
例2 水合肼(N2H4·H2O)的性质类似氨水。利用水合肼处理铜氨{[Cu(NH3)4]2+}废液回收铜粉的实验流程如图所示。下列说法错误的是 ( )
A.上述三步反应过程均为氧化还原反应
B.反应1的目的是制备NaClO
C.合成水合肼的反应中,消耗1 mol CO(NH2)2转移电子数为NA(设NA为阿伏伽德罗常数的值)
D.反应2完成后要用到过滤操作
[解析]反应1是氯气和氢氧化钠反应生成氯化钠和次氯酸钠,氯元素化合价变化;次氯酸钠把尿素氧化为水合肼,Cl元素、N元素化合价变化;反应2是{[Cu(NH3)4]2+}被水合肼还原为Cu,Cu、N元素化合价变化,上述三步反应过程均为氧化还原反应,A正确。
反应1是氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应1的目的是制备NaClO,用NaClO将尿素氧化为水合肼,B正确
。NaClO将尿素氧化为水合肼,氮元素化合价由-3价升高为-2价,消耗1 mol CO(NH2)2转移电子数为2NA,C错误。
反应2完成后要把铜粉分离出来,用到过滤操作,D正确。
[方法技巧] 分析非金属及其化合物为主体的“微流程”类题的方法
基本方法
变式题 一种以硼镁矿(含2MgO·B2O3·H2O、SiO2及少量FeO、Fe2O3、Al2O3等)为原料生产硼酸(H3BO3)的工艺流程如下。
已知:H3BO3与足量NaOH溶液反应生成Na[B(OH)4]。
下列说法错误的是 ( )
A.H3BO3的电离方程式为
H3BO3+H2O H++[B(OH)4]-
B.“热过滤”的目的是防止H3BO3从溶液中结晶析出
C.“除杂”过程中加入的试剂X依次为MgO、H2O2
D.“母液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到硫酸镁晶体
[解析]根据H3BO3与足量NaOH溶液反应生成Na[B(OH)4],则H3BO3是一元酸,电离方程式为H3BO3+H2O H++[B(OH)4]-,A正确;
“热过滤”的目的是防止 H3BO3从溶液中结晶析出,B正确;
“除杂”过程中加入的试剂X应该首先是H2O2溶液,将亚铁离子转化为铁离子,再加入MgO调节溶液的pH,使铁离子、铝离子均转化为沉淀,C错误;
“母液”中主要含有硫酸镁和硼酸,则经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得到硫酸镁晶体,D正确。
1.实验室制取少量SO2水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是 ( )
A.用装置甲制取SO2气体
B.用装置乙制取SO2水溶液
C.用装置丙吸收尾气中的SO2
D.用干燥pH试纸检验SO2水溶液的酸性
探究点一 以非金属及其化合物为主体的“微实验”
[解析]硫酸的酸性强于H2SO3,利用60%硫酸与NaHSO3(s)发生反应,可制得SO2气体,A正确;
SO2溶于水,装置乙中左侧安全瓶起到防止倒吸的作用,右侧集气瓶可制取SO2水溶液,B正确;
SO2不易溶于饱和NaHSO3溶液,也不发生反应,不能吸收尾气中的SO2,C错误;
SO2水溶液呈酸性,但不能漂白指示剂,故可用干燥pH试纸检验SO2水溶液的酸性,D正确。
2.实验室可用反应2CuSO4+2KI+SO2+2H2O =2CuI↓+2H2SO4+K2SO4来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能达到实验目的的是 ( )
A.制备SO2 B.制备CuI C.分离出CuI D.干燥CuI固体
[解析] Cu与浓硫酸加热生成SO2,可制备SO2,A正确;
由制备CuI反应原理可知,SO2通入CuSO4、KI混合液,发生氧化还原反应可制备CuI,B正确;
CuI难溶于水,可利用过滤的方法分离出CuI,C正确;
CuI受热易被氧化,干燥CuI固体要在干燥器中进行,不能选用蒸发装置,D错误。
3. 利用下列装置模拟“侯氏制碱法”,通过制备的NH3和CO2与饱和食盐水反应先制备NaHCO3。下列说法正确的是 ( )
A.实验时装置Ⅰ产生的气体要最先通入装置Ⅳ中
B.装置Ⅲ中的试剂为浓硫酸
C.导管口的连接顺序为a→e,f←d←c←b
D.实验过程中,装置Ⅳ内会出现浑浊现象
[解析]利用装置Ⅰ(碳酸钙和稀盐酸反应)产生的气体是CO2,用饱和NaHCO3溶液除去CO2气体中混有的HCl杂质;利用装置Ⅱ(熟石灰与氯化铵反应)产生氨气,氨气极易溶于水(注意防倒吸),且水溶液显碱性,利于CO2气体的吸收,实验过程先通氨气,后通二氧化碳。实验时装置Ⅰ产生的气体是CO2,应后通入装置Ⅳ中,A错误;
装置Ⅲ中的试剂为饱和NaHCO3溶液,主要吸收CO2中的HCl杂质,B错误;
实验室制得的氨气先通入饱和食盐水中,再把已经除杂的CO2气体通入饱和食盐水中,导管口的连接顺序为a→d→c→e,f←b,C错误;
实验过程中,二氧化碳、氨气和饱和食盐水
共同作用生成NaHCO3晶体,装置Ⅳ内会出
现浑浊现象,D正确。
4.探究是培养创新精神和实践能力的手段。
用如图所示装置探究氯气的性质,三支试
管口均放置浸有NaOH溶液的棉花。
下列对实验现象的分析错误的是 ( )
A.①中淀粉KI试纸变蓝,说明Cl2的氧化性强于I2
B.②中产生白色沉淀,说明氯气与水反应生成Cl-
C.③中的溶液变为棕黄色,说明氯气具有氧化性
D.④中溶液先变红后褪色,说明氯水有酸性和漂白性
[解析] Cl2可与KI反应生成I2,使淀粉KI试纸
变蓝,Cl2是氧化剂,I2是氧化产物,则Cl2的氧
化性强于I2,A正确;
浓盐酸易挥发出HCl,伴随Cl2进入AgNO3
溶液,故不能说明Cl2与水反应生成Cl-,B错误;
Cl2与FeCl2溶液反应,FeCl2被氧化生成FeCl3,溶液变为棕黄色,Cl2作氧化剂,表现氧化性,C正确;
Cl2与水反应生成HCl和HClO,溶液呈酸性,使紫色石蕊溶液变红色,HClO具有漂白性,可使指示剂褪色,D正确。
5. 碳酸镧[La2(CO3)3]常用于慢性肾衰患者高磷血病的治疗,实验室用如图所示装置,利用反应2LaCl3+6NH4HCO3 =La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O来制取。下列说法错误的是 ( )
A.装置X中盛放的试剂应为饱和NaHCO3溶液
B.实验中各装置导管口的连接方式为F→B→A→D,E←C
C.实验时可以不用X装置,将W中的盐酸用稀硫酸代替,实验效果相同
D.实验时,应先打开Y中分液漏斗的活塞,一段时间后再打开W中分液漏斗的活塞
[解析]装置X是为了除去二氧化碳中混有的HCl杂质,试剂应为饱和NaHCO3溶液,A正确;
装置Y用于制氨气,氨气极易溶于水,通入LaCl3溶液时要注意防倒吸,则C连E,装置W用于制二氧化碳,制取的二氧化碳中混有HCl杂质,需通过装置X除去HCl气体,则F连接B,A连接D,导管口的连接方式为F→B→A→D,E←C,B正确;
装置W用于制取二氧化碳,将盐酸用稀硫酸代替,生成的CaSO4附着在石灰石表面,不利于气体的产生,C错误;
实验开始时,先打开Y中分液漏斗的活塞,
先通入氨气,使LaCl3溶液呈碱性以吸收更
多的二氧化碳,一段时间后再打开W中分
液漏斗的活塞,D正确。
6.某小组利用如图所示装置,正确检验出了草酸的分解产物CO和CO2,下列有关实验现象描述错误的是 ( )
A.装置前后的澄清石灰水都会
变浑浊
B.盛浓硫酸的洗气瓶,瓶外壁或
溶液温度上升
C.红色氧化铁变黑
D.倒扣的玻璃漏斗尖端燃烧时有蓝色火焰,同时火焰夹带黄色
[解析]第一个澄清石灰水的作用是判断氢氧化钠溶液是否除尽CO2,保证结论正确,此石灰水没有变浑浊,A错误;
浓硫酸吸收水蒸气放热,洗气瓶外壁或溶液温度上升,B正确;
草酸分解生成二氧化碳和一氧化碳,一氧化碳还原氧化铁生成黑色铁,C正确;
倒扣玻璃漏斗尖端有剩余CO燃烧,产生淡蓝色火焰,由于玻璃漏斗含有钠元素,燃烧时存在钠的焰色,带有黄色,D正确。
7.实验室中利用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2,实验流程如图所示(其中NCl3中N为-3价)。下列说法错误的是 ( )
A.气体X和Y均为还原产物
B.整个过程,Cl元素至少参与了2个氧化
还原反应
C.若有0.1 mol NH4Cl参与反应,n(X)+n(Y)≤0.40 mol
D.制取1 mol ClO2至少需要 mol NH4Cl
探究点二 以非金属及其化合物为主体的“微流程”
[解析]电解NH4Cl溶液和稀盐酸混合液得到NCl3和气体X,NH4Cl→NCl3发生氧化反应,酸性条件下不能生成NH3,气体X必然是还原产物,则X应为H2,电解方程式为NH4Cl+2HCl 3H2↑ + NCl3;NCl3溶液中加入NaClO2溶液,得到ClO2、气体Y和溶液Z,化学方程式为6NaClO2+NCl3+3H2O =6ClO2↑+NH3↑+3NaCl+3NaOH,则Y为NH3,Z为NaCl和NaOH的混合溶液。
气体X为H2,为阴极的还原产物,气体Y为NH3,既不是氧化产物,又不是还原产物,A错误。
由上述分析可知,Cl在2个反应中均有化合价的变化,B正确。
有0.1 mol NH4Cl参与反应,生成0.3 mol H2和0.1 mol NCl3,0.1 mol NCl3与NaClO2反应,生成0.1 mol NH3,由于每步反应不一定进行完全且可能有副反应,则有n(X)+n(Y)≤0.40 mol,C正确。
制取1 mol ClO2,需要 mol NCl3,据N原子守恒可知,至少需要 mol NH4Cl,D正确。
8. 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法不正确的是 ( )
已知:NaHSO3溶液呈弱酸性
A.工业上用黄铁矿(FeS2,其中
硫元素为-1价)在高温下和氧
气反应制备SO2
B.结晶后母液中含有NaHCO3
C.中和后溶液中含Na2SO3和NaHCO3
D.侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl
[解析]由流程可知,结晶析出大量NaHSO3晶体,分离得到的湿料进行气流干燥,最终得到纯净的NaHSO3产品,母液含饱和NaHSO3和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,中和时发生H2SO3+2Na2CO3 =Na2SO3+2NaHCO3、NaHSO3+Na2CO3 =Na2SO3+NaHCO3,所以调节pH为8进行中和后得到Na2SO3和NaHCO3,通入二氧化硫气体进行混合吸收,此时吸收过程中发生反应为Na2SO3+SO2+H2O= 2NaHSO3、SO2+NaHCO3 =CO2+NaHSO3。
黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2,同时生成Fe2O3,发生反应的化学方程式为4FeS2+11O2 8SO2+2Fe2O3,故A正确;
母液含NaHSO3和过量的二氧化硫溶于水形成的亚硫酸,不含NaHCO3,故B错误;
中和时发生H2SO3+2Na2CO3 =Na2SO3+2NaHCO3,NaHSO3+Na2CO3 =Na2SO3+NaHCO3,则中和后溶液中含Na2SO3和NaHCO3,故C正确;
侯氏制碱法以H2O、NH3、CO2、NaCl为原料制备NaHCO3和NH4Cl,反应原理为NH3+CO2+H2O+NaCl =NaHCO3↓+NH4Cl,故D正确。
9.某工厂拟综合处理含N废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计如图所示流程:
下列说法不正确的是 ( )
A.固体1中主要含有CaCO3、
CaSO3、Ca(OH)2
B.X可以是空气,但不能过量
C.捕获剂所捕获的气体主要是CO、N2
D.处理含N废水时,发生的反应为N+N =N2↑+2H2O
[解析]工业废气中CO2、SO2可被石灰乳吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则固体1为主要含有Ca(OH)2、CaCO3、CaSO3,A正确;
气体1是不能被过量石灰乳吸收的N2、NO、CO,气体1中通入气体X,用NaOH溶液处理后得到NaNO2,X可为空气,但不能过量,否则得到硝酸钠,B正确;
气体2含有CO、N2,经捕获剂得到无污染性气体氮气和捕获产物,所捕获的气体主要是CO,防止污染空气,C错误;
NaOH溶液处理后到的NaNO2与含有N的废水反应生成无污染气体,应生成氮气,反应的离子方程式为N+N =N2↑+2H2O,D正确。
同课章节目录
