2.2.3影响化学平衡的因素 课件(共61张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.3影响化学平衡的因素 课件(共61张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 18:00:10 | ||
图片预览









文档简介
(共61张PPT)
第二章 化学反应速率与化学平衡
第二节 第三课时
影响化学平衡的因素
学习目标 1min
1.通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响。
2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。
自学指导 6min
阅读课本第34-38页,完成课堂新坐标第25页
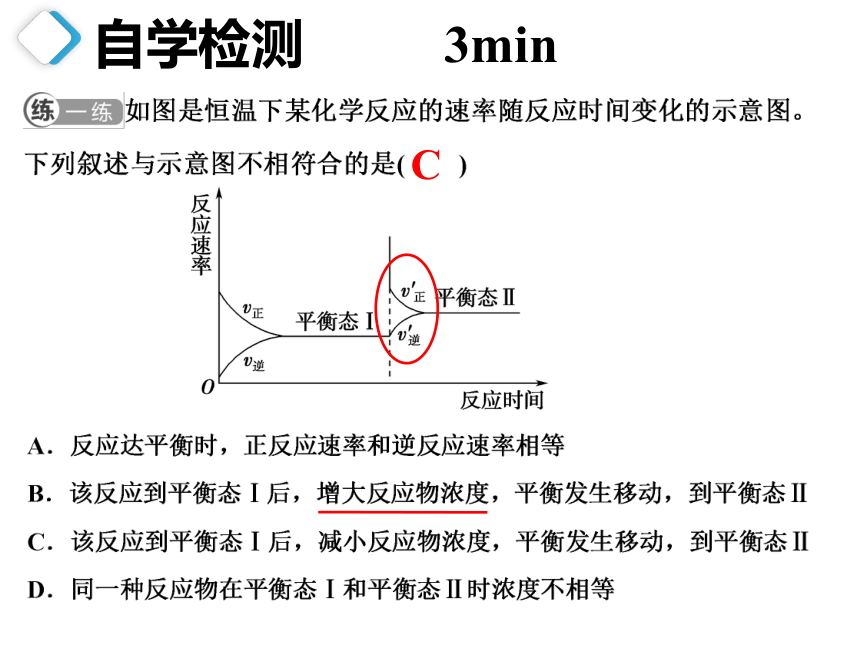
自学检测 3min
C
自学检测 3min
不变
不
增大
不
不变
不
增大
向正反应方向
教师点拨 20min
化学平衡状态
1、定义:在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分浓度保持不变的状态叫化学平衡状态。
2、特征: 逆、动、 等、 定、 变
思考:如果改变浓度、压强、温度、催化剂等条件,反应速率会改变,化学平衡状态是否会发生变化?如何变化?
一定条件下的平衡状态
(V正=V逆)
条件改变
( V正≠V逆)
新条件下的平衡状态
(V 正=V 逆)
一、化学平衡的移动
1.定义:当一个可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡。
V正= V逆
2.实质 :
各组分的百分含量发生改变
3.标志:
(1)根据反应速率判断
若v正>v逆:平衡向 方向移动。
条件改变 若v正=v逆:反应达到平衡状态,平衡不移动。
若v正<v逆:平衡向 方向移动。
(2)根据化学平衡常数判断
若Q>K:平衡向 方向移动。
条件改变 若Q=K:反应达到平衡状态,平衡不移动。
若Q正反应
逆反应
外界条件对化学平衡移动的影响是通过改变反应速率来实现的。条件改变时,判断平衡移动的方向:
逆反应
正反应
二、浓度对化学平衡的影响
【实验2-1】
浅黄色 无色 红色
b中铁粉与Fe3+反应使Fe3+浓度减小,平衡向逆反应方向移动;
c中加入KSCN溶液使SCN-的浓度增大,平衡向正反应方向移动。
向盛有5mL 0.005 mol/L FeCl3溶液中加入5mL 0.0015 mol/L 的 KSCN溶液,平均分装在三支试管中。
实验操作
实验现象
红色 红色变浅 红色变深
实验解释
实验原理
4滴
在K2Cr2O7溶液中存在如下平衡:
Cr2O72- + H2O 2CrO42-+2H+
二、浓度对化学平衡的影响
橙色 黄色
取一支试管,加入2mL 0.1mol/LK2Cr2O7溶液,然后按下表的步骤进行实验,观察到溶液的颜色变化,判断平衡是否发生移动及移动的方向。
实验步骤 实验现象 结论
(1)向试管中滴加5-10滴6mol/LNaOH溶液
(2)向试管中滴加5-10滴6mol/LH2SO4溶液
黄色加深
橙色加深
减少生成物浓度,平衡正向移动
增大生成物浓度,平衡逆向移动
课本P54
大量实验表明,在其他条件不变的情况下:
(1)增大反应物浓度或减小生成物浓度,平衡向
方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向
方向移动。
正反应
逆反应
二、浓度对化学平衡的影响
结论
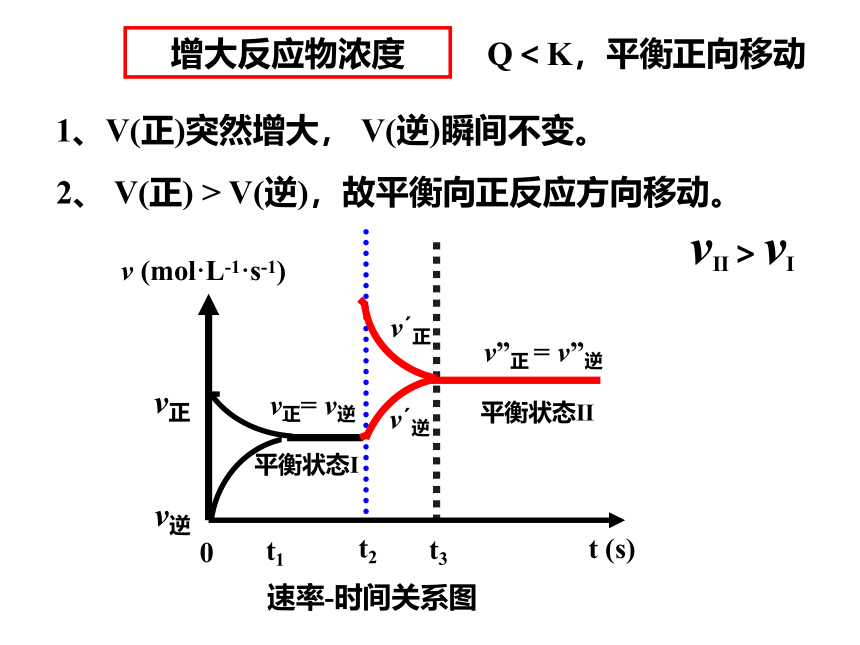
1、V(正)突然增大, V(逆)瞬间不变。
2、 V(正) > V(逆),故平衡向正反应方向移动。
增大反应物浓度
t2
t3
v正= v逆
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
平衡状态Ⅰ
速率-时间关系图
v 正
v 逆
v”正 = v”逆
平衡状态Ⅱ
vⅡ>vⅠ
Q<K,平衡正向移动
试着画出减小反应物浓度、增大生成物浓度、减小生成物浓度的 v – t 图
增大反应物浓度
v (正)
v (逆)
减小反应物浓度
增大生成物浓度
减小生成物浓度
1、 V(正)瞬间不变、 V(逆)突然减小
2、V(正) > V(逆),故平衡向正反应方向移动。
v (正)
v (逆)
vⅡ<vⅠ
vⅠ
vⅡ
减小生成物浓度
Q<K,平衡正向移动
增大反应物浓度
减小生成物浓度
v正> v逆,化学平衡向正反应方向移动
二、浓度对化学平衡的影响
2、 V(正) < V(逆) 故平衡向逆反应方向移动。
1、 V(正)瞬间不变、 V(逆)突然增大。
v (逆)
v (正)
vⅡ>vⅠ
vⅠ
vⅡ
增大生成物浓度
Q>K,平衡逆向移动
1、V(正)突然减小、 V(逆)瞬间不变
2、V(正) < V(逆) 故平衡向逆反应方向移动。
v (逆)
v (正)
vⅡ<vⅠ
vⅠ
vⅡ
减小反应物浓度
Q>K,平衡逆向移动
增大生成物浓度
减小反应物浓度
v正< v逆,化学平衡向逆反应方向移动
二、浓度对化学平衡的影响
由以上四图可以得出结论:
1)改变反应物浓度瞬间,只能改变正反应速率
改变生成物浓度瞬间,只能改变逆反应速率
2)改变浓度瞬间,
若v(正)>v(逆),平衡向正反应方向移动
若v(逆)>v(正),平衡向逆反应方向移动
3)新旧平衡速率比较:
增大浓度,新平衡速率大于旧平衡速率
减小浓度,新平衡速率小于旧平衡速率
归纳小结:
①增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以v正仍等于v逆,平衡不移动。
②作为离子反应,只有改变实际参加反应的离子浓度对平衡有影响,如:
在可逆反应达到平衡时,在其他条件不变的情况下:
(1)增大反应物浓度或减小生成物浓度,平衡向 方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向 方向移动。
正反应
逆反应
二、浓度对化学平衡的影响
结论
进一步分析,我们可以看出改变浓度,平衡总是向着减弱这种改变的方向移动。
在工业生产中,适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
1、已知在氨水中存在下列平衡:
NH3 + H2O
NH3· H2O
NH4+ + OH-
(1)向氨水中加入MgCl2固体,平衡向 移动, OH-浓度 ,NH4+ 浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,
(3) 向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。
正反应方向
减小
增大
正反应方向
逆反应方向
有气体放出
2、可逆反应C(s) + H2O(g) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
平衡正向移动,CO浓度增大
平衡不移动,CO浓度不变
平衡逆向移动,CO浓度减小
二、压强对化学平衡的影响
【实验2-2】
Ⅰ
Ⅱ
密封
体系压强减小
体系压强增大
Ⅱ
Ⅰ
NO2与N2O4
混合气
实验 体系压强增大 体系压强减小
现象 气体颜色________________,最终比Ⅱ处平衡时颜色____ 气体颜色________________,最终比Ⅰ处平衡时颜色___
结论 增大压强,化学平衡 向___________的方向移动 减小压强,化学平衡
向___________的方向移动
先变深又逐渐变浅
深
先变浅又逐渐变深
浅
气体体积减小
气体体积增大
mA + nB pC+qD
n(A) n(B)
V V
K=
n(C) n(D)
V V
p
[
[
]
]
q
——
——
——
——
[
[
]
]
m
n
=
n(C) n(D)
Vp+q
=
n(A) n(B)
Vm+n
p q
m n
K= ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
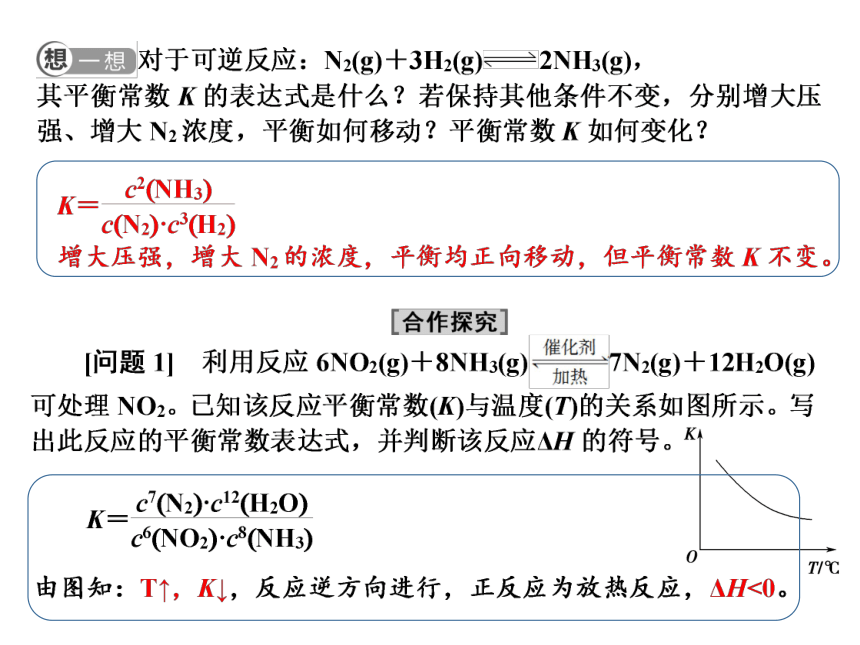
改变压强,即改变体积,体积变化如何影响浓度商变化?进而影响平衡如何变化?
Q = ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
若P↑,即V↓,则Q?平衡移动方向?
?
Q = ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
mA + nB pC+qD
① 若 m+n> p+q
P↑,即V↓,则V (m+n)-(p+q) ↓,Q↓,Q<K,平衡正向移动。
② 若 m+n< p+q
P↑,即V↓,则V (m+n)-(p+q) ↑,Q↑,Q>K,平衡逆向移动。
反之,P↓,即V↑,则V (m+n)-(p+q) ↑,Q↑,Q>K,平衡逆向移动。
反之,P↓,即V↑,则V (m+n)-(p+q) ↓,Q↓,Q<K,平衡正向移动。
③ 若 m+n = p+q
则V (m+n)-(p+q) =1,改变压强不能使Q变化,Q=K,平衡不移动。
二、压强对化学平衡的影响
大量实验表明,反应后气体的总计量数不等的可逆反应达到平衡时,在其他条件不变的情况下:
(1)增大压强(减小体积),平衡向______________方向移动。
(2)减小压强(增大体积),平衡向______________方向移动。
气体体积缩小的
气体体积增大的
结论
思考:改变压强时对正、逆反应速率有怎么样影响
反应后气体的总计量数相等的可逆反应达到平衡时,改变压强不能使化学平衡发生移动。
进一步分析,我们可以看出改变压强,平衡总是向着减弱这种改变的方向移动。
1、V正、 V逆都加快,气体系数大的一方增得多
2、 V正 > V逆,故平衡向正反应方向移动。
增大压强(缩小体积)
t2
t3
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
v正= v逆
平衡状态Ⅰ
速率-时间关系图
v 正
v 逆
v”正 = v”逆
平衡状态Ⅱ
vⅡ>vⅠ
mA + nB pC+qD(m+n>p+q)
试着画出(m+n<p+q)增大压强的 v – t 图、
(m+n>p+q)和(m+n<p+q)减小压强的 v – t 图、
以及(m+n=p+q)增大压强和减小压强的 v – t 图
增大压强
v (正)
v (逆)
(m+n<p+q)增大压强
(m+n>p+q)减小压强
(m+n<p+q)减小压强
mA + nB pC+qD(m+n>p+q)
1、V正、 V逆都加快,气体系数大的一方增得多
2、 V逆 > V正,故平衡向逆反应方向移动。
增大压强(缩小体积)
vⅡ>vⅠ
mA + nB pC+qD(m+n<p+q)
v (逆)
v (正)
vⅠ
vⅡ
mA + nB pC+qD
(m+n<p+q)
(m+n>p+q)
正向移动
逆向移动
增大压强,化学平衡向气体体积减小的方向移动
1、V正、 V逆都减慢,气体系数大的一方减得多
2、 V正 < V逆,故平衡向逆反应方向移动。
减小压强(增大体积)
vⅡ<vⅠ
mA + nB pC+qD(m+n>p+q)
v (逆)
v (正)
vⅠ
vⅡ
1、V正、 V逆都减慢,气体系数大的一方减得多
2、 V正 > V逆,故平衡向正反应方向移动。
减小压强(增大体积)
vⅡ<vⅠ
mA + nB pC+qD(m+n<p+q)
v (正)
v (逆)
vⅠ
vⅡ
mA + nB pC+qD
(m+n<p+q)
(m+n>p+q)
逆向移动
正向移动
减小压强,化学平衡向气体体积增大的方向移动
1、V正、 V逆同等程度加快,比原平衡快
2、 V正 = V逆,故平衡不移动。
增大压强(缩小体积)
mA + nB pC+qD (m+n=p+q)
vⅠ
vⅡ
v (正)=v (逆)
减小压强(增大体积)
mA + nB pC+qD (m+n=p+q)
1、V正、 V逆同等程度减慢,比原平衡慢
2、 V正 = V逆,故平衡不移动。
vⅠ
vⅡ
v (正)=v (逆)
mA + nB pC+qD
m+n=p+q
不移动
不移动
改变压强,化学平衡不移动
特别注意:
(1)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。
(2)恒容恒温下同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
mA(g) + nB(g) pC(g) + qD(g)
n始/(mol) m n 0 0
n剩/(mol) a b c d
恒容恒温下继续按m:n同等程度地加入A和B,或按a:b:c:d同等程度地加入A,B,C和D,或按p:q同等程度地加入C和D,等同于增大压强,此时平衡相对于原平衡向气体体积减小的方向移动。
二、压强对化学平衡的影响
对于反应后气体的总计量数不等的可逆反应达到平衡时,在其他条件不变的情况下:
结论
反应后气体的总计量数相等的可逆反应达到平衡时,改变压强不能使化学平衡发生移动。
增大压强:V正、V逆都增大
化学平衡向着气体系数缩小的方向移动;
减小压强: V正、V逆都减小
化学平衡向着气体系数增大的方向移动。
【练习】下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?
① 2NO(g) + O2(g) 2NO2(g)
② H2O(g) + CO(g) CO2(g) + H2(g)
③ H2O(g) + C(s) CO(g) + H2(g)
④ CaCO3(s) CaO(s) + CO2(g)
⑤ H2S(g) H2(g) + S(s)
向右移动
不移动
向左移动
向左移动
不移动
思考:对于反应②和⑤,增大压强时,平衡没有移动,但正逆反应速率有无变化?
正逆反应速率均增大
三、温度对化学平衡的影响
【实验2-3】
实验 浸泡在热水中 浸泡在冰水中
现象
结论 升高温度,化学平衡 向______的方向移动 降低温度,化学平衡
向______的方向移动
ΔH=-56.9 kJ·mol-1
红棕色逐渐加深
红棕色逐渐变浅
放热
吸热
NO2与N2O4
混合气
三、温度对化学平衡的影响
课本P54
[Cu(H2O)4]2++ 4Cl- [CuCl4]2-+4H2O ΔH >0
蓝色 黄色
取两支试管,分别加入2mL 0.5mol/LCuCl2溶液,将其中一支试管先加热,然后置于冷水中,观察并记录实验现象,与另一支试管进行对比。
实验步骤 实验现象 结论
(1)加热试管
(2)将上述试管置于冷水中
绿色逐渐变成黄色
绿色逐渐变成蓝色
升高温度,化学平衡
向吸热的方向移动
降低温度,化学平衡向放热的方向移动
升高温度
1、V吸、 V放都加快(比原平衡快)。但升温对吸热反应更有利,吸热反应速率增得更快。
2、 V吸 > V放,故平衡向吸热反应方向移动。
vⅡ>vⅠ
t2
t3
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
v正= v逆
平衡状态Ⅰ
速率-时间关系图
v 吸
v 放
v”正 = v”逆
平衡状态Ⅱ
降低温度
1、V吸、 V放都减慢(比原平衡慢)。但吸热反应速率变化更大
2、 V放 > V吸,故平衡向放热反应方向移动。
vⅡ<vⅠ
v (放)
v (吸)
vⅠ
vⅡ
mA(g)+nB(g) pC(g)+qD(g) ΔH>0
mA(g)+nB(g) pC(g)+qD(g) ΔH<0
升高温度
正反应方向
升高温度,化学平衡向吸热反应方向移动
逆反应方向
正反应方向
mA(g)+nB(g) pC(g)+qD(g) ΔH>0
mA(g)+nB(g) pC(g)+qD(g) ΔH<0
降低温度
降低温度,化学平衡向放热反应方向移动
逆反应方向
K只与温度有关,温度不变,K不变。
在其他条件不变的情况下:
升高温度,v正、v逆都增大,反应向吸热方向移动,
降低温度,v正、v逆都减小,反应向放热方向移动。
结论
三、温度对化学平衡的影响
进一步分析,我们可以看出改变温度,平衡总是向着减弱这种改变的方向移动。
若温度升高 , K ↑, 则正反应为_____反应,ΔH___0 .
若温度升高 , K ↓, 则正反应为_____反应,ΔH___0 .
吸热
>
放热
<
吸热方向
Q<K,正向移动
吸热方向
Q>K,逆向移动
若温度降低 , K ↑, 则正反应为_____反应,ΔH___0 .
若温度降低 , K ↓, 则正反应为_____反应,ΔH___0 .
放热
<
吸热
>
放热方向
Q<K,正向移动
放热方向
Q>K,逆向移动
【练一练】
四、催化剂对化学平衡的影响
催化剂同等程度改变化学反应速率,V 正= V 逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。
vⅠ
vⅡ
v (正)=v (逆)
vⅠ
vⅡ
v (正)=v (逆)
正催化剂对化学平衡的影响
负催化剂对化学平衡的影响
vⅡ>vⅠ
vⅡ<vⅠ
勒夏特列原理:
如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒夏特列原理。也称化学平衡移动原理。
①影响平衡的因素有浓度、压强、温度;
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂,具体问题具体分析;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
对化学平衡移动原理的理解
化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变,改变是不可逆转的。
新平衡时此物理量更靠近于改变的方向。
如①增大反应物A的浓度,平衡正向移动,A的浓度在增大的基础上减小,但达到新平衡时,A的浓度一定比原平衡大;
②若将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时体系的温度(T):50 ℃③若对平衡体系N2(g)+3H2(g) 2NH3(g)加压,例如从30MPa加压到60MPa,化学平衡向气体分子数减小的方向移动,达到新的平衡时体系的压强(p):30 MPa归纳总结——影响化学平衡移动的因素
外界条件的改变 化学平衡的移动
浓度 增大反应物浓度 / 减小生成物浓度 向正反应方向移动
减小反应物浓度 / 增大生成物浓度 向逆反应方向移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
压强 反应前后气体分子总数改变 增大压强 向气体分子总数减小的方向移动
减小压强 向气体分子总数增大的方向移动
反应前后气体分子总数不变 改变压强 平衡不移动
催化剂 使用催化剂 平衡不移动
已知:N2(g)+ 3H2(g) 2NH3(g) ΔH =-92.4kJ.mol-1, 反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
【练一练】
探究外界因素对化学平衡的影响
大本P26
Hb+O2 Hb(O2),Hb+CO Hb(CO)
↑
↓
↓
↓
CO +HbO2 O2+ HbCO
↑
↓
C
↓
↑
↑
平衡正向移动
平衡逆向(吸热方向)移动
↑
↑
平衡逆向移动
A
加压平衡逆向移动
相当于减压,平衡正向移动
随堂自测
B
B
反应进行的程度与速率无关
↓
稀释,各组分浓度减小,平衡向离子浓度增大的方向(逆向)进行。
C
C
1.20mol/L
加压,C的浓度减小,平衡向气体计量数减小的方向(逆向)移动
放热反应方向
增大压强
降低温度
升高温度
减小压强
第二章 化学反应速率与化学平衡
第二节 第三课时
影响化学平衡的因素
学习目标 1min
1.通过实验探究,了解温度、浓度、压强和催化剂对化学平衡状态的影响。
2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。
自学指导 6min
阅读课本第34-38页,完成课堂新坐标第25页
自学检测 3min
C
自学检测 3min
不变
不
增大
不
不变
不
增大
向正反应方向
教师点拨 20min
化学平衡状态
1、定义:在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应混合物中各组分浓度保持不变的状态叫化学平衡状态。
2、特征: 逆、动、 等、 定、 变
思考:如果改变浓度、压强、温度、催化剂等条件,反应速率会改变,化学平衡状态是否会发生变化?如何变化?
一定条件下的平衡状态
(V正=V逆)
条件改变
( V正≠V逆)
新条件下的平衡状态
(V 正=V 逆)
一、化学平衡的移动
1.定义:当一个可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡。
V正= V逆
2.实质 :
各组分的百分含量发生改变
3.标志:
(1)根据反应速率判断
若v正>v逆:平衡向 方向移动。
条件改变 若v正=v逆:反应达到平衡状态,平衡不移动。
若v正<v逆:平衡向 方向移动。
(2)根据化学平衡常数判断
若Q>K:平衡向 方向移动。
条件改变 若Q=K:反应达到平衡状态,平衡不移动。
若Q
逆反应
外界条件对化学平衡移动的影响是通过改变反应速率来实现的。条件改变时,判断平衡移动的方向:
逆反应
正反应
二、浓度对化学平衡的影响
【实验2-1】
浅黄色 无色 红色
b中铁粉与Fe3+反应使Fe3+浓度减小,平衡向逆反应方向移动;
c中加入KSCN溶液使SCN-的浓度增大,平衡向正反应方向移动。
向盛有5mL 0.005 mol/L FeCl3溶液中加入5mL 0.0015 mol/L 的 KSCN溶液,平均分装在三支试管中。
实验操作
实验现象
红色 红色变浅 红色变深
实验解释
实验原理
4滴
在K2Cr2O7溶液中存在如下平衡:
Cr2O72- + H2O 2CrO42-+2H+
二、浓度对化学平衡的影响
橙色 黄色
取一支试管,加入2mL 0.1mol/LK2Cr2O7溶液,然后按下表的步骤进行实验,观察到溶液的颜色变化,判断平衡是否发生移动及移动的方向。
实验步骤 实验现象 结论
(1)向试管中滴加5-10滴6mol/LNaOH溶液
(2)向试管中滴加5-10滴6mol/LH2SO4溶液
黄色加深
橙色加深
减少生成物浓度,平衡正向移动
增大生成物浓度,平衡逆向移动
课本P54
大量实验表明,在其他条件不变的情况下:
(1)增大反应物浓度或减小生成物浓度,平衡向
方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向
方向移动。
正反应
逆反应
二、浓度对化学平衡的影响
结论
1、V(正)突然增大, V(逆)瞬间不变。
2、 V(正) > V(逆),故平衡向正反应方向移动。
增大反应物浓度
t2
t3
v正= v逆
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
平衡状态Ⅰ
速率-时间关系图
v 正
v 逆
v”正 = v”逆
平衡状态Ⅱ
vⅡ>vⅠ
Q<K,平衡正向移动
试着画出减小反应物浓度、增大生成物浓度、减小生成物浓度的 v – t 图
增大反应物浓度
v (正)
v (逆)
减小反应物浓度
增大生成物浓度
减小生成物浓度
1、 V(正)瞬间不变、 V(逆)突然减小
2、V(正) > V(逆),故平衡向正反应方向移动。
v (正)
v (逆)
vⅡ<vⅠ
vⅠ
vⅡ
减小生成物浓度
Q<K,平衡正向移动
增大反应物浓度
减小生成物浓度
v正> v逆,化学平衡向正反应方向移动
二、浓度对化学平衡的影响
2、 V(正) < V(逆) 故平衡向逆反应方向移动。
1、 V(正)瞬间不变、 V(逆)突然增大。
v (逆)
v (正)
vⅡ>vⅠ
vⅠ
vⅡ
增大生成物浓度
Q>K,平衡逆向移动
1、V(正)突然减小、 V(逆)瞬间不变
2、V(正) < V(逆) 故平衡向逆反应方向移动。
v (逆)
v (正)
vⅡ<vⅠ
vⅠ
vⅡ
减小反应物浓度
Q>K,平衡逆向移动
增大生成物浓度
减小反应物浓度
v正< v逆,化学平衡向逆反应方向移动
二、浓度对化学平衡的影响
由以上四图可以得出结论:
1)改变反应物浓度瞬间,只能改变正反应速率
改变生成物浓度瞬间,只能改变逆反应速率
2)改变浓度瞬间,
若v(正)>v(逆),平衡向正反应方向移动
若v(逆)>v(正),平衡向逆反应方向移动
3)新旧平衡速率比较:
增大浓度,新平衡速率大于旧平衡速率
减小浓度,新平衡速率小于旧平衡速率
归纳小结:
①增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以v正仍等于v逆,平衡不移动。
②作为离子反应,只有改变实际参加反应的离子浓度对平衡有影响,如:
在可逆反应达到平衡时,在其他条件不变的情况下:
(1)增大反应物浓度或减小生成物浓度,平衡向 方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向 方向移动。
正反应
逆反应
二、浓度对化学平衡的影响
结论
进一步分析,我们可以看出改变浓度,平衡总是向着减弱这种改变的方向移动。
在工业生产中,适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可提高价格较高的原料的转化率,从而降低生产成本。
1、已知在氨水中存在下列平衡:
NH3 + H2O
NH3· H2O
NH4+ + OH-
(1)向氨水中加入MgCl2固体,平衡向 移动, OH-浓度 ,NH4+ 浓度 。
(2)向氨水中加入浓盐酸,平衡向 移动,
(3) 向氨水中加入少量NaOH固体,平衡向 .移动,此时发生的现象是 。
正反应方向
减小
增大
正反应方向
逆反应方向
有气体放出
2、可逆反应C(s) + H2O(g) CO(g) + H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?
①增大水蒸气浓度
②加入更多的碳
③增加H2浓度
平衡正向移动,CO浓度增大
平衡不移动,CO浓度不变
平衡逆向移动,CO浓度减小
二、压强对化学平衡的影响
【实验2-2】
Ⅰ
Ⅱ
密封
体系压强减小
体系压强增大
Ⅱ
Ⅰ
NO2与N2O4
混合气
实验 体系压强增大 体系压强减小
现象 气体颜色________________,最终比Ⅱ处平衡时颜色____ 气体颜色________________,最终比Ⅰ处平衡时颜色___
结论 增大压强,化学平衡 向___________的方向移动 减小压强,化学平衡
向___________的方向移动
先变深又逐渐变浅
深
先变浅又逐渐变深
浅
气体体积减小
气体体积增大
mA + nB pC+qD
n(A) n(B)
V V
K=
n(C) n(D)
V V
p
[
[
]
]
q
——
——
——
——
[
[
]
]
m
n
=
n(C) n(D)
Vp+q
=
n(A) n(B)
Vm+n
p q
m n
K= ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
改变压强,即改变体积,体积变化如何影响浓度商变化?进而影响平衡如何变化?
Q = ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
若P↑,即V↓,则Q?平衡移动方向?
?
Q = ·V (m+n)-(p+q)
n(C) n(D)
n(A) n(B)
p q
m n
mA + nB pC+qD
① 若 m+n> p+q
P↑,即V↓,则V (m+n)-(p+q) ↓,Q↓,Q<K,平衡正向移动。
② 若 m+n< p+q
P↑,即V↓,则V (m+n)-(p+q) ↑,Q↑,Q>K,平衡逆向移动。
反之,P↓,即V↑,则V (m+n)-(p+q) ↑,Q↑,Q>K,平衡逆向移动。
反之,P↓,即V↑,则V (m+n)-(p+q) ↓,Q↓,Q<K,平衡正向移动。
③ 若 m+n = p+q
则V (m+n)-(p+q) =1,改变压强不能使Q变化,Q=K,平衡不移动。
二、压强对化学平衡的影响
大量实验表明,反应后气体的总计量数不等的可逆反应达到平衡时,在其他条件不变的情况下:
(1)增大压强(减小体积),平衡向______________方向移动。
(2)减小压强(增大体积),平衡向______________方向移动。
气体体积缩小的
气体体积增大的
结论
思考:改变压强时对正、逆反应速率有怎么样影响
反应后气体的总计量数相等的可逆反应达到平衡时,改变压强不能使化学平衡发生移动。
进一步分析,我们可以看出改变压强,平衡总是向着减弱这种改变的方向移动。
1、V正、 V逆都加快,气体系数大的一方增得多
2、 V正 > V逆,故平衡向正反应方向移动。
增大压强(缩小体积)
t2
t3
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
v正= v逆
平衡状态Ⅰ
速率-时间关系图
v 正
v 逆
v”正 = v”逆
平衡状态Ⅱ
vⅡ>vⅠ
mA + nB pC+qD(m+n>p+q)
试着画出(m+n<p+q)增大压强的 v – t 图、
(m+n>p+q)和(m+n<p+q)减小压强的 v – t 图、
以及(m+n=p+q)增大压强和减小压强的 v – t 图
增大压强
v (正)
v (逆)
(m+n<p+q)增大压强
(m+n>p+q)减小压强
(m+n<p+q)减小压强
mA + nB pC+qD(m+n>p+q)
1、V正、 V逆都加快,气体系数大的一方增得多
2、 V逆 > V正,故平衡向逆反应方向移动。
增大压强(缩小体积)
vⅡ>vⅠ
mA + nB pC+qD(m+n<p+q)
v (逆)
v (正)
vⅠ
vⅡ
mA + nB pC+qD
(m+n<p+q)
(m+n>p+q)
正向移动
逆向移动
增大压强,化学平衡向气体体积减小的方向移动
1、V正、 V逆都减慢,气体系数大的一方减得多
2、 V正 < V逆,故平衡向逆反应方向移动。
减小压强(增大体积)
vⅡ<vⅠ
mA + nB pC+qD(m+n>p+q)
v (逆)
v (正)
vⅠ
vⅡ
1、V正、 V逆都减慢,气体系数大的一方减得多
2、 V正 > V逆,故平衡向正反应方向移动。
减小压强(增大体积)
vⅡ<vⅠ
mA + nB pC+qD(m+n<p+q)
v (正)
v (逆)
vⅠ
vⅡ
mA + nB pC+qD
(m+n<p+q)
(m+n>p+q)
逆向移动
正向移动
减小压强,化学平衡向气体体积增大的方向移动
1、V正、 V逆同等程度加快,比原平衡快
2、 V正 = V逆,故平衡不移动。
增大压强(缩小体积)
mA + nB pC+qD (m+n=p+q)
vⅠ
vⅡ
v (正)=v (逆)
减小压强(增大体积)
mA + nB pC+qD (m+n=p+q)
1、V正、 V逆同等程度减慢,比原平衡慢
2、 V正 = V逆,故平衡不移动。
vⅠ
vⅡ
v (正)=v (逆)
mA + nB pC+qD
m+n=p+q
不移动
不移动
改变压强,化学平衡不移动
特别注意:
(1)在恒容容器中,改变其中一种气态物质的浓度时,必然同时引起压强的改变,但判断平衡移动的方向时,应以浓度的影响进行分析。
(2)恒容恒温下同等程度地改变反应混合物中各物质的浓度时,应视为压强的影响。
mA(g) + nB(g) pC(g) + qD(g)
n始/(mol) m n 0 0
n剩/(mol) a b c d
恒容恒温下继续按m:n同等程度地加入A和B,或按a:b:c:d同等程度地加入A,B,C和D,或按p:q同等程度地加入C和D,等同于增大压强,此时平衡相对于原平衡向气体体积减小的方向移动。
二、压强对化学平衡的影响
对于反应后气体的总计量数不等的可逆反应达到平衡时,在其他条件不变的情况下:
结论
反应后气体的总计量数相等的可逆反应达到平衡时,改变压强不能使化学平衡发生移动。
增大压强:V正、V逆都增大
化学平衡向着气体系数缩小的方向移动;
减小压强: V正、V逆都减小
化学平衡向着气体系数增大的方向移动。
【练习】下列反应达到化学平衡时,增大压强,平衡是否移动?向哪个方向移动?
① 2NO(g) + O2(g) 2NO2(g)
② H2O(g) + CO(g) CO2(g) + H2(g)
③ H2O(g) + C(s) CO(g) + H2(g)
④ CaCO3(s) CaO(s) + CO2(g)
⑤ H2S(g) H2(g) + S(s)
向右移动
不移动
向左移动
向左移动
不移动
思考:对于反应②和⑤,增大压强时,平衡没有移动,但正逆反应速率有无变化?
正逆反应速率均增大
三、温度对化学平衡的影响
【实验2-3】
实验 浸泡在热水中 浸泡在冰水中
现象
结论 升高温度,化学平衡 向______的方向移动 降低温度,化学平衡
向______的方向移动
ΔH=-56.9 kJ·mol-1
红棕色逐渐加深
红棕色逐渐变浅
放热
吸热
NO2与N2O4
混合气
三、温度对化学平衡的影响
课本P54
[Cu(H2O)4]2++ 4Cl- [CuCl4]2-+4H2O ΔH >0
蓝色 黄色
取两支试管,分别加入2mL 0.5mol/LCuCl2溶液,将其中一支试管先加热,然后置于冷水中,观察并记录实验现象,与另一支试管进行对比。
实验步骤 实验现象 结论
(1)加热试管
(2)将上述试管置于冷水中
绿色逐渐变成黄色
绿色逐渐变成蓝色
升高温度,化学平衡
向吸热的方向移动
降低温度,化学平衡向放热的方向移动
升高温度
1、V吸、 V放都加快(比原平衡快)。但升温对吸热反应更有利,吸热反应速率增得更快。
2、 V吸 > V放,故平衡向吸热反应方向移动。
vⅡ>vⅠ
t2
t3
v正
v逆
t1
t (s)
v (mol·L-1·s-1)
0
v正= v逆
平衡状态Ⅰ
速率-时间关系图
v 吸
v 放
v”正 = v”逆
平衡状态Ⅱ
降低温度
1、V吸、 V放都减慢(比原平衡慢)。但吸热反应速率变化更大
2、 V放 > V吸,故平衡向放热反应方向移动。
vⅡ<vⅠ
v (放)
v (吸)
vⅠ
vⅡ
mA(g)+nB(g) pC(g)+qD(g) ΔH>0
mA(g)+nB(g) pC(g)+qD(g) ΔH<0
升高温度
正反应方向
升高温度,化学平衡向吸热反应方向移动
逆反应方向
正反应方向
mA(g)+nB(g) pC(g)+qD(g) ΔH>0
mA(g)+nB(g) pC(g)+qD(g) ΔH<0
降低温度
降低温度,化学平衡向放热反应方向移动
逆反应方向
K只与温度有关,温度不变,K不变。
在其他条件不变的情况下:
升高温度,v正、v逆都增大,反应向吸热方向移动,
降低温度,v正、v逆都减小,反应向放热方向移动。
结论
三、温度对化学平衡的影响
进一步分析,我们可以看出改变温度,平衡总是向着减弱这种改变的方向移动。
若温度升高 , K ↑, 则正反应为_____反应,ΔH___0 .
若温度升高 , K ↓, 则正反应为_____反应,ΔH___0 .
吸热
>
放热
<
吸热方向
Q<K,正向移动
吸热方向
Q>K,逆向移动
若温度降低 , K ↑, 则正反应为_____反应,ΔH___0 .
若温度降低 , K ↓, 则正反应为_____反应,ΔH___0 .
放热
<
吸热
>
放热方向
Q<K,正向移动
放热方向
Q>K,逆向移动
【练一练】
四、催化剂对化学平衡的影响
催化剂同等程度改变化学反应速率,V 正= V 逆,只改变反应到达平衡所需要的时间,而不影响化学平衡的移动。
vⅠ
vⅡ
v (正)=v (逆)
vⅠ
vⅡ
v (正)=v (逆)
正催化剂对化学平衡的影响
负催化剂对化学平衡的影响
vⅡ>vⅠ
vⅡ<vⅠ
勒夏特列原理:
如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。这就是勒夏特列原理。也称化学平衡移动原理。
①影响平衡的因素有浓度、压强、温度;
②原理的适用范围是只有一项条件变化的情况(温度或压强或一种物质的浓度),当多项条件同时发生变化时,情况比较复杂,具体问题具体分析;
③平衡移动的结果只能减弱(不可能抵消)外界条件的变化。
对化学平衡移动原理的理解
化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变,改变是不可逆转的。
新平衡时此物理量更靠近于改变的方向。
如①增大反应物A的浓度,平衡正向移动,A的浓度在增大的基础上减小,但达到新平衡时,A的浓度一定比原平衡大;
②若将体系温度从50 ℃升高到80 ℃,则化学平衡向吸热反应方向移动,达到新的平衡状态时体系的温度(T):50 ℃
外界条件的改变 化学平衡的移动
浓度 增大反应物浓度 / 减小生成物浓度 向正反应方向移动
减小反应物浓度 / 增大生成物浓度 向逆反应方向移动
温度 升高温度 向吸热反应方向移动
降低温度 向放热反应方向移动
压强 反应前后气体分子总数改变 增大压强 向气体分子总数减小的方向移动
减小压强 向气体分子总数增大的方向移动
反应前后气体分子总数不变 改变压强 平衡不移动
催化剂 使用催化剂 平衡不移动
已知:N2(g)+ 3H2(g) 2NH3(g) ΔH =-92.4kJ.mol-1, 反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施。
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
【练一练】
探究外界因素对化学平衡的影响
大本P26
Hb+O2 Hb(O2),Hb+CO Hb(CO)
↑
↓
↓
↓
CO +HbO2 O2+ HbCO
↑
↓
C
↓
↑
↑
平衡正向移动
平衡逆向(吸热方向)移动
↑
↑
平衡逆向移动
A
加压平衡逆向移动
相当于减压,平衡正向移动
随堂自测
B
B
反应进行的程度与速率无关
↓
稀释,各组分浓度减小,平衡向离子浓度增大的方向(逆向)进行。
C
C
1.20mol/L
加压,C的浓度减小,平衡向气体计量数减小的方向(逆向)移动
放热反应方向
增大压强
降低温度
升高温度
减小压强
