4.1.2化学电源课件(共44张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1.2化学电源课件(共44张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-13 00:00:00 | ||
图片预览









文档简介
(共44张PPT)
第二节 化学电源
第四章 化学反应与电能
1.知道化学电源的分类方法,熟悉几种常见化学电源的组成和工作原理。
2.了解化学电源广泛的应用及废旧电池对环境的危害,设想其处理方法,
学习目标 1min
自学指导 6min
阅读课本第96-99页,完成大本第 78-79页
D
自学检测 P78 练一练 3min
比能量和可储存时间均有所提高,适用于大电流和连续放电。
不一定,如氢氧燃料电池的正、负极均为Pt
教师点拨 20min
一、化学电池
1. 概念:
将化学能变成电能的装置
2.优点:
①能量转换效率高,供能稳定可靠
②可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便
③易维护,可在各种环境下工作。
3. 电池优劣的判断标准:
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小.
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
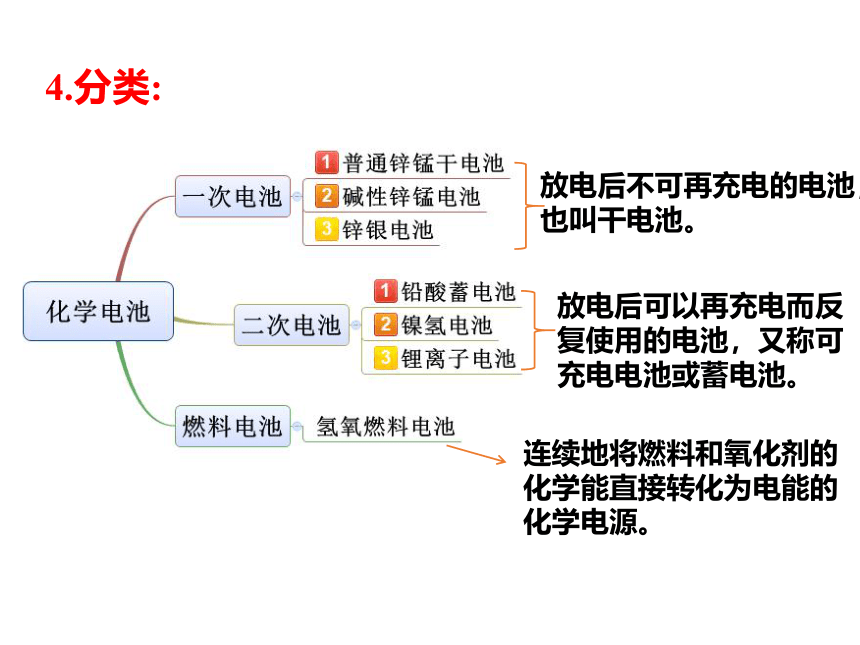
4.分类:
放电后不可再充电的电池,也叫干电池。
放电后可以再充电而反复使用的电池,又称可充电电池或蓄电池。
连续地将燃料和氧化剂的化学能直接转化为电能的化学电源。
干电池
汽车用铅蓄电池
锂离子电池
充电电池
燃料电池
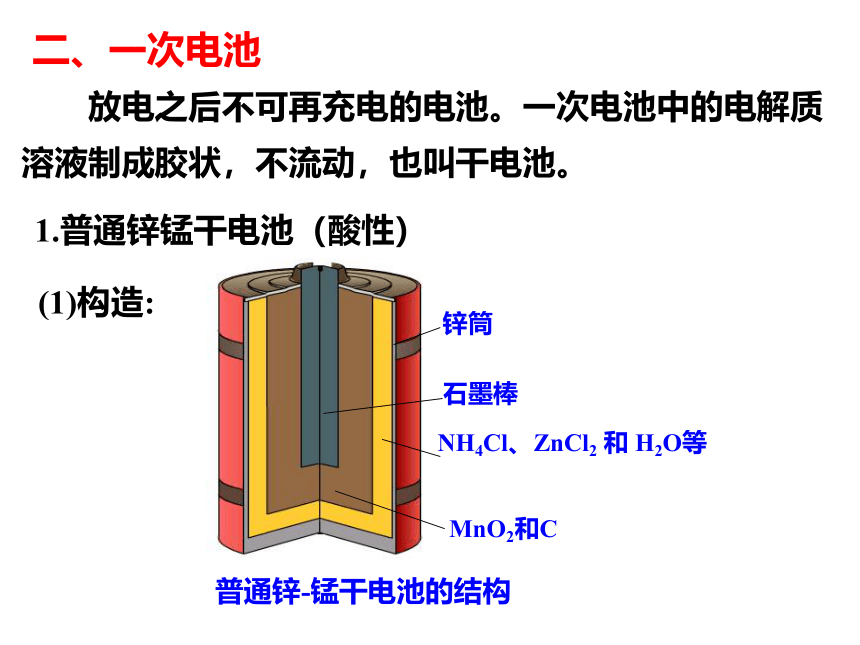
二、一次电池
放电之后不可再充电的电池。一次电池中的电解质溶液制成胶状,不流动,也叫干电池。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(1)构造:
1.普通锌锰干电池(酸性)
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(2)组成:
正极: 负极:
电解质:
石墨
Zn
NH4Cl糊
(3)工作原理:
负极反应:
正极反应:
Zn-2e-=Zn2+
2MnO2 + 2NH4++2e- = Mn2O3+ 2NH3↑+H2O
总反应:Zn+2MnO2 +2NH4Cl=Mn2O3+ZnCl2+ 2NH3+H2O
一次电池:只能使用一次,不能充电复原继续使用.
优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。
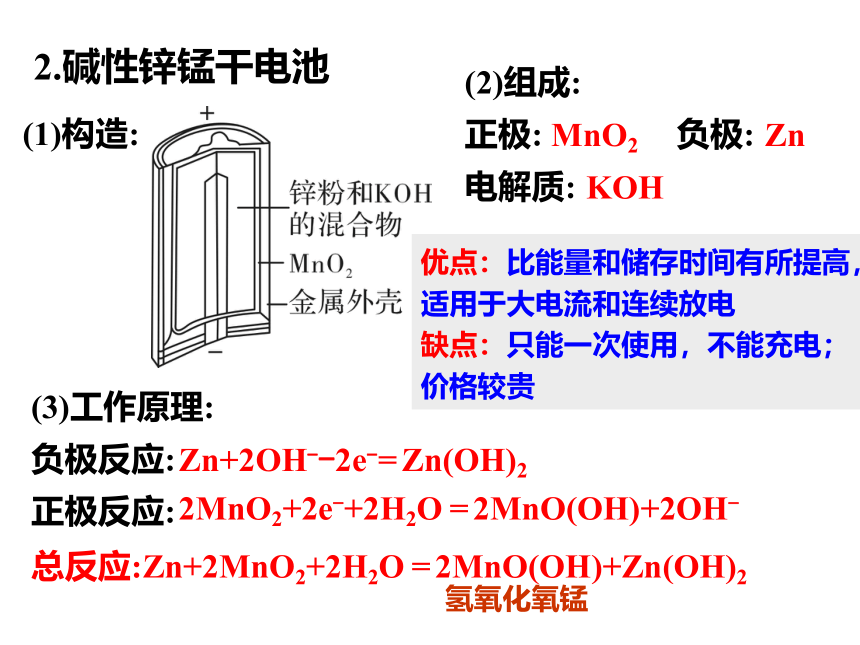
2.碱性锌锰干电池
(1)构造:
(2)组成:
正极: 负极:
电解质:
MnO2
Zn
KOH
(3)工作原理:
负极反应:
正极反应:
Zn+2OH--2e-= Zn(OH)2
2MnO2+2e-+2H2O = 2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O = 2MnO(OH)+Zn(OH)2
优点:比能量和储存时间有所提高,适用于大电流和连续放电
缺点:只能一次使用,不能充电;价格较贵
氢氧化氧锰
3.银锌电池
(1)构造:
(2)组成:
负极:Zn,正极:Ag2O,
电解质:KOH
这种电池能量大、电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
(3)工作原理:
负极反应:Zn+2OH--2e- = Zn(OH)2
正极反应:Ag2O+H2O+2e- = 2Ag+2OH-
总反应:Zn+Ag2O+H2O = Zn(OH)2+2Ag
(1)构造:
负极:Li,正极:MnO2、CuO或FeS2等。
电解质溶液可由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl4)中组成。
电池的总反应可表示为8Li+3SOCl2=6LiCl+Li2SO3+2S。
(1)负极材料为____,电极反应为_________________。
(2)正极的电极反应为_______________________________。
Li
8Li-8e-=8Li+
3SOCl2+8e-=2S+SO32-+6Cl-
必须在无水、无氧的条件下组装锂金属电池,因为构成电池的两个主要成分Li能和氧气、水反应,且SOCl2也与水反应。
4.锂亚硫酰氯(Li/SOCl2)电池—可用于心脏起搏器
C
KOH作电解质溶液,不参与反应,但能提高溶液的导电性
1.铅蓄电池
工作机制
化学能
电能
放电
充电
充电电池中能量的转化关系:
三、二次电池(充电电池或蓄电池):
放电后可以再充电使活性物质获得再生;
铅蓄电池、锂离子电池……
其电池反应可以正向和逆向进行,放电时为自发电池,充电时为电解池,充电后电池容量得到恢复,充放电次数可达千百次。
组成: 正极: PbO2 负极: Pb 电解质: H2SO4溶液
不是可逆反应
①放电过程
负极:
正极:
总反应:
Pb+SO42--2e- = PbSO4
②充电过程
阴极:
阳极:
总反应:
PbSO4+2e- =Pb+SO42-
PbO2+4H++SO42-+2e- = PbSO4+ 2H2O
Pb+PbO2+2H2SO4=2PbSO4+2H2O
PbSO4+2H2O-2e- = PbO2+4H++SO42-
2PbSO4+2H2O = Pb+PbO2+2H2SO4
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
缺点:笨重,比能量低、废弃电池污染环境
1.铅蓄电池工作原理
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2. 碱性镍镉电池
组成:
正极:NiOOH 负极:Cd 电解质:KOH
①放电过程
负极:
正极:
总反应:
Cd+2OH--2e- = Cd(OH)2
②充电过程
阴极:
阳极:
总反应:
Cd(OH)2+2e-= Cd+2OH-
2NiOOH+2e-+2H2O = 2Ni(OH)2+2OH-
2NiOOH+Cd+2H2O = 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+2OH--2e-= 2NiOOH+2H2O
2Ni(OH)2+Cd(OH)2= 2NiOOH+Cd+2H2O
优点:体积小便于携带,可重复使用500次以上,寿命比铅蓄电池长。广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等。
缺点:镉有致癌作用,废弃的镍镉电池如不回收,会严重污染环境,有被镍氢电池取代的趋势。
2. 碱性镍镉电池工作原理
2NiOOH+Cd+2H2O 2Ni(OH)2+Cd(OH)2
3. 镍氢电池
组成:镍氢电池正极活性物质为Ni(OH)2(称NiO电极),负极活性物质为金属氢化物,也称储氢合金(称储氢电极),电解液为KOH溶液。
圆柱可充镍氢电池
方形可充镍氢电池
①放电过程
负极:
正极:
总反应:
H2 -2e- + 2OH- = 2H2O
②充电过程
阴极:
阳极:
总反应:
2H2O +2e- = H2 + 2OH-
2NiOOH +2e- + 2H2O = 2Ni(OH)2 +2OH-
H2 + 2NiOOH = 2Ni(OH)2
2Ni(OH)2-2e- + 2OH- = 2NiOOH +2H2O
2Ni(OH)2 = H2 + 2NiOOH
优点:能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
3. 镍氢电池工作原理
H2 + 2NiOOH 2Ni(OH)2
4. 锂离子电池--新一代可充电的绿色电池
铜集流板
铝集流板
锂导电有机电解液
LixC6
Li1-xCoO2
石墨钴酸锂锂离子电池结构
组成:
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
①放电过程
负极:
正极:
总反应:
LixC6 - xe-= 6C+xLi+
②充电过程
阴极:
阳极:
总反应:
6C+xe-+xLi+=LixC6
Li1-xCoO2+xe-+xLi =LiCoO2
LixC6 +Li1-xCoO2 = LiCoO2+6C
LiCoO2-xe-=Li1-xCoO2+xLi+
LiCoO2+6C = LixC6 +Li1-xCoO2
4. 锂离子电池工作原理
LixC6 +Li1-xCoO2 LiCoO2+6C
锂离子电池的优越性能:
相对于传统的镉镍电池(Ni/Cd)和氢镍电池(Ni/MH),锂离子电池的电压大约是它们的3倍;重量比能量密度提高了约3倍;对于同样的功率消耗,锂离子电池的使用期限约为镍镉电池的2.25~2.57倍.现在锂离子电池已经是电子信息产品设计人员的普通配置.
①工作电压高 、②比能量大、 ③循环寿命长、 ④自放电率低 、⑤无记忆效应、 ⑥污染小。
用途:已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流电池。
D
负极:Pb-2e-+SO42-=PbSO4
正极:PbO2+2e-+4H++SO42-=PbSO4 +2H2O
消耗H+,酸性减弱
阳极生成 正极
失电子 电子流入的
四、燃料电池
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。是一种能量转化率高、可持续使用、对环境友好的化学电池。
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂。
(1)燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起导电的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
(2)燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
负极:2H2 + 4OH- - 4e-= 4H2O
正极: O2 + 4e-+ 2H2O = 4OH-
总反应式: 2H2 + O2 = 2H2O
碱性电解质溶液
酸性电解质溶液
负极:2H2 - 4e-= 4H+
正极:O2 + 4e- + 4H+ =2H2O
总反应式: 2H2 + O2 = 2H2O
碱性/中性:
O2 + 4e- + 2H2O = 4OH-
酸性:
O2 + 4e- + 4H+ = 2H2O
O2作正极写法:
1、氢氧燃料电池:
酸性电解质溶液
负极:CH4 - 8e- + 2H2O = 8H+ + CO2
正极:2O2 + 8e- + 8H+ =4H2O
总反应式: CH4 + 2O2 = CO2 + 2H2O
碱性电解质溶液
负极:CH4 - 8e- + 10OH- = 7H2O + CO32-
总反应式: CH4 + 2O2 + 2OH-= CO32-+ 3H2O
正极: 2O2 + 8e- + 4H2O = 8OH-
注意:燃料电池总反应式一般为燃烧方程式(去“点燃”);但当生成物有后续反应时,
加和后续反应.
2、甲烷燃料电池:
3.甲醇燃料电池
碱性电解质溶液
负极:
正极:
电池总反应式:
2CH3OH -12e- + 16OH- = 2CO32- + 12H2O
3O2 + 12e- + 4H2O = 8OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
4.肼燃料电池
N H4-4e-+4OH-= N ↑+ 4H O
碱性电解质溶液
负极:
正极:
电池总反应式:
O + 4e- + 2H O= 4OH-
N H4 + O = N + 2H O
5.铝-空气-海水电池
4A1-12e- = 4A13+
负极:
正极:
电池总反应式:
3O2+12e-+6H2O =12OH-
4A1+3O2+6H2O=4A1(OH)3
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产生电流。
三、废旧电池的危害与处理
1.危害:废旧电池中常含有重金属、酸和碱等物质,如随意丢弃,会对生态环境和人体健康造成危害。
2.处理方法:回收处理。
CH4+10OH--8e-=CO32-+7H2O
a
减小
O2+2CO2+4e-=2CO32- 2CO+O2=2CO2
总:CH4+2O2+2OH-=CO32-+3H2O
- +
二次电池的充、放电分析
Zn-2e-+2OH-=Zn(OH)2
放电时正极附近生成OH-,碱性增强,pH变大。
充电时阳极(即该电池放电时的正极)接外接电源正极,阴极(即该电池放电时的负极)接外接电源负极。
FeO42-+3e-+4H2O=Fe(OH)3+5OH-
C
放电时负极:Cd+2OH--2e-=Cd(OH)2
放电时正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
↓ ↑
← 充电时阳极反应
C
BiF3+3e-=Bi+3F-
正
MgF2+2e-=Mg+2F-,0.5mole-~0.5molF-, m=0.5×19=9.5g
阴极 → 阳极
充电:阳极 阴极
放电:正极 负极
负极 → 正极
阳氧阴还
负氧正还
有机燃料电池电极反应式书写方法
电极a为负极,电极b为正极,A为CO,B为O2。
负极:2CO+2CO32--4e-=4CO2
正极:O2+2CO2+4e-=2CO32-
- +
B
3O2+12e-+12H+=6H2O
CH4+2O2=CO2+2H2O2O2+8H++8e-=4H2O
CH4-8e-+2H2O=CO2+8H+
CH4+2O2+2OH-=CO32-+3H2O2O2+4H2O+8e-=8OH-
CH4+10OH--8e-=CO32-+7H2O
CH4+2O2=CO2+2H2O2O2+8e-=4O2-
CH4+4O2--8e-=CO2+2H2O
CH4+2O2=CO2+2H2O2O2+4CO2+8e-=4CO32-
CH4+4CO32--8e-=5CO2+2H2O
随堂自测 5min P77
B
A
氧化产物
锌为负极
自发的
D
A
总:2CH2=CH2+O2=2CH3CHO
b电极:2CH2=CH2-2e-+H2O=2CH3CHO+2H+
+
太阳
电
减小
NiO(OH)+H2O+e-=Ni(OH)2+OH-
Zn-2e-+2OH-=Zn(OH)2
负极:Cd-2e-+2OH-=Cd(OH)2
第二节 化学电源
第四章 化学反应与电能
1.知道化学电源的分类方法,熟悉几种常见化学电源的组成和工作原理。
2.了解化学电源广泛的应用及废旧电池对环境的危害,设想其处理方法,
学习目标 1min
自学指导 6min
阅读课本第96-99页,完成大本第 78-79页
D
自学检测 P78 练一练 3min
比能量和可储存时间均有所提高,适用于大电流和连续放电。
不一定,如氢氧燃料电池的正、负极均为Pt
教师点拨 20min
一、化学电池
1. 概念:
将化学能变成电能的装置
2.优点:
①能量转换效率高,供能稳定可靠
②可以制成各种形状和大小、不同容量和电压的电池和电池组,使用方便
③易维护,可在各种环境下工作。
3. 电池优劣的判断标准:
① 比能量
[单位:(w·h/kg),(w·h/L)]
指电池单位质量或单位体积所能输出电能的多少
② 比功率
[单位:(W/kg,W/L)]
指电池单位质量或单位体积所能输出功率的大小.
③ 电池的可储存时间的长短
除特殊情况外,质量轻、体积小而输出电能多、功率大、储存时间长的电池,其质量好。
4.分类:
放电后不可再充电的电池,也叫干电池。
放电后可以再充电而反复使用的电池,又称可充电电池或蓄电池。
连续地将燃料和氧化剂的化学能直接转化为电能的化学电源。
干电池
汽车用铅蓄电池
锂离子电池
充电电池
燃料电池
二、一次电池
放电之后不可再充电的电池。一次电池中的电解质溶液制成胶状,不流动,也叫干电池。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(1)构造:
1.普通锌锰干电池(酸性)
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
(2)组成:
正极: 负极:
电解质:
石墨
Zn
NH4Cl糊
(3)工作原理:
负极反应:
正极反应:
Zn-2e-=Zn2+
2MnO2 + 2NH4++2e- = Mn2O3+ 2NH3↑+H2O
总反应:Zn+2MnO2 +2NH4Cl=Mn2O3+ZnCl2+ 2NH3+H2O
一次电池:只能使用一次,不能充电复原继续使用.
优点:制作简单、价格便宜。
缺点:放电时间短,电压下降快。
2.碱性锌锰干电池
(1)构造:
(2)组成:
正极: 负极:
电解质:
MnO2
Zn
KOH
(3)工作原理:
负极反应:
正极反应:
Zn+2OH--2e-= Zn(OH)2
2MnO2+2e-+2H2O = 2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O = 2MnO(OH)+Zn(OH)2
优点:比能量和储存时间有所提高,适用于大电流和连续放电
缺点:只能一次使用,不能充电;价格较贵
氢氧化氧锰
3.银锌电池
(1)构造:
(2)组成:
负极:Zn,正极:Ag2O,
电解质:KOH
这种电池能量大、电压稳定,储存时间长,适宜小电流连续放电,常制成纽扣式电池,广泛用于电子手表、照相机、计算器和其他微型电子仪器。
(3)工作原理:
负极反应:Zn+2OH--2e- = Zn(OH)2
正极反应:Ag2O+H2O+2e- = 2Ag+2OH-
总反应:Zn+Ag2O+H2O = Zn(OH)2+2Ag
(1)构造:
负极:Li,正极:MnO2、CuO或FeS2等。
电解质溶液可由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl4)中组成。
电池的总反应可表示为8Li+3SOCl2=6LiCl+Li2SO3+2S。
(1)负极材料为____,电极反应为_________________。
(2)正极的电极反应为_______________________________。
Li
8Li-8e-=8Li+
3SOCl2+8e-=2S+SO32-+6Cl-
必须在无水、无氧的条件下组装锂金属电池,因为构成电池的两个主要成分Li能和氧气、水反应,且SOCl2也与水反应。
4.锂亚硫酰氯(Li/SOCl2)电池—可用于心脏起搏器
C
KOH作电解质溶液,不参与反应,但能提高溶液的导电性
1.铅蓄电池
工作机制
化学能
电能
放电
充电
充电电池中能量的转化关系:
三、二次电池(充电电池或蓄电池):
放电后可以再充电使活性物质获得再生;
铅蓄电池、锂离子电池……
其电池反应可以正向和逆向进行,放电时为自发电池,充电时为电解池,充电后电池容量得到恢复,充放电次数可达千百次。
组成: 正极: PbO2 负极: Pb 电解质: H2SO4溶液
不是可逆反应
①放电过程
负极:
正极:
总反应:
Pb+SO42--2e- = PbSO4
②充电过程
阴极:
阳极:
总反应:
PbSO4+2e- =Pb+SO42-
PbO2+4H++SO42-+2e- = PbSO4+ 2H2O
Pb+PbO2+2H2SO4=2PbSO4+2H2O
PbSO4+2H2O-2e- = PbO2+4H++SO42-
2PbSO4+2H2O = Pb+PbO2+2H2SO4
优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉
缺点:笨重,比能量低、废弃电池污染环境
1.铅蓄电池工作原理
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2. 碱性镍镉电池
组成:
正极:NiOOH 负极:Cd 电解质:KOH
①放电过程
负极:
正极:
总反应:
Cd+2OH--2e- = Cd(OH)2
②充电过程
阴极:
阳极:
总反应:
Cd(OH)2+2e-= Cd+2OH-
2NiOOH+2e-+2H2O = 2Ni(OH)2+2OH-
2NiOOH+Cd+2H2O = 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+2OH--2e-= 2NiOOH+2H2O
2Ni(OH)2+Cd(OH)2= 2NiOOH+Cd+2H2O
优点:体积小便于携带,可重复使用500次以上,寿命比铅蓄电池长。广泛用于收录机、无线对讲机、电子闪光灯、电动剃须刀等。
缺点:镉有致癌作用,废弃的镍镉电池如不回收,会严重污染环境,有被镍氢电池取代的趋势。
2. 碱性镍镉电池工作原理
2NiOOH+Cd+2H2O 2Ni(OH)2+Cd(OH)2
3. 镍氢电池
组成:镍氢电池正极活性物质为Ni(OH)2(称NiO电极),负极活性物质为金属氢化物,也称储氢合金(称储氢电极),电解液为KOH溶液。
圆柱可充镍氢电池
方形可充镍氢电池
①放电过程
负极:
正极:
总反应:
H2 -2e- + 2OH- = 2H2O
②充电过程
阴极:
阳极:
总反应:
2H2O +2e- = H2 + 2OH-
2NiOOH +2e- + 2H2O = 2Ni(OH)2 +2OH-
H2 + 2NiOOH = 2Ni(OH)2
2Ni(OH)2-2e- + 2OH- = 2NiOOH +2H2O
2Ni(OH)2 = H2 + 2NiOOH
优点:能量密度高;无镉污染,是一种绿色电池;可大电流快速充放电;电池工作电压为1.2V;在小型便携电子器件、电动工具、电动车辆和混合动力车上逐步得到应用。
3. 镍氢电池工作原理
H2 + 2NiOOH 2Ni(OH)2
4. 锂离子电池--新一代可充电的绿色电池
铜集流板
铝集流板
锂导电有机电解液
LixC6
Li1-xCoO2
石墨钴酸锂锂离子电池结构
组成:
负极材料:嵌锂层状石墨(LixC6 )
正极材料:钴酸锂(Li1-xCoO2)
电解液:锂导电有机电解液
①放电过程
负极:
正极:
总反应:
LixC6 - xe-= 6C+xLi+
②充电过程
阴极:
阳极:
总反应:
6C+xe-+xLi+=LixC6
Li1-xCoO2+xe-+xLi =LiCoO2
LixC6 +Li1-xCoO2 = LiCoO2+6C
LiCoO2-xe-=Li1-xCoO2+xLi+
LiCoO2+6C = LixC6 +Li1-xCoO2
4. 锂离子电池工作原理
LixC6 +Li1-xCoO2 LiCoO2+6C
锂离子电池的优越性能:
相对于传统的镉镍电池(Ni/Cd)和氢镍电池(Ni/MH),锂离子电池的电压大约是它们的3倍;重量比能量密度提高了约3倍;对于同样的功率消耗,锂离子电池的使用期限约为镍镉电池的2.25~2.57倍.现在锂离子电池已经是电子信息产品设计人员的普通配置.
①工作电压高 、②比能量大、 ③循环寿命长、 ④自放电率低 、⑤无记忆效应、 ⑥污染小。
用途:已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流电池。
D
负极:Pb-2e-+SO42-=PbSO4
正极:PbO2+2e-+4H++SO42-=PbSO4 +2H2O
消耗H+,酸性减弱
阳极生成 正极
失电子 电子流入的
四、燃料电池
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
它的电极材料一般为活性电极,具有很强的催化活性,如铂电极,活性炭电极等。是一种能量转化率高、可持续使用、对环境友好的化学电池。
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。反应物不是储存在电池内部,而是由外设装备提供燃料和氧化剂。
(1)燃料电池的规律
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起导电的作用。
③能量转化率高(超过80%),普通的只有30%,有利于节约能源。
(2)燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充;
②反应产物不断排出
缺点:体积较大、附属设备较多
优点:能量转换率高、清洁、对环境好
负极:2H2 + 4OH- - 4e-= 4H2O
正极: O2 + 4e-+ 2H2O = 4OH-
总反应式: 2H2 + O2 = 2H2O
碱性电解质溶液
酸性电解质溶液
负极:2H2 - 4e-= 4H+
正极:O2 + 4e- + 4H+ =2H2O
总反应式: 2H2 + O2 = 2H2O
碱性/中性:
O2 + 4e- + 2H2O = 4OH-
酸性:
O2 + 4e- + 4H+ = 2H2O
O2作正极写法:
1、氢氧燃料电池:
酸性电解质溶液
负极:CH4 - 8e- + 2H2O = 8H+ + CO2
正极:2O2 + 8e- + 8H+ =4H2O
总反应式: CH4 + 2O2 = CO2 + 2H2O
碱性电解质溶液
负极:CH4 - 8e- + 10OH- = 7H2O + CO32-
总反应式: CH4 + 2O2 + 2OH-= CO32-+ 3H2O
正极: 2O2 + 8e- + 4H2O = 8OH-
注意:燃料电池总反应式一般为燃烧方程式(去“点燃”);但当生成物有后续反应时,
加和后续反应.
2、甲烷燃料电池:
3.甲醇燃料电池
碱性电解质溶液
负极:
正极:
电池总反应式:
2CH3OH -12e- + 16OH- = 2CO32- + 12H2O
3O2 + 12e- + 4H2O = 8OH-
2CH3OH +3O2 + 4OH-=2CO32- +6H2O
4.肼燃料电池
N H4-4e-+4OH-= N ↑+ 4H O
碱性电解质溶液
负极:
正极:
电池总反应式:
O + 4e- + 2H O= 4OH-
N H4 + O = N + 2H O
5.铝-空气-海水电池
4A1-12e- = 4A13+
负极:
正极:
电池总反应式:
3O2+12e-+6H2O =12OH-
4A1+3O2+6H2O=4A1(OH)3
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产生电流。
三、废旧电池的危害与处理
1.危害:废旧电池中常含有重金属、酸和碱等物质,如随意丢弃,会对生态环境和人体健康造成危害。
2.处理方法:回收处理。
CH4+10OH--8e-=CO32-+7H2O
a
减小
O2+2CO2+4e-=2CO32- 2CO+O2=2CO2
总:CH4+2O2+2OH-=CO32-+3H2O
- +
二次电池的充、放电分析
Zn-2e-+2OH-=Zn(OH)2
放电时正极附近生成OH-,碱性增强,pH变大。
充电时阳极(即该电池放电时的正极)接外接电源正极,阴极(即该电池放电时的负极)接外接电源负极。
FeO42-+3e-+4H2O=Fe(OH)3+5OH-
C
放电时负极:Cd+2OH--2e-=Cd(OH)2
放电时正极:2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-
↓ ↑
← 充电时阳极反应
C
BiF3+3e-=Bi+3F-
正
MgF2+2e-=Mg+2F-,0.5mole-~0.5molF-, m=0.5×19=9.5g
阴极 → 阳极
充电:阳极 阴极
放电:正极 负极
负极 → 正极
阳氧阴还
负氧正还
有机燃料电池电极反应式书写方法
电极a为负极,电极b为正极,A为CO,B为O2。
负极:2CO+2CO32--4e-=4CO2
正极:O2+2CO2+4e-=2CO32-
- +
B
3O2+12e-+12H+=6H2O
CH4+2O2=CO2+2H2O2O2+8H++8e-=4H2O
CH4-8e-+2H2O=CO2+8H+
CH4+2O2+2OH-=CO32-+3H2O2O2+4H2O+8e-=8OH-
CH4+10OH--8e-=CO32-+7H2O
CH4+2O2=CO2+2H2O2O2+8e-=4O2-
CH4+4O2--8e-=CO2+2H2O
CH4+2O2=CO2+2H2O2O2+4CO2+8e-=4CO32-
CH4+4CO32--8e-=5CO2+2H2O
随堂自测 5min P77
B
A
氧化产物
锌为负极
自发的
D
A
总:2CH2=CH2+O2=2CH3CHO
b电极:2CH2=CH2-2e-+H2O=2CH3CHO+2H+
+
太阳
电
减小
NiO(OH)+H2O+e-=Ni(OH)2+OH-
Zn-2e-+2OH-=Zn(OH)2
负极:Cd-2e-+2OH-=Cd(OH)2
