2.3.3物质的量 课件(共43张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.3物质的量 课件(共43张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-14 08:54:54 | ||
图片预览










文档简介
(共43张PPT)
物质的量
3.3 物质的量浓度
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
1. 什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2. 我们知道溶液有浓、稀之分,那么如何定量的表示溶液的浓稀程度呢?
溶质的质量分数
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
3. 什么是溶液中溶质的质量分数?
溶质的质量分数:把溶质的质量与溶液的质量之比叫做溶质的质量分数
数学表示式:
溶质的质量分数=
溶质的质量(g)
× 100%
溶液的质量(g)
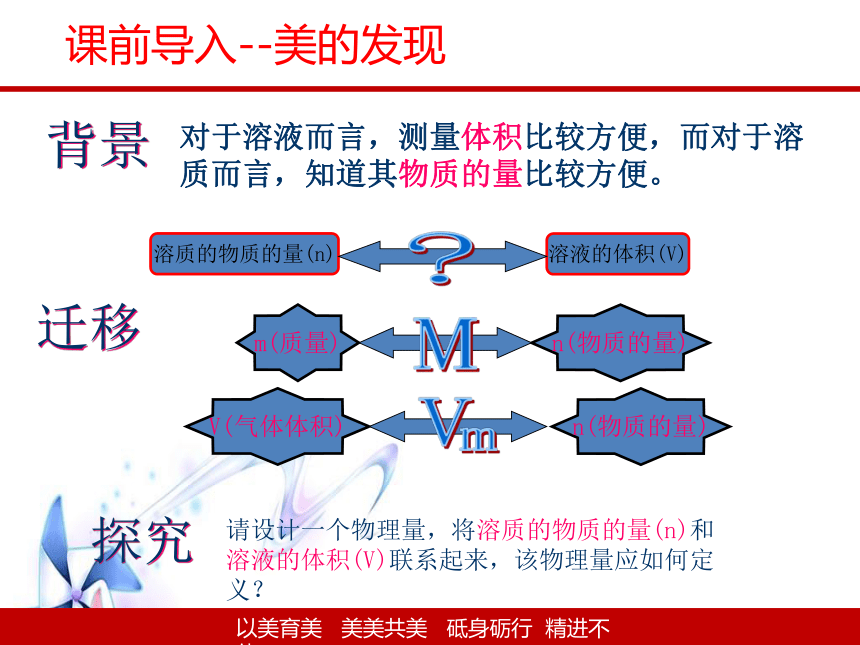
背景
对于溶液而言,测量体积比较方便,而对于溶质而言,知道其物质的量比较方便。
迁移
探究
溶质的物质的量(n)
溶液的体积(V)
m(质量)
n(物质的量)
M
V(气体体积)
n(物质的量)
V
m
请设计一个物理量,将溶质的物质的量(n)和溶液的体积(V)联系起来,该物理量应如何定义?
课前导入--美的发现
以美育美 美美共美 砥身砺行 精进不休
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.理解物质的量浓度的含义及公式中每个字母的含义
2、会将公式进行变形及运用公式做有关计算
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
预习课本P53-54,回答下列问题
1、物质的量浓度的含义、符号、单位、表达式;
预习检测--示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、物质的量浓度的含义、符号、单位、表达式;
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、物质的量浓度的含义、符号、单位、表达式
物质的量浓度:单位体积(1L)的溶液里所含溶质B的物质的量
符号:CB
单位:mol/L或者mol L-1
数学表达式:
物质的量浓度=
溶质的物质的量
溶液的体积
即:cB =
nB
V
1、1mol/L NaOH溶液的含义是什么?
答:在1L溶液中含有1mol NaOH
【思考1】
2、从 1L 1mol/L NaCl 溶液中,分别取出 100mL、10mL 和 1mL 溶液,
①它们的物质的量浓度是否相等?
②它们所含溶质是否相等?
相等
不相等
以美育美 美美共美 砥身砺行 精进不休
交流讨论--各美其美
2、能否用V=nVm来求溶液的体积?
溶液
体积
气体体积
?
合作学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
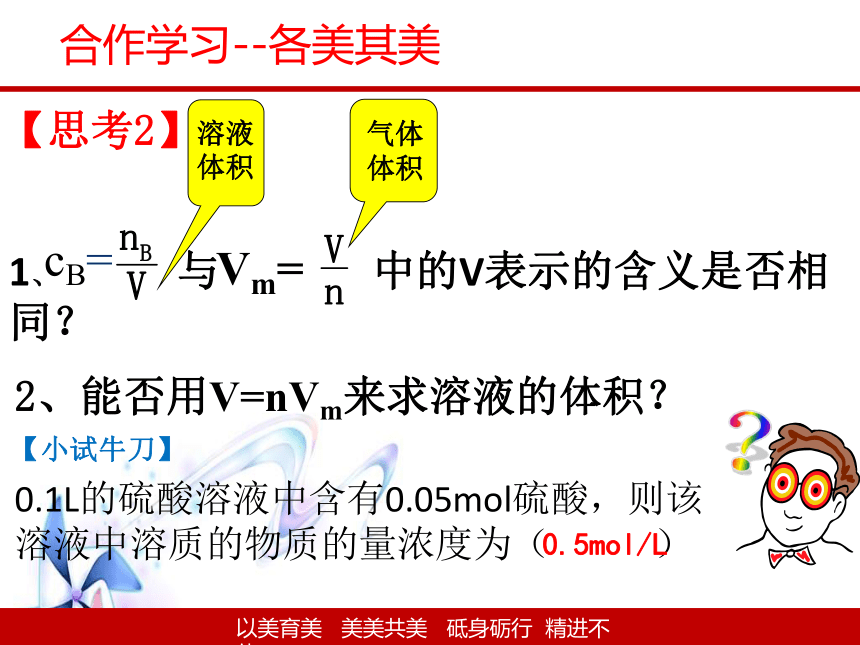
【思考2】
1、 与 中的V表示的含义是否相同?
cB=
Vm=
【小试牛刀】
0.1L的硫酸溶液中含有0.05mol硫酸,则该溶液中溶质的物质的量浓度为( )
0.5mol/L
例1:将23.4gNaCl溶于水中,配成250ml溶液,计算所得溶液中溶质的物质的量浓度。
解:
23.4gNaCl的物质的量为:
58.5g/mol
23.4g
=
n (NaCl) =
m(NaCl)
M (NaCl)
=
0.4mol
溶液中NaCl的物质的量浓度为:
C(NaCl) =
n (NaCl)
V (aq)
=
0.4mol
0.25L
=
1.6mol / L
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、
2mol/L
2、将3.1g的Na2O投入水中,配置成1L的溶液,则溶液的物质的量浓度为
0.1mol/L
3、物质的量是联系宏观和微观世界的桥梁。下列说法正确的是( )
摩尔是物质的量的单位
将1mol NaOH固体溶于1L水,其浓度为1mol/L
常温常压下,1mol N2的体积为22.4L
从10mL 2mol/L H2SO4溶液中取出5mL溶液,其浓度为1mol/L
A
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
4、
B
注意事项:
(1)溶液体积≠溶剂体积,
溶液体积≠溶剂体积+溶质体积。
(溶液体积=溶液质量÷溶液的密度)
(溶液的质量=溶质的质量+溶剂的质量)
(2)溶质一定要用“物质的量”来表示
(3)从某溶液取出一定体积的溶液,其物质的量浓度不变,但所含溶质的物质的量因体积减小而减小。
(4)n(CuSO4.5H2O)=m(CuSO4.5H2O)/M(CuSO4.5H2O),但是溶质是CuSO4,而不是CuSO4.5H2O;分析溶质时要注意有关的化学变化。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
2、物质的量浓度与质量分数间的换算
公式为:c=1000ρω/M
(ω即为溶质质量分数;ρ为溶液密度,单位g/cm3)
推导:c=n溶质/V=(m溶质/M)/V=m溶质/MV
由于m溶质代表的是溶质质量,所以m溶质=m溶液ω=1000ρVω
对于该推导公式最主要的就是注意n=m/M,并且这里的m溶质指的是溶质质量,而并非溶液质量,同理,n溶质也是溶质的物质的量。
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
例2、市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。
解:
①98%的浓硫酸的密度为1.84g/mL,该硫酸的物质的量浓度为 。
②36.5%的浓盐酸的密度为1.19g/mL,该盐酸的物质的量浓度为 。
③浓硝酸的物质的量浓度为14.5mol·L-1,密度为1.45g/mL,该硝酸的溶质质量分数为 。
④现有500mL生理盐水,其中含食盐1.17g,密度为1g/mL,则该生理盐水中NaCl的溶质质量分数为 ,其物质的量浓度为 。
18.4mol·L-1
11.9mol·L-1
63%
0.234%
0.04mol·L-1
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
配置一定物质的量浓度
的溶液
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.掌握配制一定物质的量浓度的溶液的方法
2. 容量瓶的使用及误差分析。
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
预习课本P54-55,回答下列问题
1、一定物质的量浓度溶液的配制:
①实验仪器 ②配制过程
自主学习—示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
【实验2-10】
思考
配制100mL1.0mol/LNaCl溶液
1、会要用到哪些仪器?
2、怎样进行实验操作?
学习展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
一、实验仪器
托盘天平(称固体)或量筒(量液体)
容量瓶(50mL、100mL、250mL、500mL、1000mL)
烧杯、玻璃棒、胶头滴管
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
容量瓶的使用
1、构造:梨形、细颈、平底玻璃瓶,瓶口配有磨口玻璃塞
2、特点:①标有温度和容积(规格)
②瓶颈上有刻度线而无刻度
3、用途:只能用来准确配制一定体积、浓度的溶液—量器
只有一个刻度
容积
温度
容量瓶上标有:
温度(20℃)、容积、刻度线
容量瓶的常用规格:
50mL、100mL、250mL、
500mL、1000mL
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
③不能长期存放溶液或进行化学反应
②溶解或稀释的操作不能在容量瓶中进行
①使用前要检查是否漏水
(装水盖塞→倒立→正立→玻璃塞旋转180°→倒立)
1、容量瓶在使用前应该怎么做?
2、容量瓶能不能用来溶解或稀释溶液?
3、容量瓶能否用来长期存放溶液或直接进行化学反应?
2.称量
注意事项:
(1)游码归零,调平。
(2)左右托盘各放一张大小相同的称量纸。
(3)称量时遵循左物右码的原则。
(5.85g≈5.9g)
【提示】托盘天平只能准确到0.1g,所以称取氯化钠5.9g
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
3.溶解、冷却
注意事项:
(1)应在烧杯中溶解,不能在容量瓶中溶解。(溶解时加入适量的水就可以,没有固定的量)
(2)搅拌时用到玻璃棒。
4.转移
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。
玻璃棒下端要插入容量瓶刻度下。
注意:若物质溶于水有明显温度变化的,需放置至室温方能转移到容量瓶中。
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
5.洗涤
注意事项:将烧杯和玻璃棒用少量蒸馏水洗涤2~3次,洗涤液要全部转移到容量瓶中。
提示:如果用量筒量取液体药品,量筒则无需洗涤。(量筒在设计时已经将这种误差给考虑进去了)
6.定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。
提示:此处用到胶头滴管滴加蒸馏水至液面与刻度线相切。
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
7.摇匀
将容量瓶盖好塞子,然后倒转和摇动容量瓶
几次,使得溶液混合均匀。
摇匀放置后发现液面低于刻度线,能否补充水?
【想一想】
【提示】不能。因为这是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
8.装瓶、贴标签
容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
【想一想】
配制100mL 1.00mol/L的NaCl溶液的整个实验过程,都用到了哪些仪器?
【提示】托盘天平,烧杯,玻璃棒,100mL容量瓶,胶头滴管,试剂瓶等。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
配制一定物质的量浓度溶液的步骤:
计算
称量
溶解
略
冷却
转移
洗涤
摇动
略
定容
摇匀
装瓶、贴标签
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
误差分析:
俯视或仰视刻度线对溶液浓度的影响
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
1、俯视和仰视对读数分别有什么影响?
2、俯视和仰视对所加液体的体积分别有什么影响?
3、俯视和仰视对溶液的浓度分别有什么影响?
俯视造成所读数字比实际大;仰视造成所读数字比实际小
俯视造成读数偏大,则实际所加液体小于本应该的液体;仰视造成读数偏小,则实际所加液体大于本应该加的液体
俯视造成所加液体量偏小,所以使得溶液浓度偏大;仰视造成所加液体量偏大,所以使得溶液浓度偏小
在配制溶液中哪些操作可能引起溶液浓度的误差
误差分析:
CB=
n(B)
V
根据公式分析实验过程中哪些操作会引起n(B)或V的变化,如果可以使其变化,则对C(B)造成误差.
思考与交流
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
不变
引起误差的操作 n V C
定容时加水过量用吸管吸出
定容时仰视标线
定容时俯视标线
定容摇匀后液面下降又加水
定容摇匀后,液面下降
减小
减小
减小
减小
不变
不变
不变
不变
增大
增大
减小
不变
不变
增大
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
以配制某浓度NaOH溶液为例,下列操作对所配制溶液的浓度有何影响?请将结果填入表中。
减小
不变
减小
减小
不变
减小
减小
不变
减小
不变
减小
增大
引起误差的操作 n V C
称取时间过长或用滤纸称放
向容量瓶注液时少量流出
未洗净烧杯或玻璃棒
未冷却至室温而注入定容
思考与交流
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
浓溶液稀释配制稀溶液
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、掌握浓溶液配制稀溶液的计算公式
2、灵活运用该公式做相关计算
自主学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
浓溶液稀释规则
思考
1、将浓溶液加水稀释,稀释前后哪些物理量是不变的?
溶质的物质的量、溶质的质量
2、根据不变的量,可以得出哪些等式?
稀释前后溶质的物质的量相等:
C(浓溶液)V (浓溶液)=C (稀溶液) V (稀溶液)
(2)稀释前后溶质的质量相等:
m (浓溶液) (浓溶液)=m (稀溶液) (稀溶液)
1、要配制 500 mL 0.6 mol·L-1 的NaOH溶液,需 6 mol·L-1 的 NaOH 溶液多少毫升?
6 mol·L-1 ×V = 0.6 mol·L-1 ×500 mL
V = 50 mL
答:需 6 mol·L-1的 NaOH 溶液 50 mL 。
解:设需 6 mol·L-1 NaOH 溶液的体积为 V
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
现需要配制500mL 1mol/L 硫酸溶液。
(1)需用质量分数为98%、密度为1.84 g/cm3的浓硫酸多少毫升?
(2)本实验必须用到的仪器有哪些?
量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管
【提示】需要用到如下两个公式:
C(浓溶液)V (浓溶液)=C (稀溶液) V (稀溶液)
约为27.2mL
c=1000ρω/M
一算二量三溶四冷五转移
六洗七加八定九摇十装贴
精确配液
一种仪器:
一个概念:物质的量浓度
容量瓶
一个实验:
一定物质的量浓度溶液的配制
课堂小结--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
课堂小结--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--美美共美
以美育美 美美共美 砥身砺行 精进不休
1、下列关于容量瓶的说法不正确的是 ( )
A、容量瓶上一般标有容积、温度和刻度线
B、容量瓶在使用前要检查是否漏水
C、可将浓溶液直接在容量瓶中稀释
D、容量瓶中不能长时间盛放所配置的溶液,应及时分装在试剂瓶中
C
2、《学习指导》 P51 【应用 体验】第2题
3、《配套检测卷》 P120 第10题
物质的量
3.3 物质的量浓度
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
1. 什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2. 我们知道溶液有浓、稀之分,那么如何定量的表示溶液的浓稀程度呢?
溶质的质量分数
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
3. 什么是溶液中溶质的质量分数?
溶质的质量分数:把溶质的质量与溶液的质量之比叫做溶质的质量分数
数学表示式:
溶质的质量分数=
溶质的质量(g)
× 100%
溶液的质量(g)
背景
对于溶液而言,测量体积比较方便,而对于溶质而言,知道其物质的量比较方便。
迁移
探究
溶质的物质的量(n)
溶液的体积(V)
m(质量)
n(物质的量)
M
V(气体体积)
n(物质的量)
V
m
请设计一个物理量,将溶质的物质的量(n)和溶液的体积(V)联系起来,该物理量应如何定义?
课前导入--美的发现
以美育美 美美共美 砥身砺行 精进不休
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.理解物质的量浓度的含义及公式中每个字母的含义
2、会将公式进行变形及运用公式做有关计算
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
预习课本P53-54,回答下列问题
1、物质的量浓度的含义、符号、单位、表达式;
预习检测--示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、物质的量浓度的含义、符号、单位、表达式;
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、物质的量浓度的含义、符号、单位、表达式
物质的量浓度:单位体积(1L)的溶液里所含溶质B的物质的量
符号:CB
单位:mol/L或者mol L-1
数学表达式:
物质的量浓度=
溶质的物质的量
溶液的体积
即:cB =
nB
V
1、1mol/L NaOH溶液的含义是什么?
答:在1L溶液中含有1mol NaOH
【思考1】
2、从 1L 1mol/L NaCl 溶液中,分别取出 100mL、10mL 和 1mL 溶液,
①它们的物质的量浓度是否相等?
②它们所含溶质是否相等?
相等
不相等
以美育美 美美共美 砥身砺行 精进不休
交流讨论--各美其美
2、能否用V=nVm来求溶液的体积?
溶液
体积
气体体积
?
合作学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
【思考2】
1、 与 中的V表示的含义是否相同?
cB=
Vm=
【小试牛刀】
0.1L的硫酸溶液中含有0.05mol硫酸,则该溶液中溶质的物质的量浓度为( )
0.5mol/L
例1:将23.4gNaCl溶于水中,配成250ml溶液,计算所得溶液中溶质的物质的量浓度。
解:
23.4gNaCl的物质的量为:
58.5g/mol
23.4g
=
n (NaCl) =
m(NaCl)
M (NaCl)
=
0.4mol
溶液中NaCl的物质的量浓度为:
C(NaCl) =
n (NaCl)
V (aq)
=
0.4mol
0.25L
=
1.6mol / L
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、
2mol/L
2、将3.1g的Na2O投入水中,配置成1L的溶液,则溶液的物质的量浓度为
0.1mol/L
3、物质的量是联系宏观和微观世界的桥梁。下列说法正确的是( )
摩尔是物质的量的单位
将1mol NaOH固体溶于1L水,其浓度为1mol/L
常温常压下,1mol N2的体积为22.4L
从10mL 2mol/L H2SO4溶液中取出5mL溶液,其浓度为1mol/L
A
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
4、
B
注意事项:
(1)溶液体积≠溶剂体积,
溶液体积≠溶剂体积+溶质体积。
(溶液体积=溶液质量÷溶液的密度)
(溶液的质量=溶质的质量+溶剂的质量)
(2)溶质一定要用“物质的量”来表示
(3)从某溶液取出一定体积的溶液,其物质的量浓度不变,但所含溶质的物质的量因体积减小而减小。
(4)n(CuSO4.5H2O)=m(CuSO4.5H2O)/M(CuSO4.5H2O),但是溶质是CuSO4,而不是CuSO4.5H2O;分析溶质时要注意有关的化学变化。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
2、物质的量浓度与质量分数间的换算
公式为:c=1000ρω/M
(ω即为溶质质量分数;ρ为溶液密度,单位g/cm3)
推导:c=n溶质/V=(m溶质/M)/V=m溶质/MV
由于m溶质代表的是溶质质量,所以m溶质=m溶液ω=1000ρVω
对于该推导公式最主要的就是注意n=m/M,并且这里的m溶质指的是溶质质量,而并非溶液质量,同理,n溶质也是溶质的物质的量。
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
例2、市售浓硫酸中溶质的质量分数为98%,密度为1.84g/cm3。计算市售浓硫酸中H2SO4的物质的量浓度。
解:
①98%的浓硫酸的密度为1.84g/mL,该硫酸的物质的量浓度为 。
②36.5%的浓盐酸的密度为1.19g/mL,该盐酸的物质的量浓度为 。
③浓硝酸的物质的量浓度为14.5mol·L-1,密度为1.45g/mL,该硝酸的溶质质量分数为 。
④现有500mL生理盐水,其中含食盐1.17g,密度为1g/mL,则该生理盐水中NaCl的溶质质量分数为 ,其物质的量浓度为 。
18.4mol·L-1
11.9mol·L-1
63%
0.234%
0.04mol·L-1
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
配置一定物质的量浓度
的溶液
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.掌握配制一定物质的量浓度的溶液的方法
2. 容量瓶的使用及误差分析。
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
预习课本P54-55,回答下列问题
1、一定物质的量浓度溶液的配制:
①实验仪器 ②配制过程
自主学习—示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
【实验2-10】
思考
配制100mL1.0mol/LNaCl溶液
1、会要用到哪些仪器?
2、怎样进行实验操作?
学习展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
一、实验仪器
托盘天平(称固体)或量筒(量液体)
容量瓶(50mL、100mL、250mL、500mL、1000mL)
烧杯、玻璃棒、胶头滴管
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
容量瓶的使用
1、构造:梨形、细颈、平底玻璃瓶,瓶口配有磨口玻璃塞
2、特点:①标有温度和容积(规格)
②瓶颈上有刻度线而无刻度
3、用途:只能用来准确配制一定体积、浓度的溶液—量器
只有一个刻度
容积
温度
容量瓶上标有:
温度(20℃)、容积、刻度线
容量瓶的常用规格:
50mL、100mL、250mL、
500mL、1000mL
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
③不能长期存放溶液或进行化学反应
②溶解或稀释的操作不能在容量瓶中进行
①使用前要检查是否漏水
(装水盖塞→倒立→正立→玻璃塞旋转180°→倒立)
1、容量瓶在使用前应该怎么做?
2、容量瓶能不能用来溶解或稀释溶液?
3、容量瓶能否用来长期存放溶液或直接进行化学反应?
2.称量
注意事项:
(1)游码归零,调平。
(2)左右托盘各放一张大小相同的称量纸。
(3)称量时遵循左物右码的原则。
(5.85g≈5.9g)
【提示】托盘天平只能准确到0.1g,所以称取氯化钠5.9g
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
3.溶解、冷却
注意事项:
(1)应在烧杯中溶解,不能在容量瓶中溶解。(溶解时加入适量的水就可以,没有固定的量)
(2)搅拌时用到玻璃棒。
4.转移
由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。
玻璃棒下端要插入容量瓶刻度下。
注意:若物质溶于水有明显温度变化的,需放置至室温方能转移到容量瓶中。
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
5.洗涤
注意事项:将烧杯和玻璃棒用少量蒸馏水洗涤2~3次,洗涤液要全部转移到容量瓶中。
提示:如果用量筒量取液体药品,量筒则无需洗涤。(量筒在设计时已经将这种误差给考虑进去了)
6.定容
向容量瓶中加入蒸馏水,在距离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至刻度线。
提示:此处用到胶头滴管滴加蒸馏水至液面与刻度线相切。
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
7.摇匀
将容量瓶盖好塞子,然后倒转和摇动容量瓶
几次,使得溶液混合均匀。
摇匀放置后发现液面低于刻度线,能否补充水?
【想一想】
【提示】不能。因为这是部分溶液在润湿容量瓶瓶口磨砂处有所损失所致。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
8.装瓶、贴标签
容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
【想一想】
配制100mL 1.00mol/L的NaCl溶液的整个实验过程,都用到了哪些仪器?
【提示】托盘天平,烧杯,玻璃棒,100mL容量瓶,胶头滴管,试剂瓶等。
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
配制一定物质的量浓度溶液的步骤:
计算
称量
溶解
略
冷却
转移
洗涤
摇动
略
定容
摇匀
装瓶、贴标签
以美育美 美美共美 砥身砺行 精进不休
展开学习--各美其美
误差分析:
俯视或仰视刻度线对溶液浓度的影响
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
1、俯视和仰视对读数分别有什么影响?
2、俯视和仰视对所加液体的体积分别有什么影响?
3、俯视和仰视对溶液的浓度分别有什么影响?
俯视造成所读数字比实际大;仰视造成所读数字比实际小
俯视造成读数偏大,则实际所加液体小于本应该的液体;仰视造成读数偏小,则实际所加液体大于本应该加的液体
俯视造成所加液体量偏小,所以使得溶液浓度偏大;仰视造成所加液体量偏大,所以使得溶液浓度偏小
在配制溶液中哪些操作可能引起溶液浓度的误差
误差分析:
CB=
n(B)
V
根据公式分析实验过程中哪些操作会引起n(B)或V的变化,如果可以使其变化,则对C(B)造成误差.
思考与交流
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
不变
引起误差的操作 n V C
定容时加水过量用吸管吸出
定容时仰视标线
定容时俯视标线
定容摇匀后液面下降又加水
定容摇匀后,液面下降
减小
减小
减小
减小
不变
不变
不变
不变
增大
增大
减小
不变
不变
增大
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
以配制某浓度NaOH溶液为例,下列操作对所配制溶液的浓度有何影响?请将结果填入表中。
减小
不变
减小
减小
不变
减小
减小
不变
减小
不变
减小
增大
引起误差的操作 n V C
称取时间过长或用滤纸称放
向容量瓶注液时少量流出
未洗净烧杯或玻璃棒
未冷却至室温而注入定容
思考与交流
以美育美 美美共美 砥身砺行 精进不休
合作学习--各美其美
展开学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
浓溶液稀释配制稀溶液
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、掌握浓溶液配制稀溶液的计算公式
2、灵活运用该公式做相关计算
自主学习--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
浓溶液稀释规则
思考
1、将浓溶液加水稀释,稀释前后哪些物理量是不变的?
溶质的物质的量、溶质的质量
2、根据不变的量,可以得出哪些等式?
稀释前后溶质的物质的量相等:
C(浓溶液)V (浓溶液)=C (稀溶液) V (稀溶液)
(2)稀释前后溶质的质量相等:
m (浓溶液) (浓溶液)=m (稀溶液) (稀溶液)
1、要配制 500 mL 0.6 mol·L-1 的NaOH溶液,需 6 mol·L-1 的 NaOH 溶液多少毫升?
6 mol·L-1 ×V = 0.6 mol·L-1 ×500 mL
V = 50 mL
答:需 6 mol·L-1的 NaOH 溶液 50 mL 。
解:设需 6 mol·L-1 NaOH 溶液的体积为 V
课堂练习--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
现需要配制500mL 1mol/L 硫酸溶液。
(1)需用质量分数为98%、密度为1.84 g/cm3的浓硫酸多少毫升?
(2)本实验必须用到的仪器有哪些?
量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管
【提示】需要用到如下两个公式:
C(浓溶液)V (浓溶液)=C (稀溶液) V (稀溶液)
约为27.2mL
c=1000ρω/M
一算二量三溶四冷五转移
六洗七加八定九摇十装贴
精确配液
一种仪器:
一个概念:物质的量浓度
容量瓶
一个实验:
一定物质的量浓度溶液的配制
课堂小结--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
课堂小结--各美其美
以美育美 美美共美 砥身砺行 精进不休
反馈检测--美美共美
以美育美 美美共美 砥身砺行 精进不休
1、下列关于容量瓶的说法不正确的是 ( )
A、容量瓶上一般标有容积、温度和刻度线
B、容量瓶在使用前要检查是否漏水
C、可将浓溶液直接在容量瓶中稀释
D、容量瓶中不能长时间盛放所配置的溶液,应及时分装在试剂瓶中
C
2、《学习指导》 P51 【应用 体验】第2题
3、《配套检测卷》 P120 第10题
