2.3.2物质的量 课件 (共23页) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3.2物质的量 课件 (共23页) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 343.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-14 10:13:23 | ||
图片预览







文档简介
(共23张PPT)
物质的量
3.2 气体摩尔体积
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
1、上一节课我们主要学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
分子
离子
电子
原子
质量
物质的量
粒子数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.了解气体摩尔体积含义、符号、单位、数值
2. 知道确定物质的体积大小的主要因素和外部条件(温度、压强)对气体体积大小的影响
3. 会运用物质的量、气体摩尔体积、气体的体积之间的相互关系进行简单计算关系
4.培养学生微观和宏观的转化思想。
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
问题?
大家都知道,在实验室或在生产中,对于气态物质常常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
自主学习--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
预习课本P51-53,思考下列问题:
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
2、气体摩尔体积的概念、符号、单位、数值(条件)
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
4、阿伏加得罗定律的内容、应用
预习检测--示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
根据大家的预习,回答下列问题
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
2、气体摩尔体积的概念、符号、单位、数值(条件)
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
4、阿伏加得罗定律的内容、应用。
交流展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
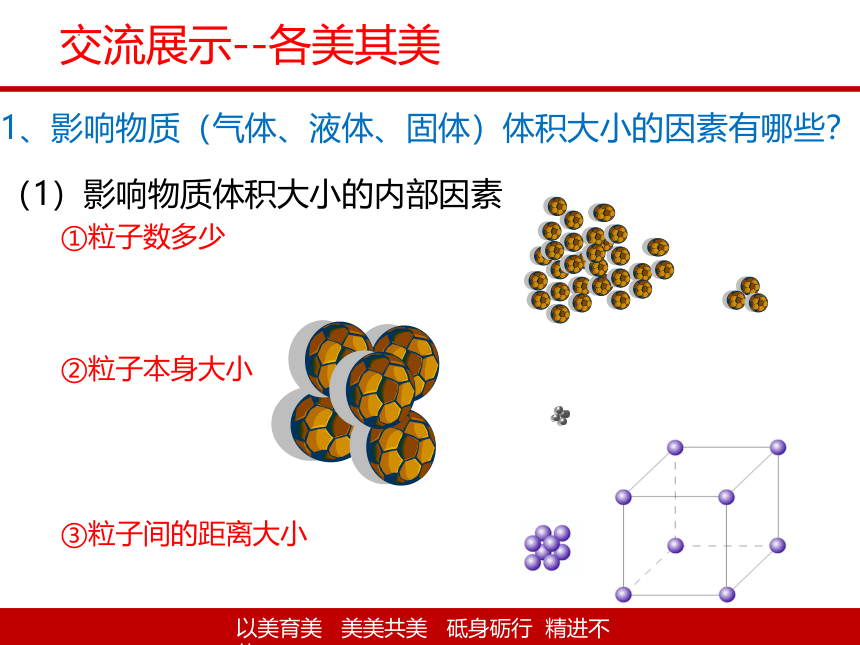
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
(1)影响物质体积大小的内部因素
①粒子数多少
②粒子本身大小
③粒子间的距离大小
Company Logo
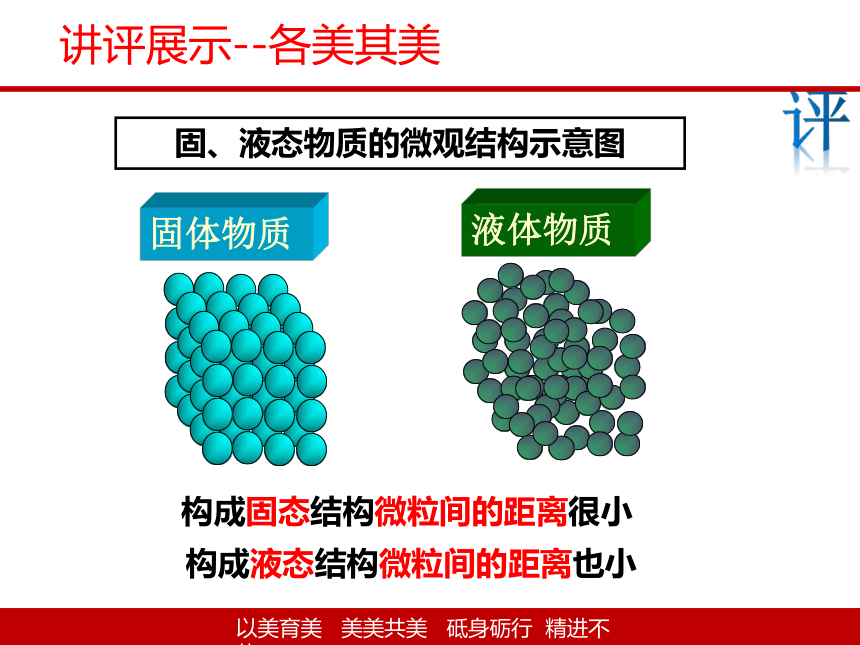
固、液态物质的微观结构示意图
液体物质
构成固态结构微粒间的距离很小
构成液态结构微粒间的距离也小
固体物质
评
讲评展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
交流展示—美美共美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
(2)影响固体、液体体积的因素:
①粒子数多少
思考
②粒子本身大小
1mol不同固体或液体物质中含有粒子数目相同,由于粒子紧密排列,所以1mol固体、液体的体积主要决定于粒子的大小。
物 质 状态 1mol物质的质量 密 度(20℃) 1 mol 物质的体积
Fe 固体 7.8g/cm3
Al 固体 2.7g/cm3
Pb 固体 11.3g/cm3
H2O 液体 0.998g/cm3
H2SO4 液体 1.83g/cm3
7.2cm3
10cm3
18.3cm3
18cm3
53.6cm3
结论:1mol不同的固体、液体的体积是各不相同的
56g
27g
207g
18g
98g
科学探究--美美共美
以美育美 美美共美 砥身砺行 精进不休
分子直径
气体物质
分子间的平均距离
分子的直径为0.4nm
分子之间的平均距离为4nm
评
讲评展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
影响气体体积的因素:(1) 粒子数多少(2)粒子之间的距离
分别计算在温度为0 ℃和压强为101K Pa(标准状况)时,1mol氢气和氧气的体积(保留小数点后1位)
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
【结论】在标准状况下,1mol任何气体所占的体积是相同的,约为 L。
22.4
科学探究—美美共美
以美育美 美美共美 砥身砺行 精进不休
交流展示--美美共美
以美育美 美美共美 砥身砺行 精进不休
2、气体摩尔体积的概念、符号、单位、数值(条件)
概念:
符号:
单位:
数值:
单位物质的量(1mol)的气体所占的体积
V m
L/mol或者m3/mol
在标准状况下,1mol任何气体的体积约为22.4L
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
合作学习--美美共美
以美育美 美美共美 砥身砺行 精进不休
注意事项:
(1)Vm的数值决定于气体所处的温度和压强
(2)Vm的使用对象是气体,包括单一气体和混合气体
(3)非标准状况下,Vm也有可能约为22.4 L·mol-1
(eg:273℃、202kPa时,气体摩尔体积也约为22.4 L/mol )
eg:标准状况(0℃、101kPa)下,Vm≈22.4L/mol
常温常压(25℃、101kPa)下,Vm≈24.5L/mol
交流展示--美我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
(n:物质的量;V:气体体积;V m:气体摩尔体积)
n=V /V m
【小试牛刀】
现有34g的某气体,摩尔质量为17g/mol,则
(1)该气体的物质的量为
(2)该气体所含的分子数为
(3)该气体在标准状况下的体积为
2mol
2NA
44.8L
科学探究—美美共美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
电解水实验
2H2O ==== 2H2↑ + O2↑(电解1.8gH2O)
电解
V(H2) V(O2) 质量 物质 的量 n(H2) n(O2) 结论
H2 0.2g 0.1mol
O2 1.6g 0.05mol
2:1
2:1
在相同的温度和压强下,1molO2和1molH2的体积相同
V(H2):V(O2)=n(H2):n(O2)
交流展示--美我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
4、阿伏加得罗定律的内容
阿伏加得罗定律的内容:相同温度和压强下,相同体积的任何气体都含有相同数目的粒子。
注意事项:
(1)适用范围:只适用于气体(既适用于单一气体,也适用于混合气体)
(2)同温、同压、同体积、同分子数,这四同共同存在,相互制约,只要三同成立,第四同必定成立。(三同决定一同)
拓展延伸—追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
同T同P下: 气体的体积之比、物质的量之比、分子数之比之间的关系
=
N1
N2
V1
V2
n1
n2
=
同T同P下,气体的密度与摩尔质量之间的关系:
M2
=
M1
ρ1
ρ2
同T同V时,气体的压强与物质的量之间的关系:
n1
=
n2
P1
P2
(2)推论:(提示:推导用到理想气体状态方程:PV=nRT)
同T同P同V时,气体的质量与摩尔质量之间的关系:
m1 M1
m2
=
M2
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
同温同压下,1molH2和1molO2的 ( )
A 质量相同,体积不同 B 分子数相同,质量不同
C 体积相同,分子数不同 D 体积相同,原子数不同
(2)下列叙述不正确的是 ( )
A 同温同压下,1molH2和1molH2O一定具有相同的体积
B 常温常压下,等体积的O2和H2的物质的量相同
C 同温同压下,O2和H2的密度之比为16:1
D 同温同压下,同容积的两个容器一个盛有NO,另一个盛有N2和O2,两容器内的气体一定具有相同的分子总数
B
A
课堂小结--追求至美
以美育美 美美共美 砥身砺行 精进不休
1.标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是( ),含原子数最多的是( ),质量最大的是( ),体积最小的是( )
2.已知标准状况下5.6L的X气体分子的质量为8g,则X气体的摩尔质量是( )
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
H2
H2
H2O
H2O
32g/mol
4.在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是 ;
3.在一定温度和压强下,并不一定是标准状况,1mol不同的气体的体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ;
在同温同压下,体积相同的气体,其分子数 ;
在同温同压下,气体体积的大小与分子数目成 ;
相同
相同
正比
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
物质的量
3.2 气体摩尔体积
课前复习--美的发现
以美育美 美美共美 砥身砺行 精进不休
1、上一节课我们主要学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
分子
离子
电子
原子
质量
物质的量
粒子数
质子
中子
÷M
×M
×NA
÷NA
(m)
(n)
(N)
目标展示--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1.了解气体摩尔体积含义、符号、单位、数值
2. 知道确定物质的体积大小的主要因素和外部条件(温度、压强)对气体体积大小的影响
3. 会运用物质的量、气体摩尔体积、气体的体积之间的相互关系进行简单计算关系
4.培养学生微观和宏观的转化思想。
课前预习--美的发现
以美育美 美美共美 砥身砺行 精进不休
问题?
大家都知道,在实验室或在生产中,对于气态物质常常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
自主学习--美之所向
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
预习课本P51-53,思考下列问题:
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
2、气体摩尔体积的概念、符号、单位、数值(条件)
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
4、阿伏加得罗定律的内容、应用
预习检测--示我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
根据大家的预习,回答下列问题
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
2、气体摩尔体积的概念、符号、单位、数值(条件)
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
4、阿伏加得罗定律的内容、应用。
交流展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
1、影响物质(气体、液体、固体)体积大小的因素有哪些?
(1)影响物质体积大小的内部因素
①粒子数多少
②粒子本身大小
③粒子间的距离大小
Company Logo
固、液态物质的微观结构示意图
液体物质
构成固态结构微粒间的距离很小
构成液态结构微粒间的距离也小
固体物质
评
讲评展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
交流展示—美美共美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
(2)影响固体、液体体积的因素:
①粒子数多少
思考
②粒子本身大小
1mol不同固体或液体物质中含有粒子数目相同,由于粒子紧密排列,所以1mol固体、液体的体积主要决定于粒子的大小。
物 质 状态 1mol物质的质量 密 度(20℃) 1 mol 物质的体积
Fe 固体 7.8g/cm3
Al 固体 2.7g/cm3
Pb 固体 11.3g/cm3
H2O 液体 0.998g/cm3
H2SO4 液体 1.83g/cm3
7.2cm3
10cm3
18.3cm3
18cm3
53.6cm3
结论:1mol不同的固体、液体的体积是各不相同的
56g
27g
207g
18g
98g
科学探究--美美共美
以美育美 美美共美 砥身砺行 精进不休
分子直径
气体物质
分子间的平均距离
分子的直径为0.4nm
分子之间的平均距离为4nm
评
讲评展示--各美其美
以美育美 美美共美 砥身砺行 精进不休
影响气体体积的因素:(1) 粒子数多少(2)粒子之间的距离
分别计算在温度为0 ℃和压强为101K Pa(标准状况)时,1mol氢气和氧气的体积(保留小数点后1位)
物质 1 mol 物质的质量(g) 密度 (g/L) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.4
【结论】在标准状况下,1mol任何气体所占的体积是相同的,约为 L。
22.4
科学探究—美美共美
以美育美 美美共美 砥身砺行 精进不休
交流展示--美美共美
以美育美 美美共美 砥身砺行 精进不休
2、气体摩尔体积的概念、符号、单位、数值(条件)
概念:
符号:
单位:
数值:
单位物质的量(1mol)的气体所占的体积
V m
L/mol或者m3/mol
在标准状况下,1mol任何气体的体积约为22.4L
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
合作学习--美美共美
以美育美 美美共美 砥身砺行 精进不休
注意事项:
(1)Vm的数值决定于气体所处的温度和压强
(2)Vm的使用对象是气体,包括单一气体和混合气体
(3)非标准状况下,Vm也有可能约为22.4 L·mol-1
(eg:273℃、202kPa时,气体摩尔体积也约为22.4 L/mol )
eg:标准状况(0℃、101kPa)下,Vm≈22.4L/mol
常温常压(25℃、101kPa)下,Vm≈24.5L/mol
交流展示--美我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
3、物质的量n、体积V、气体摩尔体积 V m之间的关系
(n:物质的量;V:气体体积;V m:气体摩尔体积)
n=V /V m
【小试牛刀】
现有34g的某气体,摩尔质量为17g/mol,则
(1)该气体的物质的量为
(2)该气体所含的分子数为
(3)该气体在标准状况下的体积为
2mol
2NA
44.8L
科学探究—美美共美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
电解水实验
2H2O ==== 2H2↑ + O2↑(电解1.8gH2O)
电解
V(H2) V(O2) 质量 物质 的量 n(H2) n(O2) 结论
H2 0.2g 0.1mol
O2 1.6g 0.05mol
2:1
2:1
在相同的温度和压强下,1molO2和1molH2的体积相同
V(H2):V(O2)=n(H2):n(O2)
交流展示--美我之美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
4、阿伏加得罗定律的内容
阿伏加得罗定律的内容:相同温度和压强下,相同体积的任何气体都含有相同数目的粒子。
注意事项:
(1)适用范围:只适用于气体(既适用于单一气体,也适用于混合气体)
(2)同温、同压、同体积、同分子数,这四同共同存在,相互制约,只要三同成立,第四同必定成立。(三同决定一同)
拓展延伸—追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
同T同P下: 气体的体积之比、物质的量之比、分子数之比之间的关系
=
N1
N2
V1
V2
n1
n2
=
同T同P下,气体的密度与摩尔质量之间的关系:
M2
=
M1
ρ1
ρ2
同T同V时,气体的压强与物质的量之间的关系:
n1
=
n2
P1
P2
(2)推论:(提示:推导用到理想气体状态方程:PV=nRT)
同T同P同V时,气体的质量与摩尔质量之间的关系:
m1 M1
m2
=
M2
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
同温同压下,1molH2和1molO2的 ( )
A 质量相同,体积不同 B 分子数相同,质量不同
C 体积相同,分子数不同 D 体积相同,原子数不同
(2)下列叙述不正确的是 ( )
A 同温同压下,1molH2和1molH2O一定具有相同的体积
B 常温常压下,等体积的O2和H2的物质的量相同
C 同温同压下,O2和H2的密度之比为16:1
D 同温同压下,同容积的两个容器一个盛有NO,另一个盛有N2和O2,两容器内的气体一定具有相同的分子总数
B
A
课堂小结--追求至美
以美育美 美美共美 砥身砺行 精进不休
1.标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是( ),含原子数最多的是( ),质量最大的是( ),体积最小的是( )
2.已知标准状况下5.6L的X气体分子的质量为8g,则X气体的摩尔质量是( )
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
H2
H2
H2O
H2O
32g/mol
4.在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是 ;
3.在一定温度和压强下,并不一定是标准状况,1mol不同的气体的体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ;
在同温同压下,体积相同的气体,其分子数 ;
在同温同压下,气体体积的大小与分子数目成 ;
相同
相同
正比
反馈检测--追求至美
以美育美 美美共美 砥身砺行 精进不休
以美育美 美美共美 砥身砺行 精进不休
