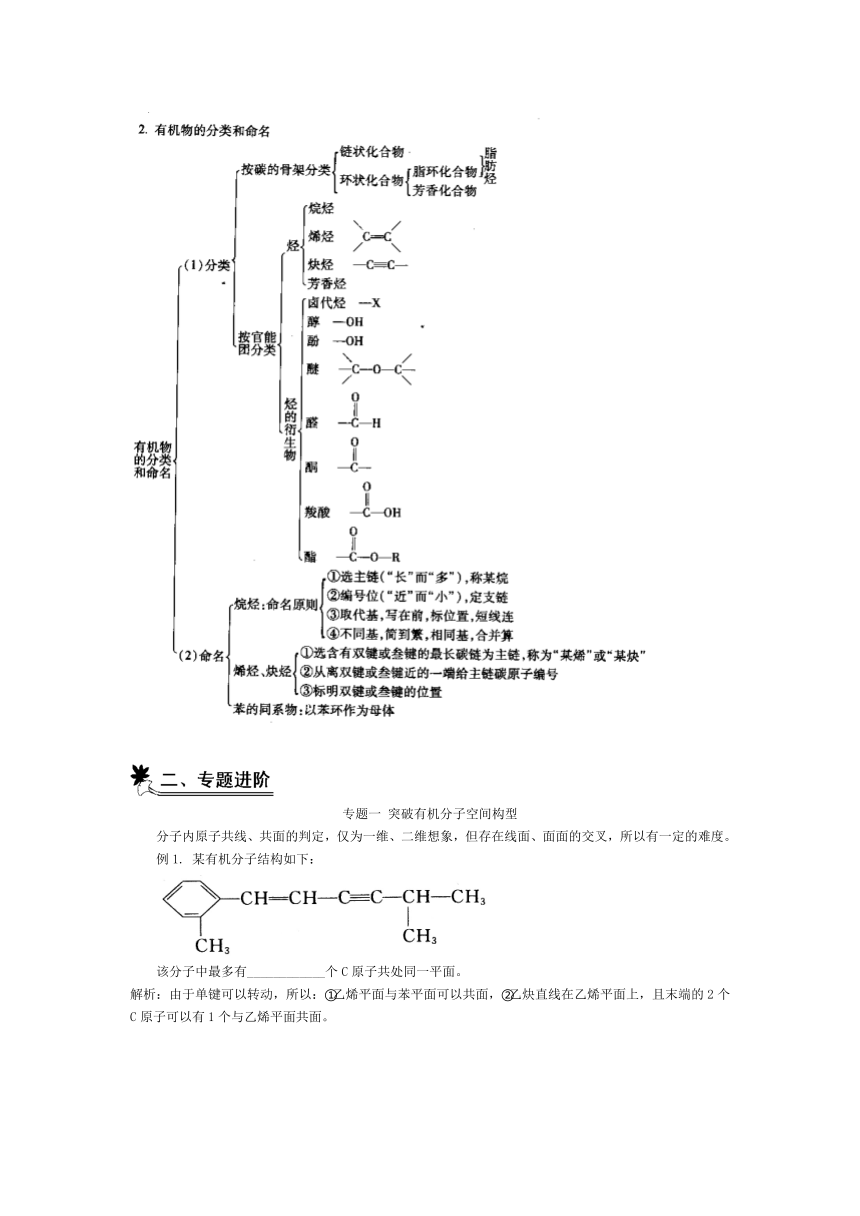
2015版高中化学苏教版选修5《有机化学基础》教材知识详解:专题二 有机物的结构与分类总结
文档属性
| 名称 | 2015版高中化学苏教版选修5《有机化学基础》教材知识详解:专题二 有机物的结构与分类总结 |  | |
| 格式 | zip | ||
| 文件大小 | 186.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-02-01 16:04:40 | ||
图片预览


文档简介
(C)——本章总结
专题一 突破有机分子空间构型
分子内原子共线、共面的判定,仅为一维、二维想象,但存在线面、面面的交叉,所以有一定的难度。
例1. 某有机分子结构如下:
该分子中最多有____________个C原子共处同一平面。
解析:由于单键可以转动,所以:①乙烯平面与苯平面可以共面,②乙炔直线在乙烯平面上,且末端的2个C原子可以有1个与乙烯平面共面。
答案:13
点拨:记住几个特殊分子的空间构型
①CH4分子为正四面体结构,其分子最多有3个原子共处同一平面。②乙烯分子中所有原子共平面。③乙炔分子中所有原子共直线。④苯分子中所有原子共平面。⑤H—CHO分子中所有原子共平面。
例2.某分子具有如下结构:C6H5—CO—C≡C—CH3((已知:HCHO分子中所有原子共平面)试回答下列问题:
(1)在同一直线上的原子最多有_______个;
(2)一定在同一平面上的原子最多有_______个;
(3)可能在同一平面上的原子最多有_______个。
解析:以甲醛平面为参照物:
转动①处C—C单键可使两平面M1和M2重合为同一平面,也可使苯平面非转动轴上的原子离开醛平面。炔直线位于醛平面上,但甲基上的H原子都不在炔直线上,转动②处C—C键,可使末端甲基中的一个H原子位于醛平面上。
答案:(1)4 (2)12 (3)17
点拨:单键的转动思想:有机物分子中的单键,包括碳碳单键、碳氢单键、碳氧单键等可转动。
四.科技信息
杂化轨道理论
杂化轨道理论(hybrid?orbital?theory)是1931年由Pauling?L等人在价键理论的基础上提出,?它实质上仍属于现代价键理论,?但它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。??
杂化轨道理论的要点:
1.在成键过程中,由于原子间的相互影响,同一原子中几个能量相近的不同类型的原子轨道(即波函数),可以进行线性组合,重新分配能量和确定空间方向,组成数目相等的新的原子轨道,这种轨道重新组合的过程称为杂化(hybridization),杂化后形成的新轨道称为?杂化轨道(hybrid?orbital)。?
2.杂化轨道的角度波函数在某个方向的值比杂化前的大得多,更有利于原子轨道间最大程度地重叠,因而杂化轨道比原来轨道的成键能力强。?
3.杂化轨道之间力图在空间取最大夹角分布,使相互间的排斥能最小,故形成的键较稳定。不同类型的杂化轨道之间的夹角不同,成键后所形成的分子就具有不同的空间构型。
轨道杂化类型及实例?????
?1.sp型杂化??:能量相近的ns轨道和np轨道之间的杂化称为sp型杂化。按参加杂化的s轨道、p轨道数目的不同,sp型杂化又可分为sp、sp2?、sp3?三种杂化。?? (1)sp杂化???
?由1个s轨道和1个p轨道组合成2个sp杂化轨道的过程称为sp杂化,所形成的轨道称为sp杂化轨道。每个sp杂化轨道均含有??的s轨道成分和??的p轨道成分。为使相互间的排斥能最小,轨道间的夹角为1800?。当2个sp杂化轨道与其他原子轨道重叠成键后就形成直线型分子。?
sp2杂化 sp2杂化轨道的空间取向示意图
(图BF3的平面三角形构型和sp2杂化轨道的空间取向)?
由1个s轨道与2个p轨道组合成3个sp2杂化轨道的过程称为sp2杂化。每个sp2?杂化轨道含有?的s轨道成分和?的p轨道成分,为使轨道间的排斥能最小,3个sp2杂化轨道呈正三角形分布,夹角为1200[图9-4]。当3个sp2杂化轨道分别与其他3个相同原子的轨道重叠成键后,就形成正三角形构型的分子。
sp3杂化轨道示意图
sp3杂化轨道是由1个s轨道和3个?p轨道组合成4个sp3杂化轨道的过程称为sp3?杂化。每个sp3杂化轨道含有?的s?轨道成分和?的p轨道成分。为使轨道间的排斥能最小,4个顶角的sp3杂化轨道间的夹角均为109?0?28’?[图9-5]。当它们分别与其他4个相同原子的轨道重叠成键后,就形成正四面体构型的分子。
实例分析1:?试说明BeCl2分子的空间构型。
解?实验测出,BeCl2分子中有2个完全等同的Be -Cl键,键角为1800?,分子的空间构型为直线。?
Be原子的价层电子组态为2s2?。在形成BeCl2?分子的过程中,Be原子的1个2s电子被激发到2p空轨道,价层电子组态为2s1?2px1?,这2个含有单电子的2s轨道和2px轨道进行sp杂化,组成夹角为1800?的2个能量相同的sp杂化轨道,当它们各与2个Cl原子中含有单电子的3p轨道重叠,就形成2个sp p的σ键,所以BeCl2分子的空间构型为直线,其形成过程可表示为
实例分析2:?试说明BF3分子的空间构型。? 解?实验测定,BF3分子中有3个完全等同的B-F键,键角为1200?,分子的空间构型为正三角形。?
BF3分子的中心原子是B,其价层电子组态为2s22px1?。在形成BF3分子的过程中,B原子的2s轨道上的1个电子被激发到2p空轨道,价层电子组态为2s12px12py1?,1个2s轨道和2个2p轨道进行sp2杂化,形成夹角均为1200?的3个完全等同的sp2杂化轨道,当它们各与1个F原子的含有单电子的2p轨道重叠时,就形成3个sp2-p的σ键。故BF3?分子的空间构型是正三角形,其形成过程可表示为
实例分析3:试解释CCl4分子的空间构型。?
解?近代实验测定表明,CCl4分子的空间构型为正四面体。其形成过程可表示为
即中心原子C以夹角均为1090?28’的4个完全等同的sp3杂化轨道分别与4个H原子的1s轨道重叠后,形成4个sp3 s的σ键。故CCl4?分子的空间构型为正四面体[图(b)]。 sp型杂化方式总结:
杂?化?类?型
参与杂化的原子轨道
杂?化?轨?道?数
杂化轨道间夹角
空?间?构?型
实?例
sp
1个?s?+?1个p
2个sp杂化轨道
1800
直?线
BeCl2?,?C2H2
sp2
1个s?+?2个p
3个sp2杂化轨道
1200
正三角形
BF3?,?C2H4
sp3
1个s?+?3个p
4个sp3杂化轨道
1090?28’
正四面体
CH4?,?CCl4
本专题作业
第38页习题答案
1.
结构简式
键线式
名称
2,4-二甲基戊烷
2-甲基—1,4-丁二烯
3-甲基戊烷
1,3-二甲苯
2-丁炔
2.⑴不能;⑵不能;⑶能;⑷不能。
3.⑴C3H6(有);CH2=CH—CH3,;⑵C4H10(有);CH3—CH2—CH2—CH3,;⑶C3H2O(没有);H—CHO;⑷C4H10O(有);CH3—CH2—CH2—CH2—OH,,,,CH3—CH2—O—CH2—CH3,CH3—O—CH2—CH2—CH3,。
4.⑴2,4-二甲基已烷;⑵2,2-二甲基—4-乙基已烷;⑶4-甲基—2-戊烯;⑷3-甲基—3-戊烷。
5.CH2=CH—CH2—CH3;CH3—CH=CH—CH3;。
