2.1.2钠的氧化物 课件(共24页) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.2钠的氧化物 课件(共24页) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 11:27:50 | ||
图片预览







文档简介
(共24张PPT)
情境引入
你可信水能生火
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
1、氧化钠(Na2O)
氧化钠是一种比较典型的碱性氧化物
Na2O2属于碱性氧化物吗?从氧化还原反应的角度分析, Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
Na2O2 + H2O = 2NaOH
Na2O2+CO2 =Na2CO3
-1
-2
-2
-1
-2
-2
过氧化钠的化学性质
因此,Na2O2不是碱性氧化物是过氧化物
2、过氧化钠(Na2O2)
1. Na2O2与H2O的反应
过氧化钠的化学性质
预测:从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能为
Na2O2 + H2O
思考:
如何设计实验去验证我们的推测?
科学探究的一般步骤:
1、提出问题 2、猜想假设 3、设计方案(包括选择仪器、选择试剂等)
4、进行实验 5、得出结论 6、交流评价
实验验证
过氧化钠的化学性质
将1~2mL水滴入盛有1~2g过氧化钠固体的仪器中,立即把带火星的木条伸入仪器内,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?滴入无色酚酞有什么现象?
实验2-3
思考:
如何设计实验去验证我们的推测?
做实验!!!
实验现象 结论
1. Na2O2与H2O的反应
过氧化钠的化学性质
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
无色酚酞先变红后褪色
有O2产生
反应放热
???
2Na2O2+2H2O=4NaOH+O2↑
1. Na2O2与H2O的反应
-1 -2 -2 0
2Na2O2+2H2O=4NaOH+O2↑
化合价升高,失去e-×2,被氧化
化合价降低,得到e-×2 ,被还原
既是氧化剂又是还原剂
过氧化钠的化学性质
2Na2O2 + 2H2O === 4NaOH + O2↑
2e-
比例关系:2Na2O2 ~ O2 ~ 2e-
实验探究过氧化钠与水的反应历程
过氧化钠与水反应过程的产物只有氢氧化钠吗?溶液中又会有什么呢?
足量过氧化钠与H2O反应后的溶液中滴入酚酞溶液,溶液先变红后褪色;取反应后的溶液加入二氧化锰后迅速产生大量气体,为什么?
试写出过氧化钠与水反应过程的化学方程式和总反应化学方程式。
Na2O2与水反应的过程中会生成H2O2和NaOH,NaOH使酚酞溶液变红,
H2O2有强氧化性,也有漂白性,使溶液褪色;
加入MnO2后,H2O2在MnO2催化作用下分解生成氧气。
①Na2O2+2H2O==2NaOH+H2O2 ②2H2O2==2H2O+O2↑
将①×2+②得总反应:2Na2O2+2H2O==4NaOH+O2↑。
实验探究过氧化钠与水的反应历程
【情境素材】
查阅相关文献可知,潮湿的CO2才能与Na2O2反应,而干燥的CO2与Na2O2不反应。
潮湿的CO2与Na2O2反应的过程可以表示如下:
首先 ①Na2O2(淡黄色)+2H2O===2NaOH+H2O2;
② 2H2O2===2H2O+O2↑,
然后:③CO2+2NaOH===Na2CO3(白色)+H2O
(①+③)×2+②得到:2Na2O2+2CO2===2Na2CO3+O2
所以CO2与Na2O2反应时需与水接触,H2O可看作“催化剂”。
过氧化钠的化学性质
2. Na2O2与CO2的反应
过氧化钠的化学性质
取一小块脱脂棉放在石棉网上,再取半药匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。
探究:
现象:
脱脂棉燃烧起来
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1 -2 -2 0
失去e-×2 ,化合价升高,被氧化
得到e-×2 ,化合价降低,被还原
既是氧化剂又是还原剂
2. Na2O2与CO2的反应
过氧化钠的化学性质
Na2O2可在呼吸面具或核潜艇中作为氧气的来源(供氧剂)
2Na2O2 + 2CO2 === 2Na2CO3 + O2
比例关系:2Na2O2 ~ O2 ~ 2e-
2e-
思考讨论
问题
类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,分析以下问题。
(1)将适量Na2O2投入盐酸中,有什么现象。写出相应的化学方程式。
(2)将适量Na2O2投入CuSO4溶液中,有什么现象。写出相应的化学方程式。
有气泡产生
2Na2O2+4HCl=4NaCl+2H2O+O2↑
有气泡放出,溶液颜色变浅,有蓝色沉淀生成
2Na2O2 + 2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
过氧化钠的化学性质
思考讨论 过氧化钠的性质
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
过氧化钠的化学性质
【讨论】Na着火能否用泡沫灭火器灭火?
【思考】实验室如何保存Na2O2?
干燥、密闭保存
不能,泡沫灭火器含CO2
2.有强氧化性,具有杀菌、消毒、漂白的作用。(氧化剂,漂白剂)
【交流研讨2】结合Na2O2的性质思考实验室中应该如何保存Na2O2
提示 Na2O2能够与空气中的CO2和H2O反应,应该密封保存。
1.过氧化钠(Na2O2)是一种非常理想的应用于密闭舱室的氧气再生物质,各国都对其进行了研究,并有多种型号产品装艇使用。(供氧剂)
【交流研讨1】结合Na2O2的性质思考Na2O2有哪些用途
过氧化钠的用途
课堂小结
Na2O Na2O2
阴阳离子组成及个数比
氧元素化合价
物理性质
化学性质 与H2O反应
与盐酸反应
与CO2反应
白色固体
淡黄色固体
O2-:Na+ = 1 : 2
O22-:Na+ = 1 : 2
-2
-1
氧化性、漂白性
主要用途
转化 /
有
呼吸面具的供氧剂、强氧化剂
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
2Na2O + O2 2Na2O2(更稳定)
保存 密封 密封、远离易燃物
/
1.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
3. 把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH
C.Na2CO3 D.CuSO4
D
4.下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应 B.氧化钠与水反应
C.过氧化钠与水反应 D.二氧化碳与水反应
C
5.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
6.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
第2课时 钠的氧化物
Thanks
谢谢观看
情境引入
你可信水能生火
第二章 海水中的重要元素—钠和氯
第一节 钠及其化合物
第2课时 钠的氧化物
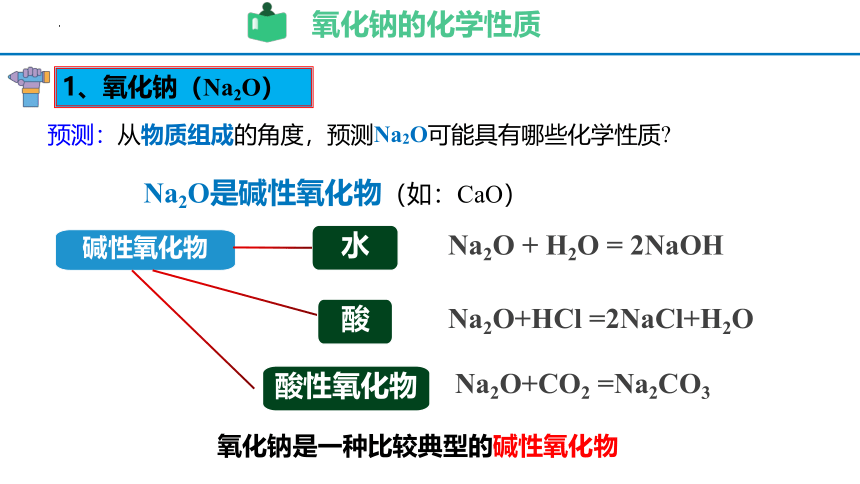
预测:从物质组成的角度,预测Na2O可能具有哪些化学性质
Na2O + H2O = 2NaOH
Na2O+CO2 =Na2CO3
Na2O是碱性氧化物(如:CaO)
Na2O+HCl =2NaCl+H2O
氧化钠的化学性质
碱性氧化物
水
酸性氧化物
酸
1、氧化钠(Na2O)
氧化钠是一种比较典型的碱性氧化物
Na2O2属于碱性氧化物吗?从氧化还原反应的角度分析, Na2O2是否同Na2O一样也能与水、CO2反应?产物是否相同?
Na2O2 + H2O = 2NaOH
Na2O2+CO2 =Na2CO3
-1
-2
-2
-1
-2
-2
过氧化钠的化学性质
因此,Na2O2不是碱性氧化物是过氧化物
2、过氧化钠(Na2O2)
1. Na2O2与H2O的反应
过氧化钠的化学性质
预测:从物质组成和氧化还原反应的角度,预测Na2O2与H2O反应的产物可能为
Na2O2 + H2O
思考:
如何设计实验去验证我们的推测?
科学探究的一般步骤:
1、提出问题 2、猜想假设 3、设计方案(包括选择仪器、选择试剂等)
4、进行实验 5、得出结论 6、交流评价
实验验证
过氧化钠的化学性质
将1~2mL水滴入盛有1~2g过氧化钠固体的仪器中,立即把带火星的木条伸入仪器内,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?滴入无色酚酞有什么现象?
实验2-3
思考:
如何设计实验去验证我们的推测?
做实验!!!
实验现象 结论
1. Na2O2与H2O的反应
过氧化钠的化学性质
剧烈反应,产生大量气泡,带火星的木条复燃
试管壁发烫
无色酚酞先变红后褪色
有O2产生
反应放热
???
2Na2O2+2H2O=4NaOH+O2↑
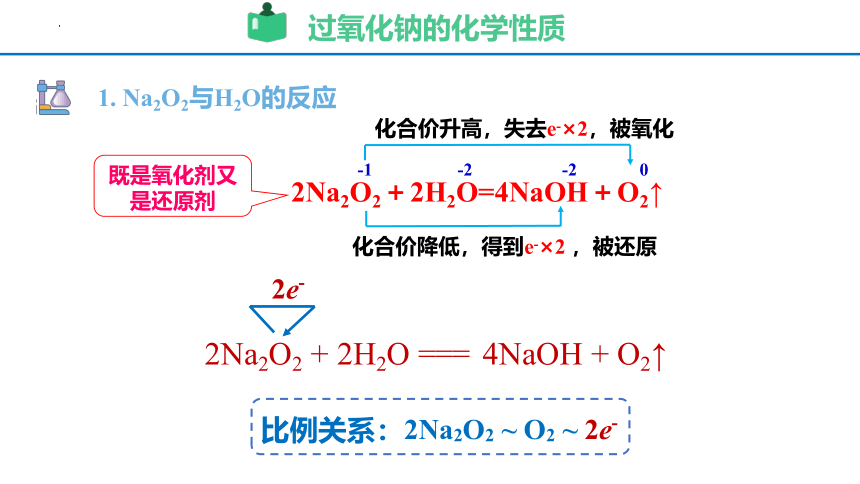
1. Na2O2与H2O的反应
-1 -2 -2 0
2Na2O2+2H2O=4NaOH+O2↑
化合价升高,失去e-×2,被氧化
化合价降低,得到e-×2 ,被还原
既是氧化剂又是还原剂
过氧化钠的化学性质
2Na2O2 + 2H2O === 4NaOH + O2↑
2e-
比例关系:2Na2O2 ~ O2 ~ 2e-
实验探究过氧化钠与水的反应历程
过氧化钠与水反应过程的产物只有氢氧化钠吗?溶液中又会有什么呢?
足量过氧化钠与H2O反应后的溶液中滴入酚酞溶液,溶液先变红后褪色;取反应后的溶液加入二氧化锰后迅速产生大量气体,为什么?
试写出过氧化钠与水反应过程的化学方程式和总反应化学方程式。
Na2O2与水反应的过程中会生成H2O2和NaOH,NaOH使酚酞溶液变红,
H2O2有强氧化性,也有漂白性,使溶液褪色;
加入MnO2后,H2O2在MnO2催化作用下分解生成氧气。
①Na2O2+2H2O==2NaOH+H2O2 ②2H2O2==2H2O+O2↑
将①×2+②得总反应:2Na2O2+2H2O==4NaOH+O2↑。
实验探究过氧化钠与水的反应历程
【情境素材】
查阅相关文献可知,潮湿的CO2才能与Na2O2反应,而干燥的CO2与Na2O2不反应。
潮湿的CO2与Na2O2反应的过程可以表示如下:
首先 ①Na2O2(淡黄色)+2H2O===2NaOH+H2O2;
② 2H2O2===2H2O+O2↑,
然后:③CO2+2NaOH===Na2CO3(白色)+H2O
(①+③)×2+②得到:2Na2O2+2CO2===2Na2CO3+O2
所以CO2与Na2O2反应时需与水接触,H2O可看作“催化剂”。
过氧化钠的化学性质
2. Na2O2与CO2的反应
过氧化钠的化学性质
取一小块脱脂棉放在石棉网上,再取半药匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。
探究:
现象:
脱脂棉燃烧起来
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1 -2 -2 0
失去e-×2 ,化合价升高,被氧化
得到e-×2 ,化合价降低,被还原
既是氧化剂又是还原剂
2. Na2O2与CO2的反应
过氧化钠的化学性质
Na2O2可在呼吸面具或核潜艇中作为氧气的来源(供氧剂)
2Na2O2 + 2CO2 === 2Na2CO3 + O2
比例关系:2Na2O2 ~ O2 ~ 2e-
2e-
思考讨论
问题
类比Na与H2O反应的分析方法及Na2O2与H2O反应的化学方程式,分析以下问题。
(1)将适量Na2O2投入盐酸中,有什么现象。写出相应的化学方程式。
(2)将适量Na2O2投入CuSO4溶液中,有什么现象。写出相应的化学方程式。
有气泡产生
2Na2O2+4HCl=4NaCl+2H2O+O2↑
有气泡放出,溶液颜色变浅,有蓝色沉淀生成
2Na2O2 + 2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
过氧化钠的化学性质
思考讨论 过氧化钠的性质
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
过氧化钠的化学性质
【讨论】Na着火能否用泡沫灭火器灭火?
【思考】实验室如何保存Na2O2?
干燥、密闭保存
不能,泡沫灭火器含CO2
2.有强氧化性,具有杀菌、消毒、漂白的作用。(氧化剂,漂白剂)
【交流研讨2】结合Na2O2的性质思考实验室中应该如何保存Na2O2
提示 Na2O2能够与空气中的CO2和H2O反应,应该密封保存。
1.过氧化钠(Na2O2)是一种非常理想的应用于密闭舱室的氧气再生物质,各国都对其进行了研究,并有多种型号产品装艇使用。(供氧剂)
【交流研讨1】结合Na2O2的性质思考Na2O2有哪些用途
过氧化钠的用途
课堂小结
Na2O Na2O2
阴阳离子组成及个数比
氧元素化合价
物理性质
化学性质 与H2O反应
与盐酸反应
与CO2反应
白色固体
淡黄色固体
O2-:Na+ = 1 : 2
O22-:Na+ = 1 : 2
-2
-1
氧化性、漂白性
主要用途
转化 /
有
呼吸面具的供氧剂、强氧化剂
Na2O + 2HCl = 2NaCl + H2O
Na2O + CO2 = Na2CO3
Na2O + H2O = 2NaOH
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑
2Na2O + O2 2Na2O2(更稳定)
保存 密封 密封、远离易燃物
/
1.下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
2.向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
A.最后溶液变蓝色
B.溶液先变蓝色最后褪色
C.溶液仍为紫色
D.因为Na2O2与石蕊发生氧化还原反应而无气泡产生
B
3. 把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH
C.Na2CO3 D.CuSO4
D
4.下列反应中,水既不做氧化剂又不做还原剂的氧化还原反应是( )
A.钠与水反应 B.氧化钠与水反应
C.过氧化钠与水反应 D.二氧化碳与水反应
C
5.如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大
B.试管b内有气泡冒出
C.U形管内红色褪去
D.U形管水位d高于c
C
6.在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
D
第2课时 钠的氧化物
Thanks
谢谢观看
