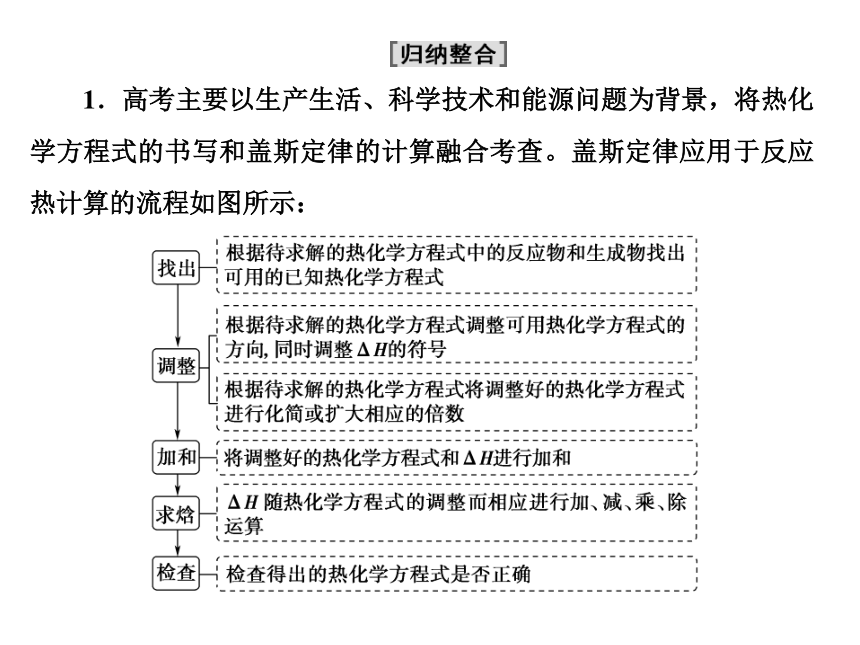
第1章 第2节 能力课时1 盖斯定律的综合应用课件(共16张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 第1章 第2节 能力课时1 盖斯定律的综合应用课件(共16张PPT)2023-2024学年上学期高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 16:09:37 | ||
图片预览





文档简介
(共16张PPT)
第二节 反应热的计算
能力课时1 盖斯定律的综合应用
第一章 化学反应的热效应
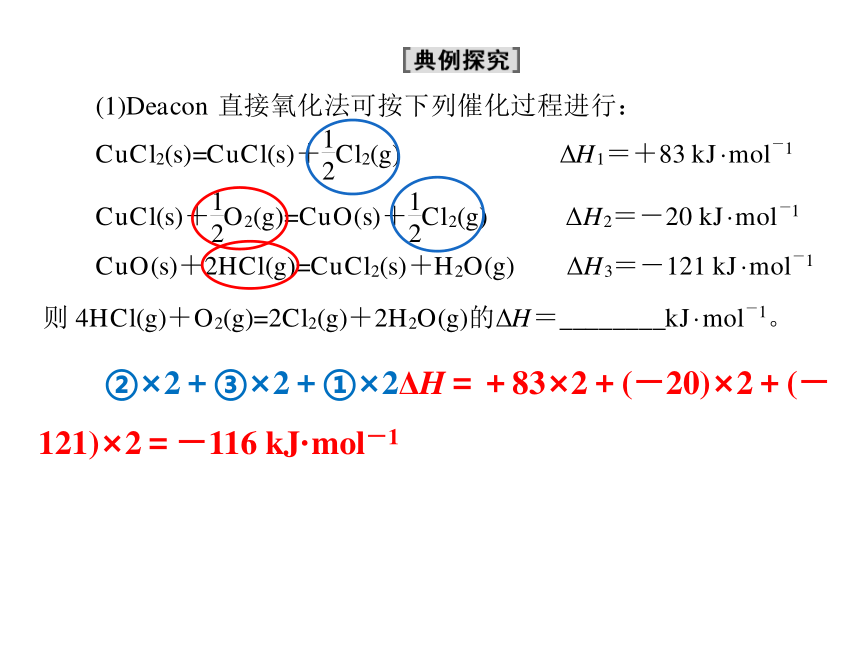
②×2+③×2+①×2ΔH=+83×2+(-20)×2+(-121)×2=-116 kJ·mol-1
Ⅱ=-Ⅰ-Ⅲ
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)
ΔH2=-254kJ·mol-1
CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=-179.3 kJ·mol-1
①+②×2+③
2ΔH1+ΔH2
①×2+②
①+②
H2S(g)+2O2(g)=SO42-(aq)+2H+(aq) ΔH=-806.39 kJ·mol-1
生活垃圾焚烧时的热能利用;防止二次污染。
诸如果皮等生活垃圾富含水分,如果直接送到焚烧炉里,难以彻底燃烧。脱水之后的生活垃圾更容易燃烧,利用率自然更高,产生的固体废物也更少,生活垃圾的处理也更加彻底。
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH=-890.24 kJ·mol-1
ΔH=-55.64×16=-890.24 kJ·mol-1
随堂自测
B
C
C
>0 断键吸热
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6
>0 >0
>0
>0 >0
<0
<0
B
>0
ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7=ΔH1
K半径大,失电子更容易
吸收热量更少
>0
2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s) ΔH=-351kJ·mol-1
-①×2+②
V2O4(s)+SO3(g)=V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①V2O4(s)+2SO3(g)=2VOSO4(s) ΔH1=-399 kJ·mol-1②
第二节 反应热的计算
能力课时1 盖斯定律的综合应用
第一章 化学反应的热效应
②×2+③×2+①×2ΔH=+83×2+(-20)×2+(-121)×2=-116 kJ·mol-1
Ⅱ=-Ⅰ-Ⅲ
3SO2(g)+2H2O(g)=2H2SO4(l)+S(s)
ΔH2=-254kJ·mol-1
CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-11 kJ·mol-1
N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=-179.3 kJ·mol-1
①+②×2+③
2ΔH1+ΔH2
①×2+②
①+②
H2S(g)+2O2(g)=SO42-(aq)+2H+(aq) ΔH=-806.39 kJ·mol-1
生活垃圾焚烧时的热能利用;防止二次污染。
诸如果皮等生活垃圾富含水分,如果直接送到焚烧炉里,难以彻底燃烧。脱水之后的生活垃圾更容易燃烧,利用率自然更高,产生的固体废物也更少,生活垃圾的处理也更加彻底。
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
ΔH=-890.24 kJ·mol-1
ΔH=-55.64×16=-890.24 kJ·mol-1
随堂自测
B
C
C
>0 断键吸热
ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=ΔH6
>0 >0
>0
>0 >0
<0
<0
B
>0
ΔH2+ΔH3+ΔH4+ΔH5+ΔH6+ΔH7=ΔH1
K半径大,失电子更容易
吸收热量更少
>0
2V2O5(s)+2SO2(g)=2VOSO4(s)+V2O4(s) ΔH=-351kJ·mol-1
-①×2+②
V2O4(s)+SO3(g)=V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1①V2O4(s)+2SO3(g)=2VOSO4(s) ΔH1=-399 kJ·mol-1②
