第11讲 氧化钠和过氧化钠 课件(共26张PPT)
文档属性
| 名称 | 第11讲 氧化钠和过氧化钠 课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 51.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 00:00:00 | ||
图片预览





文档简介
(共26张PPT)
第11讲 氧化钠和过氧化钠
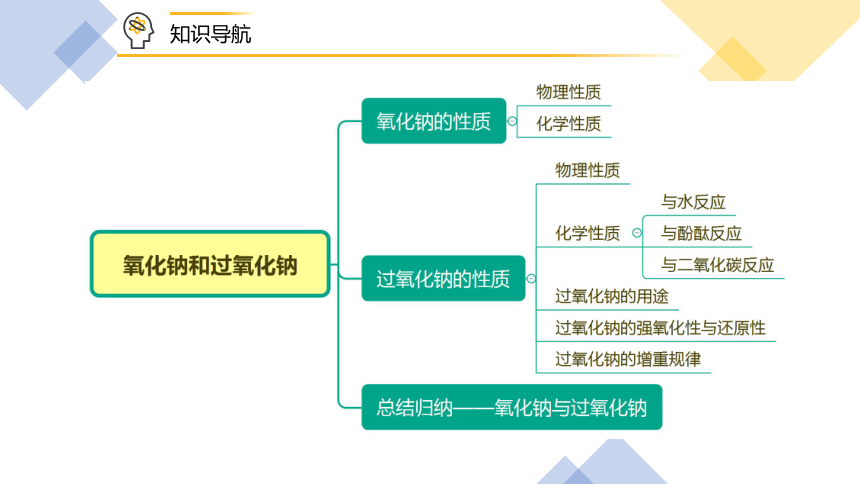
知识导航
一、氧化钠的性质
1. 物理性质:氧化钠是一种白色固体。
2. 化学性质:氧化钠是碱性氧化物,具有碱性氧化物的通性,如能与水、酸、酸性氧化物等反应。
(1)与水反应:__________________________________
(2)与盐酸反应:________________________________
(3)与CO2反应:________________________________
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
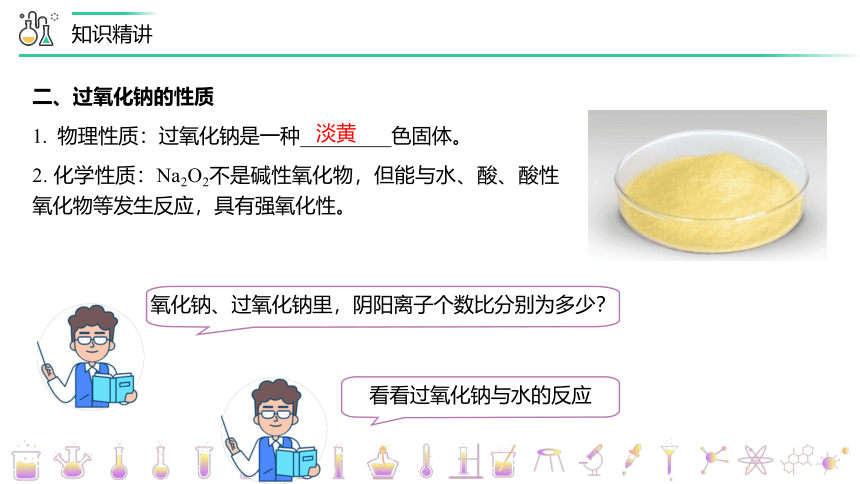
二、过氧化钠的性质
1. 物理性质:过氧化钠是一种_________色固体。
2. 化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性。
淡黄
看看过氧化钠与水的反应
氧化钠、过氧化钠里,阴阳离子个数比分别为多少?
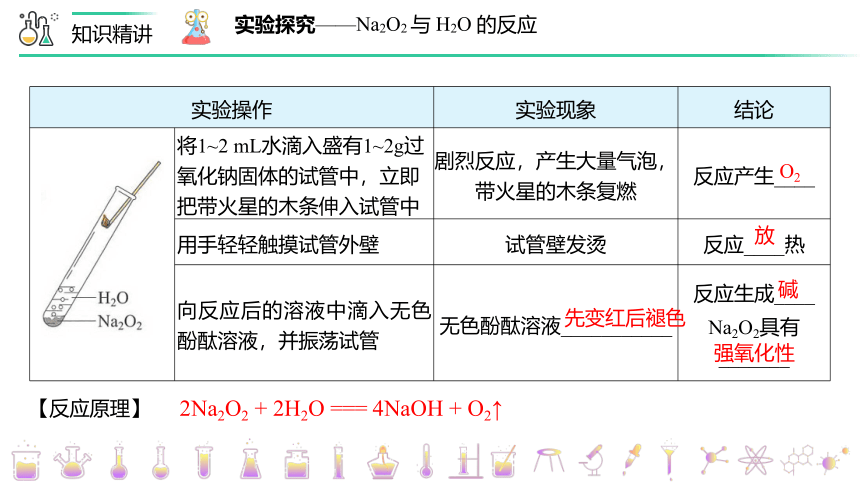
实验探究——Na2O2 与 H2O 的反应
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中 剧烈反应,产生大量气泡,带火星的木条复燃 反应产生____
用手轻轻触摸试管外壁 试管壁发烫 反应____热
向反应后的溶液中滴入无色酚酞溶液,并振荡试管 无色酚酞溶液___________ 反应生成____
Na2O2具有_______
O2
放
先变红后褪色
碱
强氧化性
【反应原理】
2Na2O2 + 2H2O === 4NaOH + O2↑
实验探究——Na2O2 与 H2O 的反应
资料卡片——Na2O2使酚酞先变红后褪色的原因
将 Na2O2 投入滴有酚酞的水中, Na2O2 与水反应生成 NaOH,使酚酞先变红;同时,Na2O2与水反应过程中,还生成了不是很稳定的中间产物H2O2,具有漂白性,使变色后的酚酞氧化褪色。
Na2O2为什么会使酚酞先变红后褪色
过氧化钠还能与二氧化碳反应生成碳酸钠和氧气。试着写出方程式。
2Na2O2 + 2CO2 === 2Na2CO3 + O2
想想我们呼吸时,吸入与呼出的气体,过氧化钠可以用来做什么?
作供氧剂
过氧化钠除了可以作供氧剂,还可以作强氧化剂、漂白剂。
资料卡片——过氧化钠的强氧化性与还原性
Na2O2中氧元素为-1价,处于中间价态,既有氧化性又有还原性。Na2O2主要表现较强的氧化性:
(1)Na2O2与SO2反应:Na2O2+SO2===Na2SO4
(2)Na2O2投入Na2SO3溶液中,可将氧化成
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(5)Na2O2 投入品红溶液中,可使品红溶液褪色
(6)Na2O2能使酚酞试液先变红后褪色
Na2O2也有还原性,如遇KMnO4等强氧化剂时,被氧化成O2。
结合氧化还原的知识,仅作简单了解
过氧化钠可以作供氧剂,是这节课的一个重点。写出其原理,并分别用双线桥、单线桥表示其电子转移。
2Na2O2 + 2H2O === 4NaOH + O2↑
2Na2O2 + 2CO2 === 2Na2CO3 + O2
这是自身氧化还原反应,氧化剂、还原剂都是Na2O2
2Na2O2 + 2H2O === 4NaOH + O2↑
2Na2O2 + 2CO2 === 2Na2CO3 + O2
将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
a g H2 在O2 中完全燃烧,将其燃烧产物通过足量的Na2O2固体,Na2O2固体质量增加多少克?
Na2O2与H2O的反应,固体增重,实为H2的质量
增加 a g
增加 2 g
2Na2O2 + 2CO2 === 2Na2CO3 + O2
将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
a g CO在O2中完全燃烧,将其燃烧产物通过足量的Na2O2固体,Na2O2固体质量增加多少克?
Na2O2与CO2的反应,固体增重,实为CO的质量
增加 a g
增加 28 g
若a g某物质O2中完全燃烧,产物通过足量的Na2O2固体,Na2O2固体增加a g,那么,该物质需要满足什么条件?
该物质的通式必须为(CO)m(H2)n
归纳总结——Na2O2的增重规律
(1)若题目只给出CO2或H2O的质量,可通过CO2或H2O的质量,求出CO或H2的质量,则固体增重就是CO或H2的质量。
(2)w g 符合通式为(CO)m(H2)n的物质,在O2中充分燃烧后,将其产物通过足量的Na2O2固体,反应完毕,固体增重也必是 w g。如甲醛(CH2O)、甲醇(CH4O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)等。
归纳总结——氧化钠与过氧化钠
Na2O Na2O2
颜色 白色 淡黄色
阴阳离子个数比 1∶2 1∶2
氧元素的化合价 -2 -1
是否为碱性氧化物 是 否
与H2O反应 Na2O + H2O == 2NaOH 2Na2O2 + 2H2O == 4NaOH + O2↑
与CO2反应 Na2O + CO2 == Na2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2
与盐酸反应 Na2O + 2HCl == 2NaCl + H2O 2Na2O2 + 4HCl == 4NaCl + 2H2O + O2↑
氧化性/漂白性 无 有
主要用途 制备NaOH 强氧化剂、漂白剂、供氧剂
知识点都掌握了吗?来做几道题检测下~
【例1】下列关于钠的氧化物的说法正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O与Na2O2中阳、阴离子的个数比不相同
C.将金属钠切开,表面变暗,最终得到淡黄色固体
D.保持温度不变,向饱和烧碱溶液中加入2 g Na2O2,充分反应后,溶液中Na+浓度增大
A
题型一:氧化钠和过氧化钠的基本性质
【例2】下列叙述正确的是
A.金属钠着火时,可用泡沫灭火器灭火
B.将一小块钠投入CuSO4溶液中可置换出红色的固体
C.向某待测溶液中滴入盐酸酸化的AgNO3溶液,产生白色沉淀,说明待测溶液中含Cl-
D.Na2O与Na2O2中阳、阴离子的个数比均为2∶1
D
题型一:氧化钠和过氧化钠的基本性质
C
题型二:过氧化钠的化学性质
【例5】在一定条件下,使12gCO和O2的混合气体充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重7g,则原混合气体中O2的质量分数可能是
①33.3% ②41.7% ③58.3% ④66.7%
A.①② B.①③ C.②③ D.②④
A
题型三:Na2O2的增重问题
【变5-2】一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
题型三:Na2O2的增重问题
【例6】某化学兴趣小组学习Na2O2的性质后,进行过氧化钠与水反应的探究实验。回答下列问题:
(1)探究该反应的热效应
实验装置如图所示,调节U型管内两侧液面相平,向试管中加入a g Na2O2粉末,再滴加10 mL蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。
①观察到U型管内液面_______(填标号),说明该反应为放热反应。
A.左侧较高 B.右侧较高 C.左、右两侧一样高
②写出该反应的离子方程式_______________________________。
(2)探究溶液红色褪去的原因
限选仪器及试剂:试管、胶头滴管、温度计、蒸馏水、酚酞试液、MnO2粉末。
①提出合理猜想:
猜想一:反应放热,酚酞受热分解,使溶液红色褪去;
猜想二:________________________________________。
题型四:Na2O2的性质探究
②设计方案证明猜想:向a g Na2O2中加入10 mL蒸馏水,所得溶液分别置于试管1和试管2中,请将实验操作、现象和结论补充完整:
③在试管2中,加入少量MnO2粉末的作用是_______。
题型四:Na2O2的性质探究
实验操作 实验现象 实验结论
将试管1中溶液冷却至室温,滴加2~3滴酚酞 _______ 猜想一不成立
向试管2中加入少量MnO2粉末,充分振荡,滴加2~3滴酚酞 振荡时,产生大量气泡;滴加酚酞后,_______ 猜想二成立
【答案】B 2Na2O2+2H2O=4Na++4OH-+O2↑ 反应过程中生成漂白性物质H2O2,使溶液红色褪去 溶液先变红,后褪色 溶液变红,不褪色 作催化剂,将产生的H2O2催化分解
知识导航
第11讲 氧化钠和过氧化钠
知识导航
一、氧化钠的性质
1. 物理性质:氧化钠是一种白色固体。
2. 化学性质:氧化钠是碱性氧化物,具有碱性氧化物的通性,如能与水、酸、酸性氧化物等反应。
(1)与水反应:__________________________________
(2)与盐酸反应:________________________________
(3)与CO2反应:________________________________
Na2O+H2O===2NaOH
Na2O+2HCl===2NaCl+H2O
Na2O+CO2===Na2CO3
二、过氧化钠的性质
1. 物理性质:过氧化钠是一种_________色固体。
2. 化学性质:Na2O2不是碱性氧化物,但能与水、酸、酸性氧化物等发生反应,具有强氧化性。
淡黄
看看过氧化钠与水的反应
氧化钠、过氧化钠里,阴阳离子个数比分别为多少?
实验探究——Na2O2 与 H2O 的反应
实验操作 实验现象 结论
将1~2 mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中 剧烈反应,产生大量气泡,带火星的木条复燃 反应产生____
用手轻轻触摸试管外壁 试管壁发烫 反应____热
向反应后的溶液中滴入无色酚酞溶液,并振荡试管 无色酚酞溶液___________ 反应生成____
Na2O2具有_______
O2
放
先变红后褪色
碱
强氧化性
【反应原理】
2Na2O2 + 2H2O === 4NaOH + O2↑
实验探究——Na2O2 与 H2O 的反应
资料卡片——Na2O2使酚酞先变红后褪色的原因
将 Na2O2 投入滴有酚酞的水中, Na2O2 与水反应生成 NaOH,使酚酞先变红;同时,Na2O2与水反应过程中,还生成了不是很稳定的中间产物H2O2,具有漂白性,使变色后的酚酞氧化褪色。
Na2O2为什么会使酚酞先变红后褪色
过氧化钠还能与二氧化碳反应生成碳酸钠和氧气。试着写出方程式。
2Na2O2 + 2CO2 === 2Na2CO3 + O2
想想我们呼吸时,吸入与呼出的气体,过氧化钠可以用来做什么?
作供氧剂
过氧化钠除了可以作供氧剂,还可以作强氧化剂、漂白剂。
资料卡片——过氧化钠的强氧化性与还原性
Na2O2中氧元素为-1价,处于中间价态,既有氧化性又有还原性。Na2O2主要表现较强的氧化性:
(1)Na2O2与SO2反应:Na2O2+SO2===Na2SO4
(2)Na2O2投入Na2SO3溶液中,可将氧化成
(3)Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
(4)Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
(5)Na2O2 投入品红溶液中,可使品红溶液褪色
(6)Na2O2能使酚酞试液先变红后褪色
Na2O2也有还原性,如遇KMnO4等强氧化剂时,被氧化成O2。
结合氧化还原的知识,仅作简单了解
过氧化钠可以作供氧剂,是这节课的一个重点。写出其原理,并分别用双线桥、单线桥表示其电子转移。
2Na2O2 + 2H2O === 4NaOH + O2↑
2Na2O2 + 2CO2 === 2Na2CO3 + O2
这是自身氧化还原反应,氧化剂、还原剂都是Na2O2
2Na2O2 + 2H2O === 4NaOH + O2↑
2Na2O2 + 2CO2 === 2Na2CO3 + O2
将18 g 水蒸气通过足量的Na2O2固体,Na2O2固体质量增加多少?
a g H2 在O2 中完全燃烧,将其燃烧产物通过足量的Na2O2固体,Na2O2固体质量增加多少克?
Na2O2与H2O的反应,固体增重,实为H2的质量
增加 a g
增加 2 g
2Na2O2 + 2CO2 === 2Na2CO3 + O2
将44 g CO2 通过足量的 Na2O2 固体,Na2O2固体质量增加多少?
a g CO在O2中完全燃烧,将其燃烧产物通过足量的Na2O2固体,Na2O2固体质量增加多少克?
Na2O2与CO2的反应,固体增重,实为CO的质量
增加 a g
增加 28 g
若a g某物质O2中完全燃烧,产物通过足量的Na2O2固体,Na2O2固体增加a g,那么,该物质需要满足什么条件?
该物质的通式必须为(CO)m(H2)n
归纳总结——Na2O2的增重规律
(1)若题目只给出CO2或H2O的质量,可通过CO2或H2O的质量,求出CO或H2的质量,则固体增重就是CO或H2的质量。
(2)w g 符合通式为(CO)m(H2)n的物质,在O2中充分燃烧后,将其产物通过足量的Na2O2固体,反应完毕,固体增重也必是 w g。如甲醛(CH2O)、甲醇(CH4O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)等。
归纳总结——氧化钠与过氧化钠
Na2O Na2O2
颜色 白色 淡黄色
阴阳离子个数比 1∶2 1∶2
氧元素的化合价 -2 -1
是否为碱性氧化物 是 否
与H2O反应 Na2O + H2O == 2NaOH 2Na2O2 + 2H2O == 4NaOH + O2↑
与CO2反应 Na2O + CO2 == Na2CO3 2Na2O2 + 2CO2 == 2Na2CO3 + O2
与盐酸反应 Na2O + 2HCl == 2NaCl + H2O 2Na2O2 + 4HCl == 4NaCl + 2H2O + O2↑
氧化性/漂白性 无 有
主要用途 制备NaOH 强氧化剂、漂白剂、供氧剂
知识点都掌握了吗?来做几道题检测下~
【例1】下列关于钠的氧化物的说法正确的是
A.向包有Na2O2粉末的脱脂棉上滴加几滴水,脱脂棉剧烈燃烧起来,说明Na2O2与H2O反应放热且有氧气生成
B.Na2O与Na2O2中阳、阴离子的个数比不相同
C.将金属钠切开,表面变暗,最终得到淡黄色固体
D.保持温度不变,向饱和烧碱溶液中加入2 g Na2O2,充分反应后,溶液中Na+浓度增大
A
题型一:氧化钠和过氧化钠的基本性质
【例2】下列叙述正确的是
A.金属钠着火时,可用泡沫灭火器灭火
B.将一小块钠投入CuSO4溶液中可置换出红色的固体
C.向某待测溶液中滴入盐酸酸化的AgNO3溶液,产生白色沉淀,说明待测溶液中含Cl-
D.Na2O与Na2O2中阳、阴离子的个数比均为2∶1
D
题型一:氧化钠和过氧化钠的基本性质
C
题型二:过氧化钠的化学性质
【例5】在一定条件下,使12gCO和O2的混合气体充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重7g,则原混合气体中O2的质量分数可能是
①33.3% ②41.7% ③58.3% ④66.7%
A.①② B.①③ C.②③ D.②④
A
题型三:Na2O2的增重问题
【变5-2】一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的过氧化钠完全反应,过氧化钠固体增重Wg,符合此要求的是
①H2 ②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH
A.全部 B.仅④⑤ C.仅①②③ D.除⑤以外
D
题型三:Na2O2的增重问题
【例6】某化学兴趣小组学习Na2O2的性质后,进行过氧化钠与水反应的探究实验。回答下列问题:
(1)探究该反应的热效应
实验装置如图所示,调节U型管内两侧液面相平,向试管中加入a g Na2O2粉末,再滴加10 mL蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。
①观察到U型管内液面_______(填标号),说明该反应为放热反应。
A.左侧较高 B.右侧较高 C.左、右两侧一样高
②写出该反应的离子方程式_______________________________。
(2)探究溶液红色褪去的原因
限选仪器及试剂:试管、胶头滴管、温度计、蒸馏水、酚酞试液、MnO2粉末。
①提出合理猜想:
猜想一:反应放热,酚酞受热分解,使溶液红色褪去;
猜想二:________________________________________。
题型四:Na2O2的性质探究
②设计方案证明猜想:向a g Na2O2中加入10 mL蒸馏水,所得溶液分别置于试管1和试管2中,请将实验操作、现象和结论补充完整:
③在试管2中,加入少量MnO2粉末的作用是_______。
题型四:Na2O2的性质探究
实验操作 实验现象 实验结论
将试管1中溶液冷却至室温,滴加2~3滴酚酞 _______ 猜想一不成立
向试管2中加入少量MnO2粉末,充分振荡,滴加2~3滴酚酞 振荡时,产生大量气泡;滴加酚酞后,_______ 猜想二成立
【答案】B 2Na2O2+2H2O=4Na++4OH-+O2↑ 反应过程中生成漂白性物质H2O2,使溶液红色褪去 溶液先变红,后褪色 溶液变红,不褪色 作催化剂,将产生的H2O2催化分解
知识导航
