2023-2024学年山东省威海市文登区重点中学联考九年级(上)月考化学试卷(10月份)(无答案)
文档属性
| 名称 | 2023-2024学年山东省威海市文登区重点中学联考九年级(上)月考化学试卷(10月份)(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 278.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-15 17:57:10 | ||
图片预览


文档简介
初四第一次月考化学试题
相对原子质量H1 C12 N14 O16 Na23 C135.5 Ca40 Ag108
一、选择题(每小题2分)
1.下列溶液中溶质与溶剂判断正确的是()
溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碘酒 碘酒 水
C 石灰水 氢氧化钙 水
D 75%的医用酒精 水 酒精
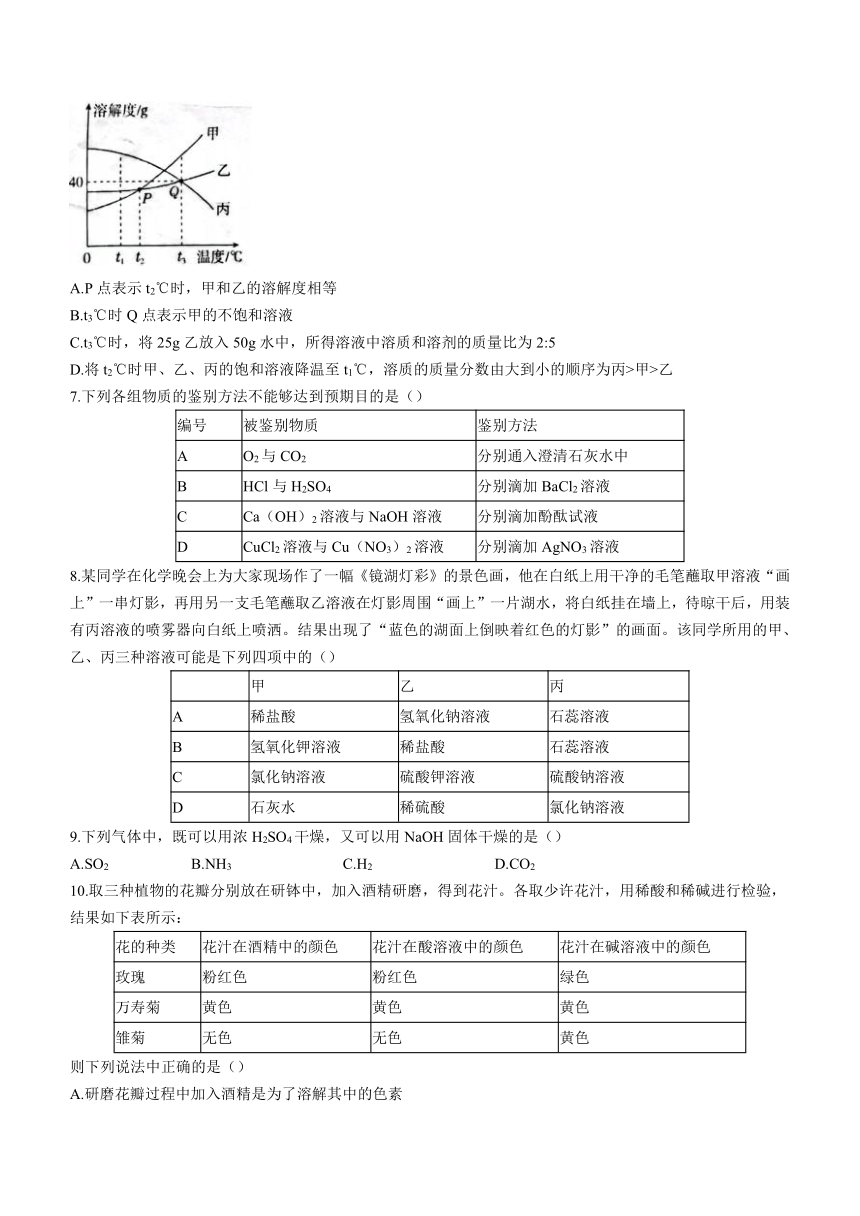
2.小茜设计了一个趣味实验装置(如图2),其气密性良好,在甲中加入下面的固体和液体后,不会使乙中尖嘴导管口有“喷泉”产生的是()
A氯化钠和水 B.氢氧化钠和水
C.二氧化锰和过氧化氢溶液 D.镁条和稀盐酸
3.下列说法正确的个数是()
图2
①稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌
②溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度
③向98g水中,加入2g的熟石灰,配制2%的氢氧化钙溶液。
④稀醋酸可使紫色石蕊溶液变红,CO2也可使紫色石蔬溶液变红,所以CO2属于酸
A.0个 B.1个 C.2个 D.3个
4.下列关于氢氧化钠的描述中不正确的是()
A.露置在空气中易潮解 B.能与CO2发生复分解反应
C.其水溶液能使石蕊试液变蓝 D.对皮肤有强烈的腐蚀作用
5.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是()
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶液的浓度改变
6.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是()
A.P点表示t2℃时,甲和乙的溶解度相等
B.t3℃时Q点表示甲的不饱和溶液
C.t3℃时,将25g乙放入50g水中,所得溶液中溶质和溶剂的质量比为2:5
D.将t2℃时甲、乙、丙的饱和溶液降温至t1℃,溶质的质量分数由大到小的顺序为丙>甲>乙
7.下列各组物质的鉴别方法不能够达到预期目的是()
编号 被鉴别物质 鉴别方法
A O2与CO2 分别通入澄清石灰水中
B HCl与H2SO4 分别滴加BaCl2溶液
C Ca(OH)2溶液与NaOH溶液 分别滴加酚酞试液
D CuCl2溶液与Cu(NO3)2溶液 分别滴加AgNO3溶液
8.某同学在化学晚会上为大家现场作了一幅《镜湖灯彩》的景色画,他在白纸上用干净的毛笔蘸取甲溶液“画上”一串灯影,再用另一支毛笔蘸取乙溶液在灯影周围“画上”一片湖水,将白纸挂在墙上,待晾干后,用装有丙溶液的喷雾器向白纸上喷洒。结果出现了“蓝色的湖面上倒映着红色的灯影”的画面。该同学所用的甲、乙、丙三种溶液可能是下列四项中的()
甲 乙 丙
A 稀盐酸 氢氧化钠溶液 石蕊溶液
B 氢氧化钾溶液 稀盐酸 石蕊溶液
C 氯化钠溶液 硫酸钾溶液 硫酸钠溶液
D 石灰水 稀硫酸 氯化钠溶液
9.下列气体中,既可以用浓H2SO4干燥,又可以用NaOH固体干燥的是()
A.SO2 B.NH3 C.H2 D.CO2
10.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
则下列说法中正确的是()
A.研磨花瓣过程中加入酒精是为了溶解其中的色素
B. 25℃时,遇到氢氧化钠的溶液,玫瑰花汁会变成粉红色
C.可用雏菊花汁来区别H2SO4和K2SO4溶液
D.上述三种花汁都能用作酸碱指示剂
二、简答题(除11题外共4分,其余每空1分)
11.内涵决定身份——认识物质的组成和结构。完成下列表格。
物质名称 生石灰 烧碱 硫酸铜溶液
物质组成(化学式)
物质构成(微粒符号) K+、SO42-
物质类别 金属氧化物
12.(1)60℃时将36g硝酸钾溶于204g水中,该溶液中溶质的质量分数为________________。
(2)将上述溶液平均分成三等份:取第一份,将温度升高到90℃,此时溶质的质量分数为______________;取第二份,要使其溶质的质量分数比原来增加一倍,需加入硝酸钾固体______________g;(保留小数点后一位)取第三份,使其溶质的质量分数变为原来的一半,需加水______________g。
13.有浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是______________(填化学式),反应的化学方程式为______________,不是因发生化学变化而使溶液质量减小的物质是______________。
14.对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应。
(1)氢氧化钙溶液能使酚酞变______________。
(2)为了检验反应③能够发生,你可选择下列哪些物质?
A.HCl B.FeCl3 C.CaO D.KOH E.Na2CO3
(3)把石灰乳刷到墙壁上,会发现墙壁变硬“出汗”涉及反应______________(只需填序号)。
15.影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。他把食盐装在竹筒中,途中为避开敌人盘查,他急中生智,把食盐全部溶成盐水,再用穿着的棉袄吸收,成功将食盐送达。回答下列问题。
(1)食盐的主要成分氯化钠是由_____________(选填“分子”“原子”或“离子”)构成的;
(2)请写出氯化钠在生活中的一种用途______________。
(3)如图是氯化钠的溶解度曲线。假设冬子的竹筒中有358g氯化钠,10℃时溶解所有氯化钠,至少需要水______________g。
(4)从盐水中重新得到食盐固体,需进行的操作是______________。
(5)根据溶解度曲线分析,下列说法中错误的是______________。
A.氯化钠的溶解度随温度升高而增大
B.10℃时,将35.8g氯化钠加入64.2g水中,可配制成浓度为35.8%的氯化钠溶液
C.20℃时,20gNaC1固体加入50g水,充分溶解后得到的是NaC1的饱和溶液
D.保持温度不变,使NaCl饱和溶液析出晶体后,剩余溶液中溶质的质量分数变小
16.味精是生活中的调味品。味精的鲜味来自于主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl及其它成分。
(1)实验表明,味精在100℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),对人体的影响甚微。对此,下列认识正确的是℃
a.味精不能吃,对人体有害
b.尽量避免在菜肴温度较高时使用味精
c.生成焦谷氨酸钠的过程是物理变化
d.实验是研究问题的一种有效方法
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是________________。
a.10m b.50 mL c.100 mL
(3)右图是配制过程,正确的操作顺序为______________(填序号)。
(4)实验后对比味精袋上的标签,发现所测得的NaCl的质量分数偏高,则可能的原因是______________(填字母)。
a.配制溶液时仰视量水
b.反应中加入的AgNO3溶液过量
c洗涤、干燥沉淀不彻底
d.味精中有其它能与AgNO3反应生成沉淀的物质
17.某同学用稀硫酸除去铁钉上的铁锈,现象是________________其反应方程式为________________在实验过程中,发现有气泡产生,产生这一现象的原因为_______________,他向同学介绍说:“根据用稀硫酸除去铁锈有气泡产生的现象,提醒我们注意,在用稀盐酸除铝壶里的水垢(碳酸钙)时,一定要注意_______________,否则该过程共会发生的反应有______________、_______________(写出方程式)。
18.获取知识、形成认识需要借助一定的科学方法。“观察”“抽象”“演绎”“归纳”“比较”“推理”等是常用的科学方法。下列描述分别运用了以上哪种科学方法?
(1)打开盛放浓盐酸的试剂瓶,“瓶口有白雾出现”,运用的是____________法;“白雾是因为浓盐酸挥发出来的氯化氢气体与空气里的水蒸气接触,形成的盐酸小液滴”,运用的是_____________法。
(2)“Na2CO3、K2CO3、CaCO3都能与盐酸反应生成二氧化碳气体,所以碳酸盐能与盐酸反应生成二氧化碳气体”,运用的______________法;“BaCO3属于碳酸盐,因此BaCO3也能与盐酸反应生成二氧化碳气体”,运用的是_____________法。
19.90℃时,五份等质量、等溶质质量分数的A物质的溶液,分别蒸发10g水后降温到不同温度,测定在不同温度下析出固体A的质量如下表。
溶液的温度/℃ 70 60 55 40 25
析出固体A的质量/g 0 0 1.9 4.1 7.6
若不考虑水份蒸发对实验的影响,请回答下列问题:
(1)60℃时,该溶液是否为饱和溶液?______________(填“是”、“否”或“无法判断”)。
(2)将35℃时A物质的饱和溶液变成不饱和溶液,下列方法中一定能达到目的的____________(填序号)。
①升温 ②降温 ③加溶质A ④加水 ⑤恒温蒸发水
⑥与35℃时A的不饱和溶液混合
(3)若配制100g16%的A物质的溶液,用托盘天平称量所需的A物质时,发现托盘天平的指针偏向右盘,则应_________________(5g以下用游码)。量水读数时___________________。
20.氢氧化钠、氢氧化钙是两种常见的碱:
(1)它们有一些相似的化学性质,其原因是溶液中都含有_______________。
(2)可作某些气体干燥剂的是_______________。(填化学式)
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为_______________。
(4)长期不合理使用化肥会使土壤酸化(如含有硝酸)熟石灰常用来改良酸性土壤,反应的化学方程式是_______________。
(5)化学实验活动课上,同学们进行了如图所示的实验。
实验一实验二
①实验一中,B试管中发生反应的化学方程式为______________。A、B两支试管中共同的实验现象是_______________。
②实验二中,C试管中有白色沉淀生成,D试管中无现象。为了探究通入二氧化碳后是否发生反应,小明同学取D中少量溶液于试管中,选择合适的试剂进行实验,用化学方程式表示发生反应_______________。
三、计算题(共6分)
21.某学校的学习小组对当地的石灰石矿区进行调查,欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
实验次数 加入稀盐酸的质量/g 剩余固体的质量/g
1 20 11
2 20 6
3 20 2.8
4 20 n
(1)表中n的数值为_______________。
(2)样品中碳酸钙的质量分数是多少?
(3)求稀盐酸中溶质的质量分数?
相对原子质量H1 C12 N14 O16 Na23 C135.5 Ca40 Ag108
一、选择题(每小题2分)
1.下列溶液中溶质与溶剂判断正确的是()
溶液 溶质 溶剂
A 硫酸铜溶液 铜 硫酸
B 碘酒 碘酒 水
C 石灰水 氢氧化钙 水
D 75%的医用酒精 水 酒精
2.小茜设计了一个趣味实验装置(如图2),其气密性良好,在甲中加入下面的固体和液体后,不会使乙中尖嘴导管口有“喷泉”产生的是()
A氯化钠和水 B.氢氧化钠和水
C.二氧化锰和过氧化氢溶液 D.镁条和稀盐酸
3.下列说法正确的个数是()
图2
①稀释浓硫酸时,将水沿容器壁慢慢注入浓硫酸中,并不断搅拌
②溶解食盐时用玻璃棒搅拌以增大氯化钠的溶解度
③向98g水中,加入2g的熟石灰,配制2%的氢氧化钙溶液。
④稀醋酸可使紫色石蕊溶液变红,CO2也可使紫色石蔬溶液变红,所以CO2属于酸
A.0个 B.1个 C.2个 D.3个
4.下列关于氢氧化钠的描述中不正确的是()
A.露置在空气中易潮解 B.能与CO2发生复分解反应
C.其水溶液能使石蕊试液变蓝 D.对皮肤有强烈的腐蚀作用
5.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是()
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶液的浓度改变
6.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是()
A.P点表示t2℃时,甲和乙的溶解度相等
B.t3℃时Q点表示甲的不饱和溶液
C.t3℃时,将25g乙放入50g水中,所得溶液中溶质和溶剂的质量比为2:5
D.将t2℃时甲、乙、丙的饱和溶液降温至t1℃,溶质的质量分数由大到小的顺序为丙>甲>乙
7.下列各组物质的鉴别方法不能够达到预期目的是()
编号 被鉴别物质 鉴别方法
A O2与CO2 分别通入澄清石灰水中
B HCl与H2SO4 分别滴加BaCl2溶液
C Ca(OH)2溶液与NaOH溶液 分别滴加酚酞试液
D CuCl2溶液与Cu(NO3)2溶液 分别滴加AgNO3溶液
8.某同学在化学晚会上为大家现场作了一幅《镜湖灯彩》的景色画,他在白纸上用干净的毛笔蘸取甲溶液“画上”一串灯影,再用另一支毛笔蘸取乙溶液在灯影周围“画上”一片湖水,将白纸挂在墙上,待晾干后,用装有丙溶液的喷雾器向白纸上喷洒。结果出现了“蓝色的湖面上倒映着红色的灯影”的画面。该同学所用的甲、乙、丙三种溶液可能是下列四项中的()
甲 乙 丙
A 稀盐酸 氢氧化钠溶液 石蕊溶液
B 氢氧化钾溶液 稀盐酸 石蕊溶液
C 氯化钠溶液 硫酸钾溶液 硫酸钠溶液
D 石灰水 稀硫酸 氯化钠溶液
9.下列气体中,既可以用浓H2SO4干燥,又可以用NaOH固体干燥的是()
A.SO2 B.NH3 C.H2 D.CO2
10.取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱进行检验,结果如下表所示:
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
则下列说法中正确的是()
A.研磨花瓣过程中加入酒精是为了溶解其中的色素
B. 25℃时,遇到氢氧化钠的溶液,玫瑰花汁会变成粉红色
C.可用雏菊花汁来区别H2SO4和K2SO4溶液
D.上述三种花汁都能用作酸碱指示剂
二、简答题(除11题外共4分,其余每空1分)
11.内涵决定身份——认识物质的组成和结构。完成下列表格。
物质名称 生石灰 烧碱 硫酸铜溶液
物质组成(化学式)
物质构成(微粒符号) K+、SO42-
物质类别 金属氧化物
12.(1)60℃时将36g硝酸钾溶于204g水中,该溶液中溶质的质量分数为________________。
(2)将上述溶液平均分成三等份:取第一份,将温度升高到90℃,此时溶质的质量分数为______________;取第二份,要使其溶质的质量分数比原来增加一倍,需加入硝酸钾固体______________g;(保留小数点后一位)取第三份,使其溶质的质量分数变为原来的一半,需加水______________g。
13.有浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化学变化而减小的物质是______________(填化学式),反应的化学方程式为______________,不是因发生化学变化而使溶液质量减小的物质是______________。
14.对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小丽总结了氢氧化钙的四条化学性质(如图),即氢氧化钙能够与图中四类物质发生化学反应。
(1)氢氧化钙溶液能使酚酞变______________。
(2)为了检验反应③能够发生,你可选择下列哪些物质?
A.HCl B.FeCl3 C.CaO D.KOH E.Na2CO3
(3)把石灰乳刷到墙壁上,会发现墙壁变硬“出汗”涉及反应______________(只需填序号)。
15.影片《闪闪的红星》中有一段儿童团员潘冬子给红军送盐的故事。他把食盐装在竹筒中,途中为避开敌人盘查,他急中生智,把食盐全部溶成盐水,再用穿着的棉袄吸收,成功将食盐送达。回答下列问题。
(1)食盐的主要成分氯化钠是由_____________(选填“分子”“原子”或“离子”)构成的;
(2)请写出氯化钠在生活中的一种用途______________。
(3)如图是氯化钠的溶解度曲线。假设冬子的竹筒中有358g氯化钠,10℃时溶解所有氯化钠,至少需要水______________g。
(4)从盐水中重新得到食盐固体,需进行的操作是______________。
(5)根据溶解度曲线分析,下列说法中错误的是______________。
A.氯化钠的溶解度随温度升高而增大
B.10℃时,将35.8g氯化钠加入64.2g水中,可配制成浓度为35.8%的氯化钠溶液
C.20℃时,20gNaC1固体加入50g水,充分溶解后得到的是NaC1的饱和溶液
D.保持温度不变,使NaCl饱和溶液析出晶体后,剩余溶液中溶质的质量分数变小
16.味精是生活中的调味品。味精的鲜味来自于主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl及其它成分。
(1)实验表明,味精在100℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成焦谷氨酸钠(有毒),对人体的影响甚微。对此,下列认识正确的是℃
a.味精不能吃,对人体有害
b.尽量避免在菜肴温度较高时使用味精
c.生成焦谷氨酸钠的过程是物理变化
d.实验是研究问题的一种有效方法
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是________________。
a.10m b.50 mL c.100 mL
(3)右图是配制过程,正确的操作顺序为______________(填序号)。
(4)实验后对比味精袋上的标签,发现所测得的NaCl的质量分数偏高,则可能的原因是______________(填字母)。
a.配制溶液时仰视量水
b.反应中加入的AgNO3溶液过量
c洗涤、干燥沉淀不彻底
d.味精中有其它能与AgNO3反应生成沉淀的物质
17.某同学用稀硫酸除去铁钉上的铁锈,现象是________________其反应方程式为________________在实验过程中,发现有气泡产生,产生这一现象的原因为_______________,他向同学介绍说:“根据用稀硫酸除去铁锈有气泡产生的现象,提醒我们注意,在用稀盐酸除铝壶里的水垢(碳酸钙)时,一定要注意_______________,否则该过程共会发生的反应有______________、_______________(写出方程式)。
18.获取知识、形成认识需要借助一定的科学方法。“观察”“抽象”“演绎”“归纳”“比较”“推理”等是常用的科学方法。下列描述分别运用了以上哪种科学方法?
(1)打开盛放浓盐酸的试剂瓶,“瓶口有白雾出现”,运用的是____________法;“白雾是因为浓盐酸挥发出来的氯化氢气体与空气里的水蒸气接触,形成的盐酸小液滴”,运用的是_____________法。
(2)“Na2CO3、K2CO3、CaCO3都能与盐酸反应生成二氧化碳气体,所以碳酸盐能与盐酸反应生成二氧化碳气体”,运用的______________法;“BaCO3属于碳酸盐,因此BaCO3也能与盐酸反应生成二氧化碳气体”,运用的是_____________法。
19.90℃时,五份等质量、等溶质质量分数的A物质的溶液,分别蒸发10g水后降温到不同温度,测定在不同温度下析出固体A的质量如下表。
溶液的温度/℃ 70 60 55 40 25
析出固体A的质量/g 0 0 1.9 4.1 7.6
若不考虑水份蒸发对实验的影响,请回答下列问题:
(1)60℃时,该溶液是否为饱和溶液?______________(填“是”、“否”或“无法判断”)。
(2)将35℃时A物质的饱和溶液变成不饱和溶液,下列方法中一定能达到目的的____________(填序号)。
①升温 ②降温 ③加溶质A ④加水 ⑤恒温蒸发水
⑥与35℃时A的不饱和溶液混合
(3)若配制100g16%的A物质的溶液,用托盘天平称量所需的A物质时,发现托盘天平的指针偏向右盘,则应_________________(5g以下用游码)。量水读数时___________________。
20.氢氧化钠、氢氧化钙是两种常见的碱:
(1)它们有一些相似的化学性质,其原因是溶液中都含有_______________。
(2)可作某些气体干燥剂的是_______________。(填化学式)
(3)用氢氧化钙溶液检验二氧化碳,反应的化学方程式为_______________。
(4)长期不合理使用化肥会使土壤酸化(如含有硝酸)熟石灰常用来改良酸性土壤,反应的化学方程式是_______________。
(5)化学实验活动课上,同学们进行了如图所示的实验。
实验一实验二
①实验一中,B试管中发生反应的化学方程式为______________。A、B两支试管中共同的实验现象是_______________。
②实验二中,C试管中有白色沉淀生成,D试管中无现象。为了探究通入二氧化碳后是否发生反应,小明同学取D中少量溶液于试管中,选择合适的试剂进行实验,用化学方程式表示发生反应_______________。
三、计算题(共6分)
21.某学校的学习小组对当地的石灰石矿区进行调查,欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如下表(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应)。根据实验数据计算:
实验次数 加入稀盐酸的质量/g 剩余固体的质量/g
1 20 11
2 20 6
3 20 2.8
4 20 n
(1)表中n的数值为_______________。
(2)样品中碳酸钙的质量分数是多少?
(3)求稀盐酸中溶质的质量分数?
同课章节目录
